корма для рыб, инфузория-туфелька, стоячая вода, способы разведения инфузорий, кормление рыб, реферат аквариумные рыбки
Инфузории — одноклеточные организмы размером 0,1-0,35 мм, передвигающиеся с помощью колебательных движений ресничек, покрывающих их тело.
Служат для кормления мальков в первые дни жизни. Наиболее пригодна инфузория-туфелька (Paramecium caudatum), которая по своей форме очень похожа на подошву и имеет то преимущество, что совершенно безвредна в отличие от некоторых других видов инфузорий, повреждающих икру. Следует учесть, что туфелька довольно быстро перемещается (до 0,2 см/с) и малоподвижные мальки некоторых видов рыб даже при высокой концентрации могут остаться голодными. Поэтому при кормлении мальков за этим нужно следить и при необходимости отказаться от кормления туфельками.
Инфузория-туфелька (Paramecium caudatum)
Туфельки встречаются почти в каждом водоеме со стоячей водой, особенно с опавшей листвой и гниющими органическими веществами, где она питается размножающимися там бактериями.
Туфельку отделяют от других инфузорий следующим образом. Взяв пипеткой воду, в которой содержатся инфузории, переносят каплю на чистое стекло, рядом на более освещенное место капают каплю свежей воды и соединяют обе капли водной перемычкой с помощью острого конца заточенной спички. Туфельки быстрее других инфузорий переберутся в свежую воду, которую пипеткой переносят в сосуд, где будут разводить туфелек.
Парамеция (Paramecium aurelia)
Некоторые способы разведения инфузорий
— Прокипятить сено в течение 20 мин из расчета 20 г сена на 1 л воды, охладить до 22-26°С, профильтровать и разбавить свежей водой из расчета 1 часть настоя на 20 частей воды. После помутнения воды, вызванного развитием бактерий внести туфелек. Через 3-4 дня образуется достаточное количество инфузорий и можно кормить мальков. Для поддержания культуры в воду нужно не чаще 2 раз в месяц добавлять кипяченое молоко из расчета 5 капель на 100 мл настоя. Настой хранят в теплом (20-25°С) и светлом месте (но не под лучами солнца), накрыв стеклом.
Для поддержания культуры в воду нужно не чаще 2 раз в месяц добавлять кипяченое молоко из расчета 5 капель на 100 мл настоя. Настой хранят в теплом (20-25°С) и светлом месте (но не под лучами солнца), накрыв стеклом.
— В наполненную свежей водой 3 л стеклянную банку капают 1-2 капли молока, когда вода помутнеет, вносят туфелек. Через 10 дней можно кормить мальков.
— Кубики брюквы 1х1х1 см высушивают и кладут в стеклянную банку со свежей водой (1 кубик на 1 л воды). Кубики, разлагаясь, образуют настил на дне, после чего вносят туфелек. Вскоре в верхнем слое обильно размножаются только туфельки. Сверху сосуд закрывают стеклом.
Рекомендуют культуру инфузорий использовать не долее 20 суток.
Перед кормлением мальков, туфельку очищают, чтобы не испортить воду в аквариуме.
Парамеция бурсария (Paramecium bursaria)
Некоторые способы фильтрации

— Настоем с туфельками наполняют бутылку до края горла, в которое вставляют ватный тампон так, чтобы он слегка погрузился в настой. Нижнюю часть бутылки затемняют, а тампон осторожно поливают свежей водой. Через некоторое время, за которое туфельки переберутся в свежую воду, тампон вынимают и прополаскивают в аквариуме.
— Закрыв пробкой конец длинной и тонкой стеклянной трубки, наполняют ее из пипетки жидкостью из верхнего слоя настоя и оставляют стоять в вертикальном положении 10-15 ч. Затем собравшихся в верхнем слое туфелек пипеткой переносят в аквариум.
ИНФУЗОРИИ • Большая российская энциклопедия
В книжной версии
Том 11. Москва, 2008, стр. 500
Скопировать библиографическую ссылку:
Авторы: С.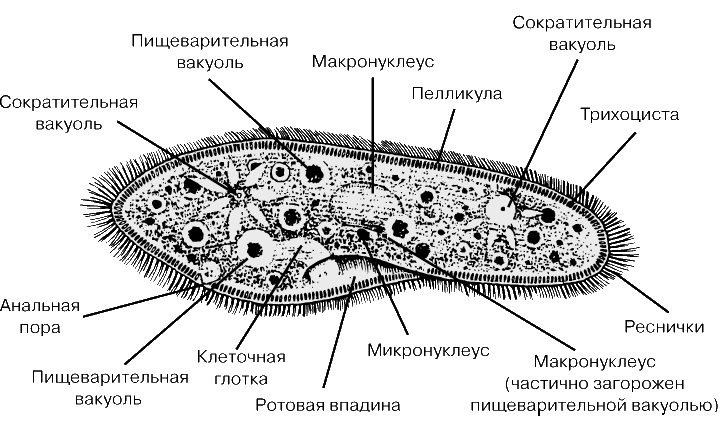 А. Карпов
А. Карпов
Схема строения инфузории туфельки (по Ю. И. Полянскому и А. А. Стрелкову): 1 – комплекс сократительных вакуолей; 2 – макронуклеус; 3 – экструсомы; 4 – реснички; 5 – пищев…
ИНФУЗО́РИИ, цилиаты (Ciliophora), подтип ресничных одноклеточных эукариот (протистов) типа Alveolata (ранее рассматривались как тип простейших). Объединяет более 8 тыс. видов, населяющих разнообразные биотопы: морские и пресные воды, почву, термальные источники, айсберги, пустыни. Длина клетки от 15 мкм до 3 мм. Для И. характерно наличие многочисл. ресничек, кортекса (покровы и подстилающие скелетные структуры), двух типов ядер и полового процесса в форме конъюгации. У большинства И. есть спец. ротовое отверстие в форме воронки, на дне которой формируются пищеварит. вакуоли. Последние перемещаются по определённому пути внутри клетки, переваривая пищу (бактерии, мелкие водоросли).
Реснички расположены продольными рядами; в области ротового отверстия формируют поперечные или косые ряды. Они служат для передвижения (плавания и ползания), а также участвуют в процессе питания, подгоняя пищевые частицы ко рту. Реснички могут быть собраны в «кисточки» (напоминают конечности и используются для «шагания» по субстрату) или в уплощённые группы (мембранеллы). Кортекс состоит из пелликулы, образованной клеточной мембраной и подстилающим её слоем альвеол [уплощённых пузырьков, в которых могут откладываться белковые (напр., род Euplotes) или кальцинированные полисахаридные (напр., род Coleps) пластинки], и инфрацилиатуры, сформированной основаниями ресничек (кинетосомами) и отходящими от каждой кинетосомы (или пары кинетосом) тремя корешками, состоящими из микротрубочек и микрофиламентов (см.
И. имеют один или неск. макронуклеусов – крупных, часто различающихся размером и строением, соматич. ядер, содержащих неполный набор многократно повторенных (амплифицированных) генов, обеспечивающих метаболизм, а также одно или неск. мелких диплоидных генеративных ядер – микронуклеусов, которые являются хранителями наследственной информации, почти не участвуют в жизнедеятельности клетки, но обеспечивают половой процесс. Во время последнего две особи одного вида частично сливаются друг с другом, микронуклеусы делятся путём мейоза, в результате чего в каждой особи остаётся по 2 гаплоидных ядра (остальные дегенерируют), одно из которых мигрирует в клетку-партнёра и сливается с оставшимся в клетке ядром, восстанавливая диплоидный набор хромосом. После такого обмена генетич. материалом партнёры разделяются; макронуклеусы разрушаются и воссоздаются заново из модифицированных микронуклеусов.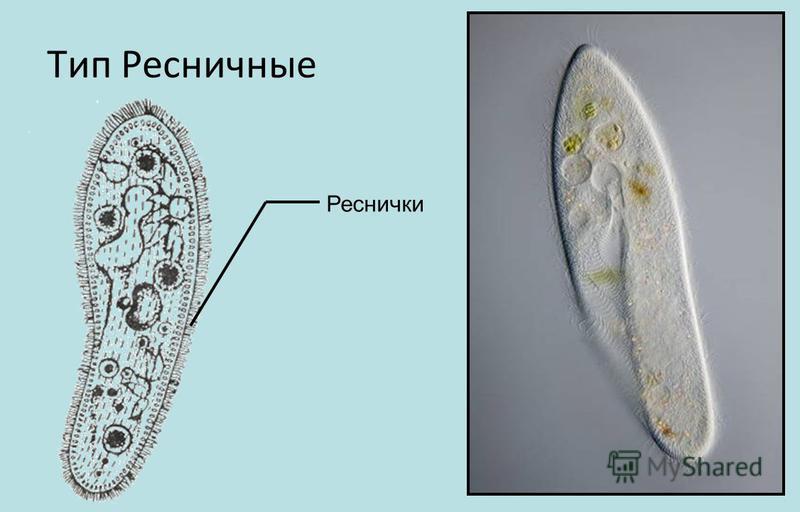
Большинство И. свободноживущие, но есть и комменсалы (в рубце жвачных), и паразитич. виды родов ихтиофтириус, балантидий; многие содержат симбиотич. бактерии и водоросли. Водные И. играют важную роль в биологич. очистке сточных вод, многие служат пищей для молоди рыб. И. – одна из наиболее изученных групп эукариот. Некоторые виды используются в качестве модельных объектов в науч. исследованиях, напр. Tetrahymena thermophila и инфузория туфелька (Paramecium caudatum).
Какие бактерии дружат с инфузориями
Инфузории дают приют бактериям, которые потеряли своего основного многоклеточного хозяина.
‹
›
Мы очень часто слышим о микроорганизмах, которые живут в кишечнике, на коже, в полости рта, и в совокупности составляют наш микробиом – так называют бактерий, вирусы, грибы, которые находятся с нами в симбиотических отношениях: они от нас получают какую-то пользу, и мы от них – тоже. (А польза нам от бактерий может быть очень велика.) Но «свои» микробы есть не только у людей, но и у зверей, у птиц, у насекомых, у растений. Более того, даже одноклеточные организмы, вроде инфузорий, держат при себе каких-то бактерий, хотя до последнего времени микробиомы простейших почти не изучали.
Известно, что инфузории гибнут в стерильных условиях, то есть им для жизни нужны бактерии. Однако довольно трудно отделить тех бактерий, которые просто живут в воде вместе с инфузориями, от тех, которые обитают прямо в клетках инфузорий или же для которых нужно присутствие инфузорий в среде обитания.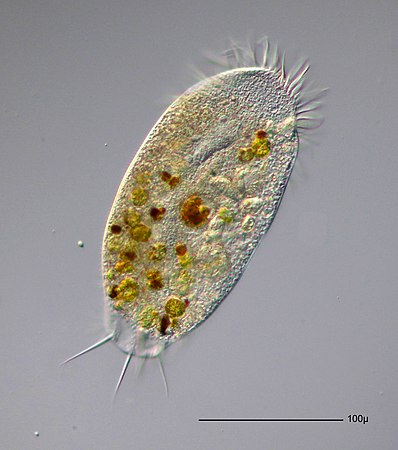 Исследователи из Санкт-Петербургского государственного университета, Института клеточного и внутриклеточного симбиоза УрО РАН, университетов Пизы и Флоренции сумели описать инфузорийных бактерий с помощью новейших методов секвенирования (то бишь чтения) ДНК и анализа прочитанных последовательностей. Авторы работы анализировали особые участки генома, которые чрезвычайно медленно меняются в ходе эволюции и по которым можно отличить одних микробов от других. В итоге удалось описать – по крайней мере, отчасти – микробиом инфузорий-туфелек (статья про которых была опубликована в январе) и инфузорий трубачей – про них недавно вышла статья в Scientific Reports.
Исследователи из Санкт-Петербургского государственного университета, Института клеточного и внутриклеточного симбиоза УрО РАН, университетов Пизы и Флоренции сумели описать инфузорийных бактерий с помощью новейших методов секвенирования (то бишь чтения) ДНК и анализа прочитанных последовательностей. Авторы работы анализировали особые участки генома, которые чрезвычайно медленно меняются в ходе эволюции и по которым можно отличить одних микробов от других. В итоге удалось описать – по крайней мере, отчасти – микробиом инфузорий-туфелек (статья про которых была опубликована в январе) и инфузорий трубачей – про них недавно вышла статья в Scientific Reports.
Оказалось, что бактерии, которые обитают в инфузориях, отличаются от тех, которые плавают в воде вокруг инфузорий (хотя разнообразие микробов в инфузориях, разумеется, меньше, чем разнообразие микробов в среде вокруг). Иными словами, клетки инфузорий представляют собой самостоятельные экологические ниши со своим набором микроорганизмов. Причём бактерии, которые живут с инфузориями-туфельками – это не те же самые бактерии, которые живут с трубачами, даже если трубачи и туфельки обитают в одном водоёме.
Причём бактерии, которые живут с инфузориями-туфельками – это не те же самые бактерии, которые живут с трубачами, даже если трубачи и туфельки обитают в одном водоёме.
В-третьих, оказалось, что в инфузориях живут представители родов бактерий, которых можно найти у животных и у человека. В частности, в инфузориях обитают бактерии групп Mycobacterium, Streptococcus и Neisseria. К ним принадлежат многие патогенные виды, однако есть ли эти патогенные виды в инфузориях, сказать пока нельзя: нужны дополнительные исследования.
В любом случае, как говорит профессор кафедры микробиологии СПбГУ и кандидат биологических наук Алексей Потехин, «очевидно, что в сожительство с инфузориями вступают преимущественно такие бактерии, которые «умеют» жить в ассоциации с организмами-хозяевами. По всей видимости, эти бактерии, оказавшись вне хозяина, в водоеме, за неимением лучшего начинают колонизировать инфузорий и прочих протистов – как-никак это крупные эукариотические клетки, сходные с клетками многоклеточных, и выжить некоторое время можно или у них внутри, или снаружи, в зависимости от тактики конкретной бактерии».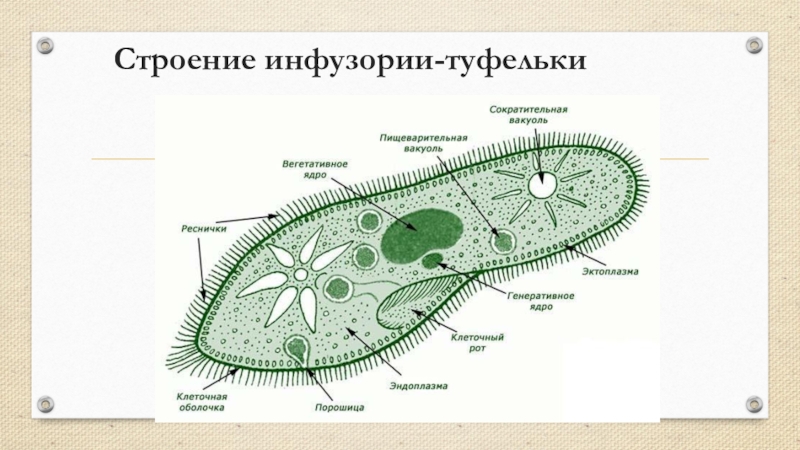 Нельзя сказать, чтобы бактерии в сожительстве с инфузориями чувствовали себя хорошо – по словам Алексея Потехина, бактерий в инфузориях всегда немного, значит, им там не очень хорошо размножаться. Но пережить трудные времена в таком хозяине вполне можно. Таким образом, инфузории (и, весьма вероятно, другие протисты) выступают в роли природного резервуара для бактерий, которые потеряли удобного многоклеточного хозяина.
Нельзя сказать, чтобы бактерии в сожительстве с инфузориями чувствовали себя хорошо – по словам Алексея Потехина, бактерий в инфузориях всегда немного, значит, им там не очень хорошо размножаться. Но пережить трудные времена в таком хозяине вполне можно. Таким образом, инфузории (и, весьма вероятно, другие протисты) выступают в роли природного резервуара для бактерий, которые потеряли удобного многоклеточного хозяина.
По материалам пресс-службы СПбГУ.
Десять простейших паразитов человека
Наталья Резник
Самый большой. Балантидий Balantidium coli
Крупнейшее простейшее — паразит человека, и единственная инфузория в этой компании. Ее размеры варьируют от 30 до 150 мкм в длину и от 25 до 120 мкм в ширину. Для сравнения: длина малярийного плазмодия в самой крупной стадии — около 15 мкм, и в разы меньше балантидия клетки кишечника, среди которых живет инфузория. Слон в посудной лавке.
Слон в посудной лавке.
Распространен везде, где есть свиньи — его основные носители. Обычно живет в подслизистом слое толстой кишки, хотя у людей встречается и в легочном эпителии. Питается B. coli бактериями, частичками пищи, фрагментами хозяйского эпителия. У животных инфекция протекает бессимптомно. У людей может развиться тяжелейшая диарея с кровавыми, слизистыми выделениями (балантидиаз), иногда в стенках толстой кишки образуются язвы. Умирают от балантидиаза редко, однако он вызывает хроническое истощение.
Люди заражаются через грязную воду или продукты, содержащие цисты. Частота инфицирования у людей не превышает 1%, в то время как свиньи могут быть заражены поголовно.
Лечится тетрациклином или метронидазолом, сообщений о лекарственной устойчивости этой инфузории пока не поступало.
Открыт шведским ученым Мальстемом в 1857 году. Сегодня балантидиаз связывают с тропическими и субтропическими районами, бедностью и плохой гигиеной.
Самая первая. Ротовая амеба Entamoeba gingivalis
Первая паразитическая амеба, найденная у человека. Этот человек был москвичом, и описание его амеб опубликовал московский исследователь Г. Гросс в 1849 году в Bulletin de la Société Impériale des Naturalistes de Moscou — старейшем русском научном журнале (выходит с 1829 года и посейчас индексируется ВАК под именем «Бюллетень Московского общества испытателей природы»). Гросс обнаружил амебу в зубном налете, отсюда и название от латинского gingivae — десны.
Живет во рту почти у всех людей с больными зубами или воспаленными деснами, населяет десневые карманы и зубной налет. Питается клетками эпителия, лейкоцитами, микробами, при случае эритроцитами. У людей со здоровой ротовой полостью встречается редко.
Это небольшое простейшее размером 10–35 мкм во внешнюю среду не выходит и цист не образует, к другому хозяину передается при поцелуях, через грязную посуду или зараженную пищу. E. gingivalis считают исключительно человеческим паразитом, но иногда ее находят у кошек, собак, лошадей и обезьян, живущих в неволе.
E. gingivalis считают исключительно человеческим паразитом, но иногда ее находят у кошек, собак, лошадей и обезьян, живущих в неволе.
В начале ХХ века E. gingivalis описали как возбудителя пародонта, поскольку она всегда присутствует в воспаленных зубных ячейках. Однако ее патогенность не доказана.
Лекарства, действующие на эту амебу, неизвестны.
Самый всепроникающий. Дизентерийная амеба Entamoeba histolytica
Этот кишечный паразит с кровью проникает в ткани печени, легких, почек, мозга, сердца, селезенки, половых органов. Ест, что добудет: частички пищи, бактерии, эритроциты, лейкоциты и клетки эпителия.
Распространена повсеместно, особенно в тропиках. Обычно люди заражаются, проглотив цисту.
В странах умеренного климата амеба, как правило, остается в просвете кишечника, и инфекция протекает бессимптомно. В тропиках и субтропиках чаще начинается патологический процесс: E. histolytica атакуют стенки. Причины перехода в патогенную форму пока неясны, но описано уже несколько молекулярных механизмов происходящего. Так, понятно, что амебы выделяют лизирующие вещества, пробиваются через слизь и убивают клетки. По-видимому, амеба может уничтожить хозяйскую клетку двумя способами: запустив у нее апоптоз или просто отгрызая куски. Первый способ долгое время считался единственным. Кстати, механизм клеточного самоубийства с рекордной скоростью — за минуты — так и не выявлен. Второй способ описан совсем недавно, авторы назвали его трогоцитозом от греческого «трого» — грызть. Примечательно, что амебы, кусающие клетки, бросают добычу, как только она погибает. А другие могут фагоцитировать мертвые клетки целиком. Предполагают, что кусающие и пожирающие клетки различаются картиной экспрессии генов.
histolytica атакуют стенки. Причины перехода в патогенную форму пока неясны, но описано уже несколько молекулярных механизмов происходящего. Так, понятно, что амебы выделяют лизирующие вещества, пробиваются через слизь и убивают клетки. По-видимому, амеба может уничтожить хозяйскую клетку двумя способами: запустив у нее апоптоз или просто отгрызая куски. Первый способ долгое время считался единственным. Кстати, механизм клеточного самоубийства с рекордной скоростью — за минуты — так и не выявлен. Второй способ описан совсем недавно, авторы назвали его трогоцитозом от греческого «трого» — грызть. Примечательно, что амебы, кусающие клетки, бросают добычу, как только она погибает. А другие могут фагоцитировать мертвые клетки целиком. Предполагают, что кусающие и пожирающие клетки различаются картиной экспрессии генов.
Сейчас способность амебы проникать в кровяное русло, печень и другие органы связывают именно с трогоцитозом.
Амебиаз — смертельно опасное заболевание, ежегодно от инфекции E.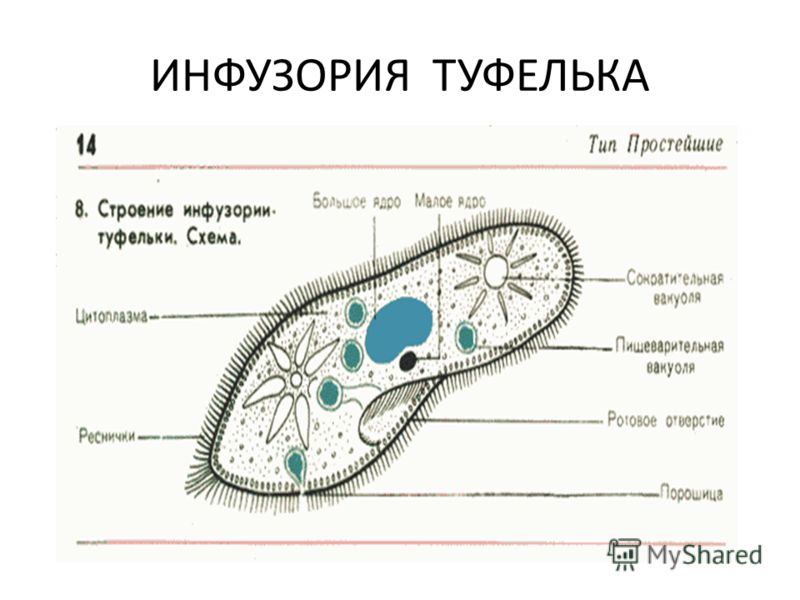 histolytica умирает около 100 тыс. человек.
histolytica умирает около 100 тыс. человек.
У дизентерийной амебы есть непатогенный близнец, E. dispar, поэтому для диагностики заболевания микроскопии недостаточно.
Для излечения необходимо уничтожить как подвижных E. histolytica (метронидазол, тинидазол), так и цисты (иодокинол или паромомицин).
Описал E. histolytica в 1875 году петербургский врач Федор Александрович Лёш у больного диареей, он же определил ее патогенную природу. Но латинское название амебе дал в 1903 году немецкий зоолог Фриц Шаудин. Histolytica означает «разрушающая ткани». В 1906 году ученый умер именно от амебного абсцесса кишечника.
Самый распространенный. Кишечная лямблия Giardia lamblia (G.intestinalis)
Лямблия, самый распространенный паразит кишечника, встречается повсеместно. Заражены 3–7% людей в развитых странах и 20–30% в развивающихся. То есть примерно 300 млн. человек.
То есть примерно 300 млн. человек.
Обитают паразиты в двенадцатиперстной кишке и желчных протоках хозяина, где то плавают, работая жгутиками, то прикрепляются к эпителию с помощью клейкого диска, расположенного на нижней стороне клетки. На 1 см2 эпителия налипает до миллиона лямблий. Они повреждают ворсинки, что нарушает всасывание питательных веществ, вызывает воспаление слизистой оболочки и диарею. Если болезнь затрагивает желчные протоки, она сопровождается желтухой.
Лямблиоз — болезнь грязных рук, воды и продуктов. Жизненный цикл простейшего прост: в кишечнике — активная форма, а на выходе с фекальными массами — устойчивые цисты. Чтобы заразиться, достаточно проглотить десяток цист, которые в кишечнике опять перейдут в активную форму.
Главный секрет
повсеместности лямблий в изменчивости поверхностных белков. Организм человека борется с лямблиями антителами и, в принципе, способен выработать иммунитет. Но люди, живущие в одной и той же местности и пьющие одну и ту же воду, заражаются снова и снова потомками своих же паразитов. Почему? Потому что при переходе от активной фазы к цисте и обратно лямблия изменяет белки, к которым вырабатываются антитела, — вариант-специфичные поверхностные белки (variant-specific surface protein). В геноме есть около 190 вариантов этих белков, но на поверхности отдельного паразита всегда присутствует лишь один, трансляция остальных прерывается по механизму РНК-интерференции. А смена случается примерно раз на десять поколений.
Но люди, живущие в одной и той же местности и пьющие одну и ту же воду, заражаются снова и снова потомками своих же паразитов. Почему? Потому что при переходе от активной фазы к цисте и обратно лямблия изменяет белки, к которым вырабатываются антитела, — вариант-специфичные поверхностные белки (variant-specific surface protein). В геноме есть около 190 вариантов этих белков, но на поверхности отдельного паразита всегда присутствует лишь один, трансляция остальных прерывается по механизму РНК-интерференции. А смена случается примерно раз на десять поколений.
Лечится метронидазолом. Болезнь проходит за неделю, но при инфицировании желчных протоков рецидивы возможны в течение многих лет. С цистами борются, иодируя воду.
Открыл Giardia lamblia в 1859 году чешский ученый Вилем Ламбль. С тех пор простейшее сменило несколько названий и нынешнее получило в честь первооткрывателя и французского паразитолога Альфреда Жиара, который лямблию не описывал.
А первую зарисовку лямблии сделал Антони ван Левенгук, обнаружив ее в собственном расстроенном стуле. Было это в 1681 году.
Кстати, лямблия еще и очень эволюционно древняя, происходит чуть ли не прямо от предка всех эукариот.
Самый интимный. Влагалищная трихомонада Trichomonas vaginalis.
Простейшее, которое передается половым путем. Обитает во влагалище, а у мужчин — в мочеиспускательном канале, эпидидимисе и предстательной железе, передается половым путем или через влажные мочалки. Младенцы могут заразиться, проходя через родовые пути. У T. vaginalis 4 жгутика на переднем конце и относительно короткая ундулирующая мембрана, при необходимости он выпускает ложноножки. Максимальные размеры трихомонады — 32 на 12 мкм.
Трихомонада более распространена, чем возбудители хламидиоза, гонореи и сифилиса вместе взятые. Ей поражено около 10% женщин, а возможно и больше, и 1% мужчин. Последняя цифра недостоверна, потому что у мужчин сложнее обнаружить паразита.
Последняя цифра недостоверна, потому что у мужчин сложнее обнаружить паразита.
T. vaginalis питается микроорганизмами, в том числе молочнокислыми бактериями вагинальной микрофлоры, которые поддерживают кислую среду, и таким образом создает оптимальный для себя рН выше 4.9.
Трихомонада разрушает клетки слизистой оболочки, вызывая воспаление. На симптомы жалуются около 15% инфицированных женщин.
Лечится метронидазолом, но беременным он противопоказан. В качестве профилактики рекомендуют регулярные спринцевания разбавленным уксусом.
Описан в 1836 году французским бактериологом Альфредом Донне. Ученый не понял, что перед ним патогенный паразит, но определил размеры, внешность и тип движения простейшего.
Самый убийственный. Возбудитель сонной болезни Trypanosoma brucei
Возбудитель африканской сонной болезни — самое убийственное простейшее. Зараженный им человек без лечения умирает. Трипаносома — вытянутый жгутиконосец длиной 15—40 мкм. Известны два подвида, внешне неотличимые. Заболевание, вызванное T. brucei gambiense, длится 2—4 года. T. brucei rhodesiense — более вирулентный, возбудитель скоротечной формы, от которой умирают через несколько месяцев или недель.
Зараженный им человек без лечения умирает. Трипаносома — вытянутый жгутиконосец длиной 15—40 мкм. Известны два подвида, внешне неотличимые. Заболевание, вызванное T. brucei gambiense, длится 2—4 года. T. brucei rhodesiense — более вирулентный, возбудитель скоротечной формы, от которой умирают через несколько месяцев или недель.
Распространен в Африке, между 15-ми параллелями Южного и Северного полушарий, в естественном ареале переносчика — кровососущих насекомых рода Glossina (муха цеце). Из 31 вида мух для человека опасны 11. От сонной болезни страдает население 37 стран к югу от Сахары на 9 млн. км2. Ежегодно заболевает до 20 тыс. человек. Сейчас больных около 500 тыс., 60 млн. живут в зоне риска.
Из кишечника мухи T. brucei попадает в кровь человека, оттуда проникает в спинномозговую жидкость и поражает нервную систему. Болезнь начинается с лихорадки и воспаления лимфатических желез, затем следуют апатия, сонливость, мышечный паралич, истощение и необратимая кома.
Смертельность паразита связывают с его способностью преодолевать гематоэнцефалический барьер. Молекулярные механизмы до конца не изучены, но известно, что при проникновении в мозг паразит выделяет цистеиновые протеазы, а также использует некоторые белки хозяина. В центральной нервной системе, с другой стороны, трипаносома укрывается от иммунных факторов.
Первое описание сонной болезни в верховьях Нигера оставил арабский ученый ибн Хальдун (1332—1406). В начале XIX века европейцам был уже хорошо знаком начальный признак заболевания — вздутие лимфатических узлов на задней стороне шеи (симптом Уинтерботтома), и работорговцы обращали на него особое внимание.
Открыл T. brucei шотландский микробиолог Дэвид Брюс, в честь которого она и названа, а в 1903 году он впервые установил связь между трипаносомой, мухой цеце и сонной болезнью.
Лечение зависит от стадии заболевания, лекарства вызывают тяжелые побочные эффекты. Паразит обладает высокой антигенной изменчивостью, поэтому вакцину создать невозможно.
Паразит обладает высокой антигенной изменчивостью, поэтому вакцину создать невозможно.
Самый экстравагантный. Лейшмания Leishmania donovani
Лейшмании заслужили звание самых экстравагантных паразитов, потому что живут и размножаются в макрофагах — клетках, призванных паразитов уничтожать. L. donovani — самая опасная из них. Она вызывает висцеральный лейшманиоз, в просторечье лихорадку думдум, или кала-азар, от которой без лечения умирают почти все заболевшие. Зато выжившие приобретают длительный иммунитет.
Существует три подвида паразита. L. donovani infantum (Средиземноморье и Средняя Азия) поражает в основном детей, его резервуаром часто служат собаки. L. donovani donovani (Индия и Бангладеш) опасен для взрослых и пожилых людей, природных резервуаров не имеет. Американский L. donovani chagasi (Центральная и Южная Америка) может жить в крови собак.
L. donovani — жгутиконосец не более 6 мкм в длину. Люди заражаются после укуса москитов рода Phlebotomus, иногда при половом контакте, младенцы — проходя через родовые пути. Попав в кровь, L. donovani проникают внутрь макрофагов, которые разносят паразита по внутренним органам. Размножаясь в макрофагах, паразит их разрушает. Молекулярный механизм выживания в макрофагах довольно сложен.
donovani — жгутиконосец не более 6 мкм в длину. Люди заражаются после укуса москитов рода Phlebotomus, иногда при половом контакте, младенцы — проходя через родовые пути. Попав в кровь, L. donovani проникают внутрь макрофагов, которые разносят паразита по внутренним органам. Размножаясь в макрофагах, паразит их разрушает. Молекулярный механизм выживания в макрофагах довольно сложен.
Симптомы заболевания — лихорадка, увеличение печени и селезенки, анемия и лейкопения, которые способствуют вторичной бактериальной инфекции. Ежегодно висцеральным лейшманиозом заболевает 500 тыс. человек и около 40 тыс. умирает.
Лечение тяжелое — внутривенное введение препаратов сурьмы и переливание крови.
Таксономическую принадлежность L. donovani определил в 1903 году знаменитый исследователь малярии и нобелевский лауреат Рональд Росс. Родовым названием она обязана Уильяму Лейшману, а видовым — Чарльзу Доновану, которые в том же 1903 году независимо обнаружили клетки простейших в селезенке больных, умерших от кала-азара, один — в Лондоне, другой — в Мадрасе.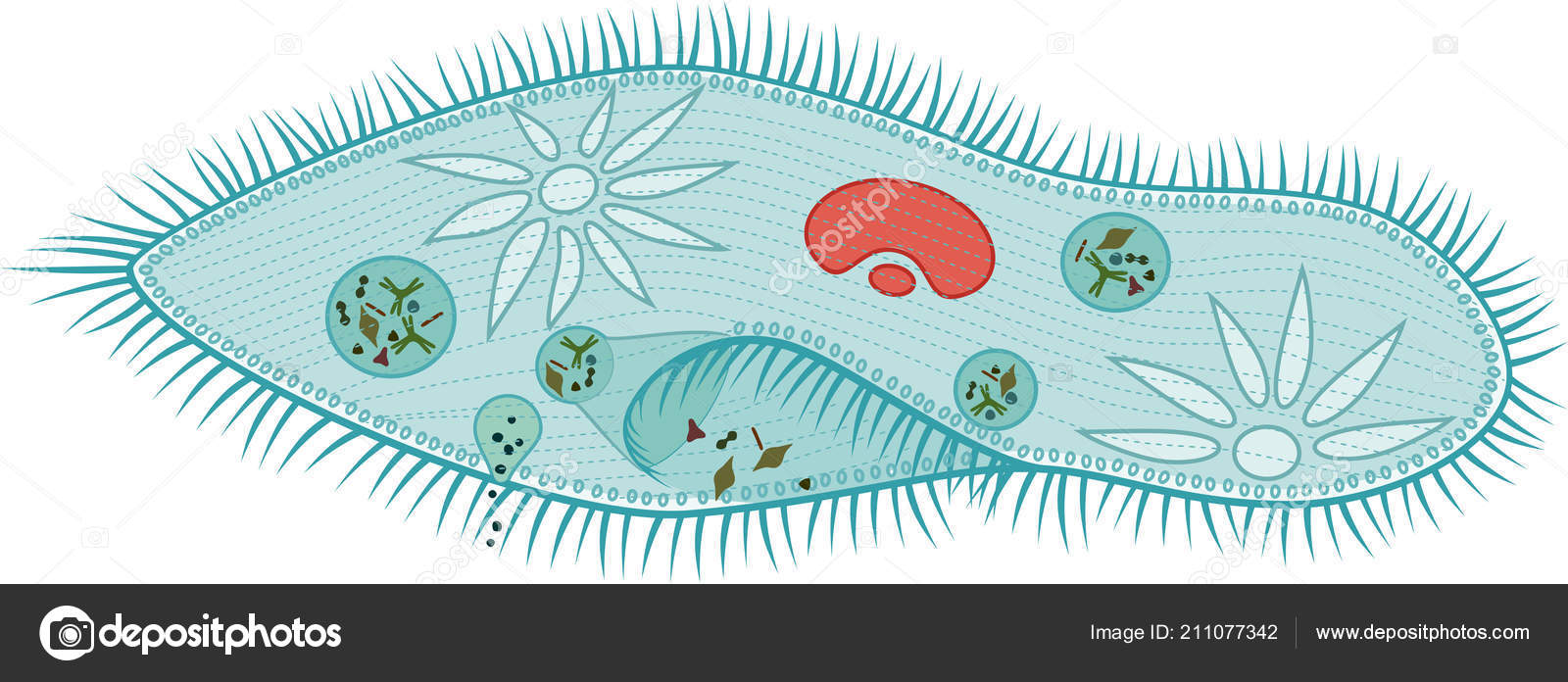
Самый сложный жизненный цикл. Babesia spp.
Бабезии, помимо многоступенчатого бесполого размножения в эритроцитах млекопитающего и полового в кишечнике клещей рода Ixodes, осложнили свое развитие трансовариальной передачей. Из кишечника самки клеща спорозоиты простейшего проникают в яичники и заражают эмбрионы. Когда личинки клещей вылупляются, бабезии переходят в их слюнные железы и с первым укусом входят в кровь позвоночного.
Распространены бабезии в Америке, Европе и Азии. Их природный резервуар — грызуны, собаки и крупный рогатый скот. Человека заражают несколько видов: B. microti, B. divergens, B. duncani и B. venatorum.
Симптомы бабезиоза напоминают малярию — периодическая лихорадка, гемолитическая анемия, увеличенные селезенка и печень. Большинство людей выздоравливает спонтанно, для больных с ослабленной иммунной системой бабезиозы фатальны.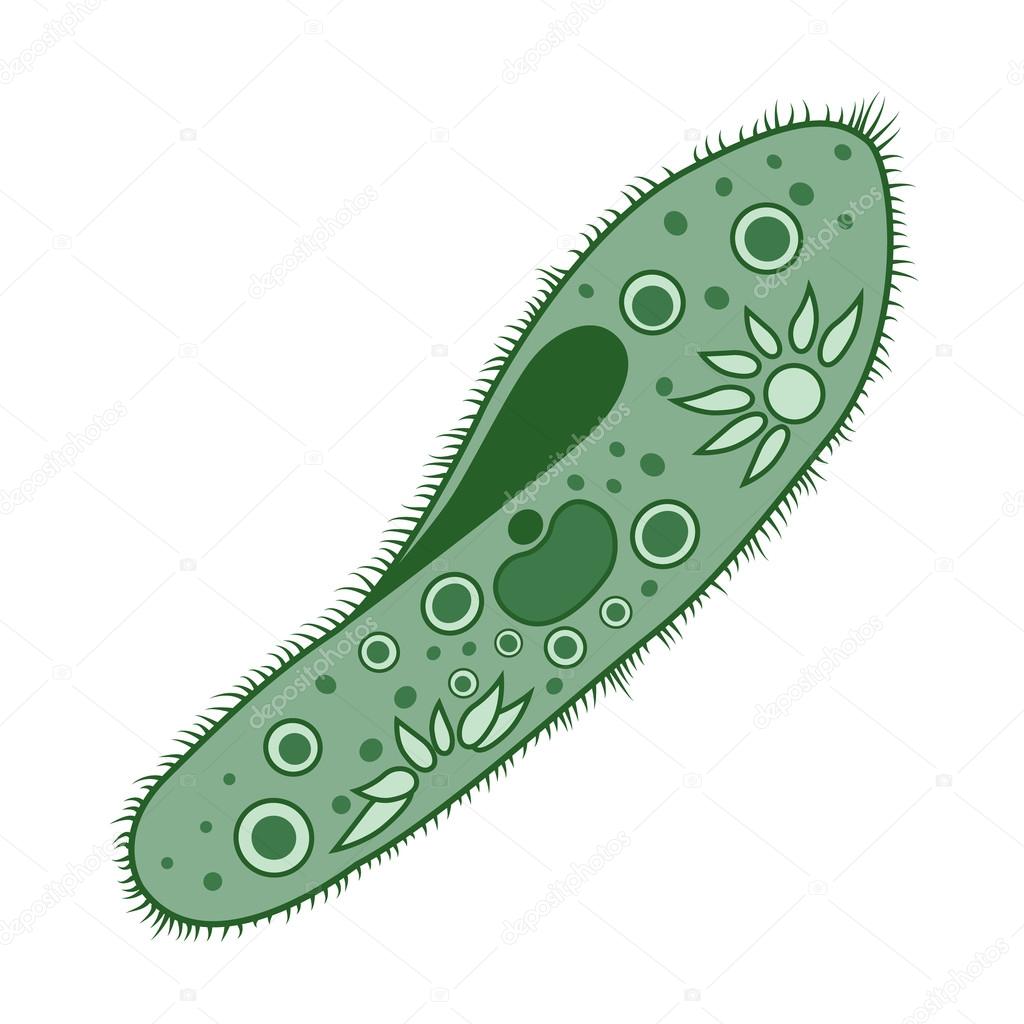
Методы лечения еще разрабатывают, пока что прописывают курс клиндамицина с хинином, а в тяжелых случаях — переливание крови.
Описал бабезию румынский микробиолог Виктор Бабеш (1888), обнаруживший ее у больных коров и овец. Он решил, что имеет дело с патогенной бактерией, которую назвал Haematococcus bovis. Бабезию долго считали патогеном животных, пока не обнаружили ее в 1957 году у югославского пастуха, умершего от заражения B. divergens.
Самый влиятельный. Возбудитель токсоплазмоза Toxoplasma gondii
T. gondii — самый влиятельный паразит, поскольку управляет поведением промежуточных хозяев.
Распространен повсеместно, распределен неравномерно. Во Франции, например, заражено 84% жителей, в Соединенном Королевстве —22%.
Жизненный цикл токсоплазмы состоит из двух стадий: бесполая протекает в организме любых теплокровных, половое размножение возможно только в эпителиальных клетках кошачьего кишечника.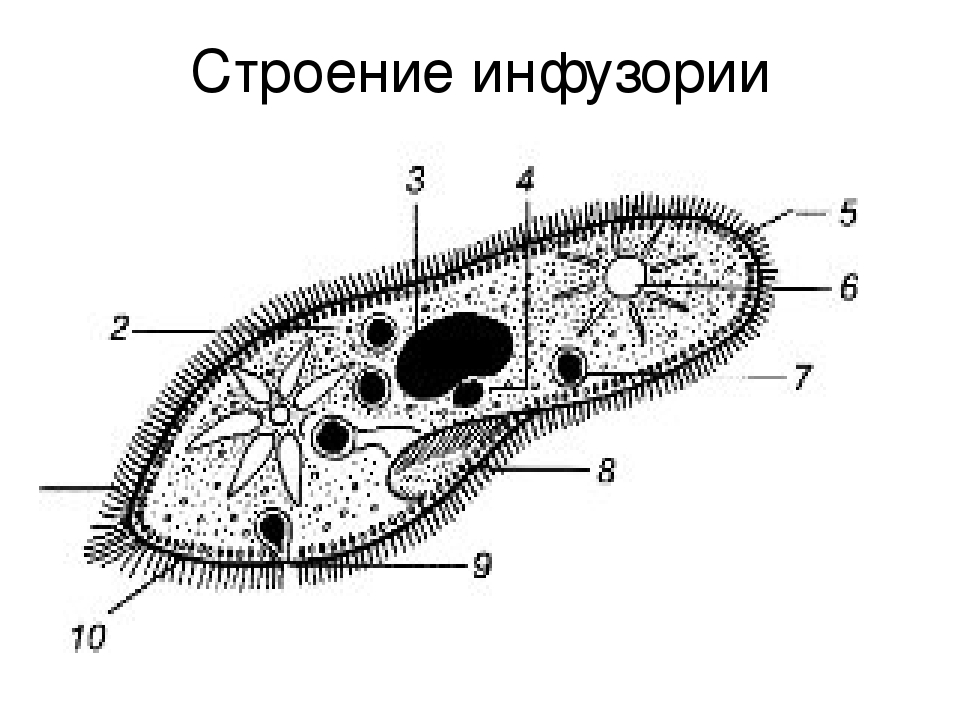 Чтобы T. gondii могла завершить развитие, кошка должна съесть зараженного грызуна. Повышая вероятность этого события, T. gondii блокирует естественный страх грызунов перед запахом кошачьей мочи и делает его привлекательным, воздействуя на группу нейронов в миндалине. Как она это делает — неизвестно. Один из предполагаемых механизмов воздействия — локальный иммунный ответ на инфекцию. Он изменяет содержание цитокинов, что, в свою очередь, повышает уровень нейромодуляторов, таких как дофамин. Влияет токсоплазма и на поведение людей, что проявляется даже на популяционном уровне. Так, в странах с высоким уровнем токсоплазмоза чаще встречается невротизм и желание избегать неопределенных, новых ситуаций. Возможно, инфицированность T. gondii может привести к культурным изменениям.
Чтобы T. gondii могла завершить развитие, кошка должна съесть зараженного грызуна. Повышая вероятность этого события, T. gondii блокирует естественный страх грызунов перед запахом кошачьей мочи и делает его привлекательным, воздействуя на группу нейронов в миндалине. Как она это делает — неизвестно. Один из предполагаемых механизмов воздействия — локальный иммунный ответ на инфекцию. Он изменяет содержание цитокинов, что, в свою очередь, повышает уровень нейромодуляторов, таких как дофамин. Влияет токсоплазма и на поведение людей, что проявляется даже на популяционном уровне. Так, в странах с высоким уровнем токсоплазмоза чаще встречается невротизм и желание избегать неопределенных, новых ситуаций. Возможно, инфицированность T. gondii может привести к культурным изменениям.
Инфекция у человека чаще протекает бессимптомно, но при ослабленном иммунитете разрушает клетки печени, легких, мозга, сетчатки, вызывая острый или хронический токсоплазмоз.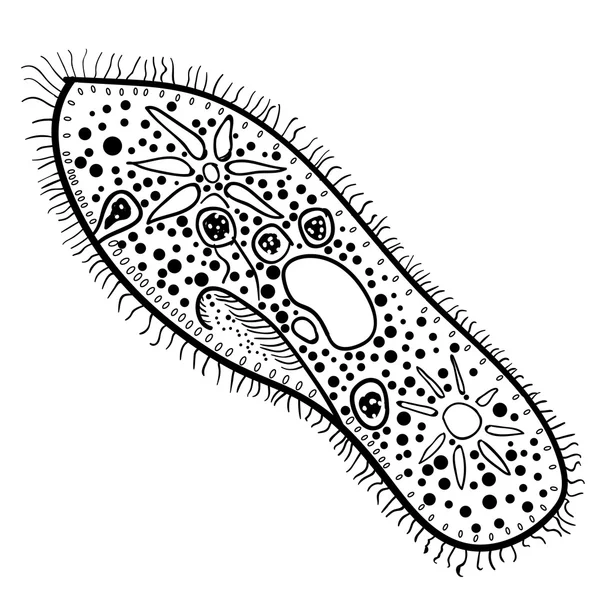 Течение инфекции зависит от вирулентности штамма, состояния иммунной системы хозяина и его возраста — пожилые люди менее восприимчивы к T. gondii.
Течение инфекции зависит от вирулентности штамма, состояния иммунной системы хозяина и его возраста — пожилые люди менее восприимчивы к T. gondii.
Лечат токсоплазмоз пириметамином и сульфадиазином.
Описан в 1908 году у пустынных грызунов. Эта честь принадлежит сотрудникам Института Пастера в Тунисе Шарлю Николю и Луису Мансо.
Самый патогенный. Малярийный плазмодий Plasmodium spр.
Малярийный плазмодий — самый патогенный паразит человека. Число больных малярией может достигать 300–500 млн., а смертность во время эпидемий — 2 млн. Болезнь до сих пор уносит в три раза больше жизней, чем вооруженные конфликты.
Малярию у человека вызывают пять видов плазмодия: Plasmodium vivax, P. falciparum, P. malariae, P. ovale и P. knowlesi, который поражает также макак.
Распространен в ареале переносчиков — комаров Anopheles, которым нужна температура 16–34°С и относительная влажность более 60%.
Сравнение генома самого вирулентного из плазмодиев, P. falciparum, с плазмодиями горилл, позволяет предполагать, что его предком люди заразились именно от этих обезьян. Возникновение этой формы плазмодия связывают с появлением сельского хозяйства в Африке, повлекшего за собой увеличение плотности населения и развитие оросительных систем.
Половое размножение плазмодиев происходит в кишечнике комаров, а в организме человека это внутриклеточный паразит, который живет и размножается в гепатоцитах и эритроцитах до тех пор, пока клетки не лопаются. В 1 мл крови больного содержится 1 — 50 тыс. паразитов.
Болезнь проявляется как воспаление, периодическая лихорадка и анемия, в случае беременности опасна для матери и плода. Эритроциты, зараженные P. falciparum, закупоривают капилляры, и в тяжелых случаях развивается ишемия внутренних органов и тканей.
Лечение требует комбинации нескольких препаратов и зависит от конкретного возбудителя. Плазмодии приобретают устойчивость к лекарствам.
Плазмодии приобретают устойчивость к лекарствам.
Пн, 3 ноя, 2008, 21:49{картинки из микроскопа} всякое околонаучное и инфузории под микроскопом вот мудаки забугорные, подумал я, когда скачав CLC RNA Workbench 3 прочел, что demo-версия работает 30 дней в полном режиме, кроме функции создания вторичных структур РНК, ради которой я ее и скачивал 🙁 это ж надо так подставить. вот самую нужную функцию в демо-режиме они и сделали недоступной. сцуки. 🙁 сегодня между парами, пока не пришла вторая группа студентов, фотографировал инфузорий своих. забавно, но надо еще тренироваться и копаться с настройками фотега и самой техникой фотографирования, ибо инфузории очень быстро дохли и лопались.. сделал три партии фотографий, но первую загубили отключив от сети комп с несохраненными фотографиями, вторую партию погубил уже я, сохранив их как-то криво, зато вот третья получилась) несупер-пупер, но все же. 400х увеличение. задняя часть инфузории. по краю клетки четко видны реснички. бедняжка мучилась-мучилась и лопнула. на фотографии виден разрыв клетки инфузории. а это общий вид трупа инфузории. получается в том случае, если лопнула она быстро и ошметки никуда не расползлись. на этом пока всё.  посмотреть красивую картинку с инфузорией можно в одном из постов рубрики sci_pict наступил период, когда всё бесит и всё раздражает. такие дела. Пн, 3 ноя, 2008 18:54 (UTC)kriskis :))) если честно, я даже не знаю, как реагировать на фотографии инфузорий%))) Пн, 3 ноя, 2008 19:01 (UTC)microb_trev ну не знаю.. сказать «ах, какая прелесть?» :)) или «фу, какая гадость!» :))) Пн, 3 ноя, 2008 19:04 (UTC)microb_trev или «фотга — гавно». и добавить — «фотоаппараты фирмы leica — тоже гавно» =) Пн, 3 ноя, 2008 19:26 (UTC)microb_trev хорошо))) спасибо)) в следующий раз я буду лучше следить за композицией, если время жизни инфузорий будет позволять 🙂 Пн, 3 ноя, 2008 20:10 (UTC)peleias: О! горизонт завален! xDDD Пн, 3 ноя, 2008 20:47 (UTC)microb_trev: Re: О! шыт! подловила, да :)) Пн, 3 ноя, 2008 19:13 (UTC)alberg а мне нравится.  а зачем нужны инфузории? а зачем нужны инфузории?Пн, 3 ноя, 2008 19:19 (UTC)microb_trev наверное их кто-то ест 🙂 а еще они нужны маленьким зелененьким хлореллам, которые прячутся в инфузориях от злых вирусов, потому что злые вирусы хотят съесть хлорелл. ) Пн, 3 ноя, 2008 19:48 (UTC)alberg ооо, это очень романтическая история. Практически рыцарский роман. Пн, 3 ноя, 2008 21:33 (UTC)ekateriana: Ах какие:) О!:)))) Неужели бессменная картинка на постерах отжила свое?.. Похоже на то:) Классно вообще. Прям захотелось тоже на эту игрушку посмотреть. Не инфузорию, лейку:) Пн, 3 ноя, 2008 21:44 (UTC)microb_trev да, она мне уже порядком надоела, до и некрасивая к тому же )) плюс в этому мне сделали втык на предзащите, что я за 5 лет изучения этой твари не сделал ни одной ее фотографии сам 🙂 лейку могу сфотографировать специально для тебя 🙂 Вт, 4 ноя, 2008 14:15 (UTC)alyonkka прикольно, кафедра обзавелась приличной техникой 🙂 Картинки оченб достойные. 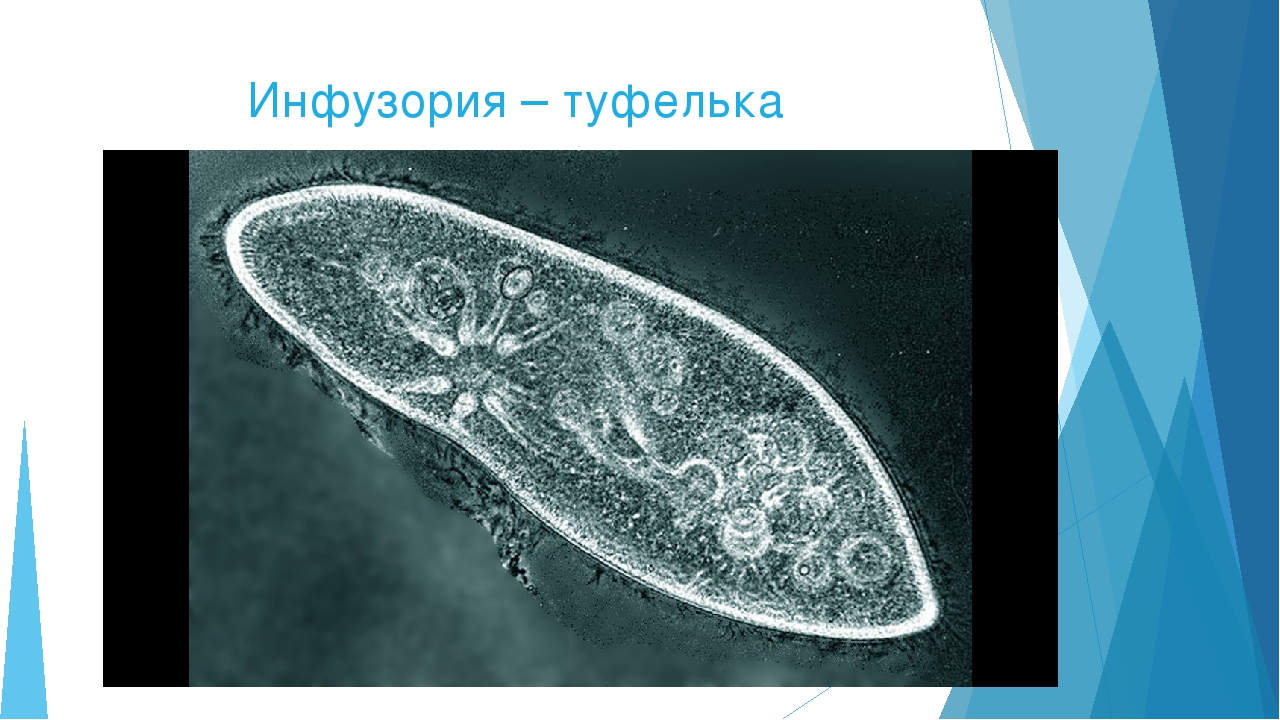 .. А в аспирантуру ты пойдешь тоже на микру? .. А в аспирантуру ты пойдешь тоже на микру?Вт, 4 ноя, 2008 14:32 (UTC)microb_trev да, наконец-то начались подвижки в оснащении кафедры. теперь мы богаты ноутами-компами, пцр-машинкой, видеокамерой для фотографирования электрофорезов и теперь вот фотегом на микроскоп. единственное тока, он шумит прилично, ибо я ожидал лушего качества от лейковской камеры за пять штук евро. в аспирантуру на микру, да. Ср, 5 ноя, 2008 06:51 (UTC)alyonkka О, пиневич наконец-то дождался этого эпического девайса — пцр-машины!!! Интересно, откуда кафедра взяла деньги? 😉 слу, тут уже возникает совсем отдельный, но совсем не жжшный вопрос — что тебя там держит? уже 5 лет там, и теперь еще 3… Ты не похож на человека, который выбирает что-то от безысходности, потому что не придумал ничего лучше. Хначит, должны быть мотивы и бонусы. Но что? Ср, 5 ноя, 2008 12:54 (UTC)microb_trev деньги собирали с нескольких грантов.  в том числе и с нашего. в том числе и с нашего.есть один небольшой такой бонус — отсрочка от армии. вот если я вдруг щас заработаю 80-90 штук деревянных, то смогу отмазаться. а пока не заработал вот щас прямо, то надо учицца продолжать. Вт, 4 ноя, 2008 14:16 (UTC)alyonkka интересно, каково живется, когда ты наполовину забит мирными водорослями? 🙂 Ср, 5 ноя, 2008 10:59 (UTC)tenrousei мне нравится 🙂 даёшь еще научных фото из-под микроскопа 🙂 Ср, 5 ноя, 2008 12:56 (UTC)microb_trev че интересное будет — покажу 🙂 Вс, 14 дек, 2008 23:41 (UTC)geri_geri а почему это инфузории надуваются и лопаются? Вс, 14 дек, 2008 23:52 (UTC)microb_trev скорее всего я, когда готовил препарат и клал их под покровное стекло, слишком сильно придавил, и повредил органеллы, плюс при таком ярком свете, что бьет в них из микроскопа, им очень жарко. надуваются вероятно от того, что стали плохо работать сократительные вакуоли, которые откачивают лишнюю воду из клетки. 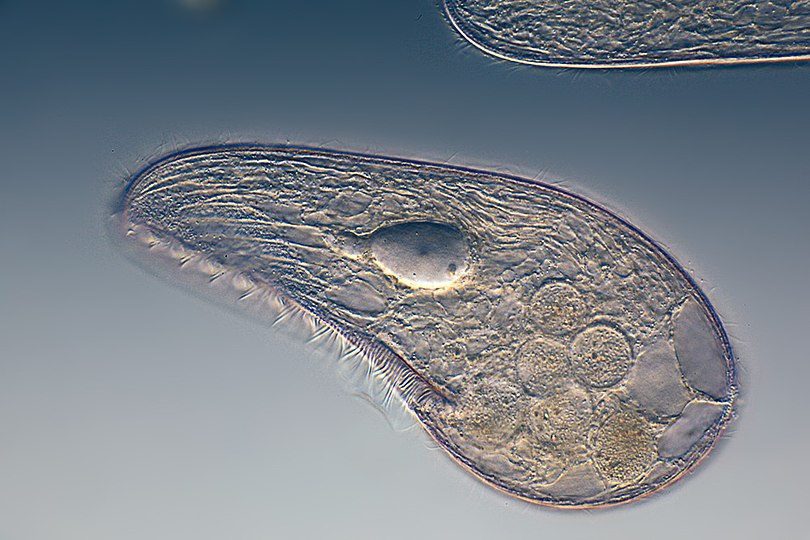 Вс, 14 дек, 2008 23:52 (UTC)geri_geri убийца инфузорий! |
Инфузория обыкновенная. Описание, строение и размеры инфузории-туфельки
Инфузория-туфелька относится к типу Инфузории, который принадлежит Простейшим (одноклеточным эукариотам). Часто инфузориями-туфельками называют несколько похожих видов. Характерными особенностями всех инфузорий являются наличие ресничек (которые являются органами передвижения) и более сложное строение их клетки-организма по сравнению с другими простейшими (например, амебами и эвгленами).
Инфузория-туфелька обитает в пресноводных, обычно загрязненных, водоемах. Размеры клетки от 0,2 до 0,6 мм. Форма тела похожа на подошву туфельки. При этом передний конец, которым инфузория плывет вперед, — это «пятка туфельки»; а «носок» — это задний конец.
Тело инфузории-туфельки окружено ресничками. На рисунках и схемах реснички изображены только вокруг клетки.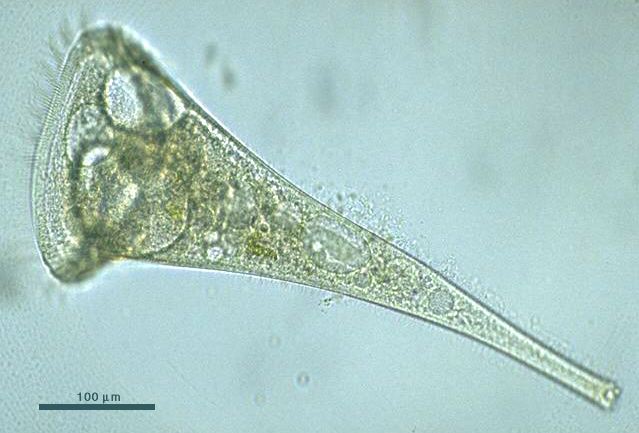 На самом деле они проходят своеобразными тяжами по всему телу (т. е. также сверху и снизу, чего мы не видим на плоском рисунке).
На самом деле они проходят своеобразными тяжами по всему телу (т. е. также сверху и снизу, чего мы не видим на плоском рисунке).
Двигается клетка благодаря волнообразным сокращениям ресничек (каждая следующая в ряду изгибается чуть позже предыдущей). При этом каждая ресничка резко двигается в одну сторону, после чего медленно возвращается на место. Скорость передвижение инфузории составляет около 2 мм в секунду.
Реснички крепятся к базальным тельцам . При этом половина из них ресничек не имеет. Базальные тельца, имеющие реснички и неимеющие их, чередуются.
Внешняя часть цитоплазмы (под клеточной мембраной) имеет структуры, позволяющие инфузории-туфельке сохранять свою форму. Эту часть цитоплазмы называют цитоскелетом .
В мембране есть трихоцисты , представляющие собой палочки, которые выбрасываются и «жалят» хищников, нападающих на инфузории-туфельки.
У клетки инфузории-туфельки есть достаточно глубокая впадина (как бы мембрана вогнута внутрь клетки). Это образование называют клеточным ртом , переходящим в клеточную глотку . Они окружены более длинными и толстыми ресничками, которые загоняют в них пищу. Чаще всего едой служат бактерии, одноклеточные водоросли. Инфузории их находят по выделяемым ими веществам.
Это образование называют клеточным ртом , переходящим в клеточную глотку . Они окружены более длинными и толстыми ресничками, которые загоняют в них пищу. Чаще всего едой служат бактерии, одноклеточные водоросли. Инфузории их находят по выделяемым ими веществам.
От клеточной глотки отделяются пищеварительные вакуоли . Каждая такая вакуоль после своего образования проходит сначала в заднюю часть клетки, затем двигается в переднюю, после чего снова в заднюю. Это перемещение обеспечивается постоянным движением цитоплазмы. К пищеварительной вакуоли подходят лизосомы и различные ферменты, питательные вещества в вакуолях расщепляются и попадают в цитоплазму. Когда пищеварительная вакуоль обойдет круг и вернется в заднюю часть клетки, то ее содержимое будет выброшено за пределы через порошицу .
У инфузории-туфельки две сократительные вакуоли . Одна находится в передней части клетки, другая — в задней. Эти вакуоли более сложные, чем у эвглены. Она состоит из центрального резервуара и отходящих от него канальцев. Избытки воды и вредные вещества сначала оказываются в канальцах, после чего идут в резервуары. Заполненные резервуары отделяются от канальцев и через поверхность клетки, сокращаясь, выбрасывают раствор. Вакуоли сокращаются поочередно.
Избытки воды и вредные вещества сначала оказываются в канальцах, после чего идут в резервуары. Заполненные резервуары отделяются от канальцев и через поверхность клетки, сокращаясь, выбрасывают раствор. Вакуоли сокращаются поочередно.
Дышит инфузория-туфелька кислородом, растворенным в воде. Однако при дефиците кислорода может переходить на бескислородный способ дыхания.
Инфузории-туфельки размножаются делением клетки надвое. В отличие от эвглены зеленой родительская клетка делится не вдоль, а поперек (т. е. одна дочерняя клетка получает заднюю часть клетки-родителя, а другая — переднюю, после чего они достраивают недостающие части).
Кроме бесполого способа размножения, у инфузорий есть половой процесс. При нем не происходит увеличения количества особей, но происходит обмен генетической информации.
У инфузории-туфельки два ядра — большое (макронуклеус) и малое (микронуклеус). Макронуклеус полиплоден (в нем несколько наборов хромосом). Микронуклеус диплоден. Макронуклеус отвечает за контроль жизнедеятельности клетки. На содержащемся в нем ДНК происходит синтез РНК, которая отвечает за синтез белков. Микронуклеус отвечает за половой процесс.
При половом процессе две инфузории-туфельки подходят друг к другу со стороны клеточных ртов. Между клетками образуется цитоплазматический мостик. В это время в каждой клетке макронуклеус растворяется, а микронуклеус делится мейозом. В результате получаются четыре гаплоидных ядра. Три из них растворяются, а оставшееся делится митозом. В результате получаются два гаплоидных ядра. Одно из низ остается в своей клетке, а другое по цитоплазматическому мостику уходит в другую инфузории. Из второй инфузории перемещается одно из ее гаплоидных ядер. Далее в каждой клетке сливаются два ядра (одно свое и одно чужое). Уже образованное диплоидное ядро (микронуклеус) потом делится, образуя макронуклеус.
Инфузория туфелька — простейший одноклеточный организм размером около 0,1 мм. Встречается в тех же водоемах, что и эвглена, и амеба простейшая. Питается преимущественно бактериями и микроскопическими водорослями. Служит пищей для личинок, мелких рыбок, рачков.
Внешний вид инфузории туфельки
За свое сходство с подошвой женской обуви этот вид инфузорий приобрел второе название — «туфелька». Форма этого одноклеточного организма постоянна и не меняется с ростом или другими факторами. Все тело покрыто мельчайшими ресничками, похожими на жгутики эвглены. Удивительно, но этих ресничек на каждой особи насчитывается около 10 тысяч! С их помощью клетка передвигается в воде и захватывает пищу.
Инфузория туфелька, строение которой так знакомо по учебникам биологии, не видна невооруженным глазом. Инфузории представляют собой мельчайшие одноклеточные организмы, но при большом скоплении их можно увидеть и без увеличительных приборов. В мутной воде они будут выглядеть как продолговатые белые точки, находящиеся в постоянном движении.
Строение инфузории туфельки
Особенности строения инфузории туфельки заключаются не только в ее внешнем сходстве с подошвой обуви. Внутренняя организация этого простейшего, на первый взгляд, организма всегда представляла огромный интерес для науки. Одна-единственная клетка покрыта плотной мембраной, внутри которой содержится цитоплазма. В этой студенистой жидкости размещены два ядра, большое и малое. Большое отвечает за питание клетки и выделения, малое — за размножение.
Отверстие, выполняющее роль рта, расположено с широкой стороны клетки. Оно ведет в глотку, на конце которой образуются пищеварительные вакуоли.
Строение тела инфузории туфельки отличается также весьма интересной особенностью — наличием трихоцист. Это особые органы, а точнее — органеллы, служащие клетке для питания и защиты. Заметив пищу, инфузория выбрасывает трихоцисты и удерживает ими добычу. Их же она выдвигает, когда хочет защитить себя от хищников.
Питание инфузории туфельки
Одноклеточные организмы питаются бактериями, которые обитают в большом количестве в загрязненной мутной воде. Не исключение и инфузория туфелька, строение рта которой позволяет захватывать проплывающие мимо бактерии и быстро отправлять их в пищеварительную вакуоль. Рот инфузории окружен ресничками, которые в этом месте длиннее, чем на других участках тела. Они образуют околоротовую воронку, позволяющую захватывать как можно больше пищи. Вакуоли образуются в цитоплазме по мере необходимости. Одновременно пища может перевариваться сразу в нескольких вакуолях. Время переваривания составляет около одного часа.
Инфузория питается почти беспрерывно, если температура воды выше 15 градусов. Питание прекращается перед началом размножения.
Дыхание и выделение инфузории туфельки
Что касается дыхания, то здесь инфузория туфелька строение имеет, схожее с другими простейшими. Дыхание осуществлятся всей поверхностью тела организма. Две сократительные вакуоли обеспечивают этот процесс. Отработанный газ проходит по специальным канальцам и выбрасывается через одну из сократительных вакуолей. Выделение лишней жидкости, являющейся результатом жизнедеятельности, происходит каждые 20-25 секунд тоже посредством сокращения. При неблагопрятных условиях инфузория перестает питаться, и сократительные движения вакуолей значительно замедляются.
Размножение инфузории туфельки
Инфузория туфелька размножается делением. Примерно один раз в сутки ядра, большое и малое расходятся в разные стороны, растягиваются и разделяются надвое. В каждой новой особи остаются по одному ядру и по одной сократительной вакуоли. Вторая образуется через несколько часов. Каждая инфузория туфелька строение имеет идентичное родительскому.
У инфузорий, прошедших многократное деление, наблюдается такое явление, как половое размножение. Две особи соединяются друг с другом. Внутри получившейся большой клетки происходит деление ядер и обмен хромосомами. После завершения такого сложного химического процесса инфузории разъединяются. Количество особей от этого не увеличивается, но они становятся более жизнеспособными в изменяющихся внешних условиях.
Строение и жизнедеятельность инфузории туфельки мало зависит от внешних факторов. Все туфельки выглядят одинаково, имеют одну и ту же форму и размер вне зависимости от условий. Жизнедеятельность тоже протекает по одному сценарию. Имеет значение только температурный и световой факторы. Инфузории очень чувствительны к изменениям освещенности. Можно провести небольшой эксперимент: затемнить сосуд, в котором живут инфузории, оставив маленькое светлое окошко. К этому отверстию уже через пару часов стянутся все особи. Также инфузории воспринимают и изменение температуры. При снижении ее до 15 о C туфельки перестают питаться и размножаться, впадая в своеобразный анабиоз.
На земле встречаются разнообразные живые организмы. Большие и не очень, сложные и простейшие. За одними человек может наблюдать невооруженным глазом, для исследования других требуется специальное оборудование. Любое живое существо состоит из клеток – миллионов, миллиардов .
Инфузория-туфелька — один из простейших одноклеточных организмов. Лучшим ответом на вопрос, что это такое, будет представление окружности или любой другой замкнутой фигуры. Ограничивающий контур — стенки клетки или клеточные мембраны, внутри контура находится все необходимое для жизнедеятельности организма.
Вконтакте
Почему туфелька?
Инфузории бывают разных размеров, но большинство их невидимы невооруженным глазом. Своим названием этот организм обязан внешнему виду. Клетки бывают довольно подвижными и даже могут менять свою форму. У инфузории-туфельки таких возможностей нет.
Мембрана всегда неподвижна, и вся клетка напоминает подошву обуви. Существо постоянно в движении. Достигается это посредством ресничек , покрывающих его внешнюю поверхность .
Все они движутся синхронно , с одинаковой частотой и силой. Интересно, что плавает туфелька тупым концом вперед , а особенности строения и направление движения заставляют ее вращаться вокруг продольной оси.
Где живет инфузория?
Проживают инфузории в водоемах и очень часто становятся пищей для рыб и других обитателей морей и . Основная среда обитания туфельки — пресные водоемы со стоячей водой. Питанием служат водоросли и бактерии . Встретить ее можно и в домашних аквариумах. Волнообразное движение ресничек позволяет ей передвигаться со скоростью до 2 мм/с.
Направление движения может меняться двумя способами:
- изгиб самой клетки — обычный вариант;
- столкновение с каким-то препятствием.
В последнем случае туфелька может развернуться на 180 градусов . Реснички туфельки помогают ей не только в передвижении. Они отвечают также за питание, создавая ток жидкости в направлении ротового отверстия инфузории. Часть ресничек прогоняет бактерии вдоль тела инфузории. Часть, склеенная в более сложные формы, помогает «заглатывать» еду. Ротовое отверстие, или клеточный рот, инфузории находится примерно посередине вогнутой части.
Внимание! Разводят туфельку и искусственным путём. Опытные аквариумисты знают, что идеальным кормом для мальков рыб является именно инфузория-туфелька. Более того, среди новорожденных существуют привереды, которые, кроме нее, ничем не питаются. На множестве интернет-проектов, посвященных аквариумистике, люди рассказывают о способах ее разведения.
Дыхание и выделение
Отдельных органов, ответственных за данные функции, инфузория не имеет. Дыхание происходит всей поверхностью тела инфузории-туфельки. Кислород , поступая через цитоплазму клетки , расщепляет пищу на , углекислый газ , а также ряд других соединений.
Процесс сопровождается высвобождением энергии, необходимой существу для поддержания жизни. Второй функцией дыхания является вывод углекислого газа . Он так же как и может выходить через всю поверхность тела инфузории.
Остальные вещества выводятся в пару специальных полостей , расположенные в разных концах туфельки. Их называют вакуоли . В процессе расщепления сложных органических веществ они наполняются водой с продуктами распада. В момент достижения критического наполнения вакуоль перемещается к поверхности тела и опустошается . Таким образом, выделения выводятся из организма инфузории-туфельки.
В спокойном положении вакуоли расположены в передней (у «каблука») и задней («пальцы») частях клетки инфузории. Ученые вычислили что вакуоли, попеременно сокращаясь, способны за час выбросить объем воды , примерно равный самому размеру клетки .
Химия жизни
Инфузория является первоклассным химиком . Двигаясь вперед, она находит пропитание по незаметным изменениям состава воды . В месте большого скопления бактерий химический состав несколько изменяется, что позволяет инфузории-туфельке безошибочно находить себе пропитание.
Хоть туфелька и живет в стоячих водах , поедая бактерии и водоросли, она очищает водоем. В таких местах вода всегда чиста и прозрачна, ведь первыми загрязнителями естественных водоемов являются именно бактерии и споры водорослей — лучший корм для инфузорий.
Инфузории-туфельки очень разборчивы. Идеальная среда обитания должна быть пресной. Важным факторов их размножения является большое количество органических остатков, бактерий и мелких водорослей. Если последних мало, инфузории стараются уйти из такого места . Ощутив неблагоприятные условия , инфузории также постараются переместиться.
К плохим условиям для процессов, способствующих их проживанию, относятся похолодание, появление в воде примесей соли, а также недостаток света. Проявление любого из указанных свойств заставит инфузории переместиться – из менее освещенных слоев жидкости на поверхность, из соленого места в более чистое, пресное. Если же температура приближается к нулю, то инфузории мигрируют.
Важно! Владельцам рыбных хозяйств нужно понимать, что туфелька — стартовый корм для мальков. Если в водоеме планируется разводить рыбу, нужно позаботиться и создать инфузориям благоприятные условия для размножения.
Миграции
При ухудшении условий для жизнедеятельности инфузории могут перебраться на новое место обитания . Процесс состоит из нескольких этапов:
- Сотни тысяч туфелек собираются группками.
- Каждая собирается в правильный шарик .
- Многоклеточная особь переносится на новое место
- На новом месте распадается на отдельные существа.
Перемещаться инфузории могут ветром или «пассажирами» на птицах и животных. Для шарика, в виде которого инфузории путешествуют, ученые придумали название — циста .
Может быть и другой вариант — инфузории впадают в «спячку» . Группы не собираются, а отдельные существа создают собственные панцири-цисты, в которых могут находиться, пока условия не станут благоприятными.
Хищники
Есть у простейших свои охотники и свои жертвы . В роли последних чаще всего оказываются именно туфельки . На противоположном конце находятся особые виды инфузорий. Люди нашли два вида охотников:
- бурсария ;
- дилептус .
Первая в несколько раз больше инфузории-туфельки. Ее размеры могут достигать 1 мм. Выглядит она, как рыболовная верша — воронка. В узком конце находится рот. Инфузория гоняется за туфельками, передвигаясь резкими размашистыми движениями .
Настигнув жертву, она замирает и пытается «пообедать». Дается ей это не так легко. Она обладает длинными ротовыми ресницами, которые загоняют туфельку в рот. Та отчаянно пытается вырваться. Часто довольно успешно.
Но если туфелька попала с током воды внутрь глотки, бурсария может праздновать победу, выбраться обратно инфузория-туфелька просто не успеет. Протоплазма бурсарии сжимается, умерщвляя добычу, после чего та переваривается.
Передвигаясь неспешными движениями, на туфелек может охотиться и дилептус — другой хищник. В отличие от бурсарии, которая просто хватает добычу ртом, одноклеточная инфузория дилептус действует хитрее. Имея длинный хобот , снабженный стрекательными иглами, инфузория использует его для умерщвления добычи. Им наносятся удары оказавшимся по соседству инфузориям, а уколы парализуют жертву . Далее начинается трапеза. Дилептус открывает широко растягивающийся рот и заглатывает добычу, которая может оказаться больше его размером.
Срок жизни туфельки
Выше были описаны два самых частых охотника. Но ответ на вопрос, сколько живут инфузории , зависит не только от количества желающих ими пообедать. Свое влияние оказывает и способ размножения (бесполое или половое), и среда обитания, и отсутствие или изменение качества питания. В обычной благоприятной среде инфузории-туфельки размножаются простым делением . Такой вариант назван бесполым . Но возможность такого размножения должна ограничиваться определенным количеством раз, в противном случае инфузория погибнет.
С другой стороны, половое размножение бывает только при серьезных угрозах жизни — резком похолодании или отсутствии пищи. Учитывая все варианты, срок жизни инфузории варьируется от нескольких дней до одного месяца .
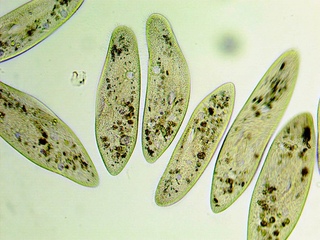
Инфузория туфелька (Paramecium caudatum).
Бесполое размножение инфузории туфельки
Вывод
Простейшее одноклеточное существо — инфузория-туфелька является одним из звеньев в цепи эволюции. Несмотря на свой короткий срок , каждая особь приносит большую пользу окружающему миру. С одной стороны, она может очищать закрытые водоемы, питаясь бактериями и микроскопичными водорослями. С другой стороны, является первоклассным кормом для мальков рыбы.
Все помнят классическое изображение инфузории-туфельки из учебника биологии, копируемого из издания в издание. Однако немногие задумываются, почему честь представлять неисчислимое количество одноклеточных организмов — простейших и бактерий — выпала именно инфузории-туфельке. Фото , полученное с помощью одного из микроскопов и видеоокуляра Альтами, позволит детально рассмотреть образец высшего совершенства элементарной ячейки жизни.
Прежде чем мы рассмотрим готовый микропрепарат инфузории-туфельки, строение ее тела-клетки под микроскопом , узнаем, что представляет собой это простейшее в среде обитания. Какую роль выполняет инфузория-туфелька в природе, какое место занимает в пищевой цепочке?
Инфузория или парамеция хвостатая (от лат. Paramecium caudatum) обитает в пресных водах. Свое название одноклеточное получило за удлиненные реснички на задней половине тельца. Между ресничками, которых насчитывается по всему тельцу более десяти тысяч, расположены трихоцисты или мелкие веретеновидные тельца. Они представляют собой органеллы (органы у многоклеточных) нападения и защиты, которые с силой выбрасываются и вонзаются в вражеское тело или в жертву. Сбоку на тельце инфузории находится предротовое углубление, переходящее в рот. Пищу инфузория переваривает образуя специальные пищеварительные вакуоли, отделяемые от глотки, которые проходят через весь организм, увлекаемые током цитоплазмы. При благоприятных температурных условиях и обилии пищи вакуоли образуются каждую минуту. Функцию выделения выполняют две сократительные вакуоли. Инфузория питается другими простейшими, одноклеточными водорослями, и сама служит кормом для личинок рыб и амфибий. Именно поэтому простейших рода Paramecium интенсивно выращивают на рыболовных хозяйствах, а также в аквариумистике.
Теперь можем приступить к исследованию инфузории под микроскопом . Не беда, если готового микропрепарата не окажется под рукой. Любой аквариумист поделится с вами пару-тройкой секретов разведения инфузорий-туфелек либо самими особями, вместе с водой из аквариума. Также можно добыть простейших в любом стоячем водоеме и для получения критической массы, достаточной для исследования, создать наиболее благоприятные условия для размножения туфелек. Эти простейшие легко разводятся в домашних условиях на высушенных банановых корках или настое сенной трухи.
Мы поделимся с вами самым простым, но от этого не менее эффективным, способом разведения инфузории на кусочке моркови. Замоченный кусочек моркови (грамм на литр) долго не разлагается бактериями, а вода остается прозрачной. Емкость помещается в темное место с температурой чуть выше комнатной. Через несколько суток можно увидеть невооруженным взглядом белесоватую взвесь, окружающую морковь, которая представляет собой скопление инфузорий-туфелек, хаотично плавающих в толще воды.
Размножается инфузория-туфелька один-два раза в сутки изначально бесполым способом, то есть делением клетки пополам по экватору. Через несколько таких делений клетка готова размножаться половым способом — сложным обменом частицами малого ядра. Причем при половом размножении число особей остается прежним, не увеличивается, но клетка получает усовершенствованную способность приспосабливаться к окружающим условиям среды.
Далее помещаем капельку воды между предметным и покровным стеклом. Живые инфузории под микроскопом , уже при 80-тикратном увеличении, представляют собой не перестающее двигаться скопище клеток длиной 0,2—0,3 мм. Поэтому строение животной клетки под микроскопом можно изучить лишь на погибающем от высыхания простейшем. Подсыхающие инфузории под микроскопом выглядят более одутловатыми и практически не двигаются. Меняя объектив, устанавливаем увеличение в 200 раз: картина та же, но крупнее, различимо внутренне строение простейших.
Двухмерное изображение простейшего не соответствует тому, что вы увидите в объективе. Клетка под микроскопом вовсе не похожа на пресловутую дамскую туфельку или веретено, как изображают инфузорию художники-анималисты. Форма тела одноклеточного организма имеет «хребет» и в поперечном разрезе оказывается не овалом, а ромбом. По-видимому, выступ усиливает гидродинамику и улучшает маневренность инфузории. Овальную форму тельце простейшего принимает лишь при усыхании.
Хоть инфузория-туфелька под микроскопом выглядит несколько иначе, чем на иллюстрации из школьного учебника, все же, при восьмисоткратном увеличении можно увидеть основные элементы строения животной клетки. Под микроскопом различимы ядро, цитоплазма и другие форменные элементы животной клетки. Состоящая из полисахаридов и белков оболочка клетки под микроскопом (световым) не видна. Ее строение смогут изучить счастливые обладатели электронного микроскопа.
Мы уверены, теперь вы будете проводить целые часы с микроскопом Альтами, ведя наблюдение за жизнью отнюдь не примитивного простейшего со сложным латинским названием Paramecium caudatum или инфузория-туфелька. Фото , которые вы сделаете с помощью видеоокуляра Альтами, будут напоминать вам о том, что природа совершенна.
Ученые полагают, что в ходе эволюции инфузории произошли от древних примитивных жгутиконосцев. Представители данного типа – балантидий, трубач, инфузория-туфелька. Некоторые виды могут вести одиночный подвижный образ жизни. Встречаются прикрепленные, иногда колониальные формы.
Инфузории могут иметь стебель и быть его лишены, сократимые и панцирные. Но все микроорганизмы, принадлежащие к данному типу, имеют определенные особенности, присущие только этой группе животных.
Это наличие ресничек для передвижения и захвата пищи, двух видов ядер, протекание полового процесса в форме конъюгации.Туфелька Инфузории (Infusoria) представляют собой одноклеточных животных, относящихся к типу простейших, микроскопически мелких существ, который насчитывает порядка 8 тысяч видов. Из всех простейших инфузории имеют самое сложное строение. Инфузория-туфелька относится к типу Infusoria, и виду Paramecium Caudatum.
Размеры инфузории-туфельки составляют от 0,1 до 0,35 мм. Свое название она получила благодаря форме своего тела. Наружный слой ее цитоплазмы плотный, за счет чего и сохраняется постоянная форма тела инфузории. Питаются инфузории главным образом бактериями и микроводорослями переваривая и проводя их через себя при помощи образующейся в цитоплазме пищеварительной вакуоли. Мелкие пищевые частицы проникают в тело инфузории через ротовое отверстие (которое всегда открыто) , и там скапливаются.
После чего пища проделывает в теле инфузории сложный путь, по ходу которого и осуществляется пищеварительный процесс. Все тело инфузории покрыто продольными рядами мелких ресничек, с помощью которых инфузория туфелька передвигается, совершая ими волнообразные движения. Инфузория туфелька достаточно подвижна. Скорость ее перемещения такова, что она за 1 секунду преодолевает
расстояние, превышающее длину ее тела в 10- 15 раз. Средой обитания инфузории туфельки является любой пресноводный водоем со стоячей водой и наличием в воде разлагающихся органических веществ. Ее можно обнаружить даже в аквариуме, взяв пробы воды с илом, и рассмотреть их под микроскопом.
Infusoria Paramecium Caudatum – инфузория туфелька является очень популярным (стартовым) кормом для мальков большинства видов аквариумных рыб. А для некоторых (гурами) и незаменимым. Согласно анализам в инфузории туфелька содержится 6,8% сухого вещества, из которого 58,1% — белок, 31,7% — жиры, 3,4% — зола.
Существует множество способов разведения туфелек, на банановой кожуре, на сене, на молоке, на сушенных листьях салата и на пекарских дрожжах и т.д.
Для себя я выбрал самое простое, на банановой кожуре, или на молоке. Что то из этих продуктов у меня всегда было под рукой.
Объясню в чем разница.
На молоке культура туфелек, размножается и развивается более быстро, но и пропадает достаточно быстро. На банановой кожуре (которой нужно совсем чуть-чуть S=1- 3 см2) культура и живет дольше, но и разводиться по дольше, но есть огромный плюс, молока в доме может не оказаться, а кожуру спелого банана нужно высушить и можно использовать довольно долго.
Любое живое существо, даже одноклеточное, нуждается в питании. Не исключение и инфузория-туфелька. Питательной средой для неё являются микроорганизмы. Значит, требуется подготовить среду, где они будут находиться в достаточном числе. Берите любую ёмкость и наливайте туда аквариумную воду. Старайтесь собрать её поближе к поверхности там, где наружу выходят растения. Почти в каждом аквариуме со сформировавшейся биологической структурой уже есть свои инфузории, пусть их пока и немного.
Та и другая культура должна быть выдержана на солнце как минимум неделю (если больший срок, то ещё лучше). Оптимальное время для ращения инфузорий, таким образом – лето. Когда вода становится тёмной, это признак того, что бактериальная колония развилась. Далее в дело вступают инфузории. Отследить их появление можно даже без микроскопов и увеличительных стёкол: вода должна стать розоватой.
Всё получилось? Можно размножить колонию, взяв другую ёмкость с похожей бактериальной культурой и добавив туда немного воды из первой. Мальков нужно подкармливать буквально каплями воды из ёмкости, где обитают инфузории. Если вы добавите больше корма, чем мальки смогут съесть, то туфельки просто погибнут, а продукты их распада отравят воду. Конечно же, лучше начинать всё с воды из открытого водоёма, где инфузорий намного больше. И в любом случае желательно иметь микроскоп, чтобы оценить содержание микроорганизмов точно.
СЕННЫЙ НАСТОЙ РАЗВЕДЕНИЕВ качестве корма для инфузорий можно использовать сен-ный настой, высушенные корки банана, тыквы, дыни, желтой брюквы, нарезанную кружками морковь, гранулы рыбьего комбикорма, молоко, сушеные листья салата, кусочки печени, дрожжи, водоросли, т.е. те субстанции, которые или непосредственно потребляются туфельками (дрожжи, водоросли), или являются субстратом для развития бактерий.
При использовании сена, его берут 10 г и помещают в 1 л воды, кипятят в течение 20 мин, затем фильтруют и разбавляют равным количеством или двумя третями отстоянной воды. Во время кипячения погибают все микроорганизмы, но сохраняются споры бактерий. Через 2 — 3 дня из спор развиваются сенные палочки, служащие пищей для инфузорий. По мере необходимости настой добавляют в культуру. Настой хранится в прохладном месте в течение месяца.
Наиболее простым способом является разведение туфелек на снятом, кипяченом или сгущенном (без сахара) молоке: его вносят в культуру 1 — 2 капли на 1 л) один раз в неделю. Туфельки используют молочнокислых бактерий.
При использовании вышеуказанных кормов важно не передозировать питание. В противном случае быстро размножающиеся бактерии оставят инфузорий без кислорода. При выращивании инфузории на бактериях они обладают положительным фототаксисом, т.е. стремятся к свету.
Можно разводить инфузорий на водорослях сценедесмусе и хлорелле. Хороших результатов можно добиться при культивировании инфузорий со слабой продувкой, когда на 1 л водорослей вносится 1 гранула карпового комбикорма. Инфузории, накормленные водорослями, обладают отрицательным фототаксисом: они стремятся в темноту. Это их свойство можно использовать при выкармливании т.е нелюбивых личинок рыб.
Используют культуру инфузорий, как правило, не дольше 20 дней. Для постоянного поддержания культуры ее заряжают в двух банках с интервалом в неделю, при этом каждую банку перезаряжают каждые две недели. Для длительного хранения культуры инфузорий, ее помещают в холодильник и хранят при температуре + 3°- + 10°С.
Недавно совершенно случайно обнаружил еще один способ получения культуры туфельки. После сифонки аквариума воду слил с осадка и налил в три пластиковые 2-литровые бутылки, выставил их на балкон, на солнце (нужна была «зеленая» вода, подкармливать наловленных дафний в течении недели). Две использовал по назначению, а третью не успел-зеленка осела. Такое всегда бывает, если не подливать свежей воды — микроводоросли «выедают» всю органику и микроэлементы и погибают.
Так вот, когда «зеленка» выпала в осадок, в бутылке оказалось просто офигенное количество инфузорий, крупных, откормленных, все как на подбор. И, кстати, без всяких подкормок культура держалась больше недели — на гниющих остатках микроводорослей.
Как я открыл для себя мир в капле воды под микроскопом
Ученик 5 класса, школы № 1591 Сусло Даниил
Мир простейших в одной капле воды
(статья будет содержать картинки из опытов)
Многие люди даже не представляют, что помимо нашего мира со всеми его трудностями и препятствиями обычной жизни, существуют и другие виды жизни, гораздо более интересные и до конца не известные.
К таким жизням можно смело отнести жизнь микроорганизмов, из которых в свою очередь состоит организм человека.
Конечно же, говоря про мельчайших в свое роде живые существа, что бы познать их мир и значение в жизни, необходимо тщательно подойти к изучению этого вопроса. А для того, что бы это сделать, нужно самому попробовать вырастить «маленькую жизнь» и провести ряд наблюдений и опытов. Только после такой плодотворной работы можно смело говорить, что у меня что то получилось и я больше стал знать о жизни микроорганизмов.
Именно с этого мы и решили начать. Нами был разработан целый проект по изучению жизни одноклеточных животных.
Сначала мы решили провести опыт по выращиванию новой жизни. В начале сентября 2018 года в результате объединения проточной воды и банановой кожуры мы получили определенную смесь, из которой в дальнейшем попытались вырастить живые микроорганизмы. После долгих наблюдений через микроскоп мы все таки добились поставленной цели. Мы вырастили одноклеточных животных!
Все наши опыты продолжались около двух месяцев. Вместе с тем наши ожидания оправдались с лихвой.
(Коловратка Филодина)
Одновременно с одноклеточными животными нам удалось вырастить самых маленьких многоклеточных существ на Земле — Коловраток Филодину и Брахионус. Вы не можете себе представить, какое удивление и радость были на наших лицах после увиденного.
Нам удалось запечатлеть бесполое размножение инфузорий, причем из одной клетки образовались сразу две особи.
Следующим нашим творением была Амеба Обыкновенная, которая не смотря на то, что не имеет постоянной формы тела и имеет бесцветный вид, ребятам все же удалось увидеть через микроскоп этот замечательный вид живого организма.
(Амеба Обыкновенная)
Целью нашего исследования и проведенных опытов было изучение особенностей строения и жизнедеятельности живых микроорганизмов, их культивирование и размножение.
В ходе работы были проведены различные уроки по познанию жизни микроорганизмов. Начиная с младших классов и заканчивая старшими, ни один из учащихся не остался равнодушным. Всем ребятам очень понравились проведенные перед ними познавательные занятия.
Следующим этапом наших исследований было проведение анкетирования. В результате него было выяснено, что к сожалению ребята абсолютно не знают одноклеточных животных, происходит путаница и сравнение бактерий и вирусов, что само по себе не допустимо.
Конечно, не мало важным фактом при проведении нашей работы сыграли различные источники литературы, в которых для себя мы с ребятами подчеркнули много нового.
Тем не менее, ни одна книга не сможет описать все то, что было увидено нами в результате огромной работы.
(Инфузории)
Оказывается, что Инфузория Стилонихия способна не только ползать, но и перемещаться с большой скоростью, похожей на бег.
Отряд Брюхоресничные — Инфузории Эплотес имеют в своем строении четыре длинных усика.
Равноресничные рода Парамециум Инфузория Путриниум имеет более округлую форму, совсем не похожую на их ближайших соседей Инфузорию Туфельку. Не смотря на небольшой размер и круглые формы это пожалуй один из самых быстрых живых организмов в своем роде.
А вот Равноресничные из рода Бурсария Инфузория Бурсария имеет форму мешка и представляется, наверное, самым большим одноклеточным животным, напоминающим гиганта инфузорий.
(Коловратка брахионус)
Коловратки, напротив, самые маленькие организмы из существующих на Земле.
После окончания наших кропотливых исследований, в которых огромную роль на ряду с ребятами сыграли родители, мы провели классный час и выпустили стенгазету. В ней мы попытались отразить не только красивые картинки с вырощенными одноклеточными, а также определили ряд вопросов, которые, мы надеемся, заинтересуют многих ребят и взрослых. А самое главное, позволят найти ответы на вопросы: Какие живые организмы существуют на нашей планете? Кто они?
Дорогой мой читатель! Я нисколько не сомневаюсь, что и ты не останешься равнодушным к жизни одноклеточных животных. Вперед к неизведанному!
Из моего доклада:
Мне стало интересно, возможно ли в домашних условиях воссоздать среду обитания и культивировать простейших.
Я поставил перед собой цель: можно ли открыть для себя что-то новое.
Для культивирования таких организмов в домашних условиях достаточно банок с водой и кормом. Подходящей средой для выведения является стоячая пресная вода из водоемов или аквариумов. Вода настаивается от 1 до 2-х недель. В качестве корма использовались сухая трава, водоросли, кожура банана, морковь в разных банках.
Для изучения я использовал цифровой микроскоп, применяя рабочее увеличение от 40 до 100 крат. Для опытов также потребовалось купить набор покровных и предметных стекол, пипетка (шпритц).
Благодаря цифровому микроскопу все-таки проще вести почти непрерывное наблюдение за культурой.
(Увеличение в 40 раз)
Простейшие организмы хорошо видны в обычный микроскоп при увеличении в 30-40 крат.
При больших увеличениях я уже столкнулись с проблемами искажениями изображения за счет толщины капли воды. Так же по мере начала опытов не удавалось вырастить организмы в необходимой концентрации или ограничить их в маленьком объеме воды, чтобы можно было сфокусироваться.
При первых наблюдениях мира в капле воды я ожидал увидеть знакомые силуэты Инфузории или Эвглены, но вместо этого столкнулись с непонятными существами — Коловратки. В моем эксперименте коловратки начинали появляться в воде на несколько дней раньше всех остальных культур.
Оказывается это микроскопические, но все-таки самые мельчайшие многоклеточные организмы, могут вырастать до особей в размере 1.5 мм.
(Увеличение в 100 раз)
По мере дальнейших наблюдений, оказалось, что мир простейших очень разнообразен, и очень удачной получилась культура с примерами организмов из отряда брюхоресничных.
К моему удивлению, дольше всего не удавалось вывести структуру с Инфузорией Туфелькой. Проблему решил корм в виде высушенной банановой кожуры.
(Размножение микроорганизмов)
На примере инфузории мне удалось увидеть подтверждение образования цисты при неблагоприятных условиях, если банка с водой стояла у окна на холодном сквозняке, мы обнаружили в воде данные примеры.
В банке с морковью у меня образовалась плесень и я думал, что уже не получится хорошая культура для наблюдения, но благодаря ей мы вспомнили что к миру одноклеточных принадлежит целое царство бактерий. Они могут быть как полезные (кисло-молочная бактерия) так и нет (кишечная палочка).
Вывод
Мне удалось увидеть как простейшие, но живые существа сами появляются в воде. В начале эксперимента нам показалось, что это очень просто по описаниям. В ходе эксперимента оказалось, что это намного сложнее, чем мы думали и разнообразие простейших стало откровением.
Удивительно, что сначала появились коловратки, но потом их стало меньше(?)
Вроде бы жизнь сама зарождается, но баланс очень хрупкий при неблагоприятных условиях даже простейшие организмы начинают пытаться адаптироваться. Сами размножаются, сами покрываются цистой….
Работа проведена учеником: Сусло Даниилом;
Помощь в работе: учитель биологии Павлоградская Екатерина Игоревна.
Учебное заведение: СОШ № 1591, г. Москва
Скутикоцилиатоз
Aiken DE; Сочаски Ж.Б .; Уэллс П.Г., 1973 г. Инфекция инфузорий в крови омара, Homarus americanus. Международный совет по исследованию моря, моллюсков и бентоса, Отчет Комитета CM1973 / K: 46.
Aiken DE; Waddy SL, 1986. Влияние окружающей среды на пополнение американского лобстера Homarus americanus: перспектива. Канадский журнал рыболовства и водных наук, 43: 2258-2270.
Армстронг DA; Burreson EM; Спаркс АК, 1981.Инфузорийная инфекция (Paranophrys sp.) У крабов Дандженесс, находящихся в лабораторных условиях, по раку. Журнал патологии беспозвоночных, 37 (2): 201-209.
Bang FB; Audouin J; Leglise M, 1972. Инфузорийная инфекция крови съедобного краба, Cancer pagurus, в резервуарах для хранения в Бретани, Франция. Журнал патологии беспозвоночных, 20: 226-227.
Bassleer G, 1983. Uronema marinum, новый и распространенный паразит тропических морских рыб. Пресноводный и морской аквариум, 6: 78-81.
Bower SM; McGladdery SE; Цена IM, 1994.Сводка инфекционных болезней и паразитов промысловых моллюсков. Ежегодный обзор болезней рыб, 4: 1-3.
Cattaneo G, 1888. Su di un infusorio ciliato, parasito del sangue del Carcinus maenes. Zoologischer Anzeiger., 11: 456-459.
Cawthorn RJ, 1997. Обзор воздействия болезни «бамперной машины» на североамериканский промысел омаров. Международный журнал паразитологии, 27 (2): 167-172.
Cawthorn RJ; Lynn DH; Despres B; MacMillan R; Мэлони Р; Loughlin M; Байер Р., 1996.Описание Anophryoides haemophila n. sp. (Scuticociliatida: Orchitophryidae), возбудитель американских лобстеров Homarus americanus. Болезни водных организмов, 24 (2): 143-148.
Чен Д., 1992. Обзор ситуации с болезнью, диагностических методов, методов лечения и профилактики, используемых на креветочных фермах в Китае. В: Fulks W, Mains KL, ред. Болезни культивируемых креветок Penaeid в Азии и Соединенных Штатах: Материалы семинара в Гонолулу, Гавайи, 27-30 апреля 1992 г. Гонолулу: Океанический институт, 47-55.
Чен З; Песня А; Чжао В., 1996. Влияние факторов окружающей среды на рост и размножение Paranophrys carcini spiralis. Acta Ecologica Sinica, 16: 83-89. (на китайском языке).
Cheung PJ; Нигрелли РФ; Ruggieri GD, 1980. Исследования морфологии Uronema marinum Dujardin (Ciliatea: Uronematidae) с описанием гистопатологии инфекции у морских рыб. Журнал болезней рыб, 3 (4): 295-303.
Coppellotti O, 1990. Описание Uronema marinum (Ciliophora, Scuticociliatida) из Антарктиды и наблюдения ядерных событий в конъюгации.Полярная биология, 10: 365-371.
Couch JA, 1978. Болезни, паразиты и токсические реакции промысловых креветок-пенеид Мексиканского залива и южноатлантического побережья Северной Америки. Бюллетень рыболовства, 76 (1): 1-44.
Cribb AE; Despres B; Cawthorn RJ, 1999. Анализ цитотоксичности на основе тетразолия для определения антипротозойной активности против scuticociliate Anophryoides haemophila. Болезни водных организмов, 35 (3): 213-219.
Crosbie PBB; Munday BL, 1999. Факторы окружающей среды и химические агенты, влияющие на рост патогенной морской инфузории Uronema nigricans.Болезни водных организмов, 36: 213-219.
Драгеско А; Dragesco J; Coste F; Gasc C; Romestand B; Raymond JC; Bouix G, 1995. Philasterides dicentrarchi, n. sp., (Ciliophora, Scuticociliatida), гистофаговый условно-патогенный паразит Dicentrarchus labrax (Linnaeus, 1758), выращиваемой морской рыбы. Европейский журнал протистологии, 31 (3): 327-340.
Дыкова I; Figueras A, 1994. Гистопатологические изменения камбалы Scophthalmus maximus, вызванные гистофагом инфузорий. Болезни водных организмов, 18 (1): 5-9.
Fauré-Fremiet E, 1935. La famille des Philasteridae Kahl (Ciliata Holosticha). Бюллетень зоологического общества Франции, 60: 127-143.
Фойсснер В., 1991. Основные методы световой и сканирующей электронной микроскопии для таксономических исследований мерцательных простейших. Европейский журнал протистологии, 27: 313-330.
Foissner W, 1996. Онтогенез у реснитчатых простейших с акцентом на стоматогенез. В: Hausmann K, Bradbury PC, eds. Инфузории. Клетки как организмы. Штутгарт, Германия: Густав Фишер, 95–178.
Gill PA; Каллинан Р.Б., 1997. Язвенный дерматит, связанный с инфекцией Uronema sp. Искусственной путассу Sillago ciliata. Австралийский ветеринарный журнал, 75 (5): 357.
Гомес-Саладин E; Small EB, 1993. Оральный морфогенез трансформации микростома в макростом у штамма Ma / 2 Miamiensis avidus. Журнал эукариотической микробиологии, 40: 363-370.
Гомес-Саладин E; Small EB, 1993. Трансформация штамма Ma / 2 Miamiensis avidus, индуцированная добычей, с помощью растворимого фактора.острый ~ лварез MF; Leiro J; Убейра FM; Sanmartín ML, 2003. Philasterides dicentrarchi (Ciliophora: Scuticociliatida) экспрессирует поверхностные иммобилизационные антигены, которые, вероятно, вызывают защитные иммунные ответы у камбалы. Паразитология, 126 (2): 125-134.
Иглесиас Р; Paramá A; Альварес М.Ф .; Leiro J; Фернандес Дж; Sanmartín ML, 2001. Philasterides dicentrarchi (Ciliophora, Scuticociliatida) как возбудитель скутикоцилиатоза у выращиваемой камбалы Scophthalmus maximus в Галисии (северо-запад Испании). Болезни водных организмов, 46 (1): 47-55.
Jee BoYoung; Ким ИЧеунг; Park MiSeon, 2001. Морфология и биология паразита, ответственного за скутикоцилиатоз культивируемой камбалы оливковой Paralichthys olivaceus. Болезни водных организмов, 47 (1): 49-55.
Kasai H; Osawa S; Кобаяши Т; Йошимидзу М., 2002. Профилактика скутикоцилиатоза у камбалы японской путем обработки водоснабжения высококачественной УФ-лампой. Gyobyo Kenkyu = Патология рыб, 37 (4): 199-200.
Ким С.М.; Cho JB; Ким СК; Nam YK; Ким ХК, 2004.Возникновение скутикоцилиатоза у камбалы оливковой Paralichthys olivaceus по Philasterides dicentrarchi (Ciliophora: Scuticociliatida). Болезни водных организмов, 62: 233-238.
Loughlin MB; Bayer RC, 1991. Сканирующая электронная микроскопия (SEM) Mugardia, ранее Anophrys, патогенного простейшего американского лобстера. Журнал исследований моллюсков, 10: 298.
Loughlin MB; Bayer RC; Prince DL, 1998. Lobster, Homarus americanus, желудочная жидкость является барьером для инфузорий, Anophryoides haemophila, в исследовании in vitro.Журнал прикладной аквакультуры, 8 (4): 67-72.
Линн Д.Х., 2003. Архив ресурсов инфузорий. Кафедра зоологии, Университет Гвельфа, Гвельф, Онтарио, Канада. В Интернете по адресу http://www.uoguelph.ca/~ciliates. Доступ 2 февраля 2005 г.
Messick GA; Small EB, 1996. Mesanophrys chesapeakensis n. sp., гистофагом инфузории синего краба, Callinectes sapidus, и связанной с ним гистопатологией. Биология беспозвоночных, 115 (1): 1-12.
Morado JF, 1993. Морфология, морфогенез, культура и патогенез морской факультативной паразитической инфузории, Mesanophrys sp., краба Дандженесс, Cancer magister, и его встречаемость в популяциях диких ракообразных. Докторская диссертация, Вашингтонский университет, Сиэтл.
Morado JF; Giesecke RH; Syrjala SE, 1999. Связанная с линькой смертность краба Дандженесс. Cancer magister, вызванная морской факультативной инфузорией Mesanophrys pugettensis. Болезни водных организмов, 38 (2): 143-150.
Morado JF; Small EB, 1995. Инфузорийные паразиты и родственные болезни ракообразных: обзор. Обзоры в Fisheries Science, 3: 275-354.острый ~ лварез MF; Leiro J; Aja C; Sanmartín ML, 2003. Philasterides dicentrarchi (Ciliophora, Scuticociliatida): экспериментальная инфекция и возможные пути проникновения в выращиваемую камбалу (Scophthalmus maximus). Аквакультура, 217 (1/4): 73-80.
Paramá A; Иглесиас Р; Альварес Ф; Leiro JM; Quintela JM; Peinador C; González L; Riguera R; Sanmartín ML, 2004. Эффективность новых антипротозойных средств против Philasterides dicentrarchi (Ciliophora, Scuticociliatida) in vitro. Болезни водных организмов, 62: 97-102.
Parker JG, 1976. Культурные характеристики морских реснитчатых простейших Uronema marinum Dujardin. Журнал экспериментальной морской биологии и экологии, 24: 213-226.
Parker JG, 1978. Дальнейшие наблюдения за культурами морских мерцающих простейших Uronema marinum Dujardin. Журнал экспериментальной морской биологии и экологии, 35: 265-271.
Планкет L; Hidu H, 1978. Роль Uronema marinum (Protozoa) в производстве устриц в инкубатории. Аквакультура, 15 (3): 219-225.
Пуассон Р., 1930. Наблюдения за Anophrys sarcophagi Cohn (= A. maggii Cattaneo) infusoire holotriche marin et sur son parasitisme, возможно, с определенными корочками. Бык. Биол. Фр-бельг., 64: 288-331.
Purdom CE; Ховард А.Е., 1971. Инвазии инфузорий: проблема морского рыбоводства. Journal du Conseil International pour l’Exploration de la Mer., 33: 511-514.
Puytorac PDe; Grolière CA, 1979. Sur le cilié Anophryoides salmacida (Mugard, 1949) nov. ген. Protistologica, 15: 223-230.
Quintela JM; Peinador C; González L; Иглесиас Р; Paramá A; Альварес Ф; Sanmartín ML; Riguera R, 2003. Пиперазин N-замещенные нафтиридины, пиридотиенопиримидины и пиридотиенотриазины: новые антипротозойные средства, активные против Philasterides dicentrarchi. Европейский журнал медицинской химии, 38: 265-275.
Sherburne SW; Bean LL, 1991. Смертность захваченных и одичавших омаров штата Мэн, Homarus americanus H. Milne-Edwards, 1837, вызванная простейшими инфузориями Mugardia (ранее Anophrys-Paranophrys), с первоначальными данными о распространенности в десяти местах вдоль побережья штата Мэн и в одном на море. область.Журнал исследований моллюсков, 10: 315-326.
Зиндерманн С.Дж., 1988. Инфузорийная (паранофриозная) болезнь крабов Дангенесса. В: Зиндерманн К.Дж., Лайтнер Д.В., ред. Диагностика и контроль заболеваний в морской аквакультуре Северной Америки. Амстердам, Оксфорд, Нью-Йорк, Токио: Elsevier, 220-221.
Зиндерманн CJ, 1988. Инфузорийная (Paranophrys) болезнь омаров. В: Зиндерманн С.Дж., Лайтнер Д.В., ред. Диагностика и контроль заболеваний в морской аквакультуре Северной Америки. Амстердам, Оксфорд, Нью-Йорк, Токио: Elsevier, 258-259.
Малый EB; Lynn DH, 1985. Phylum Ciliophora Doflein, 1901. В: Lee JJ, Hutner SH, Bovee EC, eds. Иллюстрированный справочник по простейшим. Лоуренс, Канзас, США: Общество протозоологов, 393–575.
Speare DJ; Cawthorn RJ; Хорни Б.С.; MacMillan R; Маккензи А.Л., 1996. Влияние формалина, хлорамина-Т и низкой солености на поведение и биохимию гемолимфы американского лобстера. Канадский ветеринарный журнал, 37 (12): 729-734.
Sterud E; Hansen MK; Мо ТА, 2000.Системное инфицирование Uronema-подобными инфузориями выращиваемого камбала Scophthalmus maximus (L.). Журнал болезней рыб, 23 (1): 33-37.
Sun X; Чжан Дж., 1994. Исследование инфузорий пенеидных креветок в период зимовки. Журнал океанографии морей Хуанхай и Бохай, 12: 65-68 (на китайском языке).
Thompson JC, 1964. Повторное описание Uronema marinum и предложенное новое семейство Uronematidae. Вирджинский научный журнал, 15: 80-87.
Умехара А; Kosuga Y; Хиросе Х, 2003.Инфекция Scuticociliata у засоренного морского дракона Phyllopteryx taeniolatus. Parasitology International, 52 (2): 165-168.
Wiackowski K; Hryniewiecka-Szyfter Z; Бабула А., 1999. Сколько видов входит в род Mesanophrys (Protista, Ciliophora, факультативные паразиты морских ракообразных) ?. Европейский журнал протистологии, 35 (4): 379-389.
Zhou L; Meng Q; Ю.К., 1991. Описание нового подвида Paranophrys carcini spiralis subsp. nov., паразитическая инфузория искусственной зимующей креветки Penaeus orientalis Kishnouye.J. Ocean. Univ. Циндао, 21: 90-98.
Ссылки на дистрибутив
CABI, без даты. Запись компендиума. Уоллингфорд, Великобритания: CABI
CABI, без даты а. Компендиум CABI: Статус определен в результате регионального распространения. Уоллингфорд, Великобритания: CABI
CABI, без даты b. Компендиум CABI: Статус определяется редактором CABI. Валлингфорд, Великобритания: CABI
Cawthorn R J, Lynn D. H, Despres B, MacMillan R, Maloney R, Loughlin M, Bayer R, 1996. Описание Anophryoides haemophila n.sp. (Scuticociliatida: Orchitophryidae), возбудитель американских лобстеров Homarus americanus. Болезни водных организмов. 24 (2), 143-148. DOI: 10.3354 / dao024143
Cheung PJ, Nigrelli RF, Ruggieri GD, 1980. Исследования морфологии Uronema marinum Dujardin (Ciliatea: Uronematidae) с описанием гистопатологии инфекции у морских рыб. Журнал болезней рыб. 3 (4), 295-303. DOI: 10.1111 / j.1365-2761.1980.tb00400.x
Couch J. A, 1978. Болезни, паразиты и токсические реакции промысловых креветок-пенеид Мексиканского залива и южноатлантического побережья Северной Америки.Бюллетень рыболовства. 76 (1), 1-44.
Dragesco A, Dragesco J, Coste F, Gasc C, Romestand B, Raymond J C, Bouix G, 1995. Philasterides dicentrarchi, n. sp., (Ciliophora, Scuticociliatida), гистофаговый условно-патогенный паразит Dicentrarchus labrax (Linnaeus, 1758), выращиваемой морской рыбы. Европейский журнал протистологии. 31 (3), 327-340. DOI: 10.1016 / S0932-4739 (11) 80097-0
Dyková I, Figueras A, 1994. Гистопатологические изменения тюрбо Scophthalmus maximus, вызванные гистофагом инфузории.Болезни водных организмов. 18 (1), 5-9. DOI: 10.3354 / dao018005
Gill P. A., Callinan R B., 1997. Язвенный дерматит, связанный с инфекцией Uronema sp. Австралийский ветеринарный журнал. 75 (5), 357. DOI: 10.1111 / j.1751-0813.1997.tb15714.x
Иглесиас Р., Парама А., Альварес М.Ф., Лейро Дж., Фернандес Дж., Санмартин М.Л., 2001. Philasterides dicentrarchi (Ciliophoratida, Scuticocilia) возбудитель скутикоцилиатоза у выращиваемой камбалы Scophthalmus maximus в Галисии (северо-запад Испании).Болезни водных организмов. 46 (1), 47-55. DOI: 10.3354 / dao046047
Jee BoYoung, Kim YiCheung, Park MiSeon, 2001. Морфология и биология паразита, ответственного за скутикоцилиатоз культурной камбалы Paralichthys olivaceus. Болезни водных организмов. 47 (1), 49-55.
Ким СунгМи, Чо ДжеБум, Ким СонКу, Нам ЮнКвон, Ким Кихонг, 2004. Возникновение скутикоцилиатоза у камбалы оливковых Paralichthys olivaceus у Phiasterides dicentrarchi (Ciliophora: Scuticociliatida).Болезни водных организмов. 62 (3), 233-238.
Морадо Дж. Ф., Гизеке Р. Х., Сырьяла С. Е., 1999. Связанная с линькой смертность краба Дандженесс Cancer magister, вызванная морским факультативным инфузорий Mesanophrys pugettensis. Болезни водных организмов. 38 (2), 143-150. DOI: 10.3354 / dao038143
Munday B. L., O’Donoghue P J, Watts M, Rough K, Hawkesford T., 1997. Смертельный энцефалит, вызванный scuticociliate Uronema nigricans у южного синего тунца Thunnus maccoyii в морских клетках. Болезни водных организмов.30 (1), 17-25. DOI: 10.3354 / dao030017
Purdom CE, Howard AE, 1971. Инвазии инфузорий: проблема морского рыбоводства. В: Journal du Conseil International pour l’Exploration de la Mer, 33 511-514.
Sterud E, Hansen M K, Mo T. A, 2000. Системная инфекция Uronema-подобными инфузориями у выращиваемых на фермах камбалы, Scophthalmus maximus (L.). Журнал болезней рыб. 23 (1), 33-37. DOI: 10.1046 / j.1365-2761.2000.00204.x
Umehara A., Kosuga Y, Hirose H, 2003. Инфекция Scuticociliata у сорного морского дракона Phyllopteryx taeniolatus.Parasitology International. 52 (2), 165-168. DOI: 10.1016 / S1383-5769 (02) 00080-6
Zhou L, Meng Q, Yu K, 1991. Описание нового подвида Paranophrys carcini spiralis subsp. nov., паразитическая инфузория искусственной зимующей креветки, Penaeus orientalis Kishnouye., 21 Qingdao, J. Ocean. Univ. 90-98.
Планктонный проект инфузорий онлайн
Добро пожаловать в Интернет-проект «Планктонная инфузория»
MC Strüder-Kypke, ER Kypke, S Agatha, J Warwick, DJS Montagnes
Введение
Это руководство по выявлению морских прибрежных инфузорий (в основном из вод Великобритании), собираются при обычном отборе экологических проб.Инфузории — важный компонент морских пищевых сетей (Pierce & Turner 1992), но в настоящее время трудно идентифицировать их. Мы обращаемся к экологам, незнакомым с систематикой инфузорий, как к а также студенты и естествоиспытатели; мы также надеемся предоставить полезные данные для специалисты в своей области. В справочнике основное внимание уделяется фиксированным образцам Люголя. Люголя стандартный, относительно недорогой и безопасный метод сбора инфузорий. (Гиффорд и Карон, 2000).Однако мы используем инновационный подход: описать форму и положение ядер, наблюдаемые в неподвижном и живом материале Люголя, как ключевая особенность. Мы делаем это, дополняя окрашивание Люголя окрашиванием DAPI, ядерный флуорохром. Дополнительно мы включаем данные таксономико-морфологического исследования и из экологических исследований. Комбинация этих данных должна дать возможна идентификация инфузорий и помогает указать на их важность в пищевых сетях. Это руководство в основном финансировалось НКРЭ.
в течение одного года, начиная с августа 2000 года. Мы продолжим оказывать эту услугу
общественность и научное сообщество в меру наших возможностей после того, как это финансирование будет
измученный. Мы приветствуем другие источники финансирования в будущем. Мы развиваем этот сайт
и приглашайте ваши комментарии, предложения и вклады. Отправьте электронное письмо на адрес
[email protected].
Руководство разделено на несколько разделов:
СОДЕРЖАНИЕ Виды перечислены в алфавитном порядке на этой странице.
СХЕМА Схематические рисунки основных групп инфузорий показывают их характерные особенности. Виды, относящиеся к группе, перечислены под рисунком.
ПАСПОРТЫ Для каждого вида есть лист данных, состоящий из двух страниц. Эти листы в первую очередь иллюстративны, с использованием различных методов фиксации и окрашивания. Мы также предоставляем такую информацию, как: ключевые характеристики, измерения, экологические данные, ссылки, подробное таксономическое описание и списки похожих виды и / или синонимы.
МЕТОДЫ Кратко представлены общие методы отбора, фиксации и окрашивания планктонных инфузорий. объяснил.
ГЛОССАРИЙ Термины, используемые в описаниях, объяснены и проиллюстрированы там, где это необходимо.
ССЫЛКИ Ссылки из всех разделов объединены в независимый список.
HELP Инструкции проведут вас через организацию веб-страницы и предоставят дополнительную информацию подробная информация о вариантах.
Все страницы можно скачать в виде PDF-файлов и распечатать в стандартизированном формате (на бумаге Letter или A4). Кроме того, доступен сжатый файл (Ciliate_website.exe), содержащий все руководство (ссылка на страницу помощи). Этот самораспаковывающийся файл можно загрузить и сохранить на локальном жестком диске, а затем просмотреть в оффлайн-режим; это значительно сократит время доступа.
Мы регулярно будем добавлять новые таблицы данных по видам и обновлять существующие таблицы данных; обновления будут
объявляется через список рассылки.Также изменения можно просмотреть в журнале обновлений. Зарегистрироваться
отправьте электронное письмо на адрес [email protected].
Инфузории в пищевых сетях
Инфузории планктона играют важную роль в переносе материала через прибрежные пищевые сети; они действуют как связующее звено между маленькими фитопланктон и более крупный зоопланктон (Рейд и др., 1991). Инфузории поедают от 30 до 50% первичной продукции во многих микрозоопланктон в прибрежных водах умеренного пояса (Pierce & Turner 1992). Инфузории — разнообразная группа; их нельзя рассматривать как единый функциональная группа, больше, чем мы можем рассматривать весь фитопланктон или более крупный зоопланктон как однородные группы.Инфузории образуют разнообразный комплекс, и разные таксоны могут быть функционально такими же разными, как фитопланктон и мезозоопланктон, как разные виды инфузорий могут быть автотрофными, миксотрофными, или первичные и / или вторичные потребители (Pierce & Turner 1992).
Рис. 1: Планктонная трофическая сеть (по Коноверу 1982)
(щелкните изображение, чтобы просмотреть его в увеличенном виде в новом окне)
Таким образом, виды инфузорий в локализованных регионах будут играть уникальные роли в пищевой сети.Без адекватного идентификации инфузорий трудно распознать и изучить это разнообразие, а также оценить экологическую роль инфузории в динамике пищевой сети. Пример, иллюстрирующий необходимость изучения таксонов инфузорий, представлен в недавнем исследовании, проводились в Ирландском море (Montagnes et al. 1999). Эта работа показала, что отчетливые пятна от мелкого до мезомасштаба (мкм-км) инфузорий встречается в Ирландском море.
Рис. 2: Пятна инфузорий в Ирландском море (по Montagnes et al 1999)
(щелкните изображение, чтобы просмотреть его в увеличенном виде в новом окне)
Эти пятна, в которых преобладали отдельные виды, по-видимому, вносили значительный вклад в первичные и / или вторичные производство.Подобные наблюдения были сделаны другими в водах Великобритании (Reid 1987) и в других местах (например, Dale & Dahl 1987).
Зачем выпускать справочник по инфузориям?
На сегодняшний день нет подробного таксономического справочника по инфузориям прибрежных вод Великобритании и Европы. Многие из описания инфузорий датируются концом 19 — началом 20 вв .; они основаны на живых или плохо закрепленных образцах, и методы окрашивания использовались редко. Следовательно, в более ранней литературе отсутствует строгость, применяемая в настоящее время к инфузориям. таксономия (Foissner 1994, Montagnes & Lynn 1991).Однако современные описания представлены отдельными научными публикаций, и фрагментарный характер этих описаний приводит к обширному поиску литературы, когда виды инфузорий необходимо идентифицировать. В этом руководстве будет собрана иллюстрированная база данных таксонов планктонных инфузорий из прибрежных вод. обзор литературы и новых образцов. Мы постараемся собрать все данные, необходимые для идентификации инфузорий и представить их в исчерпывающем и удобном формате.Ниже перечислены другие веб-сайты, содержащие протистские изображения:
База данных по планктону, Швеция : Иллюстрированный контрольный список содержит самую последнюю информацию о фитопланктоне и
гетеротрофные протисты, обнаруженные в водах Скагеррак и Каттегат, северная часть Атлантического океана.
http://www.marbot.gu.se
Protist Information Server, Япония : Этот сервер предоставляет исследовательские и образовательные ресурсы по
Протисты, включая библиотеку изображений многих протистов
http: // protist.i.hosei.ac.jp/Protist_menuE.html
Protist Image Data, Canada : Эта база данных содержит изображения и краткие описания выбранных
родов протистов, особенно тех родов, виды которых часто используются в качестве экспериментальных организмов или имеют важное значение в
исследования эволюции организмов.
http://megasun.bch.umontreal.ca/protists
Самая маленькая страница в Интернете, Великобритания : На этих страницах изображены некоторые из наиболее распространенных микроскопических организмов.
которые живут в пресной воде.
http://www.microscopy-uk.org.uk/mag/wimsmall/smal1.html
Dale T, Dahl E (1987) Массовое распространение планктонных олиготриховых инфузорий в заливе на юге Норвегии. J Plank Res 9: 871-879
Фойсснер В. (1994) Прогресс в таксономии планктонных пресноводных инфузорий. Пищевые сети морских микробов 8: 9-35
Gifford DJ, Caron DA (2000) Отбор проб, сохранение, подсчет и биомасса морского протозоопланктона.В: Харрис RP et al. (eds) Руководство по методологии зоопланктона ICES. Академическая пресса, Лондон
Montagnes DJS, Poulton AJ, Shammon TM (1999) Мезомасштабное, мелкомасштабное и микромасштабное распределение микро- и нанопланктон в Ирландском море с акцентом на инфузории и их добычу. Мар Биол 134: 167-179
Montagnes DJS, Lynn DH (1991) Таксономия основных групп морских планктонных инфузорий с акцентом на алориатные формы. Мар Микроб Пищевые Сети 5: 59-74
Pierce RW, Turner JT (1992) Экология планктонных инфузорий в морских пищевых сетях.Обзоры в Aquat Sci 6: 139-181 Reid PC et al. (1991) Простейшие и их роль в морских процессах. Издание НАТО ASI, Спрингер, Нью-Йорк
Reid PC (1987) Массовая инсультация планктонных инфузорий олиготрихов. Мар Биол 95: 221-230
Reid PC, Turley CM, Burkill PH (eds) (1991) Простейшие и их роль в морских процессах. Springer-Verlag, Гейдельберг [NATO ASI 25 Ser G: Ecol Sciences]
Благодарности В настоящее время проект финансируется Национальным советом по исследованиям окружающей среды (NERC) за счет исследовательского гранта, предоставленного DJS. Монтаньи в рамках программы «Морская продуктивность».Мы благодарим Manx Airlines и Ассоциацию систематиков за дополнительные гранты, которые поддержали эту работу. Этот проект был бы невозможен без помощи многих коллег, которые предоставили с образцами планктона и / или дали разрешение на использование своих иллюстраций: Эйлин Бреснан, Джон Р. Долан, Пер Дж. Хансен, Ханс Якобсен, Пер Йонссон, Кевин Кеннингтон, Денис Х. Линн, Джордж Б. Макманус, Джейсон Маллард, Гизела Мандали де Фигейредо, Ричард Пирс, Оскар Сантамария Эстепар, Юджин Б.Маленький, Дэвид Уилсон.Техническая помощь: К. Эрленд
[Версия для печати] [Авторские права] [Дом]
Свободноживущие инфузории как потенциальные резервуары для эукариотических паразитов: наличие трипаносоматиды в макронуклеусе Euplotes encysticus | Паразиты и переносчики
Маслов Д.А., Вотыпка Ю., Юрченко В., Лукеш Ю.: Разнообразие и филогения трипаносоматид насекомых: все, что скрыто, должно быть раскрыто. Trends Parasitol. 2013, 29: 43-52.10.1016 / j.pt.2012.11.001.
Артикул PubMed Google Scholar
Подлипаев С.А.: Трипаносоматиды насекомых: необходимость знать больше. Mem Inst Oswaldo Cruz. 2000, 95: 517-522. 10.1590 / S0074-02762000000400013.
CAS Статья PubMed Google Scholar
Вотыпка Я., Маслов Д.А., Юрченко В., Йирко М., Кмент П., Лун З.-Р, Лукеш Дж .: Исследование разнообразия трипаносоматидных жгутиконосцев, паразитирующих на насекомых-хозяевах в Юго-Западном Китае, выявляет как эндемизм, так и глобальное распространение.Mol Phylogenet Evol. 2010, 54: 243-253. 10.1016 / j.ympev.2009.10.014.
Артикул PubMed Google Scholar
Тыч Я., Вотипка Я., Клепеткова Х., Сулакова Х., Йирко М., Лукеш Дж .: Растущее разнообразие трипаносоматидных паразитов мух (Diptera: Brachycera): частый космополитизм и умеренная специфичность хозяев. Mol Phylogenet Evol. 2013, 69: 255-264. 10.1016 / j.ympev.2013.05.024.
Артикул PubMed Google Scholar
Borghesan TC, Ferreira RC, Takata CSA, Campaner M, Borda CC, Paiva F, Milder RV, Teixeira MMG, Camargo EP: Молекулярно-филогенетическое переопределение Herpetomonas (Kinetoplastea, Trypanosomatidae, связанного с паразитами насекомых). Протист. 2013, 164: 129-152. 10.1016 / j.protis.2012.06.001.
Артикул PubMed Google Scholar
Подлипаев С.А., Штурм Н.Р., Фиала I, Фернандес О., Вестенбергер С., Доллет М., Кэмпбелл Д., Лукес Дж .: Разнообразие трипаносоматид насекомых, оцененное по сплайсированным генам лидерной РНК и 5S рРНК и межгенным регионам.J Eukaryot Microbiol. 2004, 51: 283-290. 10.1111 / j.1550-7408.2004.tb00568.x.
CAS Статья PubMed Google Scholar
Вотипка Я., Клепеткова Х., Юрченко В.Ю., Хорак А., Лукеш Я., Маслов Д.А.: Космополитическое распространение трипаносоматиды Leptomonas pyrrhocoris . Протист. 2012, 163: 616-631. 10.1016 / j.protis.2011.12.004.
Артикул PubMed Google Scholar
Подлипаев С.А., Вотипка Ю., Йирко М., Свободова М., Лукес Ю.: Herpetomonas ztiplika n. sp. (Kinetoplastida: Trypanosomatidae): паразит кровососущей мокрецы Culicoides kibunensis Tokunaga, 1937 (Diptera: Ceratopogonidae). J Parasitol. 2004, 90: 342-347. 10.1645 / GE-156R.
Артикул PubMed Google Scholar
Zídková L, Cepicka I, Votypka J, Svobodová M: Herpetomonas trimorpha sp.ноя (Trypanosomatidae, Kinetoplastida), паразит мокрецов Culicoides truncorum (Ceratopogonidae, Diptera). Int J Syst Evol Microbiol. 2010, 60: 2236-2246. 10.1099 / ijs.0.014555-0.
Артикул PubMed Google Scholar
Votypka J, Suková E, Kraeva N, Ishemgulova A, Duˇ I, Yurchenko V, Luke J: Разнообразие трипаносоматид (Kinetoplastea: Trypanosomatidae), паразитирующих на блох (Insecta: Siphonapterachomonas), и описание ген.п. Proti. 2013, 164: 763-781. 10.1016 / j.protis.2013.08.002.
CAS Статья Google Scholar
Гамильтон П.Б., Стивенс Дж. Р., Гидли Дж, Хольц П., Гибсон В. К.: Новая линия трипаносом от австралийских позвоночных и наземных пиявок-кровососов (Haemadipsidae). Int J Parasitol. 2005, 35: 431-443. 10.1016 / j.ijpara.2004.12.005.
CAS Статья PubMed Google Scholar
Teixeira MMG, Borghesan TC, Ferreira RC, Santos MA, Takata CSA, Campaner M, Nunes VLB, Milder RV, de Souza W., Camargo EP: филогенетическая проверка родов Angomonas и Strigomonas трипаносоматозных эндонуклеаз описание новых видов трипаносоматид и протеобактериальных симбионтов. Протист. 2011, 162: 503-524. 10.1016 / j.protis.2011.01.001.
Артикул PubMed Google Scholar
Svobodová M, Zídková L, Cepicka I, Oborník M, Lukes J, Votýpka J: Sergeia podlipaevi gen. nov., sp. ноя (Trypanosomatidae, Kinetoplastida), паразит мокрецов (Ceratopogonidae, Diptera). Int J Syst Evol Microbiol. 2007, 57 (Pt 2): 423-432.
Артикул PubMed Google Scholar
Ройтман I, Бренер З., Ройтман С., Китадзима Е. Демонстрация того, что Leptomonas pessoai Galvão, Oliveira, Carvalho & Veiga, 1970, является Herpetomonas .J Protozool. 1976, 23: 291-293. 10.1111 / j.1550-7408.1976.tb03773.x.
CAS Статья PubMed Google Scholar
Фиорини Дж., Таката С., Теофило В., Насименто Л., Фариа-э-Силва П., Соарес М., Тейшейра М., Де Соуза В. Морфологическая, биохимическая и молекулярная характеристика Herpetomonas samuelpessoai camargoi n. subsp., трипаносоматида, выделенная из цветка кабачка Cucurbita moschata .J Eukaryot Microbiol. 2001, 48: 62-69. 10.1111 / j.1550-7408.2001.tb00416.x.
CAS Статья PubMed Google Scholar
Marín C, Fabre S, Sánchez-Moreno M, Dollet M: Herpetomonas spp. выделен из плодов томата ( Lycopersicon esculentum ) на юге Испании. Exp Parasitol. 2007, 116: 88-90. 10.1016 / j.exppara.2006.11.003.
Артикул PubMed Google Scholar
Морио Ф., Рейнес Дж., Доллет М., Пратлонг Ф., Дедет Дж. П., Равель С. Выделение простейшего паразита, генетически связанного с насекомым трипаносоматидом. Herpetomonas samuelpessoai от пациента с положительным вирусом иммунодефицита человека. J Clin Microbiol. 2008, 46: 3845-3847. 10.1128 / JCM.01098-08.
PubMed Central Статья PubMed Google Scholar
Foissner I, Foissner W: Ciliatosporidium platyophryae ноя.ген., ноя. спец. (Microspora incerta sedis), паразит Platyophrya terricola (Ciliophora, Colpodea). Eur J Protistol. 1995, 31: 248-259. 10.1016 / S0932-4739 (11) 80088-X.
Артикул Google Scholar
Фокин С.И., Ди Джузеппе Дж., Эрра Ф., Дини Ф .: Euplotespora binucleata n. gen., n. sp. (Protozoa: Microsporidia), паразит, инфицирующий гипотрихозную инфузорию Euplotes woodruffi , с наблюдениями за микроспоридийными инфекциями цилиофора.J Eukaryot Microbiol. 2008, 55: 214-228. 10.1111 / j.1550-7408.2008.00322.x.
CAS Статья PubMed Google Scholar
Gillies C, Hanson ED: Новый вид Leptomonas , паразитирующий на макронуклеусе Paramecium trichium . J Protozool. 1963, 10: 467-473. 10.1111 / j.1550-7408.1963.tb01707.x.
CAS Статья PubMed Google Scholar
Wille JJ, Weidner EJ, Steffens WL: Внутриядерный паразитизм инфузории Euplotes трипаносоматидным жгутиком. J Protozool. 1981, 28: 223-227. 10.1111 / j.1550-7408.1981.tb02837.x.
Артикул Google Scholar
Görtz H-D, Dieckmann J: Leptomonas ciliatorum n. sp. (Kinetoplastida, Trypanosomatidae) в макронуклеусе гипотрихозной инфузории. J Protozool. 1987, 34: 259-263. 10.1111 / j.1550-7408.1987.tb03171.x.
Артикул Google Scholar
Dyková I, Fiala I, Lukes J: Perkinsiella амебоподобные эндосимбионты Neoparamoeba spp., Родственники кинетопластиды Ichthyobodo . Eur J Protistol. 2003, 52: 37-52.
Артикул Google Scholar
Tanifuji G, Kim E, Onodera NT, Gibeault R, Dlutek M, Cawthorn RJ, Fiala I, Lukes J, Greenwood SJ, Archibald JM: Геномная характеристика Neoparamoeba pemaquidensis (Амоэбоозооплазмоз) .Эукариотическая клетка. 2011, 10: 1143-1146. 10.1128 / EC.05027-11.
PubMed Central CAS Статья PubMed Google Scholar
Вихтерман Р: Биология Paramecium. 1953, Нью-Йорк: The Blakiston Company, Inc, 1-527.
Google Scholar
Фокин С.И.: Бактериальные эндобионты инфузории Paramecium woodruffi. II. Эндобионты околоядерного пространства.Цитология. 1989, 31: 845-
Google Scholar
Корлисс Дж. О.: Импрегнация реснитчатых простейших серебром по методу Чаттона-Львова. Stain Technol. 1953, 28: 97-100.
CAS PubMed Google Scholar
Фокин С.И., Гёрц Х.-Д .: «Caedibacter macronucleorum» sp. nov., бактерия, населяющая макронуклеус Paramecium duboscqui . Arch Protistenkd.1993, 143: 319-324. 10.1016 / S0003-9365 (11) 80328-3.
Артикул Google Scholar
Людвиг В., Странк О, Вестрам Р., Рихтер Л., Мейер Х., Ядхукумар, Бюхнер А., Лай Т., Степпи С., Йобб Г., Фёрстер В., Бреттске И., Гербер С., Гинхарт А. В., Гросс О., Груманн С., Герман С., Йост Р., Кёниг А., Лисс Т., Люссманн Р., Мэй М., Нонхофф Б., Райхель Б., Стрелов Р., Стаматакис А., Штукманн Н., Вильбиг А., Ленке М., Людвиг Т.: ARB: программная среда для данных последовательности.Nucleic Acids Res. 2004, 32: 1363-1371. 10.1093 / нар / гх393.
PubMed Central CAS Статья PubMed Google Scholar
Guindon S, Gascuel O: Простой, быстрый и точный алгоритм для оценки крупных филогений по максимальной вероятности. Syst Biol. 2003, 52: 696-704. 10.1080 / 106351503520.
Артикул PubMed Google Scholar
Huelsenbeck JP, Ronquist F: MRBAYES: Байесовский вывод филогенетических деревьев.Биоинформатика. 2001, 17: 754-755. 10.1093 / биоинформатика / 17.8.754.
CAS Статья PubMed Google Scholar
Fan X, Huang J, Lin X, Li J, Al-Rasheid KAS, Hu X: Морфологическая и молекулярная характеристика Euplotes encysticus (Protozoa: Ciliophora: Euplotida). J Mar Biol Assoc United Kingdom. 2010, 90: 1411-1416. 10.1017 / S002531541000038X.
CAS Статья Google Scholar
Yonezawa F: Новая гипотрихозная инфузория Euplotes encysticus sp. ноя J Sci Hiroshima Univ Ser B, Div 1. 1985, 32: 35-46.
Google Scholar
Li Y, Niu Y, Liu L: Филогенетические исследования четырех видов инфузорий, выведенные из 16S-подобных генных последовательностей малых субъединиц рРНК. J для Res. 2008, 19: 119-124. 10.1007 / s11676-008-0020-9.
CAS Статья Google Scholar
Bhatia BL: Простейшие: Ciliophora. Фауна Британской Индии, включая Цейлон и Бирму, Том I. Отредактировал: Sewell RBS. 1936, Лондон: Taylor and Francis Ltd, 1-548.
Google Scholar
Das AK, Mandal AK, Sarkar NC: Protozoa. 1. Свободноживущие простейшие. Фауна Западной Бенгалии. Зоологическая служба Индии. 1993, New Alipore: M-Block, 1-133.
Google Scholar
Калавати С., Раман А.В.: Таксономия и экология реснитчатых простейших из маргинальных морских сред восточного побережья Индии. Зоологическая служба Индии. 2008, New Alipore: M-Block, 1-136.
Google Scholar
Yi Z, Weibo S, Clamp JC, Chen Z, Gao S, Zhang Q: Пересмотр систематических взаимосвязей внутри отряда Euplotida (Protista, Ciliophora) с использованием новых последовательностей гена, кодирующего малую субъединицу рРНК и тестирование использования объединенных наборов данных для построения филогении комплекса Diophrys .Mol Phylogenet Evol. 2009, 50: 599-607. 10.1016 / j.ympev.2008.12.006.
CAS Статья PubMed Google Scholar
Ламот Ф., Гроуб Г.: Патогены амеб как новые возбудители пневмонии. FEMS Microbiol Rev.2010, 34: 260-80. 10.1111 / j.1574-6976.2009.00207.x.
CAS Статья PubMed Google Scholar
Томас В., МакДоннелл Дж., Дениер С.П., Майярд Дж.-Й .: Свободноживущие амебы и их внутриклеточные патогенные микроорганизмы: риски для качества воды.FEMS Microbiol Rev.2010, 34: 231-59. 10.1111 / j.1574-6976.2009.00190.x.
CAS Статья PubMed Google Scholar
Schrallhammer M, Schweikert M, Vallesi A, Verni F, Petroni G: Обнаружение нового подвида Francisella noatunensis как эндосимбионта инфузории Euplotes raikovi . Microb Ecol. 2011, 61: 455-64. 10.1007 / s00248-010-9772-9.
Артикул PubMed Google Scholar
Dyková I, Veverková M, Fiala I, Machácková B, Pecková H: Nuclearia pattersoni sp. п. (Filosea), новый вид амфизойной амебы, выделенной из жабр плотвы ( Rutilus rutilus ), и ее риккетсиозного эндосимбионта. Folia Parasitol (Прага). 2003, 50: 161-170.
Артикул Google Scholar
Schrallhammer M, Ferrantini F, Vannini C, Galati S, Schweikert M, Görtz H-D, Verni F, Petroni G: «Candidatus Megaira polyxenophila» gen.nov., sp. nov .: Соображения эволюционной истории, диапазона хозяев и сдвига ранних дивергентных риккетсий. PLoS One. 2013, 8: e72581-10.1371 / journal.pone.0072581.
PubMed Central CAS Статья PubMed Google Scholar
Vannini C, Petroni G, Verni F, Rosati G: Бактерия, принадлежащая к семейству Rickettsiaceae , обитает в цитоплазме морской инфузории Diophrys appendiculata (Ciliophora), Hypotrichia.Microb Ecol. 2005, 49: 434-442. 10.1007 / s00248-004-0055-1.
CAS Статья PubMed Google Scholar
Сан Х.Й., Ноэ Дж., Барбер Дж., Койн Р.С., Кэссиди-Хэнли Д., Кларк Т.Г., Финдли Р.С., Дикерсон Х.В.: Эндосимбиотические бактерии в паразитарных инфузориях Ichthyophthirius multifiliis . Appl Env Microbiol. 2009, 75: 7445-7452. 10.1128 / AEM.00850-09.
CAS Статья Google Scholar
Феррантини Ф, Фокин С.И., Модео Л., Андреоли I, Дини Ф, Гёртц HD, Верни Ф., Петрони Г.: « Candidatus Cryptoprodotis polytropus», новый организм Rickettsia -подобный организм мерцательного протиста
10 Pseudomicro Ciliophora, Nassophorea). J Eukaryot Microbiol. 2009, 56: 119-129. 10.1111 / j.1550-7408.2008.00377.x.CAS Статья PubMed Google Scholar
Кавафуне К., Хонго Ю., Хамаджи Т., Нодзаки Х .: Молекулярная идентификация риккетсиозных эндосимбионтов в нефаготрофных вольвокалиновых зеленых водорослях.PLoS One. 2012, 7: e31749-10.1371 / journal.pone.0031749.
PubMed Central CAS Статья PubMed Google Scholar
Саммерер М., Зоннтаг Б., Соммаруга Р: Инфузорий-симбионтная специфичность пресноводного эндосимбиотика Chlorella (Trebouxiophyceae, Chlorophyta). J Phycol. 2008, 44: 77-84. 10.1111 / j.1529-8817.2007.00455.x.
CAS Статья Google Scholar
Кодама Y, Фудзисима М: Вторичный симбиоз между клетками Paramecium и Chlorella . В Int Rev Cell Mol Biol. Объем. 2010, 279: 33-77.
CAS Google Scholar
Nowack ECM, Melkonian M: Эндосимбиотические ассоциации у протистов. Philos Trans R Soc Lond B Biol Sci. 2010, 365: 699-712. 10.1098 / rstb.2009.0188.
PubMed Central CAS Статья PubMed Google Scholar
Montagna M, Sassera D, Epis S, Bazzocchi C, Vannini C, Lo N, Sacchi L, Fukatsu T, Petroni G, Bandi C: « Candidatus Midichloriaceae» fam. ноя ( Rickettsiales ), экологически широко распространенная клада внутриклеточных Alphaproteobacteria. Appl Entomol Zool. 2013, 79: 3241-3248.
CAS Google Scholar
Boscaro V, Petroni G, Ristori A, Verni F, Vannini C: «Candidatus Defluviella procrastinata» и « Candidatus Cyrtobacter zanobii», два новых цилиатных эндосимбионта
10, принадлежащих к классу Midosymbionts10. .Microb Ecol. 2013, 65: 302-310. 10.1007 / s00248-012-0170-3.Артикул PubMed Google Scholar
Thepparit C, Sunyakumthorn P, Guillotte ML, Popov VL, Foil LD, Macaluso KR: Изоляция риккетсиозного патогена от негематофагного членистоногого. PLoS One. 2011, 6: e16396-10.1371 / journal.pone.0016396.
PubMed Central CAS Статья PubMed Google Scholar
Реснички и жгутики — Инфузории и жгутиковые — Schweizerbart science publishers
Одноклеточные эукариоты, или простейшие, представляют особую жизнь. тип организации, отличный от многоклеточной жизни.В мир этих одноклеточных организмов в основном состоит из жгутиковые и реснитчатые существа, потому что большинство протистов обладают жгутики или реснички на определенных этапах жизненного цикла. В новом книга, Клаус Хаусманн, Ренате Радек и их 15 соавторов резюмируют многочисленные аспекты структуры и функции ресничек / жгутиков организация и биология инфузорий / жгутиковых. Оглавление этот том включает короткое предисловие и привлекательное введение, 14 наиболее информативных глав, разделенных на 7 разделов (Ultrastructure, Клеточная биология, подвижность, систематика и систематика, симбиоз, Биоразнообразие, ретроспективы и перспективы), Приложение, включая учебные планы биографии авторов, раздел научного юмора и благодарности, и полезный Index.
В предисловии говорится, что книга считает «актуальным резюме. описывая состояние нашего понимания ресничек / жгутиков и инфузории / жгутиковые… без биохимических и генетических аспектов ». Тем не менее современные молекулярные и генетические данные широко используются, широко упоминается во многих главах и умело переплетается с общим содержанием книги.
Во вводной главе «Реснички и жгутики — инфузории и Жгутиковые », К. Хаусманн, Р.Радек ясно и ясно исчерпывающая интерпретация универсальных особенностей ресничек и жгутики, их роль в подвижности клеток и общие характеристики ресничные и жгутиковые протисты.
Глава «Клеточная архитектура, рост, морфогенез, Хемоаттрактанты и свободные концы »Г.А. Антипа рассказывает историю исследования удивительной цитоархитектуры и пищеварения Дидиниум. Кроме того, есть отличный отчет о процесс хемоаттракции между Didinium и Paramecium.Глава также включает синтез исследований морфогенетических последовательностей в инфузорий, включая описание формирования базального тела и морфогенез тигмотактического поля Conchophthirus curtus. Этот раздел книги заканчивается важным заявлением о том, что нам нужна лучший механизм для объединения идей из молекулярных и организменных биология, которая может закрепить и объяснить эволюционные отношения внимательнее.
Глава «Изгнание, проглатывание, пищеварение и выделение при Инфузории »К.Хаусманн занимается световой и электронной микроскопией. исследования экструсом, трихоцист и токсицист, структур, которые участвует в поглощении пищи и сегрегации пищи, а также в сократительной вакуолярный комплекс инфузорий. Все эти качественные конструкционные исследования приближают нас к пониманию того, насколько важны части инфузорийной клетки действуют как экструзионные органеллы или сократительные вакуоли. Автор завершает главу глубоким идея о том, что современные структурные исследования по-прежнему необходимы для лучшее понимание поведения, физиологии и биохимии протисты.
Глава «Песнь хвалы Парамециуму как образцу в пузыре». Торговля людьми: похвала в ретроспективе с определенными Резервация »Х. Платтнера резюмирует некоторые результаты по везикулам. трафик, стыковка и слияние мембран, экзоэндоцитоз и кальций сигнализация в ячейке Paramecium, которая открыла дверь для изучение множества фундаментальных вопросов клеточного и молекулярного биология. Потрясающие результаты, полученные с моделью Paramecium ясно показывают, что у этой системы есть будущее в ближайшем будущем. расследования.
Глава П. Лупорини «Типы спаривания инфузорий и феромоны», К. Алименти и А. Валлези начинают с истории наших знаний о Типы спаривания инфузорий и заканчивается подробным описанием различных структуры, трехмерные конформации, гены и множественные амино кислотные последовательности феромонов, которые играют ключевую роль в коммуникации между особями одного вида инфузорий при конъюгации и автогамия.
В главе «Встречи с ресничками» М.А. Сани представляет тщательное и четко описанное лечение движения ресничек / жгутиков у модельные простейшие виды. Затем следует оценка значение этого знания для понимания цилиарного метахронизма и движение воды и слизи в нескольких одноклеточных и многоклеточных организмов, и завершается обзором контроля над ресничная активность. Мне всегда было интересно, как универсальность рисунок 9 × 2 + 2 фибрилл как в жгутиках, так и в ресничках может гармонизировать с их способностью выполнять совершенно разные режимы динамики и шаблоны ударов.Эта глава дает, по крайней мере частично, ответ на это важный вопрос.
Следующая глава «Насколько протисты не отстают?» Х. Мачемера посвящена углубленному анализу исследований инфузорий. механочувствительность, подвижность, гравитаксис и поведение. В соответствии с По полученным результатам, гравикинез у протистов занимает промежуточное положение. положение между классическим кинезисом и такси.
Глава «Гребневики и термиты — системы подвижности» автора S.L. Тамм занимается обширной областью изучения структуры, развитие, регенерация, моторика, механочувствительность, мембрана движения, электрическая проводимость и поведение в модельных организмах несколько так называемых простых беспозвоночных, с особым упором на интригующие механизмы, координирующие биение полей ресничек в гребневиках и жгутиках жгутиков термитов.
Д.Х. Линн, автор главы «Кинетиды, концепции и Совпадение », наглядно показывает, как трансформирующая идея о структурных консерватизм кинетид привел к созданию новой макросистемы инфузорий, что позже в определенной степени подтверждено исследованиями молекулярных филогений этих простейших. Счет Линн исследовательская карьера аккуратно перемежается поучительными рассказами о рентабельность «малых» и «больших» концепций, а также о преимуществах а иногда и непростые ситуации, которые могут возникнуть во время сотрудничество и / или конкуренция между различными научными группами.
Глава «О водорослях и других протистских жгутиках и ресничках» автора Ø. Моэструп записывает впечатляющую историю жгутиков и ресничек. исследования с первых дней световой микроскопии до наших дней современная клеточная биология. Широкомасштабное сравнительное исследование этих сложные структуры передвижения привели автора к гипотезе что, несмотря на то, что возник первый эукариотический жгутик как единичная органелла, состояние бифлагеллат для предкового эукариот, вероятно, был самым успешным в эволюции.В В главе делается вывод, что, хотя структура и функции жгутика много раз модифицировались в разных группах одноклеточных организмов, аксонема 9 × 2 + 2 и базальные структуры тела 9 × 3 остаются поразительно консервативен на всем эукариотическом «дереве жизнь».
Уточнение паттернов эндосимбиоза — ключевой вопрос в современной клеточной медицине. биология простейших. В главе «Взгляд на Симбиозы Paramecium-Holospora и Paramecium-Chlorella »М. Фудзисима и Ю.Kodama представляет комплексный синтез последних исследований. о восстановлении этого явления между Paramecium caudatum и симбиотические бактерии видов Holospora и между P. bursaria и его цитоплазматический эндосимбионт, Chlorella variabilis. Очарование этого глава состоит в том, что он позволяет понять, как симбионт вторгается в клетка-хозяин, избегает переваривания в цитоплазме и растет внутри хозяина клетки и какие молекулярные механизмы лежат в основе этих процессов.
Еще одна важная глава «Прокариотические эндосимбионты инфузорий», написанный Х.-D. Гёрц также обсуждает уникальные строения, жизнь и циклы заражения внутриклеточными микроорганизмами инфузорий. Специальный обращено внимание на виды Paramecium, инфицированные Голоспороподобные симбионты. Автор правильно констатирует, что в исследования эндосимбиоза, инфузории всегда были теми самыми организмами предоставление наиболее важной информации по проблеме за последние 130 годы.
Глава «Симбионты симбионтов — жгутиконосцы термитов и их Бактериальные ассоциации »Р.Радек и Дж. Ф. Х. Штрассерт включает обширный обзор симбиоза у протистов, с основными аспектами взаимодействия между прокариотической микробиотой и жгутиконосцами (парабазалиды и оксимонады) в задней кишке низших термитов и древесины плотва Cryptocercus.
Глава «Самые мелкие протисты в самых глубоких глубинах — жгутиковые. с дна глубинного моря »посвящена глубоководным протистам в особые жгутиконосцы, которые были отобраны, успешно культивированы и изучен К. Хаусманном и его коллегами.Их выводы ясно бросить вызов более раннему представлению о низком видовом богатстве протистана на глубинное морское дно и обосновать плодотворную перспективу дальнейшие исследования разнообразия простейших в глубоководных среды.
Наконец, Дж. Бенигк в главе «Пять десятилетий исследований в Протистология — что мы узнали? » проводит читателя через история протистологических исследований, в частности за последние 50 лет, кратко, но ясно объясняя влияние этого исследования на наше понимание мира жгутиконосцев и инфузорий.Он утверждает что исследования одноклеточных эукариот находились под сильным влиянием историческими достижениями общей биологии, другими связанными дисциплины и инновационные технологии, которые, несомненно, должны помочь начинающие ученые лучше предсказывают будущие открытия в замечательная область протистологии.
Следует сказать несколько слов о техническом качестве этого версия. Написана книга в твердой обложке и красивом формате. ярко и легко уследить. Это хорошо иллюстрируют 233 рисунка, включая линейные рисунки неизменно высокого качества, эстетично красивые световые и электронные микроскопические изображения, иллюстрирующие различные особенности биологии протистана.Все главы сводят воедино важная соответствующая литература; ссылки удобно организованы в конце каждой главы. Мне было очень приятно читать эту книгу, и я поздравляю редакторов, Клауса Хаусмана и Ренате Радеку, а также всем остальным 15 участникам за создание отличного объем реснитчатых и жгутиковых эукариотических микроорганизмов.
Я без колебаний рекомендую эту книгу всем продвинутым студентам биология, профессиональные ученые, которые работают с простейшими и любят их, и всем, кто желает углубить знания и раскрыть уникальные мир этих удивительно изящных и экологически важных одноклеточные организмы.
Сергей О. Скарлато
Протистология 8 (3) 2014, стр. 25–127
зооксантелл, собранных инфузориями, связанными с синдромом коричневой полосы кораллов, остаются фотосинтетически компетентными
Отбор проб. Образцы ветвистого коралла Acropora muricata , проявляющие симптомы BrB, были собраны в ноябре 2005 года на открытой рифовой равнине у рифа Дэвис (18 ° 49,86 ′ Ю.ш., 147 ° 38,2 ′ в.д.) на GBR и доставлены в Австралийский институт морских наук в Таунсвилле для дальнейшего анализа.
Гистологическое и микроскопическое исследование. Для гистологического исследования массу коричневой полосы, включающую инфузории и ткань коралла, соскребали с ветви коралла и концентрировали центрифугированием (1000 × г ) с удалением лишней жидкости. Перед обработкой образцы фиксировали в фиксаторе Дэвидсона (21) в течение 24 ч. Все образцы были разделены (5 мкм) и окрашены (гематоксилин Майера и эозин) с использованием обычных гистологических процедур и исследованы с помощью световой микроскопии (3). Микроскопическую визуализацию выполняли с помощью микроскопа Zeiss Axioskop II (Carl Zeiss, Йена, Германия) с изображениями, полученными с помощью охлаждаемой камеры устройства с зарядовой связью с высоким разрешением AxioCam MRC5 (Zeiss).Флуоресцентные изображения получали с использованием галогенной лампы для падающего света и набора фильтров Cy3, HQCy3 (возбуждение, BP535 / 50 нм; дихроичное зеркало, Q565 LP; излучение, BP610 / 75 нм) (Carl Zeiss, Jena, Germany).
PAR Abs и хлорофилл a определений. Imaging-PAM оценивает поглощающую способность (Abs) фотосинтетически активного излучения (PAR), то есть долю падающего PAR, которая поглощается, исходя из коэффициента отражения красного света (650 нм) (R) к коэффициенту отражения непоглощенного ближнего инфракрасного света (780 нм) (NIR) от поверхности ткани: $$ mathtex $$ \ [\ mathrm {Abs} \ {=} \ 1 \ {-} \ (\ mathrm {R} / \ mathrm {NIR}) \] $$ mathtex $$ (1)
Этот параметр был измерен как в здоровой ткани, так и в ткани коричневой полосы каждой репликационной колонии кораллов.Важно отметить, что Abs оценивает поглощение света через коэффициент отражения от поверхности. Таким образом, сильно пигментированные тканевые поверхности будут демонстрировать более высокую поглощающую способность, чем поверхности с пигментами, распределенными более однородно или глубже в ткани, хотя общая концентрация хлорофилла может быть такой же.
Ткань, полученная из ∼1 см 2 здоровой ткани и ткани коричневой полосы, соответственно, экстрагировалась в 1 мл метанола в течение 2 часов. Экстракты центрифугировали (15000 об / мин) в течение 2 минут, и осветленный супернатант смешивали 1: 1 в 70:30 (об. / Об.) Метанол-28 мМ водный раствор ацетата тетрабутиламмония, pH 6.5. 5 мкл образца смеси вводили в колонку Phenomenex C 8 (размер частиц 3 мкм, 50 × 4,6 мм) при комнатной температуре (21 ° C). Анализ был выполнен с помощью высокоэффективной жидкостной хроматографии с обращенной фазой на системе высокоэффективной жидкостной хроматографии с интерфейсом персонального компьютера (Waters Corporation). Управление системой, сбор данных и интеграция выполнялись с использованием программного обеспечения Empower Pro (Waters Corporation, 2002). Пигменты разделяли с использованием бинарной системы подвижной фазы, 70:30 (об. / Об.) Метанол-28 мМ водный ацетат тетрабутиламмония, pH 6.5 (от 75% до 100%), более 10 мин. Скорость потока поддерживалась постоянной на уровне 1 мл мин -1 . Хлорофилл и детектировали с использованием матричного фотодиодного детектора, а идентичность пигмента определяли путем спектрального сравнения со стандартом хлорофилла и (Sigma-Aldrich). Высота (h) и радиус (r) кусочков коралла в форме цилиндра и размером с кончик пальца, из которых была извлечена ткань, были измерены с точностью до миллиметра с помощью штангенциркуля и применены к формуле для расчета площади боковой поверхности цилиндра. ([2 × π × r] × h).Площадь поверхности рассчитывалась без учета вершины и основания, поскольку они представляли собой область прикрепления к колонии и, следовательно, не имели поверхностной ткани.
Комбинированные измерения переменной флуоресценции хлорофилла a и продуктивности O 2 . Чтобы оценить фотосинтетическую активность зооксантелл, измеряли три или четыре ветви Acropora muricata из отдельных колоний кораллов, проявляющих симптомы BrB. К каждой колонии применялись следующие настройки и последовательность измерений: один раз в бессимптомной здоровой ткани на расстоянии 4–5 см от поражения и один раз в центре (наиболее плотная область) зоны коричневой полосы.
Начальная быстрая кривая блеска (RLC) с 10-секундными интервалами между облучениями (0, 1, 73, 144, 365, 515, 690, 911 и 1204 мкмоль фотонов м −2 с −1 ) была выполнено на акклиматизированном к темноте коралле с использованием флуориметра Imaging-PAM (Walz, Effeltrich, Германия). Для измерений кислородного микроэлектрода коралл затем помещали в специально построенную проточную камеру (25 × 10 × 10 см), через которую морская вода из резервуара циркулировала со скоростью потока ~ 1 см / с -1 .Резервуар содержал приблизительно 20 литров морской воды и поддерживался при температуре 27 ± 0,5 ° C с использованием нагревателя стеклянного аквариума (100 Вт; Aqua One; Kong’s International, Австралия).
Микроэлектрод O 2 (39), который был линейно откалиброван путем регистрации сигналов в морской воде, насыщенной воздухом и морской воде, свободной от O 2 , располагался под углом 25 ° относительно источника света (Schott 2500). , а образец коралла исследовали с помощью препаровального микроскопа (Leica, Германия).Микросенсор помещали в непосредственный контакт с поверхностью коралловой ткани с помощью микроманипулятора с ручным управлением (MM33; Märtzhäuser, Германия), а сигнал измерения записывали с помощью пикоамперметра (PA2000; Unisense A / S, Дания) на полосовой диаграмме диктофон (Kipp & Zonen, Нидерланды). Кораллы освещались оптоволоконным вольфрамово-галогенным источником света с коллимирующей линзой (Schott KL-2500; Германия), калиброванной по светочувствительному датчику (LI-192SB; LI-COR). Каждую освещенность (0, 33, 59, 91, 130, 247, 494 и 845 мкмоль фотонов m -2 с -1 ) применяли в течение 10 минут для получения стационарных условий до O 2 измерений (53).В устойчивом состоянии для конкретной освещенности O 2 транспорт, потребление и производство находятся в равновесии, и никаких изменений уровня O 2 с течением времени не обнаруживается (26). Мониторинг уровня кислорода на поверхности ткани на ленточном самописце после регулировки освещенности показал, что 10 мин было достаточно для достижения устойчивого состояния.
Микропрофили кислорода в темноте измерялись с шагом 10 мкм по вертикали от поверхности ткани через DBL и в объемную воду, которая имела постоянное содержание кислорода (табличное значение 204.3 мкмоль O 2 литр -1 при 27 ° C и солености 35 ppt; Unisense). Поток кислорода (скорость темнового дыхания) рассчитывали по профилю концентрации кислорода как $$ mathtex $$ \ [J {=} {-} D_ {o} {\ times} \ mathrm {dC} / \ mathrm {dz} \] $$ mathtex $$ (2) где D o — коэффициент диффузии O 2 при 27 ° C и солености 35 ppt (табличное значение, 2.35 × 10 −5 см 2 с −1 ; Unisense) и dC / dz — постоянная крутизна градиента кислорода в ДБС; этот расчет предполагает одномерную диффузионную геометрию (25).
На каждом последующем уровне освещенности (33, 59, 91, 130, 247, 494 и 845 мкмоль фотонов м −2 с −1 ) кончик микроэлектрода располагался на поверхности ткани, и когда он устойчиво Состояние кислорода были проверены, был выполнен внезапный и короткий (от 1 до 3 с) сдвиг от света к темноте для оценки общей скорости фотосинтеза (26, 53). Техника сдвига свет-темнота, которая требует установившегося распределения O 2 перед смещением свет-темнота, позволяет измерить общую скорость фотосинтеза как непосредственную скорость истощения кислорода после наступления темноты (более подробная информация в ссылке 40).После измерений общего фотосинтеза были измерены микропрофили кислорода и использованы для оценки чистой скорости фотосинтеза по уравнению 2. Наконец, флуориметр Mini-PAM (Walz, Effeltrich, Германия), оснащенный 2-миллиметровым оптоволоконным датчиком, использовался на каждом уровне освещенности. для эффективного квантового выхода (Δ F / F м ′), считывание с использованием одной насыщающей вспышки. Зонд осторожно подносили рукой к поверхности коралла, прилегающей к микросенсору O 2 . Эти измерения были использованы для создания стационарной кривой блеска (SSLC) относительной скорости переноса электронов (rETR) в зависимости от освещенности.
Первоначальный RLC с использованием Imaging-PAM был повторен на самом высоком уровне освещенности (845 мкмоль фотонов m -2 с -1 ). Для поддержания акклиматизации ФС II к высокому свету актиничный свет (845 мкмоль фотонов m −2 с −1 ) включался на 1 минуту после того, как коралл был помещен в Imaging-PAM перед инициированием. RLC. Первая насыщающая вспышка в акклиматизированном к темноте RLC обеспечила измерение максимального квантового выхода ( F v / F m ), которое сравнивали с первым измерением акклиматизированного к свету RLC, которое дало сравнительную Δ F / F m ′ (845 мкмоль фотонов m −2 s −1 ).Максимальное давление возбуждения над PSII было затем рассчитано как Q м = 1 — [(Δ F / F м ′) / ( F v / F м )] (24) . Q m используется в качестве прокси для физиологических характеристик зооксантелл, где значения, близкие к 0, указывают на то, что фотосинтез ограничен светом даже при высокой освещенности, а значения, близкие к 1, указывают на закрытие ФСII при высокой освещенности, например, из-за фотоингибирования.
Значение rETR, полученное из RLC, а также из стационарных кривых блеска, было рассчитано как rETR = Δ F / F м ′ × PAR, где Δ F / F м ′ = ( F м ′ — F t ) / F м ′ (45).Кривые блеска (полученные как от флуоресценции, так и от O 2 ) были впоследствии подогнаны по формуле Platt et al. (35), посредством чего были рассчитаны количественные параметры rETR max или P g, max (максимальная скорость общего фотосинтеза), α (коэффициент использования света) и E k (минимальная насыщающая освещенность) ( подробности в ссылках 27 и 36).
Характеристики звероподобных протистов | Sciencing
Протистов называют растениями, грибами и животными, потому что они имеют некоторые общие черты растений, грибов и животных, хотя и принадлежат к другой категории: царству протистов.Все они эукариоты (то есть у них есть ядро), и все они живут во влажных условиях, будь то в соленой, пресной воде или внутри других организмов.
У них только одна клетка, хотя некоторые из них кажутся такими же многоклеточными, как и живут в колониях. Протистов, подобных животным, также называют звероподобными простейшими, или «первыми животными», поскольку они произошли от бактерий и стали эволюционными предками более сложных животных.
Общие характеристики простейших и простейших Определение
Определение простейших включает в себя их область эукарий (простейшие эукариоты), их собственное отдельное царство протистов и то, как они питаются.Почти все простейшие являются гетеротрофами, то есть они находят пищу в окружающей среде, поскольку не могут создавать свои собственные внутри клетки, как это делают растения. Клетка окружена мембраной и содержит крошечные структуры, называемые органеллами, включая митохондрии и пищеварительные вакуоли, которые выполняют важные функции, такие как преобразование кислорода и пищи в энергию.
Подробнее о различиях между простейшими и простейшими.
Существует четыре основных типа простейших, классифицируемых в зависимости от того, как они передвигаются и где живут:
- Rhizopoda (звероподобные протисты с ложными ногами, называемые псевдоподиями)
- Инфузории (простейшие покрыты крошечными волосовидные реснички)
- Жгутиковые (протисты с хлыстовыми «хвостами»)
- Sporozoa (паразитические протисты)
Большинство амеб, инфузорий и жгутиконосцев являются свободноживущими и образуют важную часть определенных бактерий, подавляя их. служит источником пищи для более крупных организмов.
Rhizopoda
Основными звероподобными простейшими в этой группе являются амебы, обитающие в пресной воде или как паразиты и фораминиферы, обитающие в море и образующие раковины. Все они характеризуются псевдоподиями («ложными ногами») — долями или пальцеобразными выпуклостями цитоплазмы, которые позволяют им двигаться. Они питаются бактериями и более мелкими простейшими, захватывая их псевдоподиями и поглощая в вакуолях, где ферменты переваривают их.
Отходы и избыток воды проходят через отверстия в клеточной мембране.Амебы размножаются бесполым путем путем бинарного деления, при котором ядро разделяется на две части, и вокруг каждой формируется новая клетка. Фораминиферы воспроизводятся по-разному в чередующихся поколениях — бесполым путем деления, затем половым путем, соединяясь вместе для обмена ядерным материалом. Некоторые амебы живут как паразиты; например, энтамоеба, источник амебной дизентерии.
Инфузории
••• Дункан Смит / Photodisc / Getty Images
Инфузории, такие как парамеции, имеют крошечные волоскоподобные структуры, называемые ресничками, растущие на их поверхности.Реснички продвигают их через воду и захватывают пищу, проникая в желобок на поверхности мембраны. Они питаются водорослями и бактериями и, в свою очередь, поедаются более крупными простейшими, такими как амебы.
Подробнее об основных функциях ресничек и жгутиков.
Инфузории имеют более одного ядра: большое, которое управляет повседневными функциями, и меньшее — для репродуктивных целей. Некоторые инфузории размножаются как половым, так и бесполым путем — сначала они объединяются, чтобы обмениваться репродуктивными ядрами, а затем образовавшиеся двойные ядра расщепляются, чтобы создать новые клетки.
Жгутиконосцы
Жгутиконосцы — это простейшие, похожие на животных, которые имеют структуру, напоминающую хлыст или хвост, для движения по воде. Некоторые из них, фитофлагелляты, могут производить себе пищу посредством фотосинтеза, как это делают растения. Другие поглощают частицы пищи в вакуоли или поглощают молекулы питательных веществ через свою поверхностную мембрану.
Большинство жгутиконосцев размножаются путем деления, но некоторые размножаются половым путем, сливаясь друг с другом перед делением. Некоторые жгутиковые паразиты; например, трипаносома и лямблия вызывают сонную болезнь и лямблиоз (диарею и рвоту) соответственно.
Sporozoa
••• Stockbyte / Stockbyte / Getty Images
Спорозоиды являются паразитами — они живут в организме хозяина или внутри него и причиняют ему вред. Не имея ресничек, жгутиков или псевдоподий, споразоа зависят от организма-хозяина в плане питания и от переносчиков, таких как комары, которые переносят их туда. Они передаются от хозяина к хозяину или от вектора к хозяину в виде спор.
Sporozoa также называют апикомплексами, потому что они имеют «апикальный комплекс», структуру, которая вырабатывает ферменты и позволяет простейшим вклиниваться в клетку-хозяин.Размножение имеет половую и бесполую стадии.
Каталог организмов: Таксон недели: Подборка инфузорий
Из всех групп одноклеточных или малоклеточных (извините за неологизм) эукариот, которые обычно объединяются под заголовком «простейшие» или «простейшие», инфузории являются одними из самых примечательных. Вместе со спорозоями они были одной из очень немногих групп, которые были признаны отличительными * до революции в классификации микробов, которая была разрешена появлением SEM и молекулярной филогении.На примере Paramecium они также являются одной из немногих протистских групп, существование которых широко известно широкой публике. В то время как другие простисты, такие как многие группы жгутиковых **, имеют тенденцию быть морфологически довольно простыми, инфузории достигают разнообразия формы и сложности, что кажется невероятным для одноклеточных организмов.
* За исключением неудачной тенденции неинфузорий Stephanopogon продолжать попытки пробраться в инфузорийную партию. Исследователи до сих пор почти не знают, что делать с Stephanopogon , но инфузории непреклонны, они не хотят иметь с ним ничего общего.
** В дореволюционной классификации простейшие обычно разделялись на основе локомоторных структур на жгутиконосцы (со жгутиками), амебы (псевдоподы), инфузории (реснички) и спорозойные (паразитические таксоны без локомоторных структур). Хотя сейчас хорошо известно, что эти подразделения в значительной степени искусственны *** (как и сам термин «простейшие»), они сохраняют определенную степень полезности в качестве описательных удобств (как и «простейшие»), хотя и «амебы» вероятно, следует исключить «амебоидный», чтобы не путать с фактическим родом Amoeba .Кроме того, в то время как световые микроскописты различали жгутики (относительно длинные и немногочисленные) и реснички (относительно короткие и обычно расположенные в виде трактов), между ними нет реальной разницы. Некоторые исследователи предпочли бы называть все такие структуры у эукариот «ресничками», оставляя термин «жгутики» для бактериальных локомоторных структур, которые сильно отличаются от .
*** Тем более, что у многих протистов в жизненном цикле есть как амебоидные , так и жгутиковые стадии.
Хотя новые технологии позволили инфузориям в целом сохранить свою целостность, они действительно вызвали небольшую перестановку внутри клады. Ранние классификации подчеркивали особенности орального аппарата, но с 1980-х годов стала признаваться важность ультраструктурных признаков, таких как расположение ресничек (Lynn, 2003). С добавлением молекулярных данных инфузории рассредоточились (с некоторой тревогой) на одиннадцать или около того классов, некоторые из них хорошо подтверждены как молекулярными, так и морфологическими данными, некоторые — только одним или другим.Именно с одним из этих классов, Spirotricha, мы и занимаемся сегодня.
Spirotricha — это разнообразная группа, и поддержка их как всей группы, по общему признанию, довольно низкая (хотя поддержка возрастает, если не учитывать расходящуюся Protocruzia ). Классическая особенность спиротрихов — это cirri — пучки ресничек, сросшихся в усики, что довольно хорошо видно на фотографии вверху сообщения Euplotes (из A Micronaturalist’s Notebook).Не все таксоны, молекулярно объединенные со спиротрихами, обладают усиками, но особенности макроядерного * деления также подтверждают группировку.
* Отдельная инфузория имеет несколько ядер — одно маленькое микроядро и одно или несколько более крупных макронуклеусов. Макронуклеусы участвуют в повседневном производстве ферментов и тому подобного, а микроядра участвуют в воспроизводстве. Когда происходит конъюгация (половое размножение), макронуклеусы разрушаются, и только микроядра размножаются. Затем макронуклеусы регенерируются из дочерних микроядер (см. Здесь для более подробного и точного описания — как и у многих так называемых «простых» организмов, инфузории восполняют простоту структуры, участвуя в непомерно сложных жизненных циклах).
Euplotes — один из самых известных спиротрихов. Фотография выше хорошо иллюстрирует, как Euplotes использует свои усики для ходьбы по субстрату, хотя их также можно использовать для плавания. Euplotes — хищник других инфузорий и поэтому имеет довольно большую ротовую полость. Его прожорливость в питании может быть замечательной — в 1974 году Клётцель отметил, что «В крайних случаях (с маленькими Tetrahymena , которые съедаются гораздо быстрее, чем большие) клетка Euplotes может проглотить 17 Tetrahymena в течение 5 минут, представляет собой площадь мембраны пищевой вакуоли примерно вдвое больше, чем вся поверхность Euplotes «.Поверьте, я борюсь с желанием добавить после этого восклицательные знаки.
Спиротрихи также включают единственную группу инфузорий, имеющую значительное количество окаменелостей, — тинтинниды. В отличие от других инфузорий, тинтинниды образуют лорику (раковину в форме вазы), которая может сохраняться после смерти организма (показано выше на сканирующем электронном микроскопе Фионы Скотт из Австралийского антарктического отдела). Существует подробная таксономия тинтиннид, основанная в основном на структуре и составе лорики, и было высказано предположение, что тинтинниды с агглютинированными лориками являются базальными по сравнению с тинтиннидами с гиалиновыми лориками.Однако исследования, основанные на живых тинтиннидах, показывают, что разные типы лорики могут принадлежать видам с одинаковым или сходным расположением ресничек, и, по-видимому, нет тесной корреляции между структурой лорики и ультраструктурой живого организма (Agatha & Strüder-Kypke , 2007).
ССЫЛКИ
Agatha, S., & M. C. Strüder-Kypke. 2007. Филогения отряда Choreotrichida (Ciliophora, Spirotricha, Oligotrichea) по данным морфологии, ультраструктуры, онтогенеза и последовательностей гена SSrRNA. Европейский журнал протистологии 43 (1): 37-63.
Kloetzel, J. A. 1974. Питание мерцательными простейшими. I. Глоточные диски в Euplotes : источник мембраны для образования пищевых вакуолей? Журнал клеточных исследований 15: 379-401.
Линн, Д. Х. 2003. Морфология или молекулы: Как мы идентифицируем основные клоны инфузорий (тип Ciliophora)? Европейский журнал протистологии 39 (4): 356-364.
.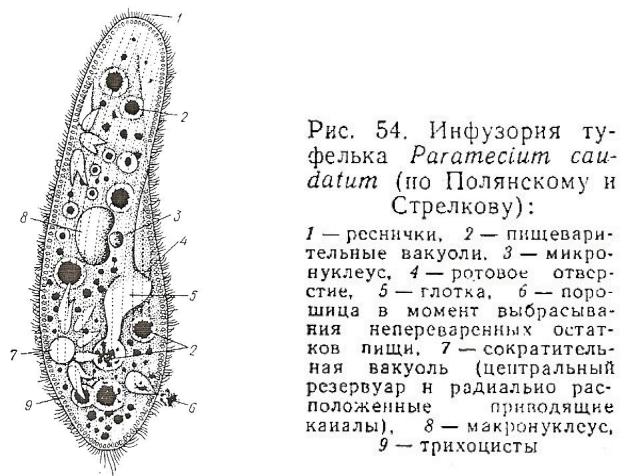 в диплом пойдет точно. и в презентацию.
в диплом пойдет точно. и в презентацию.