уход, содержание, размножение, совместимость, корм, фото-обзор
Чтобы разнообразить население своего аквариума, любители часто заводят разнообразных беспозвоночных. Не последнее место в списке таких питомцев занимают улитки. Среди них встречаются как мелкие «сорные» виды, так и очень красивые крупные моллюски. В нашей статье мы расскажем вам о содержании маризы – симпатичной полосатой улитки, которая полюбилась аквариумистам, даже несмотря на гастрономическую любовь к живым растениям.
Оглавление
Общие сведения
Мариза (Marisa cornuarietis) – аквариумная улитка, которая славится непомерным аппетитом. Свое происхождение моллюск ведет из Южной Америки. Является близким родственником широко известной ампулярии.
Типичный
растительноядный вид, который не стоит высаживать в аквариум-травник. При малейшем
недостатке корма улитки примутся за живые растения и могут съесть их под
корень. Аппетит моллюска даже используют в некоторых странах для борьбы с
инвазивными видами растений.
Тем не менее, улитка имеет эффектный внешний вид, благодаря своей крупной раковине и контрастным полоскам на ней.
Внешний вид
Улитки маризы являются обладателями плотной спирально-закрученной раковины из 3-4 витков. Она уплощенная и ее ширина может достигать 2 см, высота порядка 5 см. Крышечка, прикрывающая устье, достаточно мала и полностью убирается в раковину.
Окраска раковины вариабельна и изменяется от желтого до коричневого цвета с рядом продольных полосок. Существуют формы с однотонной окраской без полос. Само тело шоколадного или телесного цвета, часто с небольшими крапинками.
Улитки маризы являются обладателями крупных полосатых раковинДышит моллюск с
помощью жабр или легкого. Для работы последнего маризы вынуждены подниматься к
поверхности воды и выбрасывать короткую (до нескольких миллиметров) дыхательную
трубку. Рот в форме хоботка. В головной части располагаются подвижные щупальца,
в основании которых находятся органы зрения, которые, однако, способны
различать только темные и светлые области.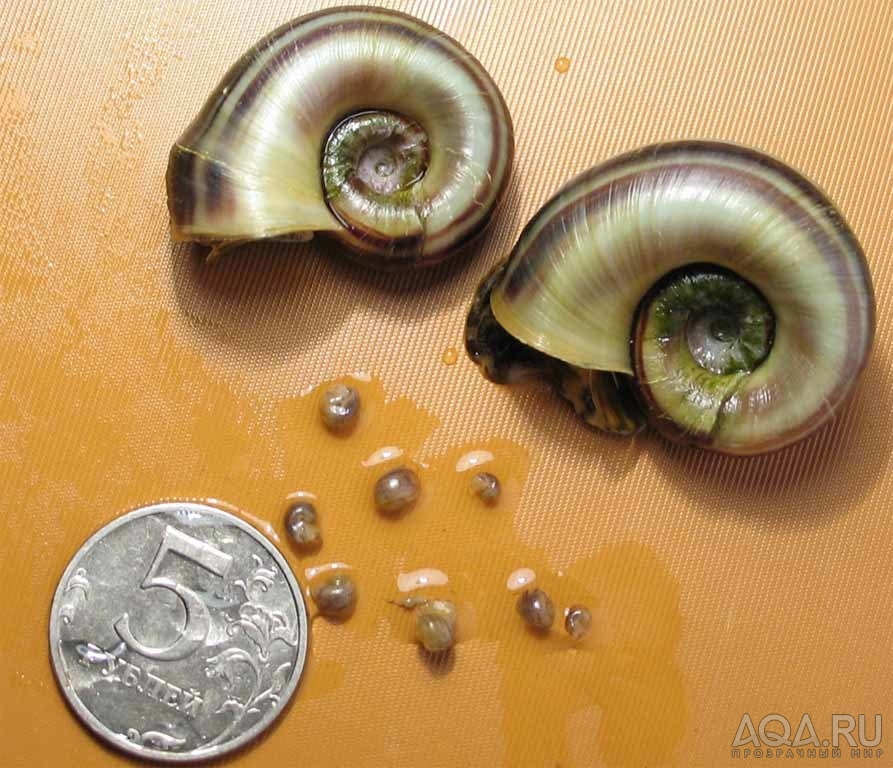
При необходимости полакомиться белковой пленкой на поверхности аквариума маризы скручивают подошву ноги наподобие воронки и ртом заглатывают пищу.
Нога у маризы мускулистая. Благодаря ей моллюск способен развивать достаточно высокую скорость.
Продолжительность жизни улиток мариз в домашних условиях составляет 2-4 года.
Ареал обитания
Родиной улитки маризы является Южная Америка. Она обитает в пресных медленнотекущих водоемах Бразилии, Венесуэлы, Гондураса, Колумбии, Коста-Рики и Панамы.
Встретить ее можно в оросительных системах, болотах, озерах и прудах. Живут маризы на небольшой глубине среди густых зарослей водных растений. Изредка улиток находят в солоноватых водах. Установлено, что маризы неплохо переносят повышенную соленость, однако размножаться в такой воде не могут.
Благодаря искусственному расселению ареал маризы значительно расширился. В настоящее время улитку можно обнаружить в южных штатах США и на Кубе.
Уход и содержание
Содержание
улиток мариз в домашних условиях не представляет никаких трудностей.
Маризам необходимо периодически всплывать на поверхность воды, чтобы подышать, поэтому не забудьте о том, что между поверхностью воды и крышкой рекомендуется оставлять воздушную прослойку.
Приветствуется хорошая фильтрация и аэрация.
Особое внимание следует уделить параметрам воды в аквариуме. Лучше всего подойдет вода средней жесткости (8-25 dH) со слабощелочной реакцией (pH=7.5-8.0). Подобное требование объясняется тем, что в мягкой и кислой воде у мариз наблюдаются проблемы с развитием раковины.
Маризы – тропические улитки, поэтому любят воду потеплее. Комфортная температура для моллюсков – 21-25°С. При более высоких показателях у мариз ускоряется метаболизм, активность и скорость размножения, однако сокращается срок жизни.
Совместимость
Маризы – миролюбивые улитки, которые не станут нападать на рыб. В опасности, пожалуй, только икра, которая может стать обедом моллюска. В остальном, ограничений на совместное жительство практически нет. Исключить из этого списка рекомендуется только крупных цихлид, а также известных любителей поедать улиток – боций, тетраодонов. Хорошо улитки сочетаются с золотыми рыбками, которых обычно содержат без живых растений.
В опасности, пожалуй, только икра, которая может стать обедом моллюска. В остальном, ограничений на совместное жительство практически нет. Исключить из этого списка рекомендуется только крупных цихлид, а также известных любителей поедать улиток – боций, тетраодонов. Хорошо улитки сочетаются с золотыми рыбками, которых обычно содержат без живых растений.
Мелкие виды рыб (гуппи, неоны, тетры и т.п.), мирные сомики (анциструсы, коридорасы) отлично уживаются с маризами.
Не рекомендуется использовать мариз в аквариумах с большим количеством живых растений: улитки наверняка погрызут их.
Кормление улиток мариз
Маризы относятся к всеядным улиткам, поэтому никогда не возникнет проблем с их пропитанием. Они поедают отмершие растительные остатки, нитчатые водоросли, бактериальный налет, икру рыб и, конечно, сухой корм. Особенно хорошо подойдут тонущие таблетки с высоким содержанием спирулины – Tetra Pleco Spirulina Wafers. Учитывая отличный аппетит мариз, кормить их необходимо регулярно.
Размножение и разведение
Маризы – раздельнополые улитки. Отличить самца от самки позволяет окрас ноги: у женских особей он шоколадный, а у мужских – бежевый с пятнами.
Спаривание длительное, порой растягивается на несколько часов. Стоит отметить, что процесс происходит только в теплой воде (25-27°С). Самка откладывает икру в студенистом коконе на листья растений или декорации. Яйца выглядят как белые пятна размером не более 1 мм. Но постепенно увеличиваются до 4 мм.
Инкубация икры длится две-три недели, после чего молодь выедает оболочку кокона и выходит наружу. Первое время они держатся группой и доедают остатки своего старого дома, после чего расползаются по аквариуму в поисках пищи. Несмотря на то, что яиц может быть более сотни, выживают далеко не все улитки. Часть гибнет от недостатка корма, часть засасывает в фильтр.
Улитка Мариза (Marisa cornuarietis) | содержание, размножение
Улитка Мариза (Marisa cornuarietis) Linnaeus, 1858.
Гигантская улитка-катушка (Marisa cornuarietis) — большая и красивая улитка, популярная среди любителей аквариумистики.
Успех во многом связан с привлекательным внешним видом и большим размером.
Общие названия: Улитка Гигантская Катушка, Улитка Колумбийская Катушка, Улитка Мариса.
Семейство: Ампулярия (Ampullariidae).
Род: Marisa Gray, 1824 (Типовой вид: Helix cornuarietis Linnaeus, 1758).
Несмотря на своеобразное сходство с катушковидными улитками, это, тем не менее, ампулярия. Ее большие размеры, отчетливые спиральные полосы и наличие жаберной крышки отличают этот вид от улиток планорбид, таких как Красная Катушка (Planorbella duryi) и Катушка Роговая (Planorbis corneus).
Ареал и Среда обитания
Южная и Центральная Америка: Бразилия, Колумбия, Венесуэла, Панама, Коста-Рика и Гондурас.
Этот вид обычно обитает в застойных и медленно текущих пресноводных экосистемах. Живет в озерах, прудах, оросительных системах и болотах. Эти улитки остаются близко к поверхности и предпочитают мелководье с большим количеством растительности. Известно, что они переносят относительно высокие концентрации солей, и их иногда обнаруживают в солоноватых водах. Они способны выжить в этих солоноватых водах, но в этих условиях они не размножаются.
Известно, что они переносят относительно высокие концентрации солей, и их иногда обнаруживают в солоноватых водах. Они способны выжить в этих солоноватых водах, но в этих условиях они не размножаются.
В литературе (Hunt, 1961; Robin, 1971) сообщается, что Marisa cornuarietis может выдержать соленость воды до примерно 30%.
Температура не может опускаться ниже 12° C в течение продолжительного периода времени, чтобы эти улитки выжили.
Из-за появления в аквариумистике и торговле, а также ее использования для борьбы с водной растительностью, улитка распространилась и на другие тропические регионы. Мариса cornuarietis появилась на Кубе в конце 1940 года и в Пуэрто-Рико в 1952 году. В 1970-х улитка попала во Флориду (США), а затем (1990-е годы) в штат Техас.
Описание
Взрослая Улитка Мариза (Marisa cornuarietis).Оболочка Marisa cornuarietis имеет около 3,5-4 витков спирали. У взрослых улиток плосковидная раковина (позвоночник не приподнят над мутовками тела, делая оболочку почти «плоской»). Молодые улитки имеют приподнятый позвоночник, что делает их шаровидными. Выраженные линии роста (поперечная полоска) на взрослых раковинах около отверстия. Жесткая пластинка, которая используется для блокирования открытия оболочки (крышечка), очень мала и может быть полностью убрана в раковину.
Молодые улитки имеют приподнятый позвоночник, что делает их шаровидными. Выраженные линии роста (поперечная полоска) на взрослых раковинах около отверстия. Жесткая пластинка, которая используется для блокирования открытия оболочки (крышечка), очень мала и может быть полностью убрана в раковину.
Их окраска сильно варьирует: от темно-желтых до темно-коричневых оттенков с черными спиральными полосками. У них почти всегда есть 3-6 темных полос. Могут наблюдаться некоторые мутации, когда улитка не имеет никаких полос вообще. Есть также виды с полной желтой раковиной.
Улитка Мариза — варианты окраса раковин.Цвет тела Маризы может быть белого с желтоватым, серым и черным рисунком на нем, с пигментными пятнами.
Есть дыхательная трубка, длина которой не такая большая, как у ампулярии.
Размер
Крупные аквариумные улитки максимальный размер которых 48-56 мм в высоту, 18-22 мм в ширину.
Поведение и совместимость
Гигантские Катушки мирные обитатели аквариума.
Активность Гигантской Катушки, как у всех Ампулярий возрастает с температурой, они почти неактивны при 18° С, в то время как грациозные движения можно наблюдать только при температуре 24° С и выше. Температура влияет не только на уровень активности, но и на всю скорость жизненного цикла улиток (от рождения до смерти). При более высоких температурах сокращается продолжительность жизни с 4 лет (при низких температурах), до менее чем одного года. Скорость размножения увеличивается с ростом температуры.
Что касается совместимости этих улиток с другими обитателями аквариума, то причин для беспокойства нет. Это мирные существа, которые успешно сосуществуют с такими же мирными рыбами.
Некоторые виды крупных цихлид и боций считаются единственными крупными врагами улиток.
Аквариум
Минимум размер: 30 см;
Минимум объем: 20 литров.
Улитка Мариса — самая большая улитка для аквариумов, которая может расти до 5 см и больше. Это большой и очень прожорливый моллюск, поэтому он не годится для аквариумов с живыми водными растениями, так как он довольно часто поедает всю растительность полностью.
Это большой и очень прожорливый моллюск, поэтому он не годится для аквариумов с живыми водными растениями, так как он довольно часто поедает всю растительность полностью.
Улитки могут содержаться как в открытом, так и в закрытом резервуаре.
Параметры воды
Даже в относительно солоноватой воде (по некоторым подсчетам до 30% солености) с минерализацией до 3% может жить, но она не будет размножаться.
Улитка Гигантская Катушка в аквариуме.Однако, если вода слишком мягкая и без карбонатов, раковина улитки начнет разрушаться. Вода с низким уровнем рН также не подходит для этих улиток.
Оптимальные условия в аквариуме:
Температура: 24-27° С, может жить при 18-32° С;
PH: от 7,0 до 8,0;
Жесткость GH: от 8,0.
Хорошая фильтрация и ограничение в кормлении рекомендуется.
Питание
Эти улитки едят почти все, что могут найти (всеядные): отмирающие и многие виды живых растений, икра других обитателей и так далее. Прожорливые едоки.
Семейство Улиток Мариза прожорливые едоки.
Диета может быть дополнена овощами — огурцами, кабачками, капустой и таблетками для сомов.
Не подходит для аквариумов с живыми растениями.
Половой диморфизм
Улитка Marisa cornuarietis не является гермафродитной (существуют оба пола). Это знание очень важно, когда есть желание разводить этих улиток или наоборот предотвратить их размножение.
Самки Маризы имеют темно-серый или шоколадный цвет ноги/тела, самцы светло-бежевый с едва заметными коричневатыми пятнами.
Разведение
Взрослые улитки откладывают икру размером 2-3 мм ниже поверхности воды. Яйца часто откладываются на растительность в студенистой оболочке. Икра выглядит как маленькие белые пятна внутри прозрачной желатиновой массы, которая их окружает.
Размер кладки в среднем составляет 30-80 икринок с инкубационным периодом около 8-24 дней.
Во время развития маленьких улиток икра сильно разбухает (до 4 мм). Они также становятся более прозрачными, и маленькие улитки становятся видимыми, так как они прикрепляются к внутренней стенке каждого яйца.
Когда икринки становятся прозрачными, появляются маленькие улитки, они рассеиваются по всему аквариуму. Несмотря на их активность, выживают не все.
Маленькие улитки Маризы очень активны в аквариуме.Продолжительность жизни Гигантской улитки-катушки (Marisa cornuarietis) около 2 лет.
Мариза: содержание,разведение,совместимость,фото,описание | АКВАРИУМНЫЕ РЫБКИ
Nevada 1976Мариза: содержание,разведение,совместимость,фото,описание 0 Comment
Один из самых симпатичных представителей аквариумных улиток — улитка мариза. В природе она обитает в теплых пресных водоемах Южной Америки: в Бразилии, Венесуэле, Гондурасе, Коста-Рике. Благодаря своей способности моментально поглощать водоросли, маризу еще в середине прошлого века начали использовать для очистки пораженных растениями водоемов.
Красивый внешний вид улитки помог ей завоевать прочную позицию среди аквариумных обитателей. Содержание и разведение мариз, вопреки устоявшемуся мнению, достаточно простое, и для успешной жизни моллюска в вашем аквариуме нужно просто учесть несколько несложных правил.
Содержание и разведение мариз, вопреки устоявшемуся мнению, достаточно простое, и для успешной жизни моллюска в вашем аквариуме нужно просто учесть несколько несложных правил.
Описание
Мариза довольно крупный моллюск. Она может достигать примерно 20 миллиметров в ширину и 35-56 миллиметров в высоту. Раковина улитки окрашена в бледновато-желтый или коричневатый цвет и имеет 3-4 завитка. Обычно по ходу завитков есть темные, почти черные линии, но встречаются отдельные особи без полос.
Цвет тела варьируется от желтоватого в темную крапинку и до коричневого. Часто бывает двухцветным — светлый верх и темный низ. У маризы есть дыхательная трубка, позволяющая ей дышать атмосферным воздухом.
Если все аквариумные условия соблюдаются, мариза проживет до 2-4 лет.
Условия содержания улитки мариза
С питанием у аквариумной улитки мариза проблем не возникает. Они едят кусочки отмерших растений, бактериальный налет, икру других животных, сухой корм. Улитки активно поедают живые растения, поэтому не очень подходят для аквариумов травников. Вообще они считаются довольно прожорливыми.
Вообще они считаются довольно прожорливыми.
Чтобы улитки не съели всю растительность нужно их активно подкармливать, особенно аквариумными смесями и хлопьями.
Во многом эти моллюски неприхотливы, но есть определенные требования по содержанию к воде. Оптимальными показателями являются температура 21-25 градусов, они очень чувствительны к понижению воды. Параметры жесткости — от 10 до 25 градусов, кислотности – 6,8-8. Если вода в сосуде не соответствует нужным нормативам, то панцирь улитки начинает разрушаться и вскоре она умирает.
Эти моллюски двуполые, мужские особи отличаются светло-бежевыми оттенками с коричневыми крапинками, а женские – темно-коричневыми или шоколадными с разводами. Икру выкладывают под листики и через пару недель из нее появляются молодые особи. Количество икринок – до ста штук, но выживают далеко не все моллюски. Контролировать рост популяции важно вручную – переносить икру и молодняк в отдельную емкость.
Маризы – мирные и спокойные обитатели, которые уживаются со многими видами рыб. Но, чтобы сохранить мариз, не рекомендуется селить их вместе с цихлидами, тетраодонами и другими крупными особями.
Но, чтобы сохранить мариз, не рекомендуется селить их вместе с цихлидами, тетраодонами и другими крупными особями.
Продолжительность жизни улитки составляет в среднем 4 года. Если создать для маризы соответствующие условия и подкармливать ее специальными хлопьями, она станет активно нереститься, приносить пользу по уборке аквариума, и скрасит его.
Внешний вид
На первый взгляд, казалось бы, нет в этих морских и речных обитателях ничего необычного, все одинаковые и бессловесные. Но истинные любители утверждают, что каждая улитка имеет свой характер и свои пристрастия.
Например, улитка, названная красиво и романтично мариза — моллюск, прибывший к нам из пресных рек Южной Америки. Во всех озёрах, болотах и реках Бразилии, Венесуэлы, Панамы, Гондураса и Коста-Рики можно встретить большое количество этих моллюсков.
Они любят районы с богатой растительностью и щедрым тропическим климатом. Имеют крайне привлекательный вид: большая спиралевидная раковина, окрашенная в нежные цвета тёплого спектра, украшена несколькими продольными полосами.
Тело улитки желтовато-белое с серым, чёрным и зелёным узором, часто бывает двухцветным: верх бежевый, а низ тёмно-коричневый. Большие маризы могут достигать 5 см.
Кормление
Ни в коем случае нельзя оставлять маризу голодной. Рацион её достаточно широк:
- остатки рыбьего корма;
- рыбий помет;
- простейшие водоросли;
- бактерии;
- мёртвые морские животные;
- икра других моллюсков.
С удовольствием едят стандартные морские корма и таблетированные морские водоросли. Если же улитки проголодаются и ничего не найдут съедобного, то посчитают пищей все аквариумные растения. Причём их они съедят под корень, так что ничего не останется.
Вообще, маризы достаточно прожорливые создания и едят всё, что находят, даже кусочки туалетной бумаги.
Поэтому, чтобы избежать поедания дорогих аквариумных растений, следует постоянно класть на дно съедобные смеси в виде хлопьев.
Размножение
В отличие от многих других моллюсков маризы двуполые, а угадать их пол можно по цвету. Мужские особи имеют тело светло-бежевого цвета с небольшими коричневыми крапинками, а женские — тёмно-коричневое или шоколадное с разводами.
Мужские особи имеют тело светло-бежевого цвета с небольшими коричневыми крапинками, а женские — тёмно-коричневое или шоколадное с разводами.
Размножаются эти улитки быстро. Икру откладывают под нижнюю сторону листа любого аквариумного растения. Расположение листа принципиального значения не имеет. Икринки достигают в диаметре от 2 до 3 мм.
Через две-две с половиной недели они становятся прозрачными и из них появляются молодые улитки. Регулировать рост популяции в аквариуме нужно вручную: убирать лишнюю икру или переносить молоденьких особей в отдельную ёмкость.
Нельзя сказать, что только что появившиеся на свет моллюски все жизнеспособны. Очень большой процент их гибнет.
Совместимость
Маризы совершенно мирные по отношению к другим обитателям аквариума создания. Они спокойны и отлично уживаются практически со всеми видами рыбок и аквариумных животных. Исключение составляют такие рыбы, как цихлиды, тетраодоны и другие виды, которые опасны для самих улиток, поскольку не прочь ими полакомиться.
С водорослями дело обстоит немного иначе. Если регулярно кормить улитку, аквариумные растения она не тронет. Но все же, во избежание риска лучше не заводить мариз в аквариумах с большим количеством растений, особенно дорогостоящих и редких.
Интересные факты
- Считается, что большие улитки привыкают к своему хозяину и начинают его узнавать.
- Маризы медленно и плавно передвигаются по аквариуму, и наблюдать за ними большое удовольствие, которое действительно завораживает и успокаивает не хуже сеанса релаксации у врача-психолога.
- Врачами не отмечено ни одного случая аллергии на улиток. И считается, что слизь моллюсков лечебна: порезы и мелкие ранки на руках заживают намного быстрее, если дать улиткам немного поползать по поврежденной поверхности.
Тем, кто не решается завести у себя домашних животных из-за боязни грязи, запаха или шума, стоит знать, что моллюски маризы ничем не пахнут, не шумят, не грызут домашнюю обувь и мебель, не царапают полы, и с ними не нужно гулять по утрам или вечерам.
Даже если вначале идея завести улиток или моллюсков покажется вам смешной, подумайте, может быть эти маленькие существа откроют вам что-то новое о мире вокруг вас!
АМПУЛЯРИЯ СОДЕРЖАНИЕ РАЗМНОЖЕНИЕ СОВМЕСТИМОСТЬ ФОТО ОПИСАНИЕ.
КАТУШКА АКВАРИУМНАЯ УЛИТКА СОДЕРЖАНИЕ РАЗМНОЖЕНИЕ СОВМЕСТИМОСТЬ ОПИСАНИЕ ФОТО.
ФИЗА УЛИТКА СОДЕРЖАНИЕ СОВМЕСТИМОСТЬ РАЗМНОЖЕНИЕ ОПИСАНИЕ ФОТО ВИДЕО.
НЕРЕТИНА УЛИТКА СОДЕРЖАНИЕ РАЗМНОЖЕНИЕ ОПИСАНИЕ ФОТО СОВМЕСТИМОСТЬ.
Влияние параметров содержания на жизненный цикл яблонной улитки Marisa cornuarietis: влияние температуры, фотопериода и плотности популяции
- Список журналов
- Wiley-Blackwell Online Open
- PMC2582394
Биология беспозвоночных
Invertebr Biol. 2006 апрель; 125(1): 9–20.
2006 апрель; 125(1): 9–20.
doi: 10.1111/j.1744-7410.2006.00035.x
, 1 , 1 , 2 , 3 , 4 , 5 and 6, a
Информация об авторе Информация об авторских правах и лицензиях Отказ от ответственности
Эти эксперименты являются частью более крупного исследования, направленного на изучение влияния параметров содержания на жизненный цикл яблочной улитки, Marisa cornuarietis . Общая цель программы состоит в том, чтобы определить подходящие условия содержания для поддержания многопоколенных популяций этого вида в лаборатории для использования в экотоксикологических испытаниях. В этой статье мы сосредоточимся на влиянии фотопериода, температуры и плотности популяции на плодовитость взрослых особей и рост молоди. Увеличение светового дня с 12 до 16 часов в день не повлияло на плодовитость взрослых особей или вылупление яиц и относительно незначительно повлияло на рост и развитие молоди.
Ключевые слова: Ampullaridae, экотоксикология, брюхоногие моллюски, рост, репродукция трематоды, вызывающие кишечный шистосомоз (Pointier & Augustin 1999; Пойнтье и Журдан, 2000). Хотя он питается в основном живыми и разлагающимися водными растениями, он также поедает яйца, только что вылупившихся детенышей и, возможно, даже взрослых особей других видов улиток (Demian & Lutfy, 1965, 1966; ВОЗ, 1982). Совсем недавно эта улитка стала объектом экотоксикологических исследований, и сообщалось, что она особенно чувствительна к некоторым химическим веществам, разрушающим гормоны (Oehlmann et al. 2000). Хотя он не является родным для европейских пресноводных местообитаний, в настоящее время он рассматривается в качестве подопытного вида при оценке риска для окружающей среды некоторых химических веществ, предположительно вызывающих эндокринные нарушения, в Европейском Союзе.
Совсем недавно эта улитка стала объектом экотоксикологических исследований, и сообщалось, что она особенно чувствительна к некоторым химическим веществам, разрушающим гормоны (Oehlmann et al. 2000). Хотя он не является родным для европейских пресноводных местообитаний, в настоящее время он рассматривается в качестве подопытного вида при оценке риска для окружающей среды некоторых химических веществ, предположительно вызывающих эндокринные нарушения, в Европейском Союзе.
Представители M. cornuarietis широко распространены в Карибском бассейне, Центральной Америке и Южной Америке, и их естественное распространение было расширено за счет интродукции для борьбы с паразитами. Его также исследовали как потенциальное средство борьбы с сорняками как в Пуэрто-Рико, так и во Флориде (Ferguson & Palmer, 1958; Ortiz-Torres, 1961; Radke et al., 1961). Хотя этот вид, по-видимому, хорошо адаптируется к различным условиям окружающей среды в полевых условиях, существует относительно мало контролируемых лабораторных исследований, изучающих, как его жизненные черты реагируют на изменения окружающей среды, например, фотопериод, температура, качество и количество пищи, плотность популяции и т. д. Знание таких реакций, как выживание, рост и размножение молодых и взрослых особей, необходимо для разработки подходящих условий содержания для поддержания популяций видов в лаборатории. Точно так же разработка эффективных протоколов экотоксикологических испытаний в решающей степени зависит от понимания того, как условия содержания влияют на производительность улиток, а также от наличия исходной информации о средних значениях и отклонениях признаков жизненного цикла в стандартных лабораторных условиях.
д. Знание таких реакций, как выживание, рост и размножение молодых и взрослых особей, необходимо для разработки подходящих условий содержания для поддержания популяций видов в лаборатории. Точно так же разработка эффективных протоколов экотоксикологических испытаний в решающей степени зависит от понимания того, как условия содержания влияют на производительность улиток, а также от наличия исходной информации о средних значениях и отклонениях признаков жизненного цикла в стандартных лабораторных условиях.
Настоящие эксперименты являются частью более крупного исследования, направленного на изучение влияния параметров содержания на жизненный цикл M. cornuarietis . Общая цель программы состоит в том, чтобы определить подходящие условия содержания для поддержания многопоколенных популяций этого вида в лаборатории для использования в экотоксикологических испытаниях. В этой первой статье мы сосредоточимся на влиянии фотопериода, температуры и плотности популяции на плодовитость взрослых особей и рост молоди. Более поздние статьи этой серии будут посвящены влиянию качества воды, качества пищи и частоты кормления при различных температурах на различные черты жизненного цикла молодых и взрослых особей.
Более поздние статьи этой серии будут посвящены влиянию качества воды, качества пищи и частоты кормления при различных температурах на различные черты жизненного цикла молодых и взрослых особей.
Сбор и техническое обслуживание
Особи Marisa cornuarietis были собраны Шарон Файл-Эмперадор на берегу озера Гуаятака, Пуэрто-Рико. Этот вид был завезен в озеро в 1960 году в рамках проекта по борьбе с бильгарциозом (шистосомозом). Озеро представляет собой искусственный водоем, расположенный высоко в Карстовой области западного Пуэрто-Рико. Качество воды и отложений в местах сбора оценивалось корпорацией Terran (Terran 2002). Были измерены различные тяжелые металлы, хлорорганические пестициды, ПХД и ПАУ, и было установлено, что все они не были повышены в результате деятельности человека.
Улиток содержали в Университете Пуэрто-Рико при температуре 25°C, pH 7,2, плотности ~0,7 улиток L -1 и кормили промытым салатом ромэн ( Lactuca sativa var. Romaine). Каждый аквариум был оснащен фильтрующим насосом AquaTec (Aquaria Inc. Regent Pet Products, Мурпарк, Калифорния, США), и вода менялась еженедельно. Аквариумы получали непрямой естественный свет в течение примерно 12 часов дня -1 , дополненный флуоресцентным светом в течение примерно 8 часов дня -1 . Улиток заворачивали по отдельности в марлю, упаковывали в пенопластовую коробку и отправляли ночной почтой в ABC Laboratories (Колумбия, Миссури). Улитки были собраны в апреле 2003 г. и отправлены двумя партиями 23 апреля и 9 июля., 2003.
Romaine). Каждый аквариум был оснащен фильтрующим насосом AquaTec (Aquaria Inc. Regent Pet Products, Мурпарк, Калифорния, США), и вода менялась еженедельно. Аквариумы получали непрямой естественный свет в течение примерно 12 часов дня -1 , дополненный флуоресцентным светом в течение примерно 8 часов дня -1 . Улиток заворачивали по отдельности в марлю, упаковывали в пенопластовую коробку и отправляли ночной почтой в ABC Laboratories (Колумбия, Миссури). Улитки были собраны в апреле 2003 г. и отправлены двумя партиями 23 апреля и 9 июля., 2003.
Общие условия содержания
Улитки для всех экспериментов выращивались в 10-литровых стеклянных аквариумах в проточных условиях. Скорость обновления составляла 5,8 объема резервуара в день, при этом каждый резервуар получал примерно 500 мл воды/цикл и 115 циклов d -1 в течение периода испытаний. Пресная вода, используемая во всех экспериментах, состояла из природной колодезной воды, смешанной с колодезной водой, которая была деминерализована обратным осмосом для достижения конечной жесткости воды ~130–160 мг л −1 (как CaCO 3 ). Температуру и рН измеряли с помощью измерителя температуры/рН Denver Instruments (Fisher Scientific, Питтсбург, Пенсильвания, США). Целевые температуры поддерживали в пределах ±1°С, а рН поддерживали в диапазоне 7,7–8,5. Растворенный кислород измеряли с помощью измерителя растворенного кислорода WTW Oxi 330 или WTW Oxi 330i (Fisher Scientific) и поддерживали на уровне выше 4,0 мг л -1 . Общая жесткость (измеренная титрованием) поддерживалась в пределах 134–154 мг CaCO 3 л −1 . Фотопериод контролировали таймером, подключенным к верхнему люминесцентному освещению, а интенсивность света в аквариумах в световой период составляла ~400–800 лк.
Температуру и рН измеряли с помощью измерителя температуры/рН Denver Instruments (Fisher Scientific, Питтсбург, Пенсильвания, США). Целевые температуры поддерживали в пределах ±1°С, а рН поддерживали в диапазоне 7,7–8,5. Растворенный кислород измеряли с помощью измерителя растворенного кислорода WTW Oxi 330 или WTW Oxi 330i (Fisher Scientific) и поддерживали на уровне выше 4,0 мг л -1 . Общая жесткость (измеренная титрованием) поддерживалась в пределах 134–154 мг CaCO 3 л −1 . Фотопериод контролировали таймером, подключенным к верхнему люминесцентному освещению, а интенсивность света в аквариумах в световой период составляла ~400–800 лк.
Улитки во всех экспериментах получали альгинатную диету для улиток, состоящую из смеси улиток в соотношении 1:4 (20% стартера из лосося, 20% корма в виде хлопьев, 45% сухих водорослей, 15% лиофилизированного салата и 3% витаминной смеси) для желеобразного корма для рыб (56% сырого белка, 16% сырого жира, 0,6% сырой клетчатки, 16% золы и 11% аминокислот, минералов и витаминов), вводимых в виде кубиков. Точное количество корма зависело от количества и размера улиток/аквариума, но было таким, чтобы улитки всегда имели доступ к корму. При необходимости экспериментальные аквариумы чистили и очищали от мусора сифоном.
Точное количество корма зависело от количества и размера улиток/аквариума, но было таким, чтобы улитки всегда имели доступ к корму. При необходимости экспериментальные аквариумы чистили и очищали от мусора сифоном.
E1: температура и фотопериод в зависимости от плодовитости
В этом эксперименте взрослых улиток, первоначально собранных в Пуэрто-Рико (поколение F 0 ), выращивали в общей сложности 32 дня при одном из следующих условий: 25°C и 12L: 12D, 25°C и 16L:8D, 28°C и 12L:12D или 28°C и 16L:8D. Было четыре повторяющихся аквариума/обработки, в каждом из которых содержались четыре самки и три самца, что давало плотность улиток 0,7 улиток L -1 . Улиток проверяли ежедневно, яйца извлекали, подсчитывали и переносили в отдельные контейнеры для вылупления. Инкубационные контейнеры состояли из 19Сетчатые колонки найтекс высотой 1 см (размер ячеек 355 мкм), прикрепленные силиконом к 100-мм стеклянной чашке Петри, днищам. Контейнеры для инкубации содержались в тех же аквариумах, что и взрослые особи. Измеряли следующие параметры плодовитости: количество яиц/кладка, количество яиц/самка/неделя, количество яиц/самка/неделя, успешность вылупления яиц (% вылупления) и количество дней до вылупления первого яйца в кладке (время до первого вылупления). люк).
Измеряли следующие параметры плодовитости: количество яиц/кладка, количество яиц/самка/неделя, количество яиц/самка/неделя, успешность вылупления яиц (% вылупления) и количество дней до вылупления первого яйца в кладке (время до первого вылупления). люк).
Температуру контролировали постоянно, растворенный кислород, рН и общую жесткость измеряли еженедельно. Все остальные параметры содержания были такими же, как описано выше для обычных условий содержания.
E2: температура и фотопериод в зависимости от роста молоди
В этом эксперименте молодь улиток (поколение F 1 ), полученная от собранных в полевых условиях взрослых особей, выращивалась в общей сложности 103 дня при одном из следующих условий: 25°C и 12L:12D, 25°C и 16L:8D, 28°C и 12L:12D или 28°C и 16L:8D. Было проведено восемь повторных аквариумов/обработок, в каждом из которых содержалось по десять мальков, что дало плотность улиток 1,0 улитки L -1 . В начале эксперимента улиткам было 23 дня. Размеры тела оценивали путем осторожного промокания улиток насухо и их взвешивания с точностью до миллиграмма. Диаметр раковины каждой улитки также измеряли штангенциркулем с точностью до 0,1 мм. Репрезентативную выборку из десяти улиток использовали для оценки среднего начального сырого веса (WW) (с раковиной; 16,4 ± 4,4 мг) и диаметра раковины (DIAM) (3,5 ± 0,5 мм). Все оставшиеся улитки были случайным образом распределены по экспериментальным аквариумам. WW и DIAM улиток измеряли, собирая один из повторных аквариумов через 4, 6, 8 и 10 недель, а оставшиеся четыре повтора собирали по окончании теста (~15 недель). Дополнительные измерения DIAM были собраны в одном повторном аквариуме после 12 недель испытания.
Размеры тела оценивали путем осторожного промокания улиток насухо и их взвешивания с точностью до миллиграмма. Диаметр раковины каждой улитки также измеряли штангенциркулем с точностью до 0,1 мм. Репрезентативную выборку из десяти улиток использовали для оценки среднего начального сырого веса (WW) (с раковиной; 16,4 ± 4,4 мг) и диаметра раковины (DIAM) (3,5 ± 0,5 мм). Все оставшиеся улитки были случайным образом распределены по экспериментальным аквариумам. WW и DIAM улиток измеряли, собирая один из повторных аквариумов через 4, 6, 8 и 10 недель, а оставшиеся четыре повтора собирали по окончании теста (~15 недель). Дополнительные измерения DIAM были собраны в одном повторном аквариуме после 12 недель испытания.
Графики DIAM в зависимости от возраста (определяемого как количество дней после вывода) были линейными во всех случаях, тогда как отношения WW и возраста были линеаризованы с помощью log 10 преобразований обеих осей. Время до морфологической зрелости (TM), определяемое как возраст, в котором самцов и самок можно различить на основе окраски головы/ног (возникает при размере ~20 мм), оценивали путем решения наиболее подходящей регрессии возраста. и DIAM для размера 20 мм. Точно так же время до первого размножения (TR), определяемое как возраст, в котором самки начинают откладывать кладки яиц (возникает при размере около 30 мм), было оценено путем решения того же уравнения регрессии для DIAM 30 мм.
и DIAM для размера 20 мм. Точно так же время до первого размножения (TR), определяемое как возраст, в котором самки начинают откладывать кладки яиц (возникает при размере около 30 мм), было оценено путем решения того же уравнения регрессии для DIAM 30 мм.
Температуру контролировали постоянно, растворенный кислород, рН и общую жесткость измеряли раз в две недели. Все остальные параметры содержания были такими же, как описано выше для обычных условий содержания.
E3: температура в зависимости от плодовитости взрослых особей
В этом эксперименте взрослых улиток, вылупившихся в лаборатории (F поколение 1 ), выращивали в общей сложности 42 дня при фотопериоде 12L:12D при температуре 25°C или 22°C. °С. Было четыре повторяющихся аквариума/обработки, в каждом из которых содержались четыре самки и три самца, что давало плотность улиток 0,7 улиток L −1 . Улиток проверяли ежедневно, и яйца удаляли, подсчитывали и переносили в отдельные контейнеры для вылупления, как в Эксперименте 1. Измерения плодовитости проводили, как в Эксперименте 1.
Измерения плодовитости проводили, как в Эксперименте 1.
Температуру контролировали непрерывно, тогда как растворенный кислород, рН и общую жесткость измеряли еженедельно. Все остальные параметры содержания были такими же, как описано выше для обычных условий содержания.
E4: температура в зависимости от роста молоди
В этом эксперименте молодь улитки (F 1 поколения), произведенные собранными в полевых условиях имаго, выращивались в общей сложности 42 дня при фотопериоде 12L:12D при температуре 25°C или 22°C. Было проведено восемь повторных аквариумов/обработок, в каждом из которых содержалось по десять мальков, что дало плотность улиток 1,0 улитки L -1 . В начале эксперимента улиткам было 44 дня. Репрезентативную выборку из десяти улиток использовали для оценки среднего начального веса (189 ± 178 мг) и DIAM (8,1 ± 2,8 мм). Все оставшиеся улитки были случайным образом распределены по экспериментальным аквариумам. WW и DIAM улиток измеряли путем сбора урожая в одном из повторных аквариумов через 1, 2, 4 и 5 недель. Оставшиеся четыре аквариума/обработку собирали в конце эксперимента (6 недель). Влияние обработки на скорость роста молоди оценивали, как в эксперименте 2.
Оставшиеся четыре аквариума/обработку собирали в конце эксперимента (6 недель). Влияние обработки на скорость роста молоди оценивали, как в эксперименте 2.
Температуру контролировали постоянно, растворенный кислород, рН и общую жесткость измеряли раз в две недели. Все остальные параметры содержания были такими же, как описано выше для обычных условий содержания.
E5: плотность по сравнению с плодовитостью взрослых особей
В этом эксперименте взрослых улиток (поколение F 1 ), которые вылупились в лаборатории, выращивали в общей сложности 26 дней при фотопериоде 12L:12D при 25°C и плотность 0,2, 0,8 или 2,0 улитки L -1 . Было проведено две повторные обработки аквариумов/плотности, каждая из которых содержала по две (0,2 улитки L -1 ), восемь (0,8 улиток L -1 ) или 20 (2,0 улиток L -1 ) взрослых особей при соотношении полов 50:50. Улиток проверяли ежедневно, и яйца удаляли, подсчитывали и переносили в отдельные контейнеры для вылупления, как в Эксперименте 1. Измерения плодовитости проводили, как в Эксперименте 1.
Измерения плодовитости проводили, как в Эксперименте 1.
Температуру контролировали непрерывно, тогда как растворенный кислород, рН и общую жесткость измеряли еженедельно. Из-за низкого уровня растворенного кислорода у улиток 0,8 и 2,0 L −1 обработок необходимо было обеспечить щадящую аэрацию аквариумов. Все остальные параметры содержания были такими же, как описано выше для обычных условий содержания.
E6: плотность по сравнению с ростом молоди
В этом эксперименте молодь улиток (поколение F 2 ), полученная от выращенных в лаборатории взрослых особей, выращивалась в общей сложности 73 дня при фотопериоде 12L:12D при 25°C и плотность 0,2, 0,8 или 2,0 улитки L -1 . Было проведено восемь повторов аквариумов/обработок с плотностью, в каждом из которых содержалось по две (0,2 улитки L -1 ), восемь (0,8 улиток L -1 ) или 20 (2,0 улиток L -1 ) мальков. В начале эксперимента улиткам было 11 дней. Репрезентативная выборка из десяти улиток использовалась для оценки среднего начального DIAM (3,3 ± 0,4 мм). Все оставшиеся улитки были случайным образом распределены по экспериментальным аквариумам. WW впервые измеряли на 4-й неделе (вместе с DIAM), а затем на 6-й, 8-й и 9-й неделях путем сбора урожая в одном повторном аквариуме. Оставшиеся четыре повторных аквариума собирали в конце эксперимента (примерно на 10-й неделе). Влияние обработки на темпы роста, время до созревания и время до первого воспроизводства оценивали, как в экспериментах 2 и 4.
Репрезентативная выборка из десяти улиток использовалась для оценки среднего начального DIAM (3,3 ± 0,4 мм). Все оставшиеся улитки были случайным образом распределены по экспериментальным аквариумам. WW впервые измеряли на 4-й неделе (вместе с DIAM), а затем на 6-й, 8-й и 9-й неделях путем сбора урожая в одном повторном аквариуме. Оставшиеся четыре повторных аквариума собирали в конце эксперимента (примерно на 10-й неделе). Влияние обработки на темпы роста, время до созревания и время до первого воспроизводства оценивали, как в экспериментах 2 и 4.
Температуру контролировали постоянно, растворенный кислород, рН и общую жесткость измеряли раз в две недели. Все остальные параметры содержания были такими же, как описано выше для обычных условий содержания.
Статистика
Влияние температуры, фотопериода и их взаимодействия на признаки плодовитости взрослых особей (Эксперимент 1) анализировали с помощью двустороннего дисперсионного анализа (ANOVA). В случаях, когда эффекты взаимодействия были значительными, t-критерии Стьюдента выполнялись для каждого фактора отдельно. Влияние температуры и плотности на плодовитость взрослых особей (эксперименты 3 и 5 соответственно) анализировали с помощью однофакторного дисперсионного анализа. Если было включено >2 обработок, попарные различия проверяли с помощью теста Тьюки HSD в случае значительных основных эффектов. Данные были проверены графически на нормальность и однородность дисперсии перед ANOVA. Воздействие лечения на рост ювенильных особей проверяли с помощью анализа ковариации (ANCOVA) с диаметром или массой в качестве зависимой переменной, возрастом в качестве ковариаты и температурой, световым периодом или плотностью в качестве воздействия. За ANCOVA следовали тесты Тьюки HSD для значимых основных эффектов для случаев, в которых было > 2 групп лечения.
Влияние температуры и плотности на плодовитость взрослых особей (эксперименты 3 и 5 соответственно) анализировали с помощью однофакторного дисперсионного анализа. Если было включено >2 обработок, попарные различия проверяли с помощью теста Тьюки HSD в случае значительных основных эффектов. Данные были проверены графически на нормальность и однородность дисперсии перед ANOVA. Воздействие лечения на рост ювенильных особей проверяли с помощью анализа ковариации (ANCOVA) с диаметром или массой в качестве зависимой переменной, возрастом в качестве ковариаты и температурой, световым периодом или плотностью в качестве воздействия. За ANCOVA следовали тесты Тьюки HSD для значимых основных эффектов для случаев, в которых было > 2 групп лечения.
Все статистические анализы были выполнены с помощью SYSTAT (вер. 10) (Ричмонд, Калифорния, США). Повсюду использовался уровень значимости p≤0,05; сравнения, в которых 0,1≤p≤0,05, определяются как незначительно значимые.
E1: температура и фотопериод в зависимости от плодовитости
При всех обработках в этом эксперименте выживаемость взрослых особей составила 100%. Не было различий в количестве кладок яиц на самку в неделю в зависимости от температуры (р = 0,45), фотопериода (р = 0,99) или их взаимодействия (р = 0,35). Точно так же не было различий в количестве яиц/самок/неделю в зависимости от температуры (р=0,72), фотопериода (р=0,80) или их взаимодействия (р=0,33). На количество яиц в кладке также не влияли температура (p=0,38), фотопериод (p=0,31) или их взаимодействие (p=0,79).). В то время как процент вылупления не зависел от температуры (p=0,16), фотопериода (p=1,00) или их взаимодействия (p=0,18), время до первого вылупления было значительно больше при 25°C по сравнению с 28°C (p<0,001). . Влияние фотопериода (p=0,18) и взаимодействия между фотопериодом и температурой (p=0,84) на время до первого вылупления не было значительным. Средние значения (±SEM) признаков плодовитости в каждой обработке приведены в .
Не было различий в количестве кладок яиц на самку в неделю в зависимости от температуры (р = 0,45), фотопериода (р = 0,99) или их взаимодействия (р = 0,35). Точно так же не было различий в количестве яиц/самок/неделю в зависимости от температуры (р=0,72), фотопериода (р=0,80) или их взаимодействия (р=0,33). На количество яиц в кладке также не влияли температура (p=0,38), фотопериод (p=0,31) или их взаимодействие (p=0,79).). В то время как процент вылупления не зависел от температуры (p=0,16), фотопериода (p=1,00) или их взаимодействия (p=0,18), время до первого вылупления было значительно больше при 25°C по сравнению с 28°C (p<0,001). . Влияние фотопериода (p=0,18) и взаимодействия между фотопериодом и температурой (p=0,84) на время до первого вылупления не было значительным. Средние значения (±SEM) признаков плодовитости в каждой обработке приведены в .
Открыть в отдельном окне
Эксперимент 1. Влияние температуры (25°C против 28°C) и фотопериода (12L:12D против 16L:8D) на репродуктивные признаки взрослых особей. Символы — это средства; планки погрешностей — это SEM. A. Масса яиц/самка/нед. B. Яйцо/самка/нед. С. Яйца/масс. D. Успех вылупления яиц. E. Количество дней до вылупления первых яиц в кладке.
Символы — это средства; планки погрешностей — это SEM. A. Масса яиц/самка/нед. B. Яйцо/самка/нед. С. Яйца/масс. D. Успех вылупления яиц. E. Количество дней до вылупления первых яиц в кладке.
Измеренные температуры в ходе эксперимента в среднем (±SD) 25,1 (±0,1)°C и 28,4 (±0,3)°C при фотопериоде 12L:12D и 25,3 (±0,1)°C и 28,5 (±0,3)°C )°C при фотопериоде 16L:8D.
E2: температура и фотопериод в сравнении с ювенильным ростом
Выживаемость молоди во всех обработках составляла >93%. В фотопериоде 12L:12D улитки росли значительно быстрее при 28°C, чем при 25°C (DIAM: p=0,001; WW: p=0,01). Однако в фотопериоде 16L:8D температура не оказывала существенного влияния на рост ювенильных особей (DIAM: p=0,50; WW: p=0,45). Хотя при 28°C фотопериод не оказывал значительного влияния на рост молоди (DIAM: p=0,15; WW: p=0,35), при 25°C влияние фотопериода было незначительно (DIAM: p=0,05; WW: p =0,09). Средние значения (±SEM) для молоди WW и раковины DIAM в конце эксперимента показаны на рис. Используя индивидуальные регрессии возраста и диаметра для каждой экспериментальной группы, а также размеры при морфологической зрелости и первом размножении, мы подсчитали, что улиткам потребуется от 89и 101 сут для достижения морфологической зрелости и между 132 и 145 сут для достижения возраста первой репродукции в этих условиях.
Средние значения (±SEM) для молоди WW и раковины DIAM в конце эксперимента показаны на рис. Используя индивидуальные регрессии возраста и диаметра для каждой экспериментальной группы, а также размеры при морфологической зрелости и первом размножении, мы подсчитали, что улиткам потребуется от 89и 101 сут для достижения морфологической зрелости и между 132 и 145 сут для достижения возраста первой репродукции в этих условиях.
Открыть в отдельном окне
Эксперимент 2. Влияние температуры (25°C против 28°C) и фотопериода (12L:12D против 16L:8D) на скорость роста молоди, измеренную по сырой массе ( A ) и диаметр корпуса ( B ). Символы — это средства; планки погрешностей — это SEM.
Температура, измеренная в ходе эксперимента, усредненная (±SD) 25,1 (±0,1)°C и 28,5 (±0,6)°C при фотопериоде 12L:12D и 25,1 (±0,4)°C и 28,7 (±0,1)°C °C при фотопериоде 16L:8D.
E3: температура в зависимости от плодовитости взрослых особей
Во всех вариантах лечения наблюдалось 100% выживание взрослых особей. Не было различий между 22°C и 25°C в количестве кладок яиц/самка/неделя (p=0,99), количестве яиц/самка/неделя (p=0,30) или количестве яиц/кладка (p=0,30). р=0,18). Однако успешность вылупления была выше при 25°C, чем при 22°C (p=0,002), а время до первого вылупления было значительно короче при 25°C, чем при 22°C (p<0,001) (1).
Не было различий между 22°C и 25°C в количестве кладок яиц/самка/неделя (p=0,99), количестве яиц/самка/неделя (p=0,30) или количестве яиц/кладка (p=0,30). р=0,18). Однако успешность вылупления была выше при 25°C, чем при 22°C (p=0,002), а время до первого вылупления было значительно короче при 25°C, чем при 22°C (p<0,001) (1).
Открыть в отдельном окне
Эксперимент 3. Влияние температуры (22°C против 25°C) на репродуктивные признаки взрослых особей. Данные представлены как среднее ± стандартная ошибка среднего. A. Масса яиц/самка/нед. B. Яйцо/самка/нед. С. Яйца/масс. D. Успех вылупления яиц. E. Количество дней до вылупления первых яиц в кладке.
Температура, измеренная в ходе эксперимента, составила в среднем (±SD) 24,4 (±0,1)°C и 22,3 (±0,2)°C.
E4: температура в зависимости от роста молоди
Выживаемость молоди при обоих вариантах лечения составила 95%. Молодые особи росли значительно быстрее при 25°C, чем при 22°C (DIAM: p=0,02; WW: p=0,02) (4). Мы подсчитали, что улитки достигают морфологической зрелости в возрасте 89 лет.г при 25°С и 102 г при 22°С. Возраст при первой репродукции оценивается в 127 дней при 25°C и 148 дней при 22°C.
Молодые особи росли значительно быстрее при 25°C, чем при 22°C (DIAM: p=0,02; WW: p=0,02) (4). Мы подсчитали, что улитки достигают морфологической зрелости в возрасте 89 лет.г при 25°С и 102 г при 22°С. Возраст при первой репродукции оценивается в 127 дней при 25°C и 148 дней при 22°C.
Открыть в отдельном окне
Эксперимент 4. Влияние температуры (22°C против 25°C) на скорость роста молоди, измеренную по сырому весу ( A ) и диаметру раковины ( B ). Данные представлены как среднее ± стандартная ошибка среднего.
Температура, измеренная в ходе эксперимента, составила в среднем (±SD) 24,7 (±0,1)°C и 22,3 (±0,2)°C.
E5: плотность по сравнению с плодовитостью взрослых особей
При всех вариантах лечения наблюдалась 100% выживаемость взрослых. Плотность оказывала значительное влияние на количество кладок яиц на самку в неделю (p = 0,02), при этом улитки, выращенные при самой высокой плотности, производили значительно меньше кладок яиц (HSD по Тьюки: 0,2 против 0,8, p = 0,86; 0,2 против 2,0). , р = 0,03; 0,8 против 2,0, р = 0,03). Количество яиц/самок/неделю также уменьшалось с увеличением плотности (p<0,001). В то время как яйценоскость не отличалась между 0,2 и 0,8 улитками L -1 (Tukey HSD: p = 0,36), она была значительно снижена у 2,0 улиток L -1 (Тьюки HSD: 0,2 против 2,0, р = 0,001; 0,8 против 2,0, р = 0,002). Значимого влияния плотности на количество яиц в кладке не было (p=0,47). Однако процент выведения снижался с увеличением плотности взрослых особей (ANOVA: p = 0,03; Tukey: 0,2 против 0,8, p = 0,64; 0,2 против 2,0, p = 0,03; 0,8 против 2,0, p = 0,06). Время до первого вылупления составляло 11 дней во всех повторностях при всех плотностях имаго. Средние значения (±SEM) переменных плодовитости в зависимости от плотности показаны на рис.
, р = 0,03; 0,8 против 2,0, р = 0,03). Количество яиц/самок/неделю также уменьшалось с увеличением плотности (p<0,001). В то время как яйценоскость не отличалась между 0,2 и 0,8 улитками L -1 (Tukey HSD: p = 0,36), она была значительно снижена у 2,0 улиток L -1 (Тьюки HSD: 0,2 против 2,0, р = 0,001; 0,8 против 2,0, р = 0,002). Значимого влияния плотности на количество яиц в кладке не было (p=0,47). Однако процент выведения снижался с увеличением плотности взрослых особей (ANOVA: p = 0,03; Tukey: 0,2 против 0,8, p = 0,64; 0,2 против 2,0, p = 0,03; 0,8 против 2,0, p = 0,06). Время до первого вылупления составляло 11 дней во всех повторностях при всех плотностях имаго. Средние значения (±SEM) переменных плодовитости в зависимости от плотности показаны на рис.
Открыть в отдельном окне
Эксперимент 5. Влияние плотности улиток (0,2, 0,8 и 2,0 улиток L -1 ) на репродуктивные признаки взрослых особей. Символы — это средства; планки погрешностей — это SEM. A. Масса яиц/самка/нед. B. Яйцо/самка/нед. С. Яйца/масс. D. Успех вылупления яиц. E. Количество дней до вылупления первых яиц в кладке.
A. Масса яиц/самка/нед. B. Яйцо/самка/нед. С. Яйца/масс. D. Успех вылупления яиц. E. Количество дней до вылупления первых яиц в кладке.
Температура, измеренная в ходе эксперимента, в среднем (±SD) 25,2 (±0,1)°C.
E6: плотность по сравнению с ростом молоди
Выживаемость молоди при всех обработках составляла >99%. Плотность оказала значительное влияние на рост молоди, измеряемый как WW (p<0,001). Попарное сравнение Тьюки роста WW показало, что молодь, содержавшаяся при плотности 0,2 улиток L -1 , росла значительно быстрее, чем улитки, выращенные при плотности 0,8 улиток L -1 (p<0,001) или 2,0 улитки L -1 (p <0,001). Для DIAM наклоны регрессий между возрастом и размером значительно различались в зависимости от обработки плотности (взаимодействие возраста и плотности: p = 0,005), и наклон регрессий уменьшался с увеличением плотности. Используя наиболее подходящую линию для каждой плотности, мы подсчитали, что для этого потребуются улитки 67, 83 и 9.8 сут, чтобы достичь морфологической зрелости при 0,2, 0,8 и 2,0 улитках L -1 соответственно. Соответствующие значения возраста при первой репродукции оцениваются в 98, 123 и 148 дней. Средние значения (±SEM) для ювенильных WW и DIAM в конце эксперимента показаны на рис.
Используя наиболее подходящую линию для каждой плотности, мы подсчитали, что для этого потребуются улитки 67, 83 и 9.8 сут, чтобы достичь морфологической зрелости при 0,2, 0,8 и 2,0 улитках L -1 соответственно. Соответствующие значения возраста при первой репродукции оцениваются в 98, 123 и 148 дней. Средние значения (±SEM) для ювенильных WW и DIAM в конце эксперимента показаны на рис.
Открыть в отдельном окне
Эксперимент 6. Влияние плотности улиток (0,2, 0,8 и 2,0 улиток L −1 ) на скорость роста молоди, измеренную по сырому весу ( A ) и диаметру раковины ( В ). Символы — это средства; планки погрешностей — это SEM.
Температура, измеренная в ходе эксперимента, в среднем (±SD) 25,2 (±0,1)°C.
Влияние температуры
Различий в плодовитости взрослых особей улиток, выращенных при 25°C и 28°C, обнаружено не было. В эксперименте 1 самки производили в среднем 0,24 кладки яиц в неделю при среднем размере кладки 125 яиц, что давало в среднем 30 яиц в неделю. Хотя для вылупления яиц при 25 °C потребовалось на 2–3 дня больше времени (10,5 дня против 8 дней при 28 °C), не было различий в успехе вылупления между двумя температурами, который составлял >93% на все процедуры. Снижение температуры с 25°C до 22°C не повлияло на продуктивность взрослых яиц или размер кладки яиц. Однако выводимость яиц снизилась на 72%, и яйцам потребовалось на 5 дней (т.е. 42%) больше времени для вывода при более низкой температуре. Демиан и Юсиф (1973) сообщили о среднем периоде эмбрионального развития у особей Marisa cornuarietis , составляющем 8 дней при температуре 25—30°С и 20 дней при 15—20°С. Робинс (1971) сообщил, что время вылупления в лабораторных аквариумах при неконтролируемых температурах, варьирующихся от 14° до 31°C, составляет 11–24 дня. В наших экспериментах для вылупления яиц требовалось от 8 дней (при 28°C) до 17 дней (при 22°C), что полностью согласуется с ранее опубликованными наблюдениями.
Хотя для вылупления яиц при 25 °C потребовалось на 2–3 дня больше времени (10,5 дня против 8 дней при 28 °C), не было различий в успехе вылупления между двумя температурами, который составлял >93% на все процедуры. Снижение температуры с 25°C до 22°C не повлияло на продуктивность взрослых яиц или размер кладки яиц. Однако выводимость яиц снизилась на 72%, и яйцам потребовалось на 5 дней (т.е. 42%) больше времени для вывода при более низкой температуре. Демиан и Юсиф (1973) сообщили о среднем периоде эмбрионального развития у особей Marisa cornuarietis , составляющем 8 дней при температуре 25—30°С и 20 дней при 15—20°С. Робинс (1971) сообщил, что время вылупления в лабораторных аквариумах при неконтролируемых температурах, варьирующихся от 14° до 31°C, составляет 11–24 дня. В наших экспериментах для вылупления яиц требовалось от 8 дней (при 28°C) до 17 дней (при 22°C), что полностью согласуется с ранее опубликованными наблюдениями.
В ряде более ранних исследований сообщалось о влиянии температуры на плодовитость M. cornuarietis . Робинс (1971) сообщил, что полевые популяции M. cornuarietis из каналов округа Дейд, Флорида, воспроизводятся во все месяцы года, кроме мая и июня, при этом репродуктивная активность сосредоточена в ноябре и с февраля по апрель. Напротив, Demian & Ibrahim (1971) обнаружили, что лабораторные популяции M. cornuarietis пуэрториканского происхождения, содержащиеся при комнатной температуре, размножаются с марта до начала декабря при температуре от 20° до 33°C. Сообщалось, что в этой популяции яйценоскость постепенно увеличивалась с повышением температуры с марта по июль, а затем снова снижалась, пока не прекратилась в январе и феврале, когда комнатные температуры находились в диапазоне 14–20 °C. По-видимому, это в значительной степени связано с температурным эффектом, поскольку авторы сообщили, что улиток можно было бы заставить размножаться в январе и феврале, если бы температура была повышена до летнего уровня. Кроме того, Блэкберн и соавт. (1971) сообщил о снижении успешности вылупления яиц M.
cornuarietis . Робинс (1971) сообщил, что полевые популяции M. cornuarietis из каналов округа Дейд, Флорида, воспроизводятся во все месяцы года, кроме мая и июня, при этом репродуктивная активность сосредоточена в ноябре и с февраля по апрель. Напротив, Demian & Ibrahim (1971) обнаружили, что лабораторные популяции M. cornuarietis пуэрториканского происхождения, содержащиеся при комнатной температуре, размножаются с марта до начала декабря при температуре от 20° до 33°C. Сообщалось, что в этой популяции яйценоскость постепенно увеличивалась с повышением температуры с марта по июль, а затем снова снижалась, пока не прекратилась в январе и феврале, когда комнатные температуры находились в диапазоне 14–20 °C. По-видимому, это в значительной степени связано с температурным эффектом, поскольку авторы сообщили, что улиток можно было бы заставить размножаться в январе и феврале, если бы температура была повышена до летнего уровня. Кроме того, Блэкберн и соавт. (1971) сообщил о снижении успешности вылупления яиц M. cornuarietis на 50%, когда яйца подвергались воздействию температуры 14–16 °C в течение 8 часов, и даже воздействие температуры 16 °C в течение 2 часов приводило к измеримому снижению в успехе вылупления.
cornuarietis на 50%, когда яйца подвергались воздействию температуры 14–16 °C в течение 8 часов, и даже воздействие температуры 16 °C в течение 2 часов приводило к измеримому снижению в успехе вылупления.
Молодые улитки росли значительно быстрее при 28°C, чем при 25°C при фотопериоде 12L:12D, но не при фотопериоде 16L:8D. Темпы роста молоди были более существенно снижены при 22°С, при этом время созревания задерживалось на 13 дней, а время до первого размножения задерживалось на 21 день по сравнению с таковым при 25°С.
Пол лабораторных популяций M. cornuarietis , использованных в настоящем исследовании, можно различить по DIAM ~20 мм, что произошло в возрасте 89–101 дней при 25°C, с некоторой изменчивостью между Экспериментами 1 и 3. При этой же температуре впервые размножаются улитки размером ~30 мм, что произошло в возрасте 127–145 дней (т. е. 4–5 мес). При 22°C (Эксперимент 3) темпы развития были на конце этого диапазона и примерно на 15% ниже, чем в группе, получавшей 25°C в этом эксперименте. Напротив, Демиан и Ибрагим (1972) охарактеризовали особей M. cornuarietis , собранных в полевой популяции Пуэрто-Рико, как новозрелых с DIAM 25 мм, что, как они сообщили, произошло в возрасте ~1 года. Независимо от того, относится ли «зрелость», как определено Демианом и Ибрагимом (1972), к морфологической зрелости или к первому размножению, возраст, в котором она наступает, значительно больше, чем возраст, наблюдаемый в наших лабораторных популяциях. Можно было ожидать, что более низкие температуры в течение части года и, возможно, недостаток пищи или другие факторы, зависящие от плотности, могут способствовать более медленному развитию полевых популяций. Сообщалось о времени генерации в 4 месяца для полевых популяций, обосновавшихся в Судане на участках со средней температурой около 26°C (Haridi et al. 19).85), что согласуется с настоящими результатами.
Напротив, Демиан и Ибрагим (1972) охарактеризовали особей M. cornuarietis , собранных в полевой популяции Пуэрто-Рико, как новозрелых с DIAM 25 мм, что, как они сообщили, произошло в возрасте ~1 года. Независимо от того, относится ли «зрелость», как определено Демианом и Ибрагимом (1972), к морфологической зрелости или к первому размножению, возраст, в котором она наступает, значительно больше, чем возраст, наблюдаемый в наших лабораторных популяциях. Можно было ожидать, что более низкие температуры в течение части года и, возможно, недостаток пищи или другие факторы, зависящие от плотности, могут способствовать более медленному развитию полевых популяций. Сообщалось о времени генерации в 4 месяца для полевых популяций, обосновавшихся в Судане на участках со средней температурой около 26°C (Haridi et al. 19).85), что согласуется с настоящими результатами.
Таким образом, на основании наших собственных и опубликованных результатов мы заключаем, что 25°–28°C лежит в основном в пределах диапазона толерантности особей M. cornuarietis, , но что при температуре 22°C улитки начинают обнаруживают признаки снижения репродуктивной функции.
cornuarietis, , но что при температуре 22°C улитки начинают обнаруживают признаки снижения репродуктивной функции.
Влияние фотопериода
Общепризнано, что для большинства сезонных производителей, живущих в умеренном климате, фотопериод является основным экологическим сигналом, который регулирует сроки размножения (Wayne 2001). Было замечено, что у видов брюхоногих умеренных широт яйцекладка увеличивается с увеличением фотопериода. Например, Болкен и др. (1986) сообщил об увеличении яйцекладки с увеличением фотопериода у Lymnaea stagnalis . Для тропических видов, таких как М. cornuarietis, , роль фотопериода в контроле воспроизводства полевых популяций менее ясна. Робинс (1971) утверждал, что M. cornuarietis ведут преимущественно ночной образ жизни и наиболее репродуктивно активны ночью. Demian & Ibrahim (1971) наблюдали, что выращенные в лаборатории взрослые особи M. cornuarietis чаще откладывали яйца ночью и рано утром, чем в другое время. Поэтому мы ожидали, что фотопериод окажет значительное влияние на плодовитость взрослых особей, выращенных в нашей лаборатории. Однако мы не наблюдали влияния фотопериода на какие-либо признаки плодовитости взрослых особей или на вылупление яиц. Хотя при фотопериоде 12L:12D молодые улитки росли быстрее при 28°C, чем при 25°C, существенных различий в росте или развитии молоди между двумя температурами при фотопериоде 16L:8D не было. Фотопериод оказывал незначительное влияние на рост молоди при 25°C, но не влиял при 28°C.
Поэтому мы ожидали, что фотопериод окажет значительное влияние на плодовитость взрослых особей, выращенных в нашей лаборатории. Однако мы не наблюдали влияния фотопериода на какие-либо признаки плодовитости взрослых особей или на вылупление яиц. Хотя при фотопериоде 12L:12D молодые улитки росли быстрее при 28°C, чем при 25°C, существенных различий в росте или развитии молоди между двумя температурами при фотопериоде 16L:8D не было. Фотопериод оказывал незначительное влияние на рост молоди при 25°C, но не влиял при 28°C.
Таким образом, несмотря на предположения из литературы о влиянии фотопериода на плодовитость улиток, мы не смогли обнаружить никакого влияния на какой-либо признак плодовитости (и лишь ограниченное влияние на рост молоди), увеличив продолжительность светового периода с 12 часов до 16 часов. час
Влияние плотности
Увеличение плотности выращивания с 0,2 до 0,8 улиток L -1 мало повлияло на показатели плодовитости взрослых особей, но увеличение плотности до 2,0 улиток L -1 привело к значительному сокращению кладки яиц на самку в неделю и яйца/самка/неделя (но не яйца/кладка). В то время как время вылупления не зависело от плотности, успех вылупления снижался при самой высокой плотности взрослых особей. Рост и развитие молоди были очень чувствительны к влиянию плотности, при этом снижение роста было заметно уже при 0,8 улитки L −1 . Было высказано предположение, что метаболиты, вырабатываемые улитками, могут ингибировать рост или размножение при увеличении плотности (Thomas et al., 1975). Однако, поскольку мы использовали проточную систему (со скоростью обновления 5,8 объема резервуара в день), маловероятно, что могло произойти накопление метаболитов даже при самых высоких плотностях.
В то время как время вылупления не зависело от плотности, успех вылупления снижался при самой высокой плотности взрослых особей. Рост и развитие молоди были очень чувствительны к влиянию плотности, при этом снижение роста было заметно уже при 0,8 улитки L −1 . Было высказано предположение, что метаболиты, вырабатываемые улитками, могут ингибировать рост или размножение при увеличении плотности (Thomas et al., 1975). Однако, поскольку мы использовали проточную систему (со скоростью обновления 5,8 объема резервуара в день), маловероятно, что могло произойти накопление метаболитов даже при самых высоких плотностях.
Другие исследования показали, что зависящее от плотности снижение роста, размножения и выживания улиток может быть прямым результатом ограничения пищи (O’Keeffe 19).85). Поскольку улиток в настоящем исследовании кормили в избытке при любой плотности, маловероятно, что ограничение в еде может объяснить эффект отрицательной плотности. Однако, как отмечают Томас и соавт. (1983), улитки могут увеличивать скорость питания по мере увеличения количества доступной пищи/улитки, и нельзя предполагать, что различные места поглощения, участвующие в росте, насыщаются просто потому, что пища остается несъеденной. Кроме того, даже если улитки могут не потреблять 100% доступной пищи, качество оставшейся пищи может снижаться с увеличением плотности улиток, что позволяет предположить, что при более высокой плотности улитки потребляют большую долю материала более низкого качества.
(1983), улитки могут увеличивать скорость питания по мере увеличения количества доступной пищи/улитки, и нельзя предполагать, что различные места поглощения, участвующие в росте, насыщаются просто потому, что пища остается несъеденной. Кроме того, даже если улитки могут не потреблять 100% доступной пищи, качество оставшейся пищи может снижаться с увеличением плотности улиток, что позволяет предположить, что при более высокой плотности улитки потребляют большую долю материала более низкого качества.
Уильямсон и др. (1976) сообщили о замедлении темпов роста молоди с увеличением плотности поля наземной улитки Cepaea nemoralis L., что они не могли объяснить зависящим от плотности ограничением качества или количества пищи. Они пришли к выводу, что взаимодействия между улитками, будь то химические или поведенческие, ответственны за замедление темпов роста молоди в популяциях с высокой плотностью. Brown & Carman (1994) обнаружили увеличение уровня поведенческих помех с увеличением плотности легочной артерии 9. 0037 Physella virgata, , который, по их предположению, способствовал снижению скорости выпаса скота при более высокой плотности. Их результаты показали, что ни растворенные метаболиты, ни сигналы, переносимые субстратом, не могут объяснить зависящее от плотности снижение скорости выпаса этого вида.
0037 Physella virgata, , который, по их предположению, способствовал снижению скорости выпаса скота при более высокой плотности. Их результаты показали, что ни растворенные метаболиты, ни сигналы, переносимые субстратом, не могут объяснить зависящее от плотности снижение скорости выпаса этого вида.
Независимо от конкретного механизма, наши результаты показывают, что плотность улиток является важным фактором контроля при выращивании популяций M. cornuarietis в лабораторных культурах.
Различия между экспериментами
Мы отметили особенно большие различия в плодовитости при сравнении эксперимента 1 с экспериментами 3 и 5 даже среди улиток, выращенных в почти одинаковых условиях температуры и освещения. Сравнение экспериментов с 25°C, 12L:12D, 0,7 или 0,8 улитками L -1 показывает, что количество яиц на самку в неделю в среднем составляло только 28 в эксперименте 1, тогда как оно было 71 в эксперименте 3 и 87 в эксперименте. 5. Кладки яиц, производимые улитками из эксперимента 1, были самыми крупными из трех, но их производилось меньше в неделю по сравнению с улитками из эксперимента 3 или 5. В то время как эксперименты 3 и 5 проводились с выведенными в лаборатории взрослыми особями в возрасте до 1 года, эксперимент 1 проводился с собранными в полевых условиях взрослыми особями неизвестного возраста. Возможно, что последние люди были намного старше и, возможно, приближались к старению, когда проводился эксперимент. Золотая яблочная улитка, Ampullarius sp., как сообщается, демонстрирует уменьшение количества и размера кладки яиц, а также выводимости яиц с увеличением возраста взрослой особи (Lacanilao 1990). Эстой и др. (2002) обнаружили, что количество кладок яиц в день и общий вес кладки яиц, но не количество яиц на кладку или вес яиц, уменьшались с возрастом у ампулларид Pomacea canaliculata .
В то время как эксперименты 3 и 5 проводились с выведенными в лаборатории взрослыми особями в возрасте до 1 года, эксперимент 1 проводился с собранными в полевых условиях взрослыми особями неизвестного возраста. Возможно, что последние люди были намного старше и, возможно, приближались к старению, когда проводился эксперимент. Золотая яблочная улитка, Ampullarius sp., как сообщается, демонстрирует уменьшение количества и размера кладки яиц, а также выводимости яиц с увеличением возраста взрослой особи (Lacanilao 1990). Эстой и др. (2002) обнаружили, что количество кладок яиц в день и общий вес кладки яиц, но не количество яиц на кладку или вес яиц, уменьшались с возрастом у ампулларид Pomacea canaliculata .
Имеются противоречивые данные о сезонности моделей производства яиц в культурных популяциях M. cornuarietis , выращенный в постоянных лабораторных условиях. Университет Сассекса (D. Thomas, неопубликованные данные) не наблюдал годовых циклов половой активности у M. cornuarietis , культивируемых при постоянном освещении и температуре (т. е. 12 L:12D, ~25°C). В культурах M. cornuarietis Датской лаборатории бильгарциоза наблюдалось небольшое угнетение половой активности в зимние месяцы, но отсутствие полового покоя весной и летом (H. Madsen, неопубликованные данные). Напротив, Oehlmann et al. (2000) сообщили, что размножение в культурах M. cornuarietis , содержащийся при несколько более низких температурах (например, ∼21°–23°C), контролируется сезонно, при этом пик копуляции и нерестовой активности приходится на ноябрь, декабрь и январь, а остальные месяцы года являются фазой полового покоя. (со сниженной яйценоскостью). В настоящем исследовании показатели яйценоскости в эксперименте 1, проведенном с 16 мая по 17 июня, были ниже, чем в опыте 3 (проведенном с 4 декабря 2003 г. по 15 января 2004 г.) и опыте 5 (проведенном с 17 октября по 12 ноября). ). На основании имеющихся результатов невозможно определить, вызвана ли эта разница влиянием возраста улиток или влиянием сезона.
cornuarietis , культивируемых при постоянном освещении и температуре (т. е. 12 L:12D, ~25°C). В культурах M. cornuarietis Датской лаборатории бильгарциоза наблюдалось небольшое угнетение половой активности в зимние месяцы, но отсутствие полового покоя весной и летом (H. Madsen, неопубликованные данные). Напротив, Oehlmann et al. (2000) сообщили, что размножение в культурах M. cornuarietis , содержащийся при несколько более низких температурах (например, ∼21°–23°C), контролируется сезонно, при этом пик копуляции и нерестовой активности приходится на ноябрь, декабрь и январь, а остальные месяцы года являются фазой полового покоя. (со сниженной яйценоскостью). В настоящем исследовании показатели яйценоскости в эксперименте 1, проведенном с 16 мая по 17 июня, были ниже, чем в опыте 3 (проведенном с 4 декабря 2003 г. по 15 января 2004 г.) и опыте 5 (проведенном с 17 октября по 12 ноября). ). На основании имеющихся результатов невозможно определить, вызвана ли эта разница влиянием возраста улиток или влиянием сезона. Тем не менее, продолжаются эксперименты по количественной оценке репродуктивной способности выращенных в лаборатории улиток известного возраста в течение всего года, чтобы определить, существует ли какая-либо сезонная и / или зависящая от возраста изменчивость признаков плодовитости.
Тем не менее, продолжаются эксперименты по количественной оценке репродуктивной способности выращенных в лаборатории улиток известного возраста в течение всего года, чтобы определить, существует ли какая-либо сезонная и / или зависящая от возраста изменчивость признаков плодовитости.
В настоящем исследовании успешность вылупления яиц в Эксперименте 3 была примерно вдвое меньше, чем в Эксперименте 1 или Эксперименте 5 для улиток, выращенных в идентичных условиях (44% против 93%). Из-за нехватки времени в начале эксперимента 3 было невозможно выделить такое же время для акклиматизации к условиям испытаний, как и в других экспериментах. Поэтому взрослых улиток собирали из исходной культуры, плотность которой превышала 1,0 улиток L -1 . Было продемонстрировано, что плотность взрослых особей влияет на вывод яиц при плотности 2,0 улитки L −1 (Опыт 5). Таким образом, возможно, более плохое состояние взрослых особей в начале эксперимента 3 привело к низкой выводимости кладки яиц из этого эксперимента по сравнению с опытами 1 и 5.
Большая изменчивость размеров кладки у M. cornuarietis сообщалось в опубликованных исследованиях. Например, Робинс (1971) обнаружил, что размер кладки у M. cornuarietis варьируется в пределах 22–191 яйца на кладку. Демиан и Ибрагим (1971) наблюдали кладку яиц у выращенных в лаборатории взрослых особей 9 особей.0037 M. cornuarietis колеблется в пределах 12–200 яиц в кладке, причем большинство из них находится в диапазоне 40–80 яиц в кладке. Всемирная организация здравоохранения (1982 г.) сообщила, что в среднем на одну кладку приходится 100 яиц. В наших экспериментах средний размер кладки колебался от 65 до 140 яиц/кладку между экспериментами, с коэффициентами вариации в пределах опытных вариантов в пределах 11-23%. На этот признак не оказывалось влияния температуры, фотопериода или плотности, что указывает на то, что большая часть изменчивости была среди повторов в экспериментальных обработках.
В заключение на основании представленных результатов мы заключаем, что выращивание популяций M. cornuarietis при температуре 25°C, фотопериоде 12L:12D и плотности <0,8 улиток L −1 (с более низкой плотностью молоди улиток) должны обеспечивать благоприятные условия содержания для поддержания многогенерационных популяций этого вида в лаборатории.
cornuarietis при температуре 25°C, фотопериоде 12L:12D и плотности <0,8 улиток L −1 (с более низкой плотностью молоди улиток) должны обеспечивать благоприятные условия содержания для поддержания многогенерационных популяций этого вида в лаборатории.
Это исследование финансировалось Глобальной промышленной группой бисфенола А. Мы благодарим всех сотрудников группы экотоксикологии в ABC Laboratories Inc. за их помощь в этих испытаниях, особенно Стива Беркли, Джеймса Херрика и Пола Коула. Мы благодарим Terran Corporation и особенно Кристофера Рюфа за сбор и анализ полевых образцов озера Гуаятака.
- Блэкберн Р.Д., Тейлор Т.М., Саттон Д.Л. проц. Евро. Сорняк Рез. Граф. 3-й междунар. Симп. водные сорняки; 1971. Устойчивость к температуре и необходимая норма посадки Marisa cornuarietis L. для борьбы с водными сорняками; стр. 79–86. [Google Scholar]
- Bohlken SJ, Joosse J, Van Elk R, Geraerts WP. Взаимодействие фотопериода и состояния питания у самок Lymnaea stagnalis .
 Междунар. Дж. Инвертбр. Репро. Дев. 1986; 2: 151–158. [Google Scholar]
Междунар. Дж. Инвертбр. Репро. Дев. 1986; 2: 151–158. [Google Scholar] - Браун К.М., Карман К.Р. Зависящие от плотности влияния на питание и метаболизм пресноводной улитки. Экология. 1994;99:158–165. [PubMed] [Google Scholar]
- Демиан Э.С., Ибрагим А.М. Яйценоскость, яйцекладка и брачное поведение улитки Marisa cornuarietis (L.) Bull. Зоол. соц. Египет. 1971; 23:1–12. [Google Scholar]
- Демьян Э.С., Ибрагим А.М. Устойчивость улитки Marisa cornuarietis (L.) к экстремальным температурам в лабораторных условиях. Бык. Зоол. соц. Египет. 1972; 24: 20–30. [Google Scholar]
- Демьян Э.С., Лутфи Р.Г. Хищническая активность Marisa cornuarietis против Biomphalaria alexandrina в лабораторных условиях. Анна. Троп. Мед. Паразит. 1965; 59: 337–339. [Google Scholar]
- Демьян Э.С., Лутфи Р.Г. Факторы, влияющие на хищничество Marisa cornuarietis на Bulinus (B.) truncatus, Biomphalaria alexandrina и Lymnaea caillaudi .
 Ойкос. 1966; 17: 212–230. [Google Scholar]
Ойкос. 1966; 17: 212–230. [Google Scholar] - Демиан Э.С., Юсиф Ф. Эмбриональное развитие и органогенез у улитки Marisa cornuarietis (Mesogastropoda: Ampullariidae). I. Общие контуры развития. Малакология. 1973;12:123–150. [PubMed] [Google Scholar]
- Estoy GF, Jr, Yusa Y, Wada T, Sakurai H, Tsuchida K. Влияние доступности пищи и возраста на репродуктивную способность яблочной улитки, Pomacea canaliculata (Lamarck) (Gastropoda : Ampullariidae) Appl. Энтомол. Зоол. 2002; 37: 543–550. [Google Scholar]
- Фергюсон Ф.Ф., Палмер Дж.Р. Биологические заметки о Marisa cornuarietis , хищнике Australorbis glabratus , улитке-промежуточном хозяине шистосомоза в Пуэрто-Рико. Являюсь. Дж. Троп. Мед. Гиг. 1958;7:640–641. [PubMed] [Google Scholar]
- Haridi AAM, El Safi SH, Jobin WR. Выживание, рост и размножение импортированной ампулярной улитки Marisa cornuarietis в Центральном Судане. Являюсь. Дж. Троп. Мед. Гиг. 1985; 88: 135–144.
 [PubMed] [Google Scholar]
[PubMed] [Google Scholar] - Лаканилао Ф. Размножение золотой яблочной улитки (Ampullaridae): яичная масса, вылупление и инкубация. Филипп. J. Sci. 1990; 119: 95–105. [Google Scholar]
- Oehlmann J, Schulte-Oehlmann U, Tillmann M, Markert B. Влияние эндокринных разрушителей на переднежаберных улиток (Mollusca Gastropoda) в лаборатории. Часть I: Бисфенол А и октилфенол как ксеноэстрогены. Экотоксикология. 2000;9: 383–397. [PubMed] [Google Scholar]
- О’Киф Дж. Х. Биология популяции пресноводной улитки Bulinus globosus на побережье Кении. II. Влияние питания и плотности на параметры популяции. Дж. Заявл. Экол. 1985; 22:85–90. [Google Scholar]
- Ortiz-Torres E. Ущерб, нанесенный улиткой Marisa cornuarietis молодым саженцам риса в Пуэрто-Рико. Дж. Агрик. ун-т пиар. 1961; 46: 211–212. [Google Scholar]
- Pointier JP, Augustin D. Биологический контроль и вторжение пресноводных улиток. Comptes rendus de l’Academie des Sciences; Париж.
 1999. стр. 1093–1098. Тематическое исследование. Sciences de la vie 322. [PubMed] [Google Scholar]
1999. стр. 1093–1098. Тематическое исследование. Sciences de la vie 322. [PubMed] [Google Scholar] - Pointier JP, Jourdane J. Биологический контроль улиток-хозяев шистосомоза в районах с низким уровнем передачи: пример Карибского региона. Акта Тропика. 2000;7:53–60. [PubMed] [Google Scholar]
- Радке М.Г., Ричи Л.С., Фергюсон Ф.Ф. Продемонстрировано подавление Australorbis glabratus с помощью Marisa cornuarietis в полевых условиях в Пуэрто-Рико. Являюсь. Дж. Троп. Мед. Гиг. 1961;10:370–373. [PubMed] [Google Scholar]
- Robins CH. Экология интродуцированной улитки Marisa cornuarietis (Ampullariidae) в округе Дейд, Флорида. Биолог. 1971; 53: 136–152. [Google Scholar]
- Землянин . 2002 г. Отбор проб поверхностных вод и отложений в Лаго-де-Гуахатака, Пуэрто-Рико, 14 октября 2002 г. Terran Corp.; п. 113. Технический отчет TB-0221. [Google Scholar]
- Томас Д.Д., Голдсуорти Г.Л., Арам Р.Х. Исследования химической экологии улиток: влияние химического кондиционирования взрослых улиток на рост молодых улиток.
 Дж. Аним. Экол. 1975;44:1–28. [Google Scholar]
Дж. Аним. Экол. 1975;44:1–28. [Google Scholar] - Томас Дж. Д., Грили Б., Феннелл С. Ф. Влияние изменения количества и качества различных растений на питание и рост Biomphalaria glabrata . Ойкос. 1983; 41: 77–90. [Google Scholar]
- Wayne NL. Регуляция сезонного размножения моллюсков. Дж. Биол. Ритмы. 2001; 16: 391–402. [PubMed] [Google Scholar]
- Williamson P, Cameron RAD, Carter MA. Плотность популяции, влияющая на размер раковины взрослой улитки Cepaea nemoralis Л. Природа. 1976; 263: 496–497. [PubMed] [Google Scholar]
- Всемирная организация здравоохранения. 1982. Лист данных по агенту биологической борьбы; п. 11. ВОЗ/VBC/82.837. [Google Scholar]
Статьи по биологии беспозвоночных предоставлены здесь с разрешения Wiley-Blackwell, John Wiley & Sons
Американский журнал тропической медицины и гигиены, том 5, выпуск 2 (1956 г.)
- Предыдущая статья
- Следующая статья
Обсуждение и резюме
Происхождение и время интродукции Marisa в Сан-Антон-Крик не могут быть точно установлены. Этот вид является популярной аквариумной улиткой, и, возможно, это способствовало ее распространению. Известно, что он распространен в Бразилии, северной части Южной и Центральной Америки (Бейкер, 19 лет).30). В последние годы он появился на Кубе (Penalver, 1950), способ интродукции неизвестен.
Этот вид является популярной аквариумной улиткой, и, возможно, это способствовало ее распространению. Известно, что он распространен в Бразилии, северной части Южной и Центральной Америки (Бейкер, 19 лет).30). В последние годы он появился на Кубе (Penalver, 1950), способ интродукции неизвестен.
Ручей Сан-Антон, очевидно, предлагал более или менее идеальные условия для этой улитки. Это, помимо возможного отсутствия естественных врагов, привело к его практически взрывному размножению. Это явление совпало с исчезновением Australorbis из этой среды обитания, но, возможно, свою роль сыграли и другие факторы. Как показано в таблице 2, только небольшое количество Marisa присутствовали в последних сборах на станции 5, поэтому не исключено, что факторы, вызвавшие это сокращение, могли повлиять и на другие виды. Однако на всех других станциях были обнаружены большие популяции мариса . Наблюдения за прудом Ла-Пальма подтвердили гипотезу о том, что Marisa на самом деле был решающим фактором, вызвавшим исчезновение Australorbis .
Еще неизвестно, будет ли Мариса останется преобладающим в Сан-Антон-Крик и пруду Ла-Пальма, или если стабилизация в новой среде в конечном итоге приведет к приспособлению, благодаря которому оба вида смогут выжить в одной и той же среде обитания. Однако любой метод, уменьшающий количество Australorbis , может снизить популяцию ниже порога, необходимого для поддержания передачи шистосомоза.
Лабораторные и полевые наблюдения за пищевыми привычками Marisa показывают, что эта улитка очень прожорлива. Это указывает на два фактора, которые могли вызвать снижение Australorbis Население человек. Во-первых, оказалось возможным, что эта улитка проглотила яйца Australorbis , отложенные на растительности. Во-вторых, наличие большого количества Мариса имеет в чем-то тот же эффект, что и пылесос, и сокращение популяции может быть связано с серьезным истощением запасов пищи. Выводы Chernin et al. , (1955) в лабораторных условиях указывают, что оба эти фактора, вероятно, играют важную роль.
Australorbis было обнаружено в большом количестве в одном небольшом притоке наблюдаемого ручья. Причина, по которой Мариса не вторглась в этот небольшой ручей, может быть связана с различиями в размерах двух видов. Диаметр имаго Australorbis из этого ручья составляет около 15 мм по сравнению с около 60 мм. для остальных видов. Последний нашел идеальные условия в основном потоке, но не распространился на приток. Во многих местах обитания, где Australorbis обитает в Пуэрто-Рико, вода часто бывает настолько мелкой, что более крупная улитка не может оставаться под водой. Это может быть ограничивающим фактором в распространении Marisa .
Насколько известно, M. cornuarietis не является хозяином, продуцирующим какие-либо церкарии трематод, способные заразить человека или домашних животных. В нашей лаборатории повторный контакт этой улитки с мирацидиями S. mansoni не привел к заражению. Поэтому планируется интродукция вида в другие отобранные Местообитания Australorbis в контролируемых условиях и при наличии адекватных экологических и популяционных исследований. В таких условиях должно быть возможно определить, можно ли использовать этот вид для биологической борьбы с одним из переносчиков S. mansoni .
В таких условиях должно быть возможно определить, можно ли использовать этот вид для биологической борьбы с одним из переносчиков S. mansoni .
Авторы выражают благодарность г-ну Нельсону Бьяджи из Департамента профилактической медицины и общественного здравоохранения Медицинского факультета Школы тропической медицины за его сотрудничество в ходе этого исследования. Также доктору Д. Б. Макмаллену, кафедра медицинской зоологии, Высшая школа армейской медицинской службы, Вашингтон, округ Колумбия, за пересмотр рукописи.
Примечания автора
1 Текущий адрес: Кафедра медицинской зоологии, Высшая школа армейской медицинской службы, Вашингтон 12, округ Колумбия.
Сохранять Отправить этот контент по электронной почте
Поделиться ссылкой
Скопируйте эту ссылку или нажмите ниже, чтобы отправить ее другу по электронной почте
Отправить этот контент по электронной почте
или скопируйте ссылку напрямую:
https://www. ajtmh.org/view/journals/tpmd/5/2/article-p290.xml
ajtmh.org/view/journals/tpmd/5/2/article-p290.xml
Ссылка не скопирована. Ваш текущий браузер может не поддерживать копирование с помощью этой кнопки.
Ссылка успешно скопирована
Ликвидация шистосомоза со скоростью улитки от Глории Лоренц Ключевые таксоны: Моллюска, Брюхоногие , Australorbis (= Biomphalaria) glabratus , Мариса рогатая Шистосомоз — это иммунологическое заболевание, возникающее в результате паразитарной инфекции и оказывающее сильное воздействие на жителей Пуэрто-Рико, где оно распространено. Шистосомоз распространяется через Australorbis glabratus (= Biomphalaria glabrata ), промежуточного хозяина улитки для паразитического червя Schistosoma mansoni . Были исследованы различные методы борьбы, в частности, с помощью химических моллюскоцидов, а также биологический контроль с использованием Marisa cornuarietis , еще один вид улиток. Шистосомоз — это инфекция, поразившая более 200 миллионов человек в Африке, Азии, Южной Америке и странах Карибского бассейна. Передача инфекции может произойти, когда человек подвергается воздействию воды, зараженной улиткой-хозяином, зараженным паразитом (Gray et al. 2011). Контакт обычно происходит во время плавания, купания и стирки одежды, и чем дольше человек находится в воде, тем выше вероятность заражения. Паразит, вызывающий это заболевание, Schistosoma mansoni 9.0614, вызывает инфекцию, когда церкарии (личинки) внедряются в кожу, попадают в сосудистую систему, а затем созревают во взрослых червей (Pearce & MacDonald 2002). Понимание Australorbis имеет жизненно важное значение для изучения его роли в шистосомозе. Australorbis glabratus — пресноводная улитка, служащая промежуточным хозяином для паразита, вызывающего шистосомоз, Schistosoma mansoni . Улитка — единственный вид в Пуэрто-Рико, известный как промежуточный хозяин, и он широко распространен по всей стране (Berry et al., 1950). Профессор Корнельского университета на пенсии Дэвид Пиментел (1957 г.) собрал более 1000 Australorbis улиток из Пуэрто-Рико для изучения истории их жизни. Улиток размещали в аквариумах по 4 размерным группам. Наблюдения предоставили много данных о Australorbis . Высокая плодовитость и круглогодичное размножение позволяют быстро увеличивать численность, что делает его одним из самых многочисленных видов в Пуэрто-Рико (Pimentel 1957). Большое количество может увеличить распространение шистосомоза, если большее количество улиток заразится и станет промежуточным хозяином для паразитов, которые затем могут быть переданы человеку. Была предпринята попытка борьбы с шистосомозом в Пуэрто-Рико путем применения моллюскоцидов на промежуточных хозяевах-улитках (Berry et al., 1950). Этот метод химической деструкции используется уже некоторое время. Однако были исследованы и другие методы контроля. Берри и др. (1950) провели исследования по изучению воздействия различных химических веществ в качестве средств борьбы на Australorbis glabratus . Более 750 химикатов использовались для создания различных соединений, которые были протестированы в лабораторных условиях. В ходе 24-часового теста было обнаружено, что 11 соединений на 100 % эффективны против Австралорбис . Эти соединения, такие как фенацилхлорид, диизобутилфенол и соли меди, затем использовались в полевых условиях на болоте в Вега-Баха, Пуэрто-Рико. Для измерения эффективности соединений было проведено сравнение числа жизнеспособных улиток на различных участках участка до и после применения соединений. Наблюдения, проведенные через 24, 48, 60 и 72 часа, показали летальное воздействие на улиток за очень короткий промежуток времени. Также был исследован биологический контроль промежуточных хозяев улиток. Борьба с шистосомозом в Пуэрто-Рико была предпринята путем вытеснения улиток-хозяев A. glabratus с другой улиткой, Marisa cornuarietis . В одном исследовании изучалось воздействие на A. glabratus в пуэрториканских фермерских прудах, куда был интродуцирован M. cornuarietis (Ferguson et al., 1958). Из 10 прудов, куда была интродуцирована мариса , колонии смогли образоваться в течение года. Важно понимать экологию Марисы , чтобы знать, как ее можно использовать в качестве биологического контроля. В лабораторных условиях исследования показали, что Marisa потребляет Australorbis (Чернин и др. Хотя шистосомоз является высокоинфекционным заболеванием, поражающим миллионы людей, было исследовано несколько методов борьбы с паразитами. В качестве промежуточного хозяина для 9Паразит 0613 Schistosoma mansoni , Australorbis glabratas был изучен в нескольких исследованиях, чтобы найти способ контролировать распространение болезни. Химические и биологические агенты применялись как в лабораторных, так и в полевых исследованиях. Эти исследования предоставили много данных о том, как промежуточные улитки-хозяева паразита могут быть уничтожены моллюскацидами или другими видами улиток, Marisa cornuarietis . Дальнейшие исследования могут дать дополнительное представление о том, как можно контролировать это заболевание с помощью химических или биологических агентов, и могут даже выявить другие виды, которые можно использовать для уменьшения распространения болезни. Важно рассмотреть варианты методов борьбы, чтобы можно было принять меры для снижения числа заболеваний и смертей от шистосомоза. Ссылки Процитировано
|
 Изучая шистосомоз и его последствия, а также роль пресноводных улиток в распространении инфекции, можно лучше понять прикладное использование M. cornuarietis для борьбы с A. glabratus . Поскольку распространение шистосомоза зависит от распространения A. glabratus , были проведены исследования, направленные на искоренение A. glabratus для уменьшения случаев заражения.
Изучая шистосомоз и его последствия, а также роль пресноводных улиток в распространении инфекции, можно лучше понять прикладное использование M. cornuarietis для борьбы с A. glabratus . Поскольку распространение шистосомоза зависит от распространения A. glabratus , были проведены исследования, направленные на искоренение A. glabratus для уменьшения случаев заражения. Инфекция продолжается, поскольку черви продолжают откладывать яйца внутри организма. Печень является основным пораженным органом из-за большого количества крови, протекающей через нее. Инфекция протекает в острой, хронической и поздней стадиях, проявляясь широким спектром симптомов. Когда люди впервые заражаются, у них может развиться острый шистосомоз или синдром Катаямы (Gray et al. 2011). Эта стадия включает лихорадку, кашель и утомляемость. По мере прогрессирования инфекции и реакции иммунной системы у человека могут развиться кишечные заболевания, воспаление мочевыделительной системы и фиброз печени. У пораженных детей могут возникать когнитивные нарушения. Наиболее тяжелым заболеванием является нейрошистосомоз, который приводит к высокому внутричерепному давлению из-за тысяч яиц и гранулем (воспалений) в головном и спинном мозге. Эти воспаления формируются вокруг новых яиц, отложившихся в организме (Pearce & MacDonald 2002). Шистосомоз можно лечить с помощью лекарств, которые заставляют паразитов отделяться от вен и умирать.
Инфекция продолжается, поскольку черви продолжают откладывать яйца внутри организма. Печень является основным пораженным органом из-за большого количества крови, протекающей через нее. Инфекция протекает в острой, хронической и поздней стадиях, проявляясь широким спектром симптомов. Когда люди впервые заражаются, у них может развиться острый шистосомоз или синдром Катаямы (Gray et al. 2011). Эта стадия включает лихорадку, кашель и утомляемость. По мере прогрессирования инфекции и реакции иммунной системы у человека могут развиться кишечные заболевания, воспаление мочевыделительной системы и фиброз печени. У пораженных детей могут возникать когнитивные нарушения. Наиболее тяжелым заболеванием является нейрошистосомоз, который приводит к высокому внутричерепному давлению из-за тысяч яиц и гранулем (воспалений) в головном и спинном мозге. Эти воспаления формируются вокруг новых яиц, отложившихся в организме (Pearce & MacDonald 2002). Шистосомоз можно лечить с помощью лекарств, которые заставляют паразитов отделяться от вен и умирать. Кортикостероиды используются для уменьшения последствий аллергических реакций, а противосудорожные препараты — для лечения судорог (Gray et al., 2011). Внутричерепное давление можно лечить путем хирургического введения шунта в головной мозг. Хирургия предназначена для тех, чье состояние ухудшается, несмотря на использование кортикостероидов, уменьшающих воспаление, и других лекарств. Во многих случаях шистосомоз можно предотвратить путем модификации окружающей среды, улучшения санитарии и санитарного просвещения. Однако во многих местах, где распространен шистосомоз, люди не могут позволить себе жить в лучших условиях. Поэтому болезнь поражает многих и потенциально может убить любого, кто ею заразится. Только в странах Африки к югу от Сахары около 280 000 человек ежегодно умирают от шистосомоза (Pearce & MacDonald 2002). Связь между шистосомозом и пресноводными улитками обеспечивает основу для исследований по борьбе с болезнью и контролю над промежуточными хозяевами паразита, ответственного за инфекцию.
Кортикостероиды используются для уменьшения последствий аллергических реакций, а противосудорожные препараты — для лечения судорог (Gray et al., 2011). Внутричерепное давление можно лечить путем хирургического введения шунта в головной мозг. Хирургия предназначена для тех, чье состояние ухудшается, несмотря на использование кортикостероидов, уменьшающих воспаление, и других лекарств. Во многих случаях шистосомоз можно предотвратить путем модификации окружающей среды, улучшения санитарии и санитарного просвещения. Однако во многих местах, где распространен шистосомоз, люди не могут позволить себе жить в лучших условиях. Поэтому болезнь поражает многих и потенциально может убить любого, кто ею заразится. Только в странах Африки к югу от Сахары около 280 000 человек ежегодно умирают от шистосомоза (Pearce & MacDonald 2002). Связь между шистосомозом и пресноводными улитками обеспечивает основу для исследований по борьбе с болезнью и контролю над промежуточными хозяевами паразита, ответственного за инфекцию.

 Шесть соединений были по крайней мере 90% эффективности при использовании в концентрации 10 частей на миллион (Berry et al., 1950). Использование химических соединений на испытательном полигоне в 1955 г. на юго-востоке Пуэрто-Рико стоило примерно 7,80 долл. США для обработки 100 кубометров воды (Jobin et al., 1970). Высокая стоимость этих соединений и токсическое воздействие на рыбу может привести к сокращению использования химикатов для борьбы с Australorbis . Если химикаты не подходят, важно рассмотреть другие методы борьбы.
Шесть соединений были по крайней мере 90% эффективности при использовании в концентрации 10 частей на миллион (Berry et al., 1950). Использование химических соединений на испытательном полигоне в 1955 г. на юго-востоке Пуэрто-Рико стоило примерно 7,80 долл. США для обработки 100 кубометров воды (Jobin et al., 1970). Высокая стоимость этих соединений и токсическое воздействие на рыбу может привести к сокращению использования химикатов для борьбы с Australorbis . Если химикаты не подходят, важно рассмотреть другие методы борьбы. В остальных 5 прудах укоренение заняло более года. В 8 из 10 прудов колоний Marisa смогли очень хорошо прижиться. Во всех 8 из этих прудов колонии по A. glabratus были уничтожены в среднем за 8 месяцев. Marisa также был интродуцирован в водораздел ручья на юге Пуэрто-Рико (Ferguson et al., 1958). Несмотря на штормы, жилищное строительство и физические изменения в водоразделе, Мариса смогла утвердиться и даже процветать в нескольких местах. Обследование различных участков с Australorbis , проведенных до и после интродукции Marisa , показало снижение численности на Австралорбис . Это снижение было связано с пространственной конкуренцией между двумя видами улиток. В результате этих выводов Пуэрто-Рико начал размещать Marisa в нескольких других водных путях по всей стране, где ранее использовался химический контроль Australorbis .
В остальных 5 прудах укоренение заняло более года. В 8 из 10 прудов колоний Marisa смогли очень хорошо прижиться. Во всех 8 из этих прудов колонии по A. glabratus были уничтожены в среднем за 8 месяцев. Marisa также был интродуцирован в водораздел ручья на юге Пуэрто-Рико (Ferguson et al., 1958). Несмотря на штормы, жилищное строительство и физические изменения в водоразделе, Мариса смогла утвердиться и даже процветать в нескольких местах. Обследование различных участков с Australorbis , проведенных до и после интродукции Marisa , показало снижение численности на Австралорбис . Это снижение было связано с пространственной конкуренцией между двумя видами улиток. В результате этих выводов Пуэрто-Рико начал размещать Marisa в нескольких других водных путях по всей стране, где ранее использовался химический контроль Australorbis . Marisa cornuarietis , гигантская улитка-баран, имеет половой диморфизм с диаметром раковины от 40 до 50 мм (Selck et al. 2006). Эта всеядная пресноводная улитка обитает в различных местах Карибского бассейна, а также в Центральной и Южной Америке. Селк и др. (2006) исследовали пищевые предпочтения Marisa и обнаружил, что он может выдержать голод в зависимости от содержания питательных веществ в том, что он ест. Подразумевается, что Мариса может лучше выживать в различных средах обитания, что позволяет использовать его в качестве контрольного агента в более широком диапазоне. Marisa также изучался в качестве средства борьбы с сорняками в Пуэрто-Рико и Флориде, а также в качестве биологического средства борьбы с промежуточным хозяином Schistosoma mansoni 9.0614 . Немного зная о Marisa cornuarietis , вы сможете лучше понять, как он используется в различных лабораторных и полевых условиях.
Marisa cornuarietis , гигантская улитка-баран, имеет половой диморфизм с диаметром раковины от 40 до 50 мм (Selck et al. 2006). Эта всеядная пресноводная улитка обитает в различных местах Карибского бассейна, а также в Центральной и Южной Америке. Селк и др. (2006) исследовали пищевые предпочтения Marisa и обнаружил, что он может выдержать голод в зависимости от содержания питательных веществ в том, что он ест. Подразумевается, что Мариса может лучше выживать в различных средах обитания, что позволяет использовать его в качестве контрольного агента в более широком диапазоне. Marisa также изучался в качестве средства борьбы с сорняками в Пуэрто-Рико и Флориде, а также в качестве биологического средства борьбы с промежуточным хозяином Schistosoma mansoni 9.0614 . Немного зная о Marisa cornuarietis , вы сможете лучше понять, как он используется в различных лабораторных и полевых условиях. , 1956). Выращенные в лаборатории образцы улиток Australorbis содержались в аквариумах, а образцов Marisa содержались в отдельных резервуарах. В одном контейнере было замечено, что Australorbis откладывали яйца на растительность. Мариса , которая также находилась в этом контейнере, поедала кресс-салат, на котором были отложены яйца, уничтожая яйца в процессе. В нескольких случаях было замечено, что Мариса действительно поедала яичную массу. В другом эксперименте изучалось влияние Marisa на рост Australorbis . Было обнаружено, что в одном и том же контейнере оба вида способны эффективно воспроизводиться без больших негативных последствий со стороны других видов. Различные завершенные исследования показывают, что Мариса не потребляет Австралорбис целенаправленно. Вместо этого разрушение может быть вызвано случайным употреблением в пищу, когда Мариса ищет пищу (Чернин и др., 1956). Однако, учитывая характер пищевых привычек Marisa , он может быть полезен в полевых условиях в качестве биологического средства борьбы с Australorbis .
, 1956). Выращенные в лаборатории образцы улиток Australorbis содержались в аквариумах, а образцов Marisa содержались в отдельных резервуарах. В одном контейнере было замечено, что Australorbis откладывали яйца на растительность. Мариса , которая также находилась в этом контейнере, поедала кресс-салат, на котором были отложены яйца, уничтожая яйца в процессе. В нескольких случаях было замечено, что Мариса действительно поедала яичную массу. В другом эксперименте изучалось влияние Marisa на рост Australorbis . Было обнаружено, что в одном и том же контейнере оба вида способны эффективно воспроизводиться без больших негативных последствий со стороны других видов. Различные завершенные исследования показывают, что Мариса не потребляет Австралорбис целенаправленно. Вместо этого разрушение может быть вызвано случайным употреблением в пищу, когда Мариса ищет пищу (Чернин и др., 1956). Однако, учитывая характер пищевых привычек Marisa , он может быть полезен в полевых условиях в качестве биологического средства борьбы с Australorbis .

