Диагностика и лечение отека легких у животных, ветцентр Воронцова
Отек легких – это патологическое состояние, при котором жидкая часть крови выпотевает и скапливается в межклеточном пространстве (интерстиции) легких или легочных альвеолах.
Легкие – основной орган дыхательной системы, именно в нем происходит газообмен. Правое и левое легкие образованы окруженными соединительной тканью бронхами, бронхиолами, альвеолярными ходами и альвеолами. Непосредственно газообмен в легких происходит в ацинусах. Это функциональная единица легкого, представленная бронхиолами, альвеолярными ходами и альвеолами. Альвеолы – это пузырьки, через которые идут капилляры, несущие кровь. Внутренняя поверхность альвеол выстлана специфическими эпителиальными клетками – респираторным эпителием. Его клетки тесно прилежат к клеткам кровеносных сосудов, благодаря чему и возможно осуществление обогащения крови кислородом.
Причины отека легких и что происходит
Отек легких может развиваться по 3 основным механизмам:
- Повышенное гидростатическое давление в сосудах малого круга кровообращения (когда при остром повышении давления в капилляре нарушается его проницаемость и жидкая часть крови выходит в интерстициальную ткань легкого).
 Это происходит при различных пороках сердца, кардиомиопатии, эндокардите и других заболеваниях сердца, а также при объемных и быстрых внутривенных инфузиях.
Это происходит при различных пороках сердца, кардиомиопатии, эндокардите и других заболеваниях сердца, а также при объемных и быстрых внутривенных инфузиях. - Снижение онкотического давления крови (в этом случае возникает разница между онкотическим давлением крови и онкотическим давлением межклеточной жидкости, и для того чтобы сравнять эту разницу, жидкость из сосуда выходит во внеклеточное пространство — интерстиций). Такой механизм развивается при гипопротеинемии.
- Повышение проницаемости капиллярно-альвеолярных мембран (в результате какого-либо повреждения нарушается белковая структура капиллярно-альвеолярных мембран с выходом жидкости в интерстициальное пространство). Этот процесс наблюдается при пневмонии, различных интоксикациях, синдроме диссеминированного внутрисосудистого свертывания крови.
Развитию отека легких также может способствовать почечная недостаточность, укус змеи, тепловой удар, электротравма, черепно-мозговая травма.
Виды отека легких
Таким образом учитывая механизм, по которому развивается патология, различают кардиогенный, некардиогенный и смешанный отек легких.
Кардиогенный (так называемый сердечный) отек легких развивается по причине увеличения гидростатического давления в системе малого круга кровообращения, ведущего к возникновению острой левожелудочковой недостаточности. При этом важна любая причина, приводящая к повышению давления в легочной артерии. Быстро нарастающее гидростатическое давление в малом круге кровообращения приводит к патологическому выпотеванию жидкости в легочную ткань, а затем и в альвеолы. Чаще всего кардиогенный отек легких развивается на фоне артериальной гипертензии, кардиосклероза, различных пороков сердца.
Некардиогенный отек легких – это скопление жидкости в интерстициальной ткани легкого и альвеолах, не связанное с заболеванием сердца. Возникает скорее из-за повышения проницаемости капилляров, а не в результате повышения гидростатического давления в отличие от кардиогенного отека легких. Встречается главным образом у собак, реже у кошек. Наиболее распространенные причины включают в себя обструкцию верхних дыхательных путей (паралич гортани, инородные тела, абсцессы), черепно-мозговую травму, отравление дымом, сепсис, анафилактический шок у кошек.
Отек легких симптомы
Отек легких у животных – это критическое состояние, требующее неотложной помощи. Сопровождается заболевание следующими симптомами:
- одышка,
- учащенное дыхание,
- беспокойное поведение,
- цианоз (синюшность) слизистых оболочек ротовой полости,
- обильное выделение пенистой розовой мокроты, которую можно принять за рвотные массы или слюну,
- тахикардия,
- дыхание с открытым ртом у кошек.
Симптомы могут появиться внезапно в зависимости от причины, вызвавшей отек, и приводят к тяжелой дыхательной недостаточности, представляющей угрозу для жизни животного.
Как диагностируют отек легких у кошек и собак
Диагноз основывается на основании клинических признаков, аускультации (прослушивания) легких, данных рентгенографического исследования. При аускультации отмечаются диффузные влажные хрипы. При лабораторных исследованиях крови иногда отмечают лейкоцитоз, гиперазотемию, повышение активности печеночных ферментов.
При эхокардиографическом исследовании можно исключить кардиологические патологии, приводящие к отеку легких.
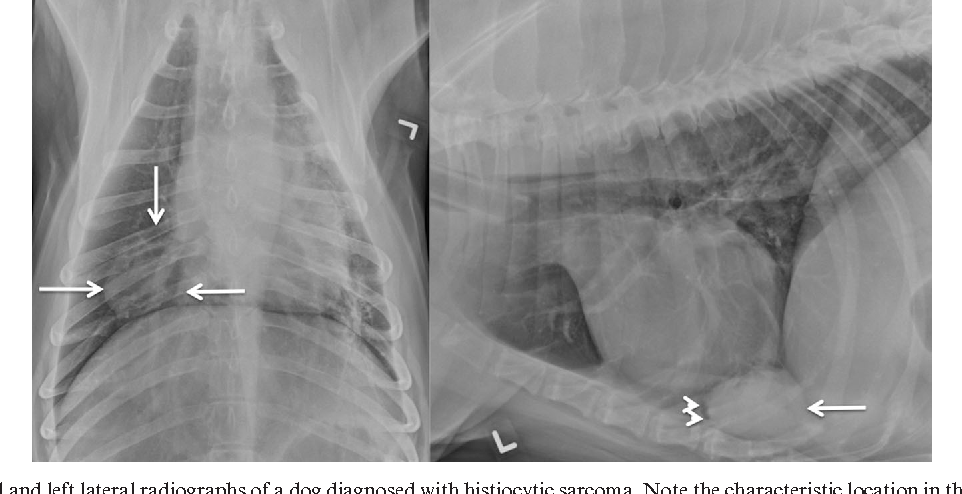
Золотым стандартом диагностики отека легких является рентгенография грудной полости в двух взаимно перпендикулярных проекциях. На рентгеновском снимке выявляют понижение прозрачности легочной ткани, расширение и «размытость» корней легких. Эти изменения могут быть как диффузными и затрагивать все доли легких, так и очаговыми, что встречается реже.
Заболевание дифференцируют от других патологий, сопровождающихся одышкой: коллапс трахеи, паралич гортани, обструкция верхних дыхательных путей, новообразования, тромбоэмболия у кошек.
Отек легких на рентгене у животных
Как лечить отек легких у кошек и собак
Лечение включает в себя:
- ограничение физической активности животного,
- минимизацию стресса,
- оксигенотерапию (ингаляция кислородом),
- медикаментозную поддержку.
Необходимо назначение диуретических препаратов (фуросемид, маннит), глюкокортикоидов (дексаметазон, преднизолон), в некоторых случаях целесообразно использование успокоительных препаратов (ацепромазин).
При некардиогенном отеке легких проводится лечение основного заболевания, в частности лечение гипопротеинемии. Данные мероприятия направлены на купирование дыхательной недостаточности, коррекцию нарастающего кислородного голодания, профилактику шокового состояния.
Интенсивная терапия по поводу отека легких должна проводиться до полной стабилизации состояния животного. Чаще всего таким пациентам требуется стационарное наблюдение для постоянного мониторинга, возможности проведения дополнительных обследований и реанимационных мероприятий в случае ухудшения.
Прогнозы
Выздоровление и прогнозы зависят от основной причины, вызвавшей отек легких. В среднем выздоровление происходит чаще всего в течение 24-72 часов и далее не требует назначения специальной терапии. В тяжелых случаях развивается так называемый респираторный дистресс-синдром, который приводит к гибели животного.
Своевременное обращение за помощью для животных с явлениями одышки и немедленное оказание помощи таким пациентам необходимо для профилактики осложнений и улучшения прогнозов в лечении данного состояния.
Лечение отека легких в ветцентре Воронцова
При любых признаках отека легкого у вашего питомца — срочно обращайтесь к ветеринарному врачу. Ветклиника Воронцова находится в ЮАО, недалеко от пересечения МКАД и Каширского шоссе. Точный адрес: Совхоз им. Ленина, дом 3а (смотрите схему проезда), метро Домодедовская, Орехово, Зябликово, Красногвардейская. Имеется стационар.
ВСЕ ЦЕНЫ И УСЛУГИ
Записывайтесь по телефонам:
+7(495) 740-48-59
+7(936) 001-03-04
Клинико-биохимические и патоморфологические особенности прямого острого повреждения легких у крыс, вызванного интратрахеальным введением липополисахарида Salmonella enterica
Ключевые слова: липополисахарид крысы острое повреждение легких острый респираторный дистресс-синдром биомоделирование
Цель исследования — оценка клинико-биохимических и патоморфологических особенностей прямого острого повреждения легких (ОПЛ) у крыс, вызванного интратрахеальным (и/т) введением липополисахарида (ЛПС) Salmonella enterica в дозе 20 мг/кг (ЛД50).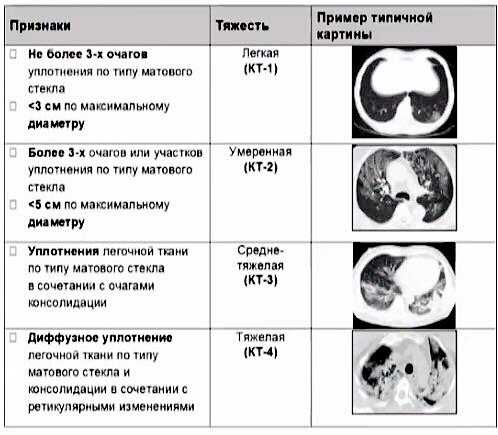
Были использованы 67 белых беспородных крыс-самцов в возрасте 8–12 нед массой тела 310–350 г (питомник «Рапполово», Ленинградская область), которые по методу аналогов были разделены на 2 группы: экспериментальную и контрольную. Экспериментальную работу проводили в два этапа. На первом этапе в течение 4 сут после моделирования ОПЛ исследовали общее состояние животных, измеряли показатели массы и температуры тела, регистрировали динамику гибели животных. В отдельной серии экспериментов изучали характер патоморфологических изменений в ткани легких у крыс. На втором этапе через 3 сут после и/т-введения ЛПС у крыс забирали кровь для проведения лабораторных исследований. Определяли показатели клинического и биохимического анализа крови, изучали гемостазиограмму, а также показатели газового и электролитного состава крови. Кроме этого, исследовали гравиметрические показатели легких (массовый коэффициент легких и степень их влагонасыщения).
Использованная модель ОПЛ характеризовалась снижением массы тела экспериментальных животных в среднем на 15%, стойкой гипотермической реакцией и развитием воспалительных гистоморфологических изменений в ткани легких на 2–3‑и сутки после и/т-введения ЛПС. Гибель животных на фоне ОПЛ регистрировали в течение 12 ч — 3 сут. Значение среднего эффективного времени гибели составило 29,10±3,05 ч.
Гибель животных на фоне ОПЛ регистрировали в течение 12 ч — 3 сут. Значение среднего эффективного времени гибели составило 29,10±3,05 ч.
По данным лабораторных исследований на 3‑и сутки после моделирования ОПЛ у экспериментальных животных отмечали лейкоцитоз, увеличение концентрации растворимых фибрин-мономерных комплексов и фибриногена, гиперкалиемию, гипогликемию, гипоксемию и ацидоз. Указанные изменения лабораторных показателей выявляли на фоне выраженного увеличения массового коэффициента легких и показателя их влагонасыщения, что свидетельствовало о развитии отека легких.
Простота исполнения, высокая воспроизводимость, наличие типовых признаков острого воспалительного повреждения легких, а также доступный набор лабораторных критериев для определения степени выраженности патологического процесса позволяют рекомендовать данную модель ОПЛ для проведения доклинических исследований, направленных на поиск и оценку эффективности кандидатных препаратов для профилактики и лечения острого респираторного дистресс-синдрома.
Введение
Острый респираторный дистресс-синдром (ОРДС) — остро возникающее диффузное воспалительное поражение паренхимы легких, развивающееся как неспецифическая реакция на различные повреждающие факторы и приводящее к формированию острой дыхательной недостаточности (как компонент полиорганной недостаточности) вследствие нарушения структуры и уменьшения массы аэрированной легочной ткани. ОРДС — полиэтиологический синдром, причинами возникновения которого являются как прямые повреждающие факторы (легочная инфекция, аспирационный синдром, утопление, вдыхание токсических веществ, тупая травма груди и др.), так и непрямые (шок, сепсис, политравма, кровопотеря, острый панкреатит, гемотрансфузии, отравления, искусственное кровообращение и т. д.) [1]. В США ежегодно диагностируется порядка 190 000 случаев и 74 000 смертей от ОРДС. Летальность у таких пациентов составляет в среднем около 35–45% в зависимости от причины ОРДС, тяжести его течения и наличия полиорганной недостаточности [2, 3].
В последние годы актуальность ОРДС особенно возросла в связи с периодически возникающими вспышками инфекционных заболеваний, при которых развивается тяжелое острое прямое повреждение легочной ткани [в том числе вызванное вирусами гриппа (А/h2N1 2009 pdm), а также коронавирусами MERS-CoV, SARS-CoV, SARS-CoV-2]. Так, например, большинство случаев тяжело протекающей новой коронавирусной инфекции, связанной с вирусом SARS-CoV-2, сопровождается развитием ОРДС, летальность при котором достигает 60%, что требует интенсивной респираторной и лекарственной терапии [4].
Существует большое количество методик, с помощью которых можно индуцировать прямое острое повреждение легких (ОПЛ) в эксперименте на лабораторных животных. Наиболее часто для воспроизведения ОПЛ используют интратрахеальное (и/т) введение липополисахаридов (ЛПС), соляной кислоты, блеомицина, а также ингаляционное воздействие газовой смесью под избыточным давлением и др. [5]. Идеальные экспериментальные модели ОПЛ должны иметь схожие механизмы развития и исходы с ОРДС, который встречается в клинической практике.
В настоящее время перспективными направлениями являются поиск и разработка экспериментальных моделей ОПЛ, обладающих высокой воспроизводимостью и возможностью применения простых количественных показателей, отражающих степень выраженности патологического процесса. Использование таких биомоделей имеет первостепенную важность при проведении доклинических исследований, направленных на поиск и оценку эффективности кандидатных препаратов для профилактики и лечения ОРДС различной этиологии.
Цель исследования — оценить клинико-биохимические и патоморфологические особенности прямого острого повреждения легких у крыс, вызванного и/т-введением липополисахарида Salmonella enterica.
Материал и методы
Все исследования выполнены с соблюдением принципов Европейской конвенции о защите позвоночных животных, используемых для экспериментов и других научных целей (Страсбург, 1986), в соответствии с правилами надлежащей лабораторной практики и Директивой 2010/63/EU Европейского парламента и Совета Европейского союза от 22 сентября 2010 г. по охране животных, используемых в научных целях. Исследование одобрено локальным этическим комитетом Военно-медицинской академии им. С.М. Кирова, Санкт-Петербург (протокол № 258 от 21.12.21).
по охране животных, используемых в научных целях. Исследование одобрено локальным этическим комитетом Военно-медицинской академии им. С.М. Кирова, Санкт-Петербург (протокол № 258 от 21.12.21).
В работе использованы 67 белых беспородных крыс-самцов в возрасте 8–12 нед массой тела 310–350 г (питомник «Рапполово», Ленинградская область), которые по методу аналогов были разделены на 2 группы: экспериментальную и контрольную. Животных содержали в условиях вивария с соблюдением основных зоогигиенических требований: температурный режим 20–24 °С, 12‑часовой световой день, свободный доступ к корму и воде.
У крыс экспериментальной группы ОПЛ моделировали посредством и/т-ведения ЛПС S. enterica («Sigma-Aldrich») в дозе 20 мг/кг (ЛД50). Объем введения составил 1,5 мл/кг. В качестве растворителя использовали фосфатно-солевой буфер (рН 7,4). Перед выполнением и/т-введения животных наркотизировали с помощью внутрибрюшинного введения препарата «Золетил 100» в дозе 5 мг/кг. Процедуру и/т-введения осуществляли через 5 мин после наркотизации и проверки глубины наркоза с помощью зонда для крыс («MicroSprayer®» Aerosolizer, модель IA-1B, США). Контрольную группу составили животные после и/т-введения фосфатно-солевого буфера в аналогичном объеме.
Процедуру и/т-введения осуществляли через 5 мин после наркотизации и проверки глубины наркоза с помощью зонда для крыс («MicroSprayer®» Aerosolizer, модель IA-1B, США). Контрольную группу составили животные после и/т-введения фосфатно-солевого буфера в аналогичном объеме.
Для выведения из эксперимента животных подвергали комбинированной эвтаназии с помощью передозировки растворов общих анестетиков [растворы препарата «Ксила» (20 мг/мл) и «Золетил 100» (50 мг/мл) в соотношении 1:1 в объеме 1 мл на 1 кг массы тела внутримышечно] и последующего обескровливания.
Эксперимент проводили в два этапа. На первом этапе (n=10) исследовали общее состояние животных, измеряли показатели массы и температуры тела, регистрировали динамику гибели животных. Измерение массы тела крыс осуществляли ежедневно в течение 4 сут в утреннее время с помощью коммерческих весов «AND NP-2000s» (Япония). Температуру тела животных регистрировали, используя ректальный термометр (зонд) «Microtherma ThermoWork» (Великобритания), через 3, 6, 12 ч после и/т-введения ЛПС, далее — ежедневно в течение 4 сут. В отдельной серии экспериментов изучали динамику патоморфологических изменений в ткани легких у крыс в течение 4 сут после моделирования ОПЛ (n=27). Через 3, 6, 12, 24, 48, 72 и 96 ч после и/т-введения ЛПС проводили эвтаназию животных и отбирали образцы ткани легких для гистологического исследования. Аутопсийный материал фиксировали в 10% растворе забуференного формалина и заливали в парафин. Гистологические срезы окрашивали гематоксилином и эозином.
В отдельной серии экспериментов изучали динамику патоморфологических изменений в ткани легких у крыс в течение 4 сут после моделирования ОПЛ (n=27). Через 3, 6, 12, 24, 48, 72 и 96 ч после и/т-введения ЛПС проводили эвтаназию животных и отбирали образцы ткани легких для гистологического исследования. Аутопсийный материал фиксировали в 10% растворе забуференного формалина и заливали в парафин. Гистологические срезы окрашивали гематоксилином и эозином.
На втором этапе исследовали лабораторные показатели у крыс через 3 сут после введения ЛПС. Для этого у контрольных (n=10) и выживших экспериментальных животных (n=9) из каудальной полой вены отбирали пробы крови. Клинический анализ крови выполняли на автоматическом ветеринарном гематологическом анализаторе («Mythic 18 Vet», Швейцария), а биохимический анализ — на автоматическом анализаторе («ChemWell 2910», США). Активированное частичное тромбопластиновое время (АЧТВ), протромбиновое время (ПВ), уровень фибриногена и активность антитромбина III (в %) определяли на полуавтоматическом анализаторе-коагулометре («Tcoag KC 4 Delta», Ирландия) с использованием реагентов «Tcoag» и НПО «Ренам». Уровень растворимых фибрин-мономерных комплексов (РФМК) исследовали в паракоагуляционном фенантролиновом тесте (НПО «Ренам»). Исследование газового и электролитного состава крови проводили при помощи автоматического анализатора «Abbot I-STAT» (Abbot, США). Определяли следующие показатели газового и электролитного состава крови: Na, K, Ca, pH, pCO2, pO2, TCO2, HCO3, BE, sO2.
Уровень растворимых фибрин-мономерных комплексов (РФМК) исследовали в паракоагуляционном фенантролиновом тесте (НПО «Ренам»). Исследование газового и электролитного состава крови проводили при помощи автоматического анализатора «Abbot I-STAT» (Abbot, США). Определяли следующие показатели газового и электролитного состава крови: Na, K, Ca, pH, pCO2, pO2, TCO2, HCO3, BE, sO2.
После обескровливания животного извлекали легочный комплекс для изучения гравиметрических показателей, которые включали определение массового коэффициента легких и степени их влагонасыщения [6].
Статистическую обработку полученных результатов проводили при помощи пакета прикладных программ Graph Pad Prism 8.0. Результаты исследования приведены в виде медианы, верхнего и нижнего квартилей — Me [Q1; Q3]. При сравнении показателей применяли критерий Вилкоксона и U-критерий Манна–Уитни. Различия считали статистически значимыми при р<0,05. Для оценки динамики показателей массы и температуры тела в качестве фоновых значений использовали данные измерений, полученные за день до моделирования ОПЛ. Вероятностную оценку среднеэффективного времени гибели выполняли по методике, предложенной Т.В. Пастушенко [7].
Для оценки динамики показателей массы и температуры тела в качестве фоновых значений использовали данные измерений, полученные за день до моделирования ОПЛ. Вероятностную оценку среднеэффективного времени гибели выполняли по методике, предложенной Т.В. Пастушенко [7].
Результаты и обсуждение
На первом этапе исследования оценивали показатели температуры и массы тела, а также патоморфологические изменения в ткани легких в течение 4 сут после моделирования ОПЛ.
В контрольной группе у животных регистрировали стабильный прирост массы тела в течение всего периода наблюдения, который в итоге составил 7,4% (p<0,05). Измерение температуры тела позволило выявить незначительные колебания показателя, которые не имели статистической значимости. У животных экспериментальной группы в течение 4 сут после и/т-введения ЛПС отмечали снижение массы тела относительно фоновых величин в среднем на 13,4% (p<0,05). Весь период наблюдения регистрировали стойкую гипотермическую реакцию. Уже через 3 ч после моделирования ОПЛ определяли резкое снижение температуры тела на 3,9 °C (p<0,05) относительно фоновых значений. Далее динамика температуры тела характеризовалась постепенным повышением показателя, в результате чего температура тела приближалась к уровню фоновых значений к исходу 4‑х суток наблюдения.
Уже через 3 ч после моделирования ОПЛ определяли резкое снижение температуры тела на 3,9 °C (p<0,05) относительно фоновых значений. Далее динамика температуры тела характеризовалась постепенным повышением показателя, в результате чего температура тела приближалась к уровню фоновых значений к исходу 4‑х суток наблюдения.
Гибель животных после и/т-введения ЛПС регистрировали в течение 12 ч — 3 сут. Значение среднего эффективного времени гибели составило 29,10±3,05 ч.
При оценке патоморфологических изменений через 3 и 6 ч после и/т-введения ЛПС в паренхиме легких экспериментальных животных отмечали развитие выраженного интерстициального и внутриальвеолярного отека, мелкоочаговых кровоизлияний и массивной лейкоцитарной инфильтрации всех структурных компонентов паренхимы органа. Через 12–24 ч более 50% объема легочной паренхимы было представлено безвоздушной тканью с тотальным внутриальвеолярным отеком и крупноочаговыми кровоизлияниями. В отечном паравазальном интерстиции большинства сосудов значительно увеличивались количество и плотность инфильтрата, содержащего нейтрофильные лейкоциты и активные формы макрофагов. На 2–3‑и сутки выявленные ранее патоморфологические изменения прогрессировали. Практически вся паренхима была представлена плотной гомогенной легочной тканью в состоянии альвеолярного отека с экссудатом, насыщенным белками, наличием кровоизлияний различного характера и со скоплением значительного количества сегментоядерных лейкоцитов на фоне дистелектаза. На 4‑е сутки исчезали проявления паравазального отека, а в участках альвеолярных перегородок увеличивалось количество клеточного инфильтрата в виде активных форм макрофагов и лимфоцитов с примесью эозинофильных лейкоцитов. Определяли активацию процессов клеточной репарации эпителия респираторных и воздухоносных путей.
На 2–3‑и сутки выявленные ранее патоморфологические изменения прогрессировали. Практически вся паренхима была представлена плотной гомогенной легочной тканью в состоянии альвеолярного отека с экссудатом, насыщенным белками, наличием кровоизлияний различного характера и со скоплением значительного количества сегментоядерных лейкоцитов на фоне дистелектаза. На 4‑е сутки исчезали проявления паравазального отека, а в участках альвеолярных перегородок увеличивалось количество клеточного инфильтрата в виде активных форм макрофагов и лимфоцитов с примесью эозинофильных лейкоцитов. Определяли активацию процессов клеточной репарации эпителия респираторных и воздухоносных путей.
Выявленная патоморфологическая картина изменений ткани легких у крыс после и/т-введения ЛПС S. enterica определяется как ОПЛ и является характерной для экспериментальных моделей ОРДС [8].
С учетом выявленной стадийности воспалительных изменений при гистологическом исследовании и максимальной выраженности патоморфологических изменений ткани легких все лабораторные исследования проводили на 3‑и сутки после индукции ОПЛ.
При исследовании показателей клинического анализа крови у животных экспериментальной группы установили увеличение количества лейкоцитов (p<0,05) и абсолютного количества моноцитов (p<0,05) в сравнении с показателями контрольных животных (табл. 1).
Анализ гемостазиологических показателей позволил выявить увеличение концентрации РФМК (p<0,05) и фибриногена (p<0,05), что свидетельствовало об активации свертывающей системы и высоком риске развития внутрисосудистого свертывания и тромботических осложнений (табл. 2). Увеличение количества лейкоцитов и фибриногена указывало на формирование системного воспалительного ответа.
При исследовании биохимических показателей у животных экспериментальной группы было выявлено увеличение концентрации калия (p<0,05) и снижение концентрации глюкозы (p<0,05) в крови в сравнении с животными контрольной группы. Более высокие значения уровня калия в экспериментальной группе, вероятнее всего, были связаны с гипоперфузией почек на фоне системной воспалительной реакции, развивающейся после введения ЛПС.
Анализ газового состава венозной крови экспериментальных животных позволил выявить развитие гипоксемии, которая проявлялась в уменьшении парциального напряжения кислорода (pO2; p<0,05) и снижении сатурации (sO2; p<0,05). Кроме этого, наблюдали понижение pH (p<0,05), что свидетельствовало о формировании ацидоза на фоне уменьшения уровня буферных оснований (BE; p<0,05) (табл. 3).
При анализе гравиметрических показателей легких выявлено увеличение массового коэффициента легких в 2,1 раза и повышение их влагонасыщения на 21,7% в сравнении со значениями контрольных животных. Указанные изменения свидетельствовали о развитии экссудативной фазы воспаления после и/т-введения ЛПС, сопровождающейся отеком легочной ткани (табл. 4).
Заключение
В настоящем исследовании использована модель ОПЛ у крыс, вызванная и/т-введением ЛПС S. enterica. На фоне введения ЛПС у экспериментальных животных определены снижение массы тела в среднем на 15% в сравнении с контрольными животными и стойкая гипотермическая реакция, наблюдаемые в течение 4 сут после воздействия. Экспериментальная модель характеризовалась типовой воспалительной реакцией в ткани легких, пик патоморфологических изменений регистрировали на 2–3‑и сутки после моделирования ОПЛ.
Экспериментальная модель характеризовалась типовой воспалительной реакцией в ткани легких, пик патоморфологических изменений регистрировали на 2–3‑и сутки после моделирования ОПЛ.
По данным лабораторных исследований на 3‑и сутки после моделирования ОПЛ у экспериментальных животных определяли лейкоцитоз, увеличение концентрации РФМК и фибриногена, гиперкалиемию, гипогликемию, гипоксемию и ацидоз. Указанные изменения лабораторных показателей происходили на фоне выраженного увеличения массового коэффициента и влагонасыщения легких, что свидетельствовало о развитии отека.
Простота исполнения указанной модели, высокая воспроизводимость и наличие простых клинико-биохимических и патоморфологических показателей позволяют рекомендовать данную модель ОПЛ для проведения доклинических исследований, направленных на поиск и оценку эффективности кандидатных препаратов для профилактики и лечения ОРДС.
Н.И. Волошин — проведение экспериментов, сбор данных, анализ данных, написание рукописи.
В.А. Пугач — проведение экспериментов, сбор данных, анализ данных, написание рукописи.
М.А. Тюнин — критический пересмотр рукописи и утверждение окончательного варианта статьи для публикации.
Е.И. Строкина — экспериментальное моделирование, отбор биоматериала.
В.В. Хижа — проведение лабораторных методов исследования.
А.В. Николаев — разработка концепции исследования и критический пересмотр его содержания.
В.В. Салухов — разработка концепции исследования и критический пересмотр его содержания.
Депрессия левого желудочка и отек легких у крыс после кратковременной нормобарической гипоксии: эффекты адренергической блокады и снижения жидкостной нагрузки активация. Am J Physiol. 1999; 276:L1–L8. doi: 10.1152/ajplung.1999.276.1.L1. [PubMed] [CrossRef] [Google Scholar]
2. Арья С., Белвал С., Униял Б., Тивари Б., Шарма П. Безольд Рефлекс Яриша — новый интерес, старый феномен. Американский журнал внутренней медицины. 2020;8:24 . doi: 10.11648/j.ajim.20200801.15. [Перекрестная ссылка] [Академия Google]
Американский журнал внутренней медицины. 2020;8:24 . doi: 10.11648/j.ajim.20200801.15. [Перекрестная ссылка] [Академия Google]
3. Эшмор Т., Фернандес Б.О., Бранко-Прайс С., Уэст Дж.А., Коуберн А.С., Хизер Л.С., Гриффин Дж.Л., Джонсон Р.С., Филиш М., Мюррей А.Дж. Диетический нитрат увеличивает доступность аргинина и защищает митохондриальный комплекс I и энергетику в гипоксическом сердце крысы. Дж. Физиол. 2014;592:4715–4731. doi: 10.1113/jphysiol.2014.275263. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
4. Bärtsch P, Mairbäurl H, Maggiorini M, Swenson ER. Физиологические аспекты высокогорного отека легких. J Appl Physiol. 2005;98:1101–1110. doi: 10.1152/japplphysiol.01167.2004. [PubMed] [CrossRef] [Google Scholar]
5. Bauersfeld W, Ratge D, Knoll E, Wisser H. Определение катехоламинов в плазме с помощью ВЭЖХ и амперометрического обнаружения. Сравнение с радиоферментным методом. J Clin Chem Clin Biochem. 1986; 24: 185–188. [PubMed] [Google Scholar]
6. Bölter C, Gabriel P, Appelt P, Salameh A, Schierle K, Rassler B. Влияние адренергических агонистов и антагонистов на сердечно-легочную функцию во время нормобарической гипоксии у крыс. Фронт Физиол. 2019;10:860. doi: 10.3389/fphys.2019.00860. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Bölter C, Gabriel P, Appelt P, Salameh A, Schierle K, Rassler B. Влияние адренергических агонистов и антагонистов на сердечно-легочную функцию во время нормобарической гипоксии у крыс. Фронт Физиол. 2019;10:860. doi: 10.3389/fphys.2019.00860. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Briest W, Rassler B, Deten A, Leicht M, Morwinski R, Neichel D, Wallukat G, Ziegelhoeffer T, Zimmer HG. Индуцированное норэпинефрином увеличение интерлейкина-6 в сердцах крыс: дифференциальная передача сигнала в миоцитах и немиоцитах. Pflügers Arch Eur J Physiol. 2003; 446: 437–446. doi: 10.1007/s00424-003-1043-x. [PubMed] [CrossRef] [Google Scholar]
8. Broaddus VC, Wiener-Kronish JP, Staub NC. Расхождение отека легких в плевральную полость у наркотизированных овец с объемной нагрузкой. J Appl Physiol. 1990;68:2623–2630. doi: 10.1152/jappl.1990.68.6.2623. [PubMed] [CrossRef] [Google Scholar]
9. Campen MJ, Shimoda LA, O’Donnell CP. Острые и хронические сердечно-сосудистые эффекты перемежающейся гипоксии у мышей C57BL/6J. J Appl Physiol. 2005;99:2028–2035. doi: 10.1152/japplphysiol.00411.2005. [PubMed] [CrossRef] [Google Scholar]
J Appl Physiol. 2005;99:2028–2035. doi: 10.1152/japplphysiol.00411.2005. [PubMed] [CrossRef] [Google Scholar]
10. Коэн Дж. Учебник по силе. Психологический бык. 1992; 112: 155–159. doi: 10.1037/0033-2909.112.1.155. [PubMed] [CrossRef] [Google Scholar]
11. Colice GL, Matthay MA, Bass E, Matthay RA. Нейрогенный отек легких. Ам преподобный Респир Дис. 1984;130:941–948. doi: 10.1164/arrd.1984.130.5.941. [PubMed] [CrossRef] [Google Scholar]
12. Dai J, Chen SJ, Yang BS, Lü SM, Zhu M, Xu YF, Chen J, Cai HW, Mao W. Рецидив некардиогенного отека легких и устойчивый Гипотензивный шок при кистозной феохромоцитоме. J Zhejiang Univ Sci B. 2017; 18: 449–452. doi: 10.1631/jzus.B1600411. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
13. Dart C, Standen NB. Активация АТФ-зависимых К+-каналов гипоксией в гладкомышечных клетках, выделенных из коронарной артерии свиньи. Дж. Физиол. 1995;483:29–39. doi: 10.1113/jphysiol.1995.sp020565. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
14. de Burgh DM, Scott JM. Анализ первичных сердечно-сосудистых рефлекторных эффектов стимуляции хеморецепторов каротидных телец у собак. Дж. Физиол. 1962; 162: 555–573. doi: 10.1113/jphysiol.1962.sp006950. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
de Burgh DM, Scott JM. Анализ первичных сердечно-сосудистых рефлекторных эффектов стимуляции хеморецепторов каротидных телец у собак. Дж. Физиол. 1962; 162: 555–573. doi: 10.1113/jphysiol.1962.sp006950. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Диненно Ф.А. Вазодилатация скелетных мышц при системной гипоксии у человека. J Appl Physiol. 2016;120:216–225. doi: 10.1152/japplphysiol.00256.2015. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
16. Duplain H, Vollenweider L, Delabays A, Nicod P, Bärtsch P, Scherrer U. Повышенная симпатическая активация во время кратковременной гипоксии и высокогорного воздействия у субъектов, предрасположенных к высокогорному отеку легких. Тираж. 1999; 99: 1713–1718. doi: 10.1161/01.CIR.99.13.1713. [PubMed] [CrossRef] [Google Scholar]
17. Haditsch B, Roessler A, Krisper P, Frisch H, Hinghofer-Szalkay HG, Goswami N. Регуляция объема и функция почек на большой высоте в зависимости от пола. ПЛОС ОДИН. 2015;10:e0118730. doi: 10.1371/journal.pone.0118730. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2015;10:e0118730. doi: 10.1371/journal.pone.0118730. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
18. Hildebrandt W, Ottenbacher A, Schuster M, Swenson ER, Bärtsch P. Диуретический эффект гипоксии, гипокапнии и гиперпноэ у людей: связь с гормонами и хемочувствительностью к O2. J Appl Physiol. 2000; 88: 591–610. doi: 10.1152/jappl.2000.88.2.599. [PubMed] [CrossRef] [Google Scholar]
19. Холлоуэй С., Кохлин Л., Кодряну И., Блох Э., Фатемиан М., Шмигельски С., Атертон Х., Хизер Л., Фрэнсис Дж., Нойбауэр С., Роббинс П., Монтгомери Х., Кларк К. Нормобарическая гипоксия нарушает энергетику сердца человека. FASEB J. 2011; 25:3130–3135. дои: 10.1096/fj.11-183426. [PubMed] [CrossRef] [Google Scholar]
20. Hu CT, Wu CY, Chen HI. Бета-адренергические механизмы артериальной гемодинамики: сравнение нормотензивных и гипертензивных крыс. J биомедицинских наук. 1996; 3: 286–292. doi: 10.1007/BF02253709. [PubMed] [CrossRef] [Google Scholar]
21. Kubo K, Hanaoka M, Hayano T, Miyahara T, Hachiya T, Hayasaka M, Koizumi T, Fujimoto K, Kobayashi T, Honda T. Воспалительные цитокины в жидкости БАЛ и Легочная гемодинамика при высокогорном отеке легких. Респир Физиол. 1998;111:301–310. doi: 10.1016/S0034-5687(98)00006-1. [PubMed] [CrossRef] [Google Scholar]
Воспалительные цитокины в жидкости БАЛ и Легочная гемодинамика при высокогорном отеке легких. Респир Физиол. 1998;111:301–310. doi: 10.1016/S0034-5687(98)00006-1. [PubMed] [CrossRef] [Google Scholar]
22. Lesske J, Fletcher EC, Bao G, Unger T. Гипертония, вызванная хронической перемежающейся гипоксией – влияние хеморецепторов и симпатической нервной системы. Дж Гипертензия. 1997; 15:1593–1603. doi: 10.1097/00004872-199715120-00060. [PubMed] [CrossRef] [Google Scholar]
23. Leuenberger U, Gleeson K, Wroblewski K, Prophet S, Zelis R, Zwillich C, Sinoway L. Клиренс норадреналина увеличивается во время острой гипоксемии у людей. Am J Physiol. 1991;261:h2659–h2664. doi: 10.1152/ajpheart.1991.261.5.h2659. [PubMed] [CrossRef] [Google Scholar]
24. Леви СП. Блокаторы бета-адренорецепторов при спонтанной артериальной гипертензии. Am J Med. 1976; 61: 779–789. doi: 10.1016/0002-9343(76)
25. Loeh B, Baloglu E, Ke A, Bärtsch P, Mairbäurl H. Бета2-адренергическая стимуляция притупляет ингибирование транспорта эпителиальных ионов при гипоксии альвеолярных эпителиальных клеток крысы. Cell Physiol Biochem. 2010;25:123–134. дои: 10.1159/000272057. [PubMed] [CrossRef] [Google Scholar]
Бета2-адренергическая стимуляция притупляет ингибирование транспорта эпителиальных ионов при гипоксии альвеолярных эпителиальных клеток крысы. Cell Physiol Biochem. 2010;25:123–134. дои: 10.1159/000272057. [PubMed] [CrossRef] [Google Scholar]
26. Луи Э.К., Рич С., Брандейдж Б.Х. Допплерэхокардиографическая оценка нарушения наполнения левого желудочка у пациентов с перегрузкой правого желудочка давлением вследствие первичной легочной гипертензии. J Am Coll Кардиол. 1986; 8: 1298–1306. doi: 10.1016/S0735-1097(86)80300-X. [PubMed] [CrossRef] [Google Scholar]
27. Lu WH, Chen HH, Chen BH, Lee JC, Lai CC, Li CH, Tseng CJ. Норадреналин приводит к большей сердечно-легочной токсичности, чем адреналин, из-за передозировки катехоламинов у крыс. Токсики. 2020;8:69. doi: 10.3390/toxics8030069. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Madjdpour C, Jewell UR, Kneller S, Ziegler U, Schwendener R, Booy C, Kläusli L, Pasch T, Schimmer RC, Beck-Schimmer B , Снижение альвеолярного кислорода вызывает воспаление легких. Am J Physiol Lung Cell Mol Physiol. 2003; 284:L360–L367. doi: 10.1152/ajplung.00158.2002. [PubMed] [CrossRef] [Google Scholar]
Am J Physiol Lung Cell Mol Physiol. 2003; 284:L360–L367. doi: 10.1152/ajplung.00158.2002. [PubMed] [CrossRef] [Google Scholar]
29. Maggiorini M, Mélot C, Pierre S, Pfeiffer F, Greve I, Sartori C, Lepori M, Hauser M, Scherrer U, Naeije R. Высотный отек легких первоначально вызвано повышением капиллярного давления. Тираж. 2001;103:2078–2083. doi: 10.1161/01.CIR.103.16.2078. [PubMed] [CrossRef] [Академия Google]
30. Маршалл Дж.М., Меткалф Дж.Д. Анализ сердечно-сосудистых изменений, индуцированных у крыс различными уровнями системной гипоксии. Дж. Физиол. 1988; 407: 385–403. doi: 10.1113/jphysiol.1988.sp017422. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
31. Matthay MA, Folkesson HG, Clerici C. Транспорт эпителиальной жидкости легких и разрешение отека легких. Physiol Rev. 2002; 82: 569–600. doi: 10.1152/physrev.00003.2002. [PubMed] [CrossRef] [Google Scholar]
32. Негрини Д., Пасси А., де Лука Г., Мизерокки Г. Легочное интерстициальное давление и протеогликаны при развитии отека легких. Am J Physiol Heart Circul Physiol. 1996;270:h3000–h3007. doi: 10.1152/ajpheart.1996.270.6.h3000. [PubMed] [CrossRef] [Google Scholar]
Am J Physiol Heart Circul Physiol. 1996;270:h3000–h3007. doi: 10.1152/ajpheart.1996.270.6.h3000. [PubMed] [CrossRef] [Google Scholar]
33. Probst RJ, Lim JM, Bird DN, Pole GL, Sato AK, Claybaugh JR. Половые различия в объеме крови крыс Sprague-Dawley в сознании. J Am Assoc Lab Anim Sci. 2006; 45:49–52. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Rachfalska N, Putowski Z, Krzych ŁJ. Отдаленное поражение органов при острой черепно-мозговой травме. наук о мозге. 2020;10:1019. doi: 10.3390/brainsci10121019. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
35. Расслер Б., Барт В., Циммер Х.Г. Транзиторный плевральный выпот у крыс, стимулированных норадреналином. Базовый Рез Кардиол. 2001; 96: 471–477. doi: 10.1007/s003950170029. [PubMed] [CrossRef] [Google Scholar]
36. Расслер Б., Рейссиг С., Брист В., Таннапфель А., Циммер Х.Г. Катехоламин-индуцированный отек легких и плевральный выпот у крыс – альфа- и бета-адренергические эффекты. Респир Физиол Нейробиол.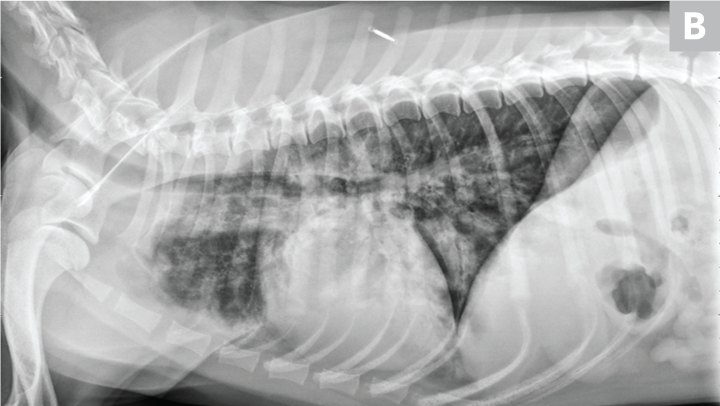 2003; 135: 25–37. doi: 10.1016/S1569-9048(03)00062-4. [PubMed] [CrossRef] [Академия Google]
2003; 135: 25–37. doi: 10.1016/S1569-9048(03)00062-4. [PubMed] [CrossRef] [Академия Google]
37. Расслер Б., Рейссиг С., Брист В., Таннапфель А., Циммер Х.Г. Отек легких и плевральный выпот у стимулированных норадреналином крыс — гемодинамический или воспалительный эффект? Мол Селл Биохим. 2003; 250:55–63. doi: 10.1023/A:1024942132705. [PubMed] [CrossRef] [Google Scholar]
38. Расслер Б., Рейссиг С., Ролинг М.А., Таннапфель А., Венгер Р.Х., Циммер Х.Г. Динамика повреждения легких, вызванного гипоксией, у крыс. Респ Физиол Нейробиол. 2007; 159:45–54. doi: 10.1016/j.resp.2007.05.008. [PubMed] [CrossRef] [Академия Google]
39. Расслер Б., Ролинг М.А., Рейссиг С., Брист В., Таннапфель А., Циммер Х.Г. Участие цитокинов и воспаления в катехоламин-индуцированном повреждении легких у крыс. Vasc Dis Prev. 2005; 2:1–9. doi: 10.2174/1567270052774395. [CrossRef] [Google Scholar]
40. Rohlicek CV, Matsuoka T, Saiki C. Реакция сердечно-сосудистой системы на острую гипоксемию у взрослых крыс с гипоксемией в неонатальном периоде. Кардиовасц Рез. 2002; 53: 263–270. doi: 10.1016/S0008-6363(01)00475-8. [PubMed] [CrossRef] [Академия Google]
Кардиовасц Рез. 2002; 53: 263–270. doi: 10.1016/S0008-6363(01)00475-8. [PubMed] [CrossRef] [Академия Google]
41. Rumsey WL, Abbott B, Bertelsen D, Mallamaci M, Hagan K, Nelson D, Erecinska M. Адаптация к гипоксии изменяет энергетический обмен в сердце крысы. Am J Physiol. 1999;276:H71–H80. doi: 10.1152/ajpheart.1999.276.1.H71. [PubMed] [CrossRef] [Google Scholar]
42. Šedý J, Kuneš J, Zicha J. Патогенетические механизмы нейрогенного отека легких. J Нейротравма. 2015;32:1135–1145. doi: 10.1089/neu.2014.3609. [PubMed] [CrossRef] [Google Scholar]
43. Tan KS, Nackley AG, Satterfield K, Maixner W, Diatchenko L, Flood PM. Активация бета2-адренергических рецепторов стимулирует выработку провоспалительных цитокинов в макрофагах через PKA- и NF-kappaB-независимые механизмы. Сотовый сигнал. 2007;19: 251–260. doi: 10.1016/j.cellsig.2006.06.007. [PubMed] [CrossRef] [Google Scholar]
44. Thorén PN. Характеристики рецепторов левого желудочка с немедулированными афферентами блуждающего нерва у кошек. Цирк рез. 1977; 40: 415–421. doi: 10.1161/01.res.40.4.415. [PubMed] [CrossRef] [Google Scholar]
Цирк рез. 1977; 40: 415–421. doi: 10.1161/01.res.40.4.415. [PubMed] [CrossRef] [Google Scholar]
45. Уолли К.Р., Беккер С.Дж., Хоган Р.А., Теплинский К., Вуд Л.Д. Прогрессирующая гипоксемия ограничивает потребление кислорода и сократительную способность левого желудочка. Цирк Рез. 1988; 63: 849–859. doi: 10.1161/01.res.63.5.849. [PubMed] [CrossRef] [Google Scholar]
46. Wiener-Kronish JP, Matthay MA, Callen PW, Filly RA, Gamsu G, Staub NC. Связь плевральных выпотов с легочной гемодинамикой у больных с застойной сердечной недостаточностью. Ам преподобный Респир Дис. 1985; 132: 1253–1256. doi: 10.1164/arrd.1985.132.6.1253. [PubMed] [CrossRef] [Google Scholar]
47. Wolf FW, Marks RM, Sarma V, Byers MG, Katz RW, Shows TB, Dixit VM. Характеристика нового гена первичного ответа эндотелия, индуцированного фактором некроза опухоли-альфа. Дж. Биол. Хим. 1992;267:1317–1326. doi: 10.1016/S0021-9258(18)48432-3. [PubMed] [CrossRef] [Google Scholar]
48. Y-Hassan S, Falhammar H, Сердечно-сосудистые проявления и осложнения феохромоцитом и параганглиом. Дж. Клин Мед. 2020;9:2435. doi: 10.3390/jcm9082435. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Дж. Клин Мед. 2020;9:2435. doi: 10.3390/jcm9082435. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
49. Yamamoto H, Kawada T, Shimizu S, Hayama Y, Shishido T, Iwanaga Y, Fukuda K, Miyazaki S, Sugimachi M. Острые последствия внутривенного введения карведилол по сравнению с метопрололом на опосредованную барорефлексом регуляцию симпатического кровообращения у крыс. Int J Кардиол. 2019;285:65–71. doi: 10.1016/j.ijcard.2019.02.062. [PubMed] [CrossRef] [Google Scholar]
50. Zucker IH. Рецепторы левого желудочка: физиологические регуляторы или патологические диковинки? Базовый Рез Кардиол. 1986; 81: 539–557. doi: 10.1007/BF02005179. [PubMed] [CrossRef] [Google Scholar]
Оценка повреждения легких у крыс и мышей
Обзор
. 2004 г., февраль; 286 (2): L231-46.
doi: 10.1152/ajplung.00049.2003.
Джеймс Паркер 1 , Мэри I Таунсли
принадлежность
- 1 Кафедра физиологии, MSB 3074, Университет Южной Алабамы, Мобил, AL 36688-0002, США.
 [email protected]
[email protected]
- PMID: 14711798
- DOI: 10.1152/ajplung.00049.2003
Бесплатная статья
Обзор
James C Parker et al. Am J Physiol Lung Cell Mol Physiol. 2004 Февраль
Бесплатная статья
. 2004 г., февраль; 286 (2): L231-46.
doi: 10.1152/ajplung.00049.2003.
Авторы
Джеймс Паркер 1 , Мэри I Таунсли
принадлежность
- 1
 [email protected]
[email protected]
- PMID: 14711798
- DOI: 10.1152/ajplung.00049.2003
Абстрактный
Повреждение легкого — это широкий дескриптор, который можно применять к состояниям, начиная от легкого интерстициального отека без повреждения клеток и заканчивая массивным и фатальным разрушением легкого. В этом обзоре рассматриваются те методы, которые могут быть легко применены к крысам и мышам, чей небольшой размер ограничивает методы, которые можно практически использовать для оценки повреждений. Используемые методологии варьируются от неспецифического измерения образования отека до методов расчета значений удельного коэффициента проницаемости микрососудистой мембраны легких. Накопление отека легких легко и количественно измеряется гравиметрическими методами и свидетельствует о дисбалансе фильтрационных сил или рестриктивных свойствах микрососудистого барьера.
Похожие статьи
Фенотипическая гетерогенность легочных капилляров и экстраальвеолярных эндотелиальных клеток.
 Повышенной экстраальвеолярной эндотелиальной проницаемости достаточно для снижения комплаентности.
Повышенной экстраальвеолярной эндотелиальной проницаемости достаточно для снижения комплаентности.Лоу К., Альварес Д., Кинг Дж., Стивенс Т. Лоу К. и др. J Surg Res. 2007 ноябрь; 143(1):70-7. doi: 10.1016/j.jss.2007.03.047. J Surg Res. 2007. PMID: 17950075 Бесплатная статья ЧВК.
Острое повреждение легких и проницаемость легочных сосудов: использование трансгенных моделей.
Паркер Дж.К. Паркер Дж. сост. физиол. 2011 Апрель; 1 (2): 835-82. doi: 10.1002/cphy.c100013. сост. физиол. 2011. PMID: 23737205 Обзор.
Изопротеренол снижает проницаемость белка в отечных изолированных легких кролика: оценка PS и сигма.
Kreienberg PB, Vincent PA, Bell DR, Saba TM, Minnear FL.
 Крайенберг П.Б. и соавт.
J Appl Physiol (1985). 1994 г., июль; 77 (1): 325–31. doi: 10.1152/jappl.1994.77.1.325.
J Appl Physiol (1985). 1994.
PMID: 7961254
Крайенберг П.Б. и соавт.
J Appl Physiol (1985). 1994 г., июль; 77 (1): 325–31. doi: 10.1152/jappl.1994.77.1.325.
J Appl Physiol (1985). 1994.
PMID: 7961254Региональные измерения отека легких с помощью магнитно-резонансной томографии.
Caruthers SD, Paschal CB, Pou NA, Roselli RJ, Harris TR. Карутерс С.Д. и соавт. J Appl Physiol (1985). 1998 г., июнь; 84 (6): 2143-53. doi: 10.1152/jappl.1998.84.6.2143. J Appl Physiol (1985). 1998. PMID: 9609811
Повреждение легких, связанное с ИВЛ, снижает способность легких устранять отек у крыс.
Лекуона Э., Салдиас Ф., Комельяс А., Ридж К., Герреро С., Шнайдер Д.И. Лекуона Э. и др. Am J Respir Crit Care Med.
 1999 г., февраль; 159(2):603-9. дои: 10.1164/ajrccm.159.2.9805050.
Am J Respir Crit Care Med. 1999.
PMID: 9927379
1999 г., февраль; 159(2):603-9. дои: 10.1164/ajrccm.159.2.9805050.
Am J Respir Crit Care Med. 1999.
PMID: 9927379
Посмотреть все похожие статьи
Цитируется
Повреждение шейного отдела спинного мозга приводит к повреждению и изменению метаболизма в легких.
Хаффман Э.Е., Донг Б.Е., Кларк Х.А., Янг Л.А., Джентри М.С., Эллисон Д.Б., Сан Р.К., Уотерс К.М., Алилайн В.Дж. Хаффман Э.Е. и др. Мозговая коммуна. 2023 28 марта; 5 (2): fcad091. doi: 10.1093/braincomms/fcad091. Электронная коллекция 2023. Мозговая коммуна. 2023. PMID: 37065091 Бесплатная статья ЧВК.
Создание модели заболевания легких, вызванного искусственными твердыми частицами, путем анализа патологических изменений и транскриптомных профилей у мышей.
Ким Ди, Сон М.К., Юк Ч.Е., Сео Х.Дж., Ли К. Ким Д.И. и др. Научный представитель 2023 12 апреля; 13 (1): 5955. дои: 10.1038/s41598-023-29919-9. Научный представитель 2023. PMID: 37045933 Бесплатная статья ЧВК.
Отцовская диета с рыбьим жиром уменьшает воспаление легких в мышиной модели новой бронхолегочной дисплазии, вызванной токсикантами.
Румф Дж.Т., Стивенс В.Р., Амели С., Браун Л.К., Рэйфорд К.Дж., Нде П.Н., Остин К.Г., Брунер-Тран К.Л. Румф Дж.Т. и др. Мар Наркотики. 2023 27 февраля; 21 (3): 161. дои: 10.3390/md21030161. Мар Наркотики. 2023. PMID: 36976210 Бесплатная статья ЧВК.
Век физиологии упражнений: баланс жидкости в легких во время и после упражнений.
 Это происходит при различных пороках сердца, кардиомиопатии, эндокардите и других заболеваниях сердца, а также при объемных и быстрых внутривенных инфузиях.
Это происходит при различных пороках сердца, кардиомиопатии, эндокардите и других заболеваниях сердца, а также при объемных и быстрых внутривенных инфузиях.