Неон, свойства атома, химические и физические свойства
Неон, свойства атома, химические и физические свойства.
Ne 10 Неон
20,1797(6) 1s2 2s2 2p6
Неон — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 10. Расположен в 18-й группе (по старой классификации — главной подгруппе восьмой группы), втором периоде периодической системы.
Атом и молекула неона. Формула неона. Строение атома неона
Изотопы и модификации неона
Свойства неона (таблица): температура, плотность, давление и пр.
Физические свойства неона
Химические свойства неона. Взаимодействие неона. Химические реакции с неоном
Получение неона
Применение неона
Таблица химических элементов Д.И. Менделеева
Атом и молекула неона. Формула неона. Строение атома неона:
Неон (лат. Neon, от греч. νέος – «новый») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Ne и атомным номером 10. Расположен в 18-й группе (по старой классификации – главной подгруппе восьмой группы), втором периоде периодической системы.
И. Менделеева с обозначением Ne и атомным номером 10. Расположен в 18-й группе (по старой классификации – главной подгруппе восьмой группы), втором периоде периодической системы.
Неон – неметалл. Относится к группе инертных (благородных) газов.
Неон обозначается символом Ne.
Как простое вещество неон при нормальных условиях представляет собой инертный одноатомный газ без цвета, вкуса и запаха.
Молекула неона одноатомна.
Химическая формула неона Ne.
Электронная конфигурация атома неона 1s2 2s2 2p6. Потенциал ионизации (первый электрон) атома неона равен 2080,66 кДж/моль (21,564540(7) эВ).
Строение атома неона. Атом неона состоит из положительно заряженного ядра (+10), вокруг которого по двум оболочкам движется 10 электронов. При этом 2 электрона находятся на внутреннем уровне, а 8 электронов – на внешнем. Поскольку неон расположен во втором периоде, оболочек всего две. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внешняя оболочка представлены s- и р-орбиталями. На внешнем энергетическом уровне атома неона на 2s-орбитали находятся два спаренных электрона, на 2p-орбитали находятся шесть спаренных электрона. В свою очередь ядро атома неона состоит из 10 протонов и 10 нейтронов. Неон относится к элементам p-семейства.
Радиус атома неона (вычисленный) составляет 38 пм.
Атомная масса атома неона составляет 20,1797(6) а. е. м.
Неон – пятый по распространённости элемент Вселенной после водорода, гелия, кислорода и углерода. Содержание неона в земной коре составляет 3,0×10-7 %, в морской воде и океане – 1,2×10-8 %.
Неон – химически инертный химический элемент.
Неон, свойства атома, химические и физические свойства
Изотопы и модификации неона:
Свойства неона (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Неон |
| 102 | Прежнее название | |
| 103 | Латинское название | Neon |
| 104 | Английское название | Neon |
| 105 | Символ | Ne |
| 106 | Атомный номер (номер в таблице) | 10 |
| 107 | Тип | Неметалл |
| 108 | Группа | Инертный (благородный) газ |
| 109 | Открыт | Уильям Рамзай и Моррис Уильям Траверс, Великобритания, 1898 г. |
| 110 | Год открытия | 1898 г. |
| 111 | Внешний вид и пр. | Инертный газ без цвета, запаха и вкуса |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0,0014 % |
| 119 | Содержание в земной коре (по массе) | 3,0·10-7 % |
| 120 | Содержание в морях и океанах (по массе) | 1,2·10-8 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,13 % |
| 122 | Содержание в Солнце (по массе) | 0,1 % |
| 123 | Содержание в метеоритах (по массе) | |
| 124 | Содержание в организме человека (по массе) | |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 20,1797(6) а. е. м. (г/моль) е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 |
| 203 | Электронная оболочка | K2 L8 M0 N0 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 38 пм |
| 205 | Эмпирический радиус атома | |
| 206 | Ковалентный радиус | 58 пм |
| 207 | Радиус иона (кристаллический) | |
| 208 | Радиус Ван-дер-Ваальса | 154 пм |
| 209 | Электроны, Протоны, Нейтроны | 10 электронов, 10 протонов, 10 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 2 |
| 212 | Группа в периодической таблице | 18-ая группа (по старой классификации – главная подгруппа 8-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | 0 |
| 302 | Валентность | 0 |
| 303 | Электроотрицательность | 4,4 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 2080,66 кДж/моль (21,564540(7) эВ) |
| 305 | Электродный потенциал | 0 В |
| 306 | Энергия сродства атома к электрону | -116(19) кДж/моль (-1,2(2) эВ) – предположительно |
| 400 | Физические свойства | |
| 401 | Плотность* | 0,00090035 г/см3 (при 0 °C и 101,325 кПа, состояние вещества – газ), 0,00090035 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – газ), 1,204 г/см3 (при температуре кипения -246 °C и иных стандартных условиях, состояние вещества – жидкость), 1,444 г/см3 (при температуре плавления -248,49 °C и иных |
| 402 | Температура плавления* | -248,59 °C (24,56 K, -415,46 °F) |
| 403 | Температура кипения* | -246,046 °C (27,104 K, -410,883 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 0,335 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 1,71 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость | 20,79 Дж/(K·моль) |
| 411 | Молярный объём | 22,42 см³/моль |
| 412 | Теплопроводность | 0,0491 Вт/(м·К) (при стандартных условиях), 0,0493 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая гранецентрированная
|
| 513 | Параметры решётки | 4,430 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 63 К |
| 516 | Название пространственной группы симметрии | Fm_ 3m |
| 517 | Номер пространственной группы симметрии | 225 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS |
Примечание:
401* Плотность неона согласно [1] составляет 1,207 г/см3 (при -246,046 °C и иных стандартных условиях, состояние вещества – жидкость).
402* Температура плавления неона согласно [3] составляет -248,6 °C (24,55 K, -415,48 °F).
403* Температура кипения неона согласно [3] составляет -246,05 °C (27,1 K, -410,89 °F).
407* Удельная теплота плавления (энтальпия плавления ΔHпл) неона согласно [4] составляет 0,33 кДж/моль.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) кислорода согласно [3] и [4] составляет 1,74 кДж/моль и 1,79 кДж/моль соответственно.
Физические свойства неона:
Химические свойства неона. Взаимодействие неона. Химические реакции с неоном:
Получение неона:
Применение неона:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10.
 Неон
Неон - 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44.
 Рутений
Рутений - 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78.
 Платина
Платина - 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110.
 Дармштадтий
Дармштадтий - 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Neon
- https://de.wikipedia.org/wiki/Neon
- https://ru.wikipedia.org/wiki/Неон
- http://chemister.ru/Database/properties.php?dbid=1&id=220
- https://chemicalstudy.ru/neon-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: © Фото https://www.pexels.com, https://pixabay.com
неон атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле неона
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности 2 911
Neon — Wikipedia
This article is about the chemical element. For other uses, see Neon (disambiguation).
For other uses, see Neon (disambiguation).
Neon is a chemical element with the symbol Ne and atomic number 10. It is a noble gas.[10] Neon is a colorless, odorless, inert monatomic gas under standard conditions, with about two-thirds the density of air. It was discovered (along with krypton and xenon) in 1898 as one of the three residual rare inert elements remaining in dry air, after nitrogen, oxygen, argon and carbon dioxide were removed. Neon was the second of these three rare gases to be discovered and was immediately recognized as a new element from its bright red emission spectrum. The name neon is derived from the Greek word, νέον, neuter singular form of νέος (neos), meaning ‘new’. Neon is chemically inert, and no uncharged neon compounds are known. The compounds of neon currently known include ionic molecules, molecules held together by van der Waals forces and clathrates.
During cosmic nucleogenesis of the elements, large amounts of neon are built up from the alpha-capture fusion process in stars. Although neon is a very common element in the universe and solar system (it is fifth in cosmic abundance after hydrogen, helium, oxygen and carbon), it is rare on Earth. It composes about 18.2 ppm of air by volume (this is about the same as the molecular or mole fraction) and a smaller fraction in Earth’s crust. The reason for neon’s relative scarcity on Earth and the inner (terrestrial) planets is that neon is highly volatile and forms no compounds to fix it to solids. As a result, it escaped from the planetesimals under the warmth of the newly ignited Sun in the early Solar System. Even the outer atmosphere of Jupiter is somewhat depleted of neon, although for a different reason.[11]
Although neon is a very common element in the universe and solar system (it is fifth in cosmic abundance after hydrogen, helium, oxygen and carbon), it is rare on Earth. It composes about 18.2 ppm of air by volume (this is about the same as the molecular or mole fraction) and a smaller fraction in Earth’s crust. The reason for neon’s relative scarcity on Earth and the inner (terrestrial) planets is that neon is highly volatile and forms no compounds to fix it to solids. As a result, it escaped from the planetesimals under the warmth of the newly ignited Sun in the early Solar System. Even the outer atmosphere of Jupiter is somewhat depleted of neon, although for a different reason.[11]
Neon gives a distinct reddish-orange glow when used in low-voltage neon glow lamps, high-voltage discharge tubes and neon advertising signs.[12][13] The red emission line from neon also causes the well known red light of helium–neon lasers. Neon is used in some plasma tube and refrigerant applications but has few other commercial uses. It is commercially extracted by the fractional distillation of liquid air. Since air is the only source, it is considerably more expensive than helium.
It is commercially extracted by the fractional distillation of liquid air. Since air is the only source, it is considerably more expensive than helium.
Contents
- 1 History
- 2 Isotopes
- 3 Characteristics
- 4 Occurrence
- 5 Chemistry
- 6 Production
- 6.1 2022 shortage
- 7 Applications
- 7.1 Semiconductor industry
- 8 See also
- 9 References
- 10 External links
History[edit]
Neon gas-discharge lamps forming the symbol for neon
Neon was discovered in 1898 by the British chemists Sir William Ramsay (1852–1916) and Morris Travers (1872–1961) in London.[14] Neon was discovered when Ramsay chilled a sample of air until it became a liquid, then warmed the liquid and captured the gases as they boiled off. The gases nitrogen, oxygen, and argon had been identified, but the remaining gases were isolated in roughly their order of abundance, in a six-week period beginning at the end of May 1898. First to be identified was krypton. The next, after krypton had been removed, was a gas which gave a brilliant red light under spectroscopic discharge. This gas, identified in June, was named «neon», the Greek analogue of the Latin novum (‘new’)[15] suggested by Ramsay’s son. The characteristic brilliant red-orange color emitted by gaseous neon when excited electrically was noted immediately. Travers later wrote: «the blaze of crimson light from the tube told its own story and was a sight to dwell upon and never forget.»[16]
First to be identified was krypton. The next, after krypton had been removed, was a gas which gave a brilliant red light under spectroscopic discharge. This gas, identified in June, was named «neon», the Greek analogue of the Latin novum (‘new’)[15] suggested by Ramsay’s son. The characteristic brilliant red-orange color emitted by gaseous neon when excited electrically was noted immediately. Travers later wrote: «the blaze of crimson light from the tube told its own story and was a sight to dwell upon and never forget.»[16]
A second gas was also reported along with neon, having approximately the same density as argon but with a different spectrum – Ramsay and Travers named it metargon.[17][18] However, subsequent spectroscopic analysis revealed it to be argon contaminated with carbon monoxide. Finally, the same team discovered xenon by the same process, in September 1898.[17]
Neon’s scarcity precluded its prompt application for lighting along the lines of Moore tubes, which used nitrogen and which were commercialized in the early 1900s. After 1902, Georges Claude’s company Air Liquide produced industrial quantities of neon as a byproduct of his air-liquefaction business. In December 1910 Claude demonstrated modern neon lighting based on a sealed tube of neon. Claude tried briefly to sell neon tubes for indoor domestic lighting, due to their intensity, but the market failed because homeowners objected to the color. In 1912, Claude’s associate began selling neon discharge tubes as eye-catching advertising signs and was instantly more successful. Neon tubes were introduced to the U.S. in 1923 with two large neon signs bought by a Los Angeles Packard car dealership. The glow and arresting red color made neon advertising completely different from the competition.[19] The intense color and vibrancy of neon equated with American society at the time, suggesting a «century of progress» and transforming cities into sensational new environments filled with radiating advertisements and «electro-graphic architecture».[20][21]
After 1902, Georges Claude’s company Air Liquide produced industrial quantities of neon as a byproduct of his air-liquefaction business. In December 1910 Claude demonstrated modern neon lighting based on a sealed tube of neon. Claude tried briefly to sell neon tubes for indoor domestic lighting, due to their intensity, but the market failed because homeowners objected to the color. In 1912, Claude’s associate began selling neon discharge tubes as eye-catching advertising signs and was instantly more successful. Neon tubes were introduced to the U.S. in 1923 with two large neon signs bought by a Los Angeles Packard car dealership. The glow and arresting red color made neon advertising completely different from the competition.[19] The intense color and vibrancy of neon equated with American society at the time, suggesting a «century of progress» and transforming cities into sensational new environments filled with radiating advertisements and «electro-graphic architecture».[20][21]
Neon played a role in the basic understanding of the nature of atoms in 1913, when J.![]() J. Thomson, as part of his exploration into the composition of canal rays, channeled streams of neon ions through a magnetic and an electric field and measured the deflection of the streams with a photographic plate. Thomson observed two separate patches of light on the photographic plate (see image), which suggested two different parabolas of deflection. Thomson eventually concluded that some of the atoms in the neon gas were of higher mass than the rest. Though not understood at the time by Thomson, this was the first discovery of isotopes of stable atoms. Thomson’s device was a crude version of the instrument we now term a mass spectrometer.
J. Thomson, as part of his exploration into the composition of canal rays, channeled streams of neon ions through a magnetic and an electric field and measured the deflection of the streams with a photographic plate. Thomson observed two separate patches of light on the photographic plate (see image), which suggested two different parabolas of deflection. Thomson eventually concluded that some of the atoms in the neon gas were of higher mass than the rest. Though not understood at the time by Thomson, this was the first discovery of isotopes of stable atoms. Thomson’s device was a crude version of the instrument we now term a mass spectrometer.
Isotopes[edit]
Main article: Isotopes of neon
The first evidence for isotopes of a stable element was provided in 1913 by experiments on neon plasma. In the bottom right corner of J. J. Thomson’s photographic plate are the separate impact marks for the two isotopes neon-20 and neon-22.
Neon has three stable isotopes: 20Ne (90. 48%), 21Ne (0.27%) and 22Ne (9.25%).
48%), 21Ne (0.27%) and 22Ne (9.25%).
21Ne and 22Ne are partly primordial and partly nucleogenic (i.e. made by nuclear reactions of other nuclides with neutrons or other particles in the environment) and their variations in natural abundance are well understood. In contrast, 20Ne (the chief primordial isotope made in stellar nucleosynthesis) is not known to be nucleogenic or radiogenic. The causes of the variation of 20Ne in the Earth have thus been hotly debated.[22][23]
The principal nuclear reactions generating nucleogenic neon isotopes start from 24Mg and 25Mg, which produce 21Ne and 22Ne respectively, after neutron capture and immediate emission of an alpha particle. The neutrons that produce the reactions are mostly produced by secondary spallation reactions from alpha particles, in turn derived from uranium-series decay chains. The net result yields a trend towards lower 20Ne/22Ne and higher 21Ne/22Ne ratios observed in uranium-rich rocks such as granites. [23]
[23]
In addition, isotopic analysis of exposed terrestrial rocks has demonstrated the cosmogenic (cosmic ray) production of 21Ne. This isotope is generated by spallation reactions on magnesium, sodium, silicon, and aluminium. By analyzing all three isotopes, the cosmogenic component can be resolved from magmatic neon and nucleogenic neon. This suggests that neon will be a useful tool in determining cosmic exposure ages of surface rocks and meteorites.[24]
Neon in solar wind contains a higher proportion of 20Ne than nucleogenic and cosmogenic sources.[23] Neon content observed in samples of volcanic gases and diamonds is also enriched in 20Ne, suggesting a primordial, possibly solar origin.[25]
Characteristics[edit]
Neon is the second-lightest noble gas, after helium. It glows reddish-orange in a vacuum discharge tube. Also, neon has the narrowest liquid range of any element: from 24.55 to 27. 05 K (−248.45 °C to −245.95 °C, or −415.21 °F to −410.71 °F). It has over 40 times the refrigerating capacity (per unit volume) of liquid helium and three times that of liquid hydrogen.[2] In most applications it is a less expensive refrigerant than helium.[26][27]
05 K (−248.45 °C to −245.95 °C, or −415.21 °F to −410.71 °F). It has over 40 times the refrigerating capacity (per unit volume) of liquid helium and three times that of liquid hydrogen.[2] In most applications it is a less expensive refrigerant than helium.[26][27]
Spectrum of neon with ultraviolet (at left) and infrared (at right) lines shown in white
Neon plasma has the most intense light discharge at normal voltages and currents of all the noble gases. The average color of this light to the human eye is red-orange due to many lines in this range; it also contains a strong green line, which is hidden, unless the visual components are dispersed by a spectroscope.[28]
Two quite different kinds of neon lighting are in common use. Neon glow lamps are generally tiny, with most operating between 100 and 250 volts.[29] They have been widely used as power-on indicators and in circuit-testing equipment, but light-emitting diodes (LEDs) now dominate in those applications. These simple neon devices were the forerunners of plasma displays and plasma television screens.[30][31]Neon signs typically operate at much higher voltages (2–15 kilovolts), and the luminous tubes are commonly meters long.[32] The glass tubing is often formed into shapes and letters for signage, as well as architectural and artistic applications.
These simple neon devices were the forerunners of plasma displays and plasma television screens.[30][31]Neon signs typically operate at much higher voltages (2–15 kilovolts), and the luminous tubes are commonly meters long.[32] The glass tubing is often formed into shapes and letters for signage, as well as architectural and artistic applications.
Occurrence[edit]
Neon sign in a Hamden, Connecticut, florist shop
Stable isotopes of neon are produced in stars. Neon’s most abundant isotope 20Ne (90.48%) is created by the nuclear fusion of carbon and carbon in the carbon-burning process of stellar nucleosynthesis. This requires temperatures above 500 megakelvins, which occur in the cores of stars of more than 8 solar masses.[33][34]
Neon is abundant on a universal scale; it is the fifth most abundant chemical element in the universe by mass, after hydrogen, helium, oxygen, and carbon (see chemical element). [35] Its relative rarity on Earth, like that of helium, is due to its relative lightness, high vapor pressure at very low temperatures, and chemical inertness, all properties which tend to keep it from being trapped in the condensing gas and dust clouds that formed the smaller and warmer solid planets like Earth.
Neon is monatomic, making it lighter than the molecules of diatomic nitrogen and oxygen which form the bulk of Earth’s atmosphere; a balloon filled with neon will rise in air, albeit more slowly than a helium balloon.[36]
[35] Its relative rarity on Earth, like that of helium, is due to its relative lightness, high vapor pressure at very low temperatures, and chemical inertness, all properties which tend to keep it from being trapped in the condensing gas and dust clouds that formed the smaller and warmer solid planets like Earth.
Neon is monatomic, making it lighter than the molecules of diatomic nitrogen and oxygen which form the bulk of Earth’s atmosphere; a balloon filled with neon will rise in air, albeit more slowly than a helium balloon.[36]
Neon’s abundance in the universe is about 1 part in 750; in the Sun and presumably in the proto-solar system nebula, about 1 part in 600. The Galileo spacecraft atmospheric entry probe found that even in the upper atmosphere of Jupiter, the abundance of neon is reduced (depleted) by about a factor of 10, to a level of 1 part in 6,000 by mass. This may indicate that even the ice-planetesimals, which brought neon into Jupiter from the outer solar system, formed in a region which was too warm to retain the neon atmospheric component (abundances of heavier inert gases on Jupiter are several times that found in the Sun).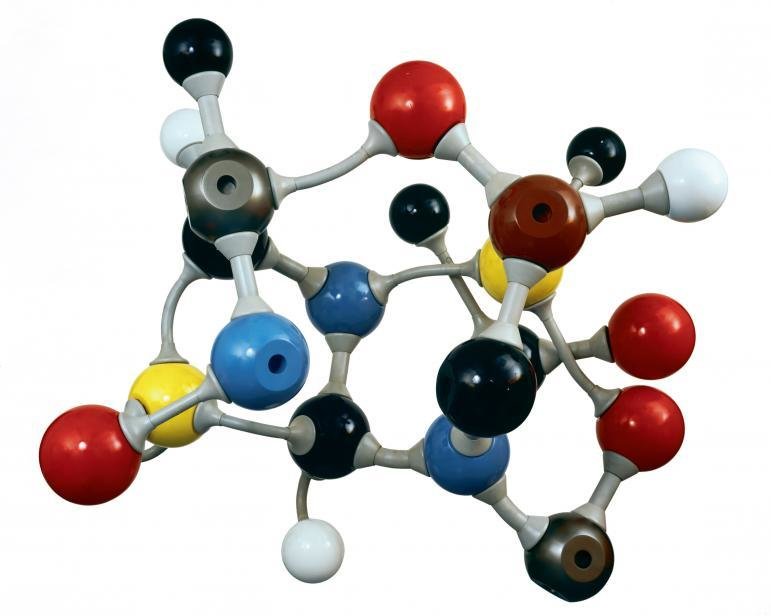 [37]
[37]
Neon comprises 1 part in 55,000 in the Earth’s atmosphere, or 18.2 ppm by volume (this is about the same as the molecule or mole fraction), or 1 part in 79,000 of air by mass. It comprises a smaller fraction in the crust. It is industrially produced by cryogenic fractional distillation of liquefied air.[2]
On 17 August 2015, based on studies with the Lunar Atmosphere and Dust Environment Explorer (LADEE) spacecraft, NASA scientists reported the detection of neon in the exosphere of the moon.[38]
Chemistry[edit]
Crystal structure of Ne clathrate hydrate[39]
Main article: Neon compounds
Neon is the first p-block noble gas, and the first element with a true octet of electrons. It is inert: as is the case with its lighter analogue, helium, no strongly bound neutral molecules containing neon have been identified. The ions [NeAr]+, [NeH]+, and [HeNe]+ have been observed from optical and mass spectrometric studies. [2] Solid neon clathrate hydrate was produced from water ice and neon gas at pressures 350–480 MPa and temperatures about −30 °C.[40] Ne atoms are not bonded to water and can freely move through this material. They can be extracted by placing the clathrate into a vacuum chamber for several days, yielding ice XVI, the least dense crystalline form of water.[39]
[2] Solid neon clathrate hydrate was produced from water ice and neon gas at pressures 350–480 MPa and temperatures about −30 °C.[40] Ne atoms are not bonded to water and can freely move through this material. They can be extracted by placing the clathrate into a vacuum chamber for several days, yielding ice XVI, the least dense crystalline form of water.[39]
The familiar Pauling electronegativity scale relies upon chemical bond energies, but such values have obviously not been measured for inert helium and neon. The Allen electronegativity scale, which relies only upon (measurable) atomic energies, identifies neon as the most electronegative element, closely followed by fluorine and helium.
The triple point temperature of neon (24.5561 K) is a defining fixed point in the International Temperature Scale of 1990.[41]
Production[edit]
Neon is produced from air in cryogenic air-separation plants. A gas-phase mixture mainly of nitrogen, neon, and helium is withdrawn from the main condenser at the top of the high-pressure air-separation column and fed to the bottom of a side column for rectification of the neon. [42] It can then be further purified from helium.
[42] It can then be further purified from helium.
About 70% of global neon supply is produced in Ukraine[43] as a by-product of steel production in Russia.[44] As of 2020, the company Iceblick, with plants in Odessa and Moscow, supplies 65 per cent of the world’s production of neon, as well as 15% of the krypton and xenon.[45][46]
2022 shortage[edit]
Global neon prices jumped by about 600% after the 2014 Russian annexation of Crimea,[47] spurring some chip manufacturers to start shifting away from Russian and Ukrainian suppliers[48] and toward suppliers in China.[46] The 2022 Russian invasion of Ukraine also shut down two companies in Ukraine: LLC «Cryoin engineering» (Ukrainian: ТОВ «Кріоін Інжинірінг») and LLC «Ingaz» (Ukrainian: ТОВ «ІНГАЗ») located in Odessa and Mariupol respectively; that produced about half of the global supply.[47][49] The closure was predicted to likely exacerbate COVID-19 chip shortage,[46][45] which may further shift neon production to China. [48]
[48]
Applications[edit]
Neon is often used in signs and produces an unmistakable bright reddish-orange light. Although tube lights with other colors are often called «neon», they use different noble gases or varied colors of fluorescent lighting.
Neon is used in vacuum tubes, high-voltage indicators, lightning arresters, wavemeter tubes, television tubes, and helium–neon lasers. Liquefied neon is commercially used as a cryogenic refrigerant in applications not requiring the lower temperature range attainable with more extreme liquid-helium refrigeration.
Neon, as liquid or gas, is relatively expensive – for small quantities, the price of liquid neon can be more than 55 times that of liquid helium. Driving neon’s expense is the rarity of neon, which, unlike helium, can only be obtained in usable quantities by filtering it out of the atmosphere.
Semiconductor industry[edit]
As of 2022 gas mixtures that include neon are used to power lasers for EUV lithography. «Россия и Украина обрушили мировое производство микросхем». CNews.ru (in Russian). March 11, 2022. Retrieved 2022-04-17.
«Россия и Украина обрушили мировое производство микросхем». CNews.ru (in Russian). March 11, 2022. Retrieved 2022-04-17.
External links[edit]
- Neon at The Periodic Table of Videos (University of Nottingham)
- WebElements.com – Neon.
- It’s Elemental – Neon
- USGS Periodic Table – Neon
- Atomic Spectrum of Neon
- Neon Museum, Las Vegas
Неон — Госстандарт
Неон (лат. Neonum), Ne, химический элемент VIII группы периодической системы Менделеева, относится к инертным газам, атомный номер 10, атомная масса 20,179. На Земле присутствует главным образом в атмосфере, содержание Неона в которой оценивается в 7,1·1011 т. В 1 м3воздуха находится около 16 см3 Неона. Атмосферный Неон состоит из смеси трех стабильных изотопов: 20Ne, 21Ne и 22Ne; преобладает 20Ne (90,92%). Неон открыт в 1898 году английскими учеными У. Рамзаем и M. Траверсом при исследовании легколетучей фракции жидкого воздуха; название происходит от греческого neos — новый.
Рамзаем и M. Траверсом при исследовании легколетучей фракции жидкого воздуха; название происходит от греческого neos — новый.
При обычных условиях Неон — газ без цвета и запаха. При 0°C и 760 мм рт. ст. (101 кн/м2) плотность Неона 0,900 г/л, tпл -248,6 °C, tкип (при 101 кн/м2) -245,9 °C, растворимость в воде 10,4 мл/л; кристаллическая решетка твердого Неона кубическая; параметр а элементарной ячейки равен 4,52 Å при -253 °C. Молекула Неон одноатомна. Внешняя электронная оболочка атома Неона содержит 8 электронов и очень устойчива; химические соединения Неон еще не синтезированы.
Получают Неон при разделении воздуха. Применение Неона связано главным образом с электротехнической промышленностью. Лампы, заполненные Неоном, дающие красное свечение, используют в портах, на аэродромах и т. д. Жидкий Неон начинают применять для получения низких температур.
Практическое применение неону нашли не сразу. Кроме научных лабораторий, занимавшихся его изучением, первыми открыли свойства неона специалисты в сфере электровакуумной промышленности. Однако им требовалось весьма небольшое количество этого газа, для производства которого хватало маломощных установок.
Однако им требовалось весьма небольшое количество этого газа, для производства которого хватало маломощных установок.
Даже при нынешнем, развитии технологий из 4080 тысяч кубометров воздуха получают всего 320 литров неона, сжатого под давлением 150 атмосфер.
Таким образом, в наши дни спрос на неон существенно превышает возможности его производства. Неон активнейшим образом применяется в криогенной технике в качестве охлаждающего агента. Поскольку жидкий неон не взрывается и весьма мало испаряется, он хранится в криостатах по много месяцев. С его помощью, к примеру, хранят ракетное топливо, замораживают животные ткани. С помощью неона в термобарокамерах осуществляется имитация условий открытого космоса.
Смесь неона, гелия и кислорода – основной компонент так называемого искусственного, безазотного воздуха, которым дышат водолазы, пассажиры глубоководных аппаратов, которым по причине пребывания в условиях высокого давления необходимо уберечься от азотной эмболии (кессонной болезни), а также люди с заболеваниями дыхательных органов.
Общеизвестно, что неон является газом, порождающим свет. Каждый вечер жители городов видят на улицах большое количество неоновой рекламы, магазинных вывесок. Изготовление неоновых вывесок, светящихся и днем и ночью, сегодня выросло в отдельную, крупную отрасль рекламной промышленности. Газосветные неоновые трубки еще очень долго будут использоваться – по крайней мере, до тех пор, пока не удешевится технология производства светодиодных светильников, высокая стоимость которых сегодня отпугивает очень многих потенциальных покупателей. И уж точно неоновые трубки будут вечно популярны при изготовлении высокохудожественных, уникальных дизайнерских изделий, предметов интерьера.
Неон используется в высококачественных осветительных лампах, когда применение недорогого аргона является недостаточным. Лампы заправляют неоно-гелиевой смесью, с малым добавлением аргона, который способствует уменьшению напряжения зажигания. Такие лампы, дающие мощный, красно-оранжевый свет, видны издалека даже сквозь туман. Нетрудно догадаться, что по этой причине неоновые лампы применяются на маяках. С их помощью в темноте обозначаются габариты небоскребов, телевизионных вышек, границы взлетных полос и аэродромов.
Нетрудно догадаться, что по этой причине неоновые лампы применяются на маяках. С их помощью в темноте обозначаются габариты небоскребов, телевизионных вышек, границы взлетных полос и аэродромов.
Что касается применения в радиоэлектронной промышленности, то неон, а также прочие тяжелые инертные газы, используют для фотоэлементов, работающих на газе. Такими газами заполняются электровакуумные ионные устройства – тиратроны (реле сверхбыстрого действия). Небольшие газоразрядные приборы, размером приблизительно 1,5х1,5 сантиметра, давно и успешно пришли на замену расходующим много электроэнергии и недолговечным радиолампам, а также полупроводникам, которые слишком чувствительны к резким температурным перепадам.
Не нашли что искали? Вы можете оставить заявку, в форме обратной связи.
Портал Gosstanart.info не осуществляет коммерческой деятельности, не сотрудничает с рекламодателями, производителями товаров и компаниями предоставляющими услуги. Просьба, не обращаться с коммерческими предложениями! Вся информация, представленная на портале, результат независимых исследований и является свободно распространяемой информацией.
Главная Новости портала Черный список Архив Обратная связь
Неон — информация об элементе, свойства и использование
Перейти к основному содержанию
У вас не включен JavaScript. Пожалуйста, включите JavaScript, чтобы получить доступ ко всем функциям сайта.
Перейти к натрию >
| Группа | 18 | Температура плавления | −248,59° С, -415,46 ° F, 24,56 К |
| Период | 2 | Точка кипения | -246,046 ° С, -410,883 ° F, 27,104 К |
| Блок | п | Плотность (г см −3 ) | 0,000825 |
| Атомный номер | 10 | Относительная атомная масса | 20. 180 180 |
| Состояние при 20°C | Газ | Ключевые изотопы | 20 Не |
| Электронная конфигурация | [Он] 2s 2 2p 6 | Номер КАС | 7440-01-9 |
| ChemSpider ID | 22377 | ChemSpider — бесплатная база данных химической структуры. | |
Изображения Лас-Вегаса и неоновый символ доллара отражают использование газа в неоновом освещении для рекламы.
Бесцветный газ без запаха. Неон не будет реагировать ни с каким другим веществом.
Наиболее часто неон используется для изготовления вездесущих «неоновых вывесок» для рекламы. В вакуумной разрядной трубке неон светится красновато-оранжевым цветом. Только красные знаки на самом деле содержат чистый неон. Другие содержат разные газы, дающие разные цвета.
Неон также используется для изготовления высоковольтных индикаторов и коммутационных устройств, молниеотводов, водолазного снаряжения и лазеров.
Жидкий неон является важным криогенным хладагентом. Его холодопроизводительность на единицу объема более чем в 40 раз больше, чем у жидкого гелия, и более чем в 3 раза больше, чем у жидкого водорода.
Биологическая роль неона неизвестна. Он нетоксичен.
Он нетоксичен.
Неон является пятым по распространенности элементом во Вселенной. Однако в атмосфере Земли он присутствует в концентрации всего 18 частей на миллион. Его извлекают фракционной перегонкой жидкого воздуха. Это дает фракцию, содержащую как гелий, так и неон. Гелий удаляют из смеси активированным углем.
История элементов и периодической таблицы
В 1898 году Уильям Рамзи и Моррис Трэверс из Университетского колледжа Лондона выделили газ криптон путем испарения жидкого аргона. Они ожидали найти более легкий газ, который занял бы нишу над аргоном в периодической таблице элементов. Затем они повторили свой эксперимент, на этот раз позволив твердому аргону медленно испаряться при пониженном давлении и собрав газ, который вышел первым. На этот раз им это удалось, и когда они поместили образец нового газа в свой атомный спектрометр, он поразил их ярко-красным свечением, которое мы теперь ассоциируем с неоновыми вывесками. Рамзи назвал новый газовый неон, взяв за основу neos, греческое слово для нового.
Рамзи назвал новый газовый неон, взяв за основу neos, греческое слово для нового.
| Атомный радиус, несвязанный (Å) | 1,54 | Ковалентный радиус (Å) | 0,62 |
| Сродство к электрону (кДж моль −1 ) | Нестабильный | Электроотрицательность (шкала Полинга) | Неизвестный |
| Энергии ионизации (кДж моль −1 ) | 1 ст 2080. 2 -й 3952.325 3 рд 6121,99 4 -й 9370,66 5 -й 12177,41 6 -й 15237,93 7 -й 19999. 8 -й 23069,539 | ||
| Общие степени окисления | | ||||
| Изотопы | Изотоп | Атомная масса | Естественное изобилие (%) | Период полураспада | Режим распада |
| 20 Не | 19. | 90,48 | — | — | |
| 21 Не | 20.994 | 0,27 | — | — | |
| 22 Не | 21. 991 991 | 9.25 | — | — | |
|
|
| Удельная теплоемкость (Дж кг -1 К -1 ) | 1030 | Модуль Юнга (ГПа) | Неизвестный | |||||||||||
| Модуль сдвига (ГПа) | Неизвестный | Объемный модуль (ГПа) | Неизвестный | |||||||||||
| Давление пара | ||||||||||||||
| Температура (К) |
| |||||||||||||
| Давление (Па) |
| |||||||||||||
| Слушайте неоновый подкаст |
Стенограмма: (Промо) Вы слушаете Химию в ее стихии, представленную вам Chemistry World , журналом Королевского химического общества. (Конец промо) Крис Смит Привет! На этой неделе мы встречаемся с элементом, который сделал район красных фонарей тем, чем он является сегодня, ну, в некотором роде; то, что вы обязательно увидите, — это сияние неоновых вывесок, и с историей о том, как они появились, вот Виктория Гилл. Виктория Гилл Возможно, это самый увлекательный элемент периодической таблицы. Это газ, который может дать вам ваше имя или любое слово, которое вы хотите, на самом деле, в свете. Неоновый газ наполнил первые научные светильники, которые были произведены почти столетие назад, и с тех пор он проник в язык и культуру. Это слово вызывает в воображении образы красочной, а иногда и довольно потрепанной, светящейся науки, многие из которых теперь не содержат самого газа. Только красное свечение — это чистый неон, почти все остальные цвета теперь производятся с использованием аргона, ртути и фосфора в различных пропорциях, что дает более 150 возможных цветов. До того, как он был изолирован, оставшееся место в таблице Менделеева было источником многих лет разочарования. С открытием аргона в 1894 году и последующим выделением гелия в 1895 году британский химик сэр Уильям Рамсей обнаружил первый и третий члены группы инертных газов. Чтобы восполнить пробел, ему нужно было найти второе. Наконец, в 1898 году в Университетском колледже Лондона Рамзи и его коллега Моррис Трэверс модифицировали эксперимент, который они проводили ранее, они позволили твердому аргону, окруженному жидким воздухом, медленно испаряться при пониженном давлении и собрали газ, который вышел первым. Когда они поместили образец недавно открытого газа в атомный спектрометр и нагрели его, они были поражены его светящимся блеском. Трэверс писал об этом открытии, «Пылающий малиновый свет из трубки рассказал свою собственную историю, и это было зрелище, на котором стоит остановиться и которое нельзя забыть. Французскому инженеру, химику и изобретателю Жоржу Клоду потребовалось немного воображения, который в начале 20 -го -го века впервые применил электрический разряд к запаянной трубке с неоновым газом. Красное свечение, которое он производил, натолкнуло Клода на мысль создать источник света совершенно новым способом. Он сделал стеклянные трубки из неона, которые можно было использовать как лампочки. Клод представил публике первую неоновую лампу 11 декабря -го -го года 1910 года на выставке в Париже. Таким образом, неон, возможно, потерял часть своего уникального блеска здесь, на Земле, но вдали он помог раскрыть некоторые секреты самого важного светящегося объекта для нашей планеты — Солнца. Солнечные частицы или солнечный ветер также содержат неон в соотношении двух изотопов неона в образцах лунных пород, горных породах, которые подвергались воздействию солнечного ветра в течение миллиардов лет, что до недавнего времени сбивало с толку ученых. Это связано с тем, что соотношение двух изотопов варьировалось в зависимости от глубины породы; с большим количеством неона-22, чем неона-20 на меньших глубинах. Значит ли это, что солнце когда-то было значительно более активным, чем сегодня, выбрасывая частицы с более высокой энергией, которые могли проникать глубже в скалы? Окончательный ответ на этот вопрос был получен, когда ученые исследовали кусок металлического стекла, который всего два года подвергался воздействию солнечного ветра, на космическом корабле «Генезис», который разбился о Землю в 2004 году. Так что, возможно, вам стоит остановиться и остановиться на следующей неоновой вывеске, которую вы увидите, и просто оценить поистине уникальное свечение. Крис Смит Итак, этот элемент чувствует себя как дома в открытом космосе, так как он рекламирует торговую марку здесь, на Земле. Это была Виктория Гилл с историей неона. В следующий раз к химикату, который сгладил морщины в сталелитейном производстве. Рон Каспи Когда сэр Генри Бессемер изобрел процесс производства стали в 1856 году, его сталь разрушилась при горячей прокатке или ковке; проблема была решена позже в том же году, когда Роберт Фостер Мушет, другой англичанин, обнаружил, что добавление небольшого количества марганца в расплавленное железо решает проблему. Крис Смит Но как же это сработало, Рон Каспи будет здесь на следующей неделе с рассказом о марганце, элементе, который делает возможным фотосинтез и дал нам альтернативу зеленому стеклу. Это на следующей неделе Химия в своей стихии; Надеюсь, вы присоединитесь к нам. Я Крис Смит, спасибо за внимание и до свидания! (Промо) Химия в ее стихии представлена вам Королевским химическим обществом и произведена thenakedscientists.com. Дополнительную информацию и другие эпизоды химии в ее стихии можно найти на нашем веб-сайте chemistryworld.org/elements. (окончание акции) |
Нажмите здесь, чтобы посмотреть видео о неоне
Learn Chemistry: ваш единственный путь к сотням бесплатных учебных ресурсов по химии.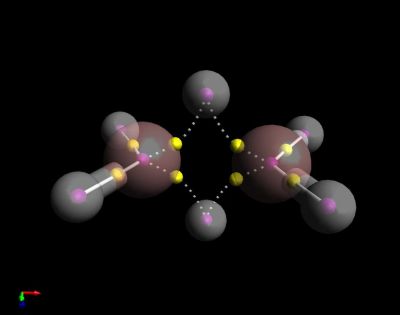
Изображения и видео Visual Elements
© Murray Robertson 1998-2017.
W.M. Haynes, ed., CRC Handbook of Chemistry and Physics , CRC Press/Taylor and Francis, Boca Raton, FL, 95th Edition, Internet Version 2015, по состоянию на декабрь 2014 г.
Дж. С. Курси, Д. Дж. Шваб, Дж. Дж. Цай и Р. А. Драгосет, Атомные веса и изотопные композиции (версия 4.1) , 2015 г., Национальный институт стандартов и технологий, Гейтерсберг, Мэриленд, по состоянию на ноябрь 2016 г.
TL Cottrell, The Strengths of Chemical Bonds , Butterworth, London, 1954.
Использование и свойства
John Emsley, Nature’s Building Blocks: An AZ Guide to the Elements , Oxford University Press, New York, 2nd, New York, 2nd.
 Издание 2011 г.
Издание 2011 г. Национальный ускорительный центр Томаса Джефферсона — Управление научного образования, It’s Elemental — The Periodic Table of Elements, по состоянию на декабрь 2014 г.
Периодическая таблица видео, по состоянию на декабрь 2014 г.
Данные о рисках поставок
Частично получены из материалов, предоставленных Британской геологической службой © NERC.
Исторический текст
Элементы 1-112, 114, 116 и 117 © Джон Эмсли 2012. Элементы 113, 115, 117 и 118 © Королевское общество химии 2017.
Podcasts
, созданные The Nake Scients Scientists. .
Периодическая таблица видео
Создано видеожурналистом Брэди Хараном, работающим с химиками Ноттингемского университета.
Загрузите наше бесплатное приложение Периодической таблицы для мобильных телефонов и планшетов.
Исследуйте все элементы
Элемент Неон— Неон Атом
Неон является химическим элементом в периодическая таблица, которая имеет символ Ne и атомный номер 10. Бесцветный почти инертный благородный газ, неон дает отчетливый красноватое свечение при использовании в вакуумных газоразрядных трубках и неоновых лампах и содержится в воздухе в следовых количествах.
| |||||
| Общие | |||||
|---|---|---|---|---|---|
| Имя, символ, номер | Неон, Неон, 10 | ||||
| Химическая серия | Благородные газы | ||||
| Группа, период, блок | 18 (VIIIA), 2 , стр | ||||
| Плотность, твердость | 0,8999 кг/м 3 (273 К) , NA | ||||
| Внешний вид | бесцветный | ||||
| Атомные свойства | |||||
| Атомный вес | 20. 1797 а.е.м. 1797 а.е.м. | ||||
| Атомный радиус (расч.) | нет данных (38) pm | ||||
| Ковалентный радиус | 69 вечера | ||||
| Радиус Ван-дер-Ваальса | 154 вечера | ||||
| Электронная конфигурация | [He]2s 2 2p 6 | ||||
| e — на уровень энергии | 2, 8 | ||||
| Степени окисления (оксид) | 0 (неизвестно) | ||||
| Кристаллическая структура | Кубическая грань по центру | ||||
| Физические свойства | |||||
| Состояние вещества | газ (немагнитный) | ||||
| Температура плавления | 24,56 К (-415,5 F) | ||||
| Температура кипения | 27,07 К (-410,9 F) | ||||
| Молярный объем | 13,23 10 -6 м 3 /моль | ||||
| Теплота парообразования | 1,7326 кДж/моль | ||||
| Теплота плавления | 0,3317 кДж/моль | ||||
| Давление паров | нет данных | ||||
| Скорость звука | 435 м/с при 273,15 К | ||||
| Разное | |||||
| Электроотрицательность | нет данных | ||||
| Удельная теплоемкость | 103 Дж/(кг*К) | ||||
| Электропроводность | нет данных | ||||
| Теплопроводность | 0,0493 Вт/(м*К) | ||||
| 1 st потенциал ионизации | 2080,7 кДж/моль | ||||
| 2 nd потенциал ионизации | 3952,3 кДж/моль | ||||
| 3 rd потенциал ионизации | 6122 кДж/моль | ||||
| 4 -й потенциал ионизации | 9371 кДж/моль | ||||
| 5 -й потенциал ионизации | 12177 кДж/моль | ||||
| 6 -й потенциал ионизации | 15238 кДж/моль | ||||
| 7 -й потенциал ионизации | 19999,0 кДж/моль | ||||
| 8 -й потенциал ионизации | 23069,5 кДж/моль | ||||
СИ
единицы и STP используются, если не указано иное. | |||||
Примечательные характеристики
Неон — второй по легкости благородный газ, светится красновато-оранжевым в вакуумной разрядной трубке и имеет более чем в 40 раз более высокую холодопроизводительность. емкость жидкого гелия и три раз больше, чем у жидкого водорода (на в расчете на единицу объема). В большинстве приложений это меньше более дорогой хладагент, чем гелий. Неон имеет самый интенсивный разряд при нормальных напряжениях и токах всех редких газы.
Применение
Красновато-оранжевый цвет, который неон излучает в неоновом свете,
широко используется для изготовления рекламных вывесок. Также используется «неон».
как правило, для этих типов огней, когда на самом деле многие
другие газы используются для получения различных цветов света. Другое применение:
Другое применение:
- высоковольтные индикаторы,
- разрядники молниезащитные,
- Трубки для измерения волн,
- телевизионные трубки.
- Неон и гелий используются для изготовления газового лазера.
Сжиженный неон коммерчески используется в качестве экономичного криогенного хладагент.
История
Неон (греч. neos означает «новый») был открыт Уильям Рамзи и Моррис Трэверс в 1898 году.
Происшествие
Неон обычно встречается в виде газа с молекулами
состоящий из одного атома неона. Неон редкий газ, который
содержится в атмосфере Земли в количестве 1 части на 65 000 и составляет
получают переохлаждением воздуха и его фракционной перегонкой
из полученной криогенной жидкости.
Соединения
Несмотря на то, что неон для большинства практических целей является инертным элемент, он может образовывать экзотическое соединение с фтором в лаборатории. неизвестно наверняка, если это или какое-либо соединение неона существует в природе но некоторые данные свидетельствуют о том, что это может быть правдой. Ионы, Не + , (NeAr) + , (NeH) + и (HeNe + ) также наблюдались в оптических и масс-спектрометрические исследования. Кроме того, неон образует неустойчивый гидрат.
Изотопы
Неон имеет три стабильных изотопа: Ne-20 (90,48%), Ne-21 (0,27%)
и Ne-22 (9,25%). Ne-21 и Ne-22 являются нуклеогенными и их
вариации хорошо понятны. Напротив, Не-20 не
известное как нуклеогенное, и причины его изменения в
Земля горячо обсуждалась. Основные ядерные реакции
которые генерируют изотопы неона, это испускание нейтронов, альфа-распад
реакции на Mg-24 и Mg-25 с образованием Ne-21 и Ne-22,
соответственно. Альфа-частицы происходят из ряда урана.
цепочки распада, в то время как нейтроны в основном производятся вторичными
реакции альфа-частиц. Чистый результат дает тенденцию
в сторону более низкого отношения Ne-20/Ne-22 и более высокого отношения Ne-21/Ne-22, наблюдаемого
в богатых ураном породах, таких как граниты. Изотопный анализ
обнаженных земных пород продемонстрировал космогенный
производство Не-21. Этот изотоп образуется в результате расщепления
реакции на Mg, Na, Si и Al. Проанализировав все три изотопа,
космогенная составляющая может быть выделена из магматического неона
и нуклеогенный неон.
Основные ядерные реакции
которые генерируют изотопы неона, это испускание нейтронов, альфа-распад
реакции на Mg-24 и Mg-25 с образованием Ne-21 и Ne-22,
соответственно. Альфа-частицы происходят из ряда урана.
цепочки распада, в то время как нейтроны в основном производятся вторичными
реакции альфа-частиц. Чистый результат дает тенденцию
в сторону более низкого отношения Ne-20/Ne-22 и более высокого отношения Ne-21/Ne-22, наблюдаемого
в богатых ураном породах, таких как граниты. Изотопный анализ
обнаженных земных пород продемонстрировал космогенный
производство Не-21. Этот изотоп образуется в результате расщепления
реакции на Mg, Na, Si и Al. Проанализировав все три изотопа,
космогенная составляющая может быть выделена из магматического неона
и нуклеогенный неон. Это говорит о том, что неон будет полезен
инструмент для определения возраста поверхностных пород, подвергшихся космическому воздействию
и метеориты.
Это говорит о том, что неон будет полезен
инструмент для определения возраста поверхностных пород, подвергшихся космическому воздействию
и метеориты.
Подобно ксенону, содержание неона наблюдается в образцах вулканических газы обогащены Ne-20, а также нуклеогенным Ne-21, относительно содержания Ne-22. Изотопный состав неона эти образцы из мантии представляют собой неатмосферный источник неона. Компоненты, обогащенные Ne-20, были отнесены к экзотические первичные компоненты редкого газа на Земле, возможно представляющий солнечный неон. Повышенное содержание Ne-20 также было найдены в алмазах, далее предполагая наличие солнечного неонового резервуара на Земле.
Ссылка
- Лос-Аламосская национальная лаборатория
Неон ( http://periodic.lanl.
 gov/elements/10.html )
gov/elements/10.html )
Внешние ссылки
- EnvironmentalChemistry.com Неон ( http://environmentalchemistry.com/yogi/periodic/Ne.html )
- Элементарный неон ( http://education.jlab.org/itselemental/ele010.html )
Благородный неон | Периодическая таблица неоновых элементов
Элементы
- Сообщение от Кларис Чан
08 Июль
Введение в неон
Элемент неон , символ Ne , представляет собой благородный газ, который в стандартных условиях не имеет цвета и запаха. В присутствии электрического тока неоновый газ светится знакомым ярким красно-оранжевым цветом. Неон не реагирует.
Десять удивительных фактов о неоне
- Неон имеет самый узкий спектр жидкого состояния среди всех элементов.
 Элемент существует в жидкой форме в диапазоне всего 2,5 ℃.
Элемент существует в жидкой форме в диапазоне всего 2,5 ℃. - Это второй по легкости благородный газ, первым из которых является гелий.
- Несмотря на то, что неон довольно редко встречается на Земле, он является четвертым по распространенности элементом во Вселенной. Он составляет 18 частей на миллион воздуха.
- Неоновая вывеска — самое известное применение этого элемента. Первый был сделан Жоржем Клодом в 1910 и дебютировал на выставке Paris Expo. Если вы видите неоновую вывеску не красновато-оранжевого цвета, газ внутри не неоновый!
- Неон имеет примерно две трети плотности воздуха. Таким образом, неоновый шар будет плавать, но подниматься медленнее, чем гелиевый, потому что гелий легче.
- Вдыхание неона сделает ваш голос более высоким, но не так сильно, как гелий.
- Название неон происходит от греческого слова «неос», означающего «новый».
- Жидкий неон используется в качестве криогенного хладагента, а также для замораживания трупов (жутко!).

- Гелий и неон — единственные элементы, которые не образуют соединений с другими элементами, хотя ионы и лиганды были образованы.
- Неон имеет 3 стабильных изотопа, встречающихся в природе, и еще 17 радиоактивных изотопов.
Неон в периодической таблице
Элемент неон с атомным символом Ne является благородным газом в группе 18 периодической таблицы . Как и другие благородные газы, он имеет полную внешнюю оболочку с 8 валентными электронами и его электронную конфигурацию [He]2s 9.0052 2 2 шт. 6 . Он расположен в p-блоке во втором периоде. Атомный номер неона равен 10.
Охлаждающая способность неона
В своей жидкой форме неон используется в качестве криогенного хладагента, что означает, что это жидкость, которая используется в процессе охлаждения объектов при температуре ниже 150 К. Охлаждающая способность неона очень высокая. Его охлаждающая способность (на единицу объема) в 40 раз больше, чем у жидкого гелия, и более чем в 3 раза больше, чем у жидкого водорода. Свойства неона как благородного (и, следовательно, инертного) газа позволяют ему не реагировать и не смешиваться с другими элементами. Эти свойства, а также очень низкая температура кипения делают его эффективным для использования в качестве хладагента.
Свойства неона как благородного (и, следовательно, инертного) газа позволяют ему не реагировать и не смешиваться с другими элементами. Эти свойства, а также очень низкая температура кипения делают его эффективным для использования в качестве хладагента.
Редкость неона
Как в жидкой, так и в газообразной форме неон очень редок и поэтому дорог на Земле. Он очень легкий, имеет высокое давление паров при низких температурах и не вступает в реакцию. Эти свойства предотвращают попадание неона в ловушку при формировании Земли из облаков пыли. Неон составляет 0,00182% атмосферы Земли. Напротив, неон является четвертым по распространенности элементом во Вселенной.
Применение неона в современном мире
Для чего используется неон?
Помимо использования в качестве криогенного хладагента, неон в основном используется в различных источниках света, включая вывески и лазеры.
Неоновые огни и вывески
Возможно, самое известное применение неона, характерные красно-оранжевые неоновые огни, были изобретены в 1910 году. Стеклянные трубки, содержащие атомы неона, вытягивают различные формы и буквы. Прохождение электрического тока через трубку возбуждает электроны внешней оболочки, заставляя их подпрыгивать на один энергетический уровень. Когда атомы в конце концов возвращаются к своему первоначальному энергетическому уровню, они высвобождают энергию в виде красно-оранжевого света.
Стеклянные трубки, содержащие атомы неона, вытягивают различные формы и буквы. Прохождение электрического тока через трубку возбуждает электроны внешней оболочки, заставляя их подпрыгивать на один энергетический уровень. Когда атомы в конце концов возвращаются к своему первоначальному энергетическому уровню, они высвобождают энергию в виде красно-оранжевого света.
Гелий-неоновые лазеры
По механизму, аналогичному неоновым вывескам, электрические токи возбуждают атомы гелия и неона в газоразрядных трубках. Столкновения между атомами передают и высвобождают энергию. Это усиливает свет внутри трубки и производит лазер. He-Ne лазеры излучают ярко-красный свет с длиной волны 632,8 нанометров (нм).
История неона
Когда и как был открыт неон?
Британские химики Уильям Рамсей и Моррис Трэверс открыли элемент неон в 189 г.8. В своем эксперименте Рамзи кипятил образец жидкого воздуха и улавливал газы по мере их испарения. Этот процесс называется фракционной перегонкой. После идентификации и исключения азота, кислорода и аргона Рамзи открыл криптон. Позже он открыл другой газ, излучавший красно-оранжевый свет при спектроскопическом разряде. Этим элементом оказался неон. Он был назван в честь греческого слова neos , что означает «новый».
После идентификации и исключения азота, кислорода и аргона Рамзи открыл криптон. Позже он открыл другой газ, излучавший красно-оранжевый свет при спектроскопическом разряде. Этим элементом оказался неон. Он был назван в честь греческого слова neos , что означает «новый».
Neon Reactions
Поскольку это благородный газ, неон стабилен с полным октетом электронов. Неон — инертный газ, не вступающий в реакцию ни с какими другими элементами.
Соединения неона
Элемент не реактивен, но есть несколько исключений, таких как несколько молекулярных ионов и эксимеров. Эксимеры (сокращение от «возбужденный димер») представляют собой короткоживущие димерные молекулы. Один из атомов эксимеров должен иметь полный октет электронов. Некоторые примеры включают молекулы Ван-дер-Ваальса (например, LiNe), лиганды (например, Cr(CO) 5 Ne) и ионы (например: NeH + ). И молекулы Ван-дер-Ваальса, и лиганды имеют относительно слабые связи.
Изоляция неона
Точно так же, как химик Уильям Рамсей открыл этот элемент, ученые могут выделить неон.
 662
662 086
086

 Тем не менее, именно неон теперь является общим названием для всех светящихся трубок, которые позволяют рекламодателям и даже многим художникам рисовать и писать светом, и именно это свечение впервые выдало свое присутствие.
Тем не менее, именно неон теперь является общим названием для всех светящихся трубок, которые позволяют рекламодателям и даже многим художникам рисовать и писать светом, и именно это свечение впервые выдало свое присутствие. » Название неон происходит от греческого neos , что означает новый. На самом деле тринадцатилетний сын Рэмси предложил название для газа, сказав, что хотел бы назвать его novum от латинского слова «новый». Его отцу идея понравилась, но он предпочел использовать греческий язык. Так новый элемент по названию и природе наконец занял свое место в таблице Менделеева. И изначально его отсутствие реактивности означало, что у Неона не было очевидных применений.
» Название неон происходит от греческого neos , что означает новый. На самом деле тринадцатилетний сын Рэмси предложил название для газа, сказав, что хотел бы назвать его novum от латинского слова «новый». Его отцу идея понравилась, но он предпочел использовать греческий язык. Так новый элемент по названию и природе наконец занял свое место в таблице Менделеева. И изначально его отсутствие реактивности означало, что у Неона не было очевидных применений. Его яркий дисплей привлекал внимание, но, к сожалению, неоновые лампы не продаются. Люди просто не хотели освещать свои дома красным светом; но Клода это не смутило. Он запатентовал свое изобретение в 1915 и во время своих поисков, чтобы найти ему применение, он обнаружил, что, сгибая трубки, он может делать светящиеся буквы. Использование неоновых трубок для рекламных вывесок началось в 1923 году, когда его компания Claude Neon представила в Соединенных Штатах газонаполненные трубчатые вывески. Две машины он продал автосалону Packard в Лос-Анджелесе. Первые неоновые вывески были названы «жидким огнем», и люди останавливались на улице, чтобы посмотреть на них, даже при дневном свете они заметно светятся. В наши дни неон извлекают из жидкого воздуха методом фракционной перегонки, и всего несколько тонн в год имеющегося в изобилии газа достаточно для удовлетворения любых коммерческих нужд. И, конечно же, в настоящее время существует множество источников световых вывесок, экранов и дисплеев, которые дают нам гораздо более впечатляющие прокручивающиеся буквы и движущиеся изображения, которые мы ассоциируем с яркими красочными огнями, скажем, на Таймс-сквер в Нью-Йорке.
Его яркий дисплей привлекал внимание, но, к сожалению, неоновые лампы не продаются. Люди просто не хотели освещать свои дома красным светом; но Клода это не смутило. Он запатентовал свое изобретение в 1915 и во время своих поисков, чтобы найти ему применение, он обнаружил, что, сгибая трубки, он может делать светящиеся буквы. Использование неоновых трубок для рекламных вывесок началось в 1923 году, когда его компания Claude Neon представила в Соединенных Штатах газонаполненные трубчатые вывески. Две машины он продал автосалону Packard в Лос-Анджелесе. Первые неоновые вывески были названы «жидким огнем», и люди останавливались на улице, чтобы посмотреть на них, даже при дневном свете они заметно светятся. В наши дни неон извлекают из жидкого воздуха методом фракционной перегонки, и всего несколько тонн в год имеющегося в изобилии газа достаточно для удовлетворения любых коммерческих нужд. И, конечно же, в настоящее время существует множество источников световых вывесок, экранов и дисплеев, которые дают нам гораздо более впечатляющие прокручивающиеся буквы и движущиеся изображения, которые мы ассоциируем с яркими красочными огнями, скажем, на Таймс-сквер в Нью-Йорке.
 Когда ученые измерили распределение неона в образцах стекла, подвергнутых воздействию к солнечному ветру они обнаружили, что верхний слой также содержит больше неона-20, чем нижний слой. Нижний слой был похож на лунный камень. Поскольку маловероятно, что активность Солнца изменилась в течение двухлетней миссии, кажется, что это несоответствие было вызвано космической эрозией, микрометеороидами или частицами, просто унесшими часть исходного неона с верхней поверхности лунного спутника. рок.
Когда ученые измерили распределение неона в образцах стекла, подвергнутых воздействию к солнечному ветру они обнаружили, что верхний слой также содержит больше неона-20, чем нижний слой. Нижний слой был похож на лунный камень. Поскольку маловероятно, что активность Солнца изменилась в течение двухлетней миссии, кажется, что это несоответствие было вызвано космической эрозией, микрометеороидами или частицами, просто унесшими часть исходного неона с верхней поверхности лунного спутника. рок.