Что такое микоплазмоз у кошек и как его лечить
Микоплазмоз – одно из наиболее серьeзных инфекционных заболеваний кошек. Недуг вызывают прокариоты микоплазмы, которые всасываются в клетки организма животного и отравляют аммиачными и водородными производными.
Микоплазмоз делится на острый и хронический. Болезнь поражает верхние и нижние дыхательные пути кошки, мочеполовую систему, печень и суставы животного. Возможен летальный исход, если вовремя не начать лечение.
Симптомы
Микоплазмоз на протяжении долгого времени никак не напоминает о себе и не вызывает неудобств у животного.
Очень сложно найти однозначные симптомы этого заболевания: оно оказывает комплексное влияние на организм и поражает множество систем органов.
При развитии острого микоплазмоза можно выделить следующие симптомы:
• общее угнетeнное состояние животного;
• плохой аппетит;
• обильное слезотечение;
• конъюнктивит разной степени тяжести;
• лихорадка;
• ринит, кашель, чиханье;
• повышение температуры тела;
• полиартрит, т. е. боль в суставах, животное хромает или же вовсе отказывается вставать и двигаться;
• подкожные абсцессы.
В особых случаях инфекция вызывает заболевания мочеполовой системы: цистит, нефрит, бесплодие, мертворождение и выкидыши при беременности кошки и т. д., затрагивает суставы, т. е. возникает артрит.
Хроническая форма проявляется в виде кашля, чиханья и повышенного слезотечения.
Без лечения микоплазмоз вызывает осложнения в дыхательной системе: бронхит, пневмонию, отeк лeгких. Инфекция постоянно распространяется и увеличивает зону поражения: начинается с кашля и конъюнктивита, а заканчивается дисфункцией всех органов дыхания. Возможен летальный исход.
Диагностика и лечение
Следует помнить, что вакцинации от этого заболевания не существует, поэтому если присутствуют даже незначительные симптомы, следует немедленно обратиться к ветеринару.
Приветствуются плановые осмотры животного раз в полгода. Это поможет если не предупредить болезнь, то хотя бы выявить еe на ранних стадиях, что способствует успешному лечению.
Так как симптомы микоплазмоза довольно разнообразны, диагностировать заболевание «на глаз» очень сложно. Проводится клинический анализ. Затем берeтся анализ крови и мазок с конъюнктивы, проводятся смывы со слизистых оболочек дыхательных и мочеполовых органов. На данный момент актуальны исследования методом полимеразной цепной реакции, т. е. с помощью выявления ДНК возбудителя.
Для кошек патогенными являются микоплазмы вида M. Gateae и M. Felis. Вследствие заражения микоплазмозом первого вида возникают полиартриты, второго – конъюнктивиты и заболевания дыхательной системы. У здоровых особей в организме также встречаются бактерии микоплазмы. Если обнаружилось, что питомец является их носителем, необходимо быть очень осторожным в дальнейшем – болезнь может проявиться в любой момент.
Схема лечения заключается в применении антибиотиков, препаратов тетрациклинового ряда, которые подавляют синтез микроорганизмов. К таким лекарствам относятся фелиферон, тилозин (фармазин), тетрациклин.
Необходимы препараты, поддерживающие организм животного. Чаще всего страдает печень, т. к. микоплазмы и антибиотики повреждают еe. Для защиты врач может выписать растительный карсил. Иногда кошке нужны пробиотики, средства для поддержания органов желудочно-кишечного тракта.
Для успешного излечения следует строго соблюдать прописанную врачом диету, включая лекарства, витамины и пищевые добавки, обеспечить покой питомцу, оградить его от сквозняков и источников других инфекций. Необходимо регулярно промывать слизистые оболочки питомца и очищать их от гноя. Можно использовать глазные капли Риботан, Иммунофан и т. п.
Избавиться от острых симптомов микоплазмоза можно за 3–4 дня лечения. А вот если заболевание перешло в хроническую форму, то избавиться от него намного сложнее. Полностью излечить животное можно лишь за несколько месяцев. После окончания лечения необходимо ещe одно обследование кошки, чтобы врач и хозяин могли убедиться в эффективности проведeнной терапии.
После окончания лечения необходимо ещe одно обследование кошки, чтобы врач и хозяин могли убедиться в эффективности проведeнной терапии.
Опасен ли микоплазмоз для человека?
Ни один врач не способен точно сказать о степени опасности для человека. Но обычно в организме больных особей обнаруживают вид микоплазм, который не передается человеку.
Многие ветеринары склоняются к тому, что при соблюдении людьми элементарных правил гигиены микоплазмоз не заразен для людей. Поэтому не стоит изолировать кошку в отдельной комнате. Наоборот, в такое время ей необходимо особое внимание и забота.
А в вашем организме живут паразиты?
Симптомами появления паразитов в организме могут быть:
• частые простудные заболевания • потеря веса • усталость и голод • головные боли, а также различные боли и спазмы во внутренних органах особенно!
Если у вас есть домашнее животное, то однозначно вы в группе риска!
Микоплазмоз собак и кошек » ФГБУ Саратовская МВЛ
Микоплазмоз – инфекционное заболевание, вызванное микоплазмами – мельчайшими свободноживущими микроорганизмами, лишенными клеточной стенки.
В природе встречаются повсеместно в качестве комменсалов, сапрофитов и паразитов животных и растений, часть из них являются условно-патогенными для человека.
К микоплазмам, выделенным у мелких домашних животных, относятся М. Felis и М. Gatae – у кошек и M. Cynos – у собак. Устойчивость этих организмов во внешней среде не велика, по отношению к человеку они являются сапрофитами и в большинстве случаев не представляют опасности. Микоплазмы часто входят в состав постоянной флоры слизистых оболочек верхних дыхательных путей, желудочно-кишечного тракта, половых путей и могут представлять собой оппортунистические организмы, вызывая системную инфекцию при иммунодефиците, иммуносупрессии и онкологических заболеваниях.
 Кроме того, микоплазмы способны включать антиген клеток хозяина в свою плазмалемму, а белковый антиген микоплазм может включаться в плазмалемму клетки хозяина, в результате чего нарушается механизм иммунной защиты.
Кроме того, микоплазмы способны включать антиген клеток хозяина в свою плазмалемму, а белковый антиген микоплазм может включаться в плазмалемму клетки хозяина, в результате чего нарушается механизм иммунной защиты.У собак наиболее часто диагностируют урогенитальные заболевания, вызванные представителями Mycoplasma и Ureaplasma, которые в норме встречаются в мочеполовой системе здоровых животных. Передача происходит, как правило, половым путем, но возможен и воздушно-капельный путь передачи. Плод заражается внутриутробно. При тяжелых микоплазмозах возможно рассасывание эмбрионов, абортирование, щенки рождаются недоразвитыми, наблюдается высокая неонатальная смертность в первые дни.
У сук регистрируются рецидивирующие вагиниты, устойчивые к классическому лечению, выкидыши, мертворожденность; у кобелей – баланопоститы, уретриты, простатиты, орхоэпидидимиты, отек мошонки, снижение фертильности. Дыхательные пути поражаются микоплазмой только у маленьких щенков или у животных с поражением ресничного аппарата бронхов (дискинезия ресничного эпителия). Микоплазменная инфекция суставов (хронический фибринозно-гнойный полиартрит, тендосиновит) может развиться в результате распространения микроорганизмов из очагов активной или латентной инфекции со слизистых оболочек дыхательных путей, мочеполового тракта, конъюнктивы.
У кошек выделены несколько видов микоплазм, наиболее часто встречаются Mycoplasma felis и M. Gatae. Инфекция распространена как в больших колониях кошек, так и среди животных домашнего содержания, причем микроорганизм выделен как от больных, так и от здоровых кошек. Присутствие в верхних дыхательных путях и на конъюнктиве кошек М. Gatae естественно, хотя, возможна, она и имеет в этих местах небольшой патогенный потенциал. При конъюнктивите и болезнях верхних дыхательных путей патогенная роль отводится М. Felis.
В сочетании с хламидиями, герпес-вирусом и иммунопатиями микоплазмы могут быть причиной конъюнктивитов. Конъюнктивиты с участием микоплазм сопровождаются блефароспазмом, отеком и покраснением конъюнктивы, слезотечением, появлением катарального или гнойного отделяемого. В большинстве случаев симптомы исчезают через 7-10 дней.
В большинстве случаев симптомы исчезают через 7-10 дней.
Носительство микоплазмоза весьма распространено среди декоративных крыс – считается, что до 70% этих животных поражены этим заболеванием в активной или латентной форме. Издавна крысы считались источником заражения микоплазмозом для человека, но по последним данным «крысиные» штаммы микоплазмы для человека не опасны.
При подозрении на клинически значимый микоплазмоз (преимущественно у ослабленных животных и животных с иммуносупрессией) показано применение тетрациклинов, доксициклина, левомицетина, аминогликозидов, фторхинолонов, макролидов, тилозина. Не последнюю роль в терапии микоплазмоза и сопутствующих инфекций играет применение иммуномодуляторов, повышающих сопротивляемость организма.
Предположительный диагноз на микоплазмоз ставится на основании клинических признаков с подтверждением лабораторного исследования.
В настоящее время используют метод полимеразно-цепной реакции, которая является более точной и чувствительной.
ПО ВОПРОСАМ ПРОФИЛАКТИКИ, ДИАГНОСТИКИ И ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ СОБАК И КОШЕК ОБРАЩАЙТЕСЬ ПО АДРЕСУ:
ФГУ «САРАТОВСКАЯ МЕЖОБЛАСТНАЯ ВЕТЕРИНАРНАЯ ЛАБОРАТОРИЯ»,
Ул. БЛИНОВА, 13.
Тел. (8452) 62-16-54, 89297795032
ОТДЕЛ ГЕНОДИАГНОСТИКИ И ИФА.
№AN32ОБС, Гемотропные микоплазмы (M.haemofelis, C.M. haemominutum, C.M.turicensis) : показатели, норма
ОПИСАНИЕГемотропные микоплазмы (гемоплазмы) – это мелкие (0,3-0,8 мкм) некультивируемые микроорганизмы, которые локализуются на поверхности эритроцитов и вызывают гемолитическую анемию различной степени тяжести у инфицированных животных. Гемоплазмы поражают широкий круг млекопитающих, включая человека, распространены повсеместно.
Минимум три вида гемоплазм вызывают инфекции у домашних и диких кошек: Mycoplasma haemofelis, Candidatus Mycoplasma haemominutum и Candidatus Mycoplasma turicensis. M. haemofelis (ранее называемая штаммом из Огайо, или крупной формой Haemobartonella felis) является наиболее патогенным организмом, вызывающим гемолитическую анемию от умеренной до выраженной у иммунокомпетентных кошек.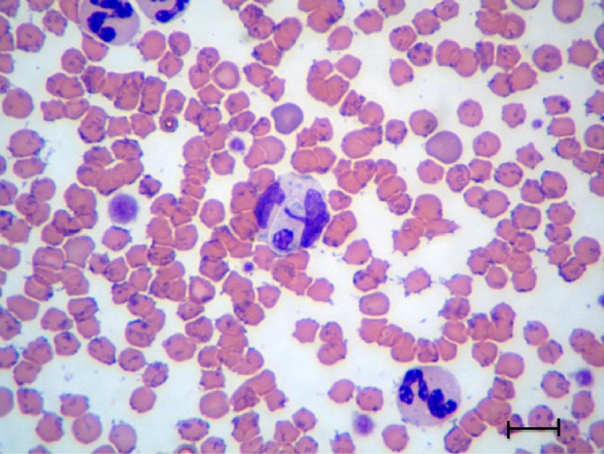 Данное заболевание называется инфекционной анемией кошек. При цитологическом исследовании мазков крови M. haemofelis имеют форму кокков, иногда образующих цепи по три-шесть микроорганизмов.
Данное заболевание называется инфекционной анемией кошек. При цитологическом исследовании мазков крови M. haemofelis имеют форму кокков, иногда образующих цепи по три-шесть микроорганизмов.
Ca. M. haemominutum (ранее называемая калифорнийским штаммом, или малой формой H. felis) обычно меньше, чем M. haemofelis. Связи между инфицированием данным организмом и заболеванием у иммунокомпетентных кошекустановлено не было. При цитологическом исследовании мазков крови Ca. M. haemominutum обнаруживаются как кокки малого размера, от 0,3 до 0,6 мкм в диаметре. Однако достоверно отличить M. haemofelis от Ca. M. haemominutum с помощью данного метода невозможно. Ca. M. haemominutum встречается у кошек по всему миру, инфекции наблюдаются у 20% кошек, поступающих на прием в ветеринарные госпитали. Инфекция Ca. M. haemominutum у кошек вызывает незначительное снижение гематокрита. У кошек с коинфекцией FeLV и Ca. M. haemominutum отмечается более выраженная анемия, чем при моноинфекции Ca. M. haemominutum, а прогрессирование миелопролиферативного заболевания, вызванного FeLV, происходит быстрее.
Ca. M. turicensis впервые была обнаружена в Швейцарии у кошки с выраженным внутрисосудистым гемолизом. С тех пор было установлено, что инфекции Ca. M. turicensis встречаются повсеместно. С использованием световой микроскопии мазков крови Ca. M. turicensis не обнаруживается, у инфицированных кошек бактериальная нагрузка обычно низкая. Инфекции Ca. M. turicensis немногим более распространены в популяции кошек, чем инфекции M. haemofelis, и регистрируются у 0,5-10% больных животных, поступающих на прием в ветеринарные госпитали. Патогенный потенциал данного микроорганизма остается во многом неясным.
Инфекции гемоплазм чаще встречаются у беспородных котов, имеющих доступ на улицу. Инфекция Ca. M. haemominutum в большей степени распространена у кошек старшего возраста. Напротив, у молодых животных чаще наблюдается клиническая форма инфекции M. haemofelis. Было установлено, что в Соединенных Штатах у кошек с инфекцией M. haemofelis вероятность коинфекции FIV в 6 раз выше, чем у кошек, свободных от гемоплазм.
haemofelis вероятность коинфекции FIV в 6 раз выше, чем у кошек, свободных от гемоплазм.
Несколько видов гемоплазм могут поражать собак. У собак, которым была проведена спленэктомия, и в редких случаях при наличии иммуносупрессивных патологий или коинфекций, наблюдается гемолитическая анемия при инфекции Mycoplasma haemocanis (ранее называемой Haemobartonella canis). M. haemocanis представляет собой микроорганизм округлой формы, зачастую формирующий длинные цепи. Распространенность данной инфекции особенно высока у собак, выращенных в питомниках, у которых часто отмечается субклиническая форма болезни.
У собак было обнаружено еще три вида гемоплазм. Candidatus Mycoplasma haematoparvum представляет собой микроорганизм небольшого размера (0,3 мкм) округлой формы, имеющий морфологическое и генетическое сходство с Ca. Mycoplasma haemominutum.
Пути передачи инфекции гемоплазм остаются неясными.
Очевидно, блохи и другие членистоногие могут играть роль в передаче инфекции гемоплазм у кошек, однако данные экспериментальных исследований по данному вопросу недостаточно убедительны. Была показана возможность передачи инфекции M. haemocanis клещом Rhipicephalus sanguineus в экспериментальных условиях, но эти исследования проводились до того, как применение метода ПЦР для подтверждения инфекции стало доступно. Вариабельность распространенности инфекции гемоплазм у собак и кошек в различных географических регионах свидетельствует в пользу того, что членистоногие играют роль переносчиков заболевания. Например, в Европе инфекция M. haemocanis более распространена в странах Средиземноморья, что соответствует ареалу клеща Rh. sanguineus. Существуют гипотезы о возможности вертикальной (трансплацентарной) передачи инфекции, что было установлено для гемоплазм крупного рогатого скота. Также предполагают, что укусы являются одним из путей передачи инфекции у кошек, что подтверждается более высокой распространенностью заболевания у котов, а также наличием абсцессов от укусов в анамнезе. Возможна передача инфекции при переливании крови.
Возможна передача инфекции при переливании крови.
Ввиду того, что только инфекция M. haemofelis сопровождается выраженной анемией у кошек, ниже рассматривается патогенез заболевания, вызываемого данным видом. Появление клинических симптомов наблюдается через 2-34 дня после экспериментального инфицирования. Затем происходит развитие и персистирование анемии в течение 18-30 дней (острая фаза), однако выраженность и продолжительность симптомов на данной стадии значительно варьирует у разных кошек. Причиной анемии является преимущественно экстраваскулярный гемолиз, который сопровождается выраженным регенеративным ответом с появлением ретикулоцитоза. Микроорганизм локализуется на вдавлении поверхности эритроцита. У инфицированных кошек образование связываемых с эритроцитами антител способствует повышению хрупкости эритроцитов и снижает продолжительность их жизни. Микроорганизм также может образовывать мостики между эритроцитами, что способствует утилизации таких эритроцитов селезенкой.
Анемия может приводить к летаргии, отсутствию аппетита, бледности и слабости. Имеют место снижение массы тела и дегидратация. Быстрое развитие анемии может вызывать появление неврологических симптомов, вокализацию, потерю сознания и смерть. У некоторых инфицированных кошек наблюдаются циклические изменения гематокрита и числа пораженных эритроцитов, при этом значительное снижение гематокрита совпадает по времени с появлением большого числа микроорганизмов в мазках крови.
У кошек, которые выживают после завершения острой фазы болезни, значения гематокрита возвращаются к нормальным или субнормальным (фаза восстановления), при этом микроорганизмы более не обнаруживаются в мазках крови. Возможно, что у некоторых из выздоровевших кошек имеет место персистенция инфекции, при этом рецидивирование анемии возможно в период стресса, беременности, сопутствующей инфекции или развития неопластического процесса. Однако согласно имеющимся данным существует вариабельность в способности гемоплазм вызывать персистирующую инфекцию. Носительство инфекции в большей степени характерно для Ca. M. haemominutum и в меньшей – для M. haemofelis и Ca. M. turicensis. У кошек спленэктомия может давать вариабельные эффекты на течение гемоплазмоза. Сообщалось о рецидивировании анемии и бактериемии у некоторых кошек с хронической формой инфекции после спленэктомии, в то время, согласно другим исследованиям, спленоэктомия вызывает лишь повышение числа микроорганизмов, видимых при исследовании мазков крови, при отсутствии выраженной анемии.
Носительство инфекции в большей степени характерно для Ca. M. haemominutum и в меньшей – для M. haemofelis и Ca. M. turicensis. У кошек спленэктомия может давать вариабельные эффекты на течение гемоплазмоза. Сообщалось о рецидивировании анемии и бактериемии у некоторых кошек с хронической формой инфекции после спленэктомии, в то время, согласно другим исследованиям, спленоэктомия вызывает лишь повышение числа микроорганизмов, видимых при исследовании мазков крови, при отсутствии выраженной анемии.
У собак с клинической формой гемоплазмоза обычно в анамнезе имеется спленэктомия, реже – иммуносупрессивные заболевания, использование иммуносупрессивных препаратов, коинфекции таких патогенов, как Babesia spp. и Ehrlichia canis.
Клинические признаки при этом включают слабость, летаргию и бледность, в некоторых случаях – отсутствие аппетита.
В настоящее время методом выбора при диагностике гемоплазмоза у собак и кошке является ПЦР. Этот метод обладает гораздо большей чувствительностью, чем исследование мазка крови. Ввиду того, что патогенность гемоплазм варьирует, предпочтительнее идентификация микроорганизма до вида. При интерпретации результатов необходимо учитывать альтернативные причины анемии, особенно у животных с положительным результатом по Ca. M. haemominutum или Ca. M. turicensis ввиду того, что инфекция данными организмами обычно не сопровождается анемией.
ПРЕАНАЛИТИКА
Для ПЦР исследования биоматериалом служит кровь с ЭДТА (гепаринизированная кровь не допускается). Важно! Кровь на ПЦР исследование отбирается в отдельную пробирку! Минимальное количество образца, необходимое для исследования, 1 мл. Образец стабилен два часа при температуре +18ºС…+25ºС, трое суток при температуре +2ºС…+8ºС, замораживание цельной крови не допускается.
ИНТЕРПРЕТАЦИЯ
Результаты исследования содержат информацию исключительно для врачей. Диагноз ставится на основании комплексной оценки различных показателей, дополнительных сведений и зависит от методов диагностики.
В связи с отсутствием статистики по распространению инфицирования кошек несколькими видами гемотропных микоплазмам в РФ, лаборатория рекомендует проводить данное исследование профилем. Значительная часть кошек остается не дообследованной, что может повлиять на выбор антибиотикотерапии и не приведет к клиническому улучшению состояния животного.
РЕЗУЛЬТАТ ИССЛЕДОВАНИЯ
ПЦР: обнаружение или необнаружение в исследуемой пробе РНК Mycoplasma haemofelis, Candidatus Mycoplasma haemominutum и Candidatus Mycoplasma turicensis.
Микоплазмоз у кошек и собак
Микоплазмозы — группа инфекций, вызываемых прокариотическими (безъядерными) микроорганизмами из класса Mollicutes, и проявляющихся конъюнктивитами, поражением респираторной и мочеполовой системы, опорно-двигательного аппарата.Возбудитель
Это одни из самых мелких прокариотов (безъядерных микроорганизмов), размером 0, 2-0, 3 мкм, грамотрицательные, факультативно-анаэробные. Они не имеют клеточной оболочки, что обуславливает их пластичность и чувствительность по отношению к различным детергентам, спиртам, резким осмотическим изменениям среды. Широко распространены в природе в качестве микобионтов почвы, комменсалов, а также как возбудители инфекций растений и животных. Есть микоплазмы, опасные и для человека. У кошек и собак выделено несколько видов микоплазм, из них только три представляют интерес для ветеринарии: у кошек — Mycoplasma felis и Mycoplasma gatae, а у собак -Mycoplasma cynos.
Роль микоплазм в возникновении респираторных заболеваний кошек и собак до конца еще не выяснена. Так, примерно в 70-80% случаев микоплазма выявляется на слизистых оболочках здоровых кошек. Также в 25% случаях микоплазмы выделяются от кошек с воспалением конъюнктивы и хроническими заболеваниями бронхов. Предполагается, что Mycoplasma felis может быть патогенной, а Mycoplasma gatae является комменсалом (безвредной микрофлорой). Считается, что микоплазмы могут быть первичными патогенами в редких случаях и способны вызвать заболевание у кошек с ослабленной иммунной системой, а также совместно с другими инфекциями (например, герпесвирусом и хламидиями). У здоровых собак часто выделяют микоплазмы из нижних дыхательных путей, но они приводят к заболеванию только щенков или собак с поражением ресничного эпителия верхних дыхательных путей.
Считается, что микоплазмы могут быть первичными патогенами в редких случаях и способны вызвать заболевание у кошек с ослабленной иммунной системой, а также совместно с другими инфекциями (например, герпесвирусом и хламидиями). У здоровых собак часто выделяют микоплазмы из нижних дыхательных путей, но они приводят к заболеванию только щенков или собак с поражением ресничного эпителия верхних дыхательных путей.
Клинические признаки
Основные симптомы у кошек и собак проявляются одно- или двусторонним конъюнктивитом в виде эпифоры (слезотечение), блефароспазмом, хемозом (отек конъюнктивы глаза), гиперемией конъюнктивы с серозными или гнойными выделениями. Могут наблюдаться поражения верхних дыхательных путей (риниты) и мочеполовой системы (баланопостит, цистит, простатит, уретрит, вагинит, эндометрит). А при распространении микроорганизма из очагов болезни или латентной инфекции, локализованной на слизистых оболочках, могут встречаться микоплазменные артриты. При этом происходит разрушение суставного хряща и образование выраженных эрозий на суставной поверхности. Поражение суставов вызывается L-формой микоплазм, которая также связана с образованием подкожных абсцессов. А инфекцию, вызванную Mycoplasma spumans, ассоциируют с поражением суставов.
Диагностика
Для постановки диагноза берут мазки с конъюнктивы, делают смывы с бронхов и трахеи. Полученный материал исследуют методом ПЦР (полимеразной цепной реакции).
Лечение
Лечение микоплазмоза у кошек и собак, как правило, длительное. Микоплазмы наиболее чувствительны к антибиотикам группы тетрациклинов, в том числе к левомицетину и доксициклину, то есть, теми, которые ингибируют синтез у прокариотов. Разрешается также использовать аминогликозиды, фторхинолоны, макролиды и тилозин. При конъюнктивитах также назначают местную антибактериальную терапию. Специфической профилактики (вакцинации) микоплазмоза у собак и кошек не существует.
Гемобартонеллез кошек Полезная информация: Дипилидиоз собак и кошек
« Назад05.04.2015 03:51
Гемобартонеллез кошек известен также как Инфекционная анемия кошек и Гемотропный микоплазмоз. Это заболевание, переносимое клещами и иногда блохами. Гемобартонеллез поражает красные кровяные тельца, отвечающие за перенос кислорода.
Что вызывает гемобартонеллез у кошек? Обычно возбудителем гемобартонеллеза у кошек являются микоплазмы вида Mycoplasma haemofelis (прежнее название — Haemobartonella felis), паразитирующая в крови на поверхности эритроцитов. Кошки могут заражаться также дугой разновидностью — Mycoplasma haemominutum, но это случается это гораздо реже Микоплазмы — это микроорганизмы, занимающие промежуточное положение в медицинской классификации между бактериями, грибами и вирусами. Это самые маленькие самостоятельно существующие из известных микроорганизмов. Обе разновидности, и Mycoplasma haemofelis, и Mycoplasma haemominutum называют терминами «гемотропная микоплазма» или просто «гемоплазма», так как они крове(hemo)- ассоциированные(tropic).
Как передаются Mycoplasma haemofelis и Mycoplasma haemominutum? Клещи и блохи заражаются этими микоплазмами при паразитировании на больных животных. Когда клещ (или блоха) оказывается на кошке и кусает ее, микоплазмы попадают в кровь, передавая болезнь.
Симптомы гемобартонеллеза у кошек. У кошек гемобартонеллез может протекать как легко, беcсимптомно, лишь с легкой анемией, так и в очень тяжелой форме. Признаки заболевания — депрессия, потеря аппетита, дегидрация. В тяжелых случаях, выраженная анемия может проявляться в потере веса, бледности слизистых оболочек, слабости, учащенном сердцебиении и дыхании, желтухе, и даже приводить к смерти кошки.
Диагностика гемобартонеллеза у кошек. Иногда микроорганизмы можно обнаружить в мазке крови внутри клеток. Анализ крови с использованием метода полимеразной цепной реакции (ПЦР) позволяет точно определить, заражена ли кошка гемотропным микоплазмозом.
Анализ крови с использованием метода полимеразной цепной реакции (ПЦР) позволяет точно определить, заражена ли кошка гемотропным микоплазмозом.
Прогноз лечения гемобартонеллеза у кошек. При отсутствии лечения велика вероятность гибели кошки. При наличии таких заболеваний, как хронические болезни почек, системные воспалительные реакции, вирусные инфекции и т.д. течение гемобартонеллеза значительно осложняется, что существенно ухудшает прогноз выживаемости кошки. При своевременном начале лечения гемобартонеллеза и сопутствующих заболеваний, вероятность выздоровления считается вполне реальной.
Профилактика гемобартонеллеза у кошек. Как и в случае с другими болезнями, передаваемыми клещами и блохами, основой профилактики гемобартонеллеза служит очистка от них территории. Для этого применяются средства, уничтожающие и отпугивающие блох Домашнее содержание кошек помогает предотвратить инфекцию.
Опасен ли гемобартонеллез кошек для людей? Нет. Пока не зафиксировано сообщений о случаях гемобартонеллезе у людей.
Лечение вирусных инфекций у кошек в Калининграде
Какие вирусы кошек передаются человеку?
Внимательное отношение к симптомам животного необходимо также для предупреждения заражения инфекцией хозяев. Если питомец принес в дом вирус, заразиться рискуют все, но в большей степени младенцы, пожилые люди и взрослые с ослабленным иммунитетом. Существует множество заболеваний, которые передаются от кошки к человеку:
- последствия кошачьих царапин. Попавший через ранку вирус может вызвать лихорадку, особенно если организм человека ослаблен;
- сальмонеллез. Если питомец ест сырое мясо, при уборке туалета можно заразиться вирусом. Признаки поражения человека: диарея, головная боль, лихорадка;
- паразитарные инфекции. Блохи, вши и прочие возбудители чесотки могут переселиться на хозяев кошки;
- стригущий лишай. Достаточно контакта с больным животным, чтобы заразиться;
- бешенство.
Для защиты животного от болезни проводят вакцинацию, а заразившемуся человеку предстоит пройти тот самый болезненный курс уколов в живот.
Это лишь краткий список заболеваний. Вывод таков: при обнаружении симптомов вируса у питомца поспешите к врачу, чтобы не только помочь животному, но и обезопасить семью.
Профилактика вирусных заболеваний у котов
Заботьтесь о самочувствии пушистого компаньона с момента вашей первой встречи. Кошка будет более устойчива к вирусам, если соблюдать три правила:
- кормить сбалансированным кормом, который подходит животному. Недостаток витаминов в пище приводит к ослаблению иммунитета и повышает риск развития вирусных болезней;
- проводить регулярную чистку кошки от паразитов. Проводите процедуру самостоятельно либо обратитесь за услугой в клинику;
- вакцинировать питомца от распространенных вирусов и заболеваний: панлейкопении, бешенства, калицивироза, хламидиоза. Вакцина обойдется дешевле лечения или потери друга.
Обнаружили симптомы вирусного заболевания у домашнего животного — незамедлительно звоните нам. Мы запишем вас на прием или приедем к вам домой, чтобы осмотреть больного. Опытные врачи «Калининградского областного центра ветеринарной медицины» сделают все возможное для здоровья вашей кошки.
Микоплазмоз — Консультационно-диагностический центр «G8 Сочиlab»
Микоплазма является микробом, малого размера осуществляющий внутриклеточный паразитизм. Это свойство делает микобактерию промежуточным организмом между бактерией и вирусом, делает невозможным ее выявление с помощью оптического микроскопа.
Микоплазма предпочитает поражать слизистый эпителий половых путей и слизистую дыхательных путей.
Патогенными для человека являются три вида микоплазм: Mycoplasma hominis (Микоплазма хоминис), Mycoplasma genitalium (Микоплазма гениталиум), Mycoplasma pneumoniae (Микоплазма пневмониэ).
Половой путь передачи инфекции – в настоящее время является наиболее распространенным способом распространения микоплазмы.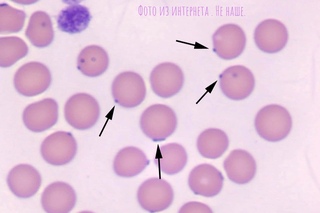 Причем любой из видов полового контакта (оральный, генитальный, анальный) может увенчаться инфицированием. Лишь барьерный механический способ защиты может с высокой надежностью снижать вероятность передачи инфекции. Для микоплазменной инфекции характерно медленное нарастание симптомов, потому после инфицирования, симптомов заболевания может долгое время и не быть, или они могут постепенно появляться спустя месяцы после инфицирования. Многие инфицированные люди становятся носителями инфекции – они даже могут и не подозревать о том, что являются «распространителями» микоплазм.
Причем любой из видов полового контакта (оральный, генитальный, анальный) может увенчаться инфицированием. Лишь барьерный механический способ защиты может с высокой надежностью снижать вероятность передачи инфекции. Для микоплазменной инфекции характерно медленное нарастание симптомов, потому после инфицирования, симптомов заболевания может долгое время и не быть, или они могут постепенно появляться спустя месяцы после инфицирования. Многие инфицированные люди становятся носителями инфекции – они даже могут и не подозревать о том, что являются «распространителями» микоплазм.
Вертикальный путь передачи инфекции – при прохождении плодом женских половых путей при естественных родах возможно инфицирование новорожденного. Этому способствует то обстоятельство, что наибольшая концентрация инфекционных агентов наблюдается с секретах половых путей и в клетках слизистых покровных тканей.
Контактно-бытовой путь передачи инфекции – на данный момент доказать возможность данного пути инфицирования не удалось. Потому его можно исключить из возможных.
Микоплазмоз поражает не только человека. Среди 120 типов микоплазм есть те, которые вызывают заболевание у домашних животных: кошек, собак, домашней птицы и скота, особенно молодняка. Также 70% декоративных крыс болеют скрытой формой микоплазмоза или являются носителями. Несколько десятилетий назад считалось, что кошачий и крысиный микоплазмоз опасен для человека. Но при проведении исследований это утверждение не подтвердилось. На данный момент установлено, что для человека опасны только 15 типов микоплазм, которые не паразитируют на животных.
Сегодня считается, что микоплазмоз кошек не опасен для людей и другие виды животных также не могут служить источником инфекции. Однако дискуссии на этот счет не утихают. Некоторое ветеринары и врачи-инфекционисты утверждают, что в связи с мутацией и высокой приспосабливаемостью микоплазмы животных могут представлять опасность для человека. Особенно если его организм ослаблен другими инфекциями.
Поэтому при общении с бездомными животными или при уходе за больными питомцами необходимо соблюдать меры предосторожности:
— Если животное заболело, то необходимо своевременно обратиться к ветеринару и сдать анализы.
— Регулярно менять животному подстилку, так как в ней микоплазмы сохраняются до 7-ми дней.
— Мыть руки после общения с животными и ухода за ними, не касаться слизистых грязными руками
Берегите себя и своих близких. Соблюдайте гигиену. Не занимайтесь самолечением и своевременно обращайтесь к специалистам.
Микоплазмоз — обзор | ScienceDirect Topics
Микоплазменный полиартрит
Микоплазменный артрит — это смертельное заболевание коз, которое проявляется полиартритом, сепсисом и маститом. Это заболевание обычно вызывается Mycoplasma mycoides subsp. mycoides Большая колония (MmmLC), недавно реклассифицированная как серовар Mycoplasma mycoides subsp. капри. 12 Другие виды микоплазм (Mycoplasma agalactiae, Mycoplasma capricolum, Mycoplasma putrefaciens) вызывают аналогичные синдромы. 13 Это отличается от небольшой колонии (SC) или биотипа крупного рогатого скота Mmm, который вызывает контагиозную плевропневмонию крупного рогатого скота (CBPP), болезнь, искорененную в Соединенных Штатах в 1892 году. происходить. 14
Микоплазменный артрит является эпизоотическим заболеванием во многих странах мира. В Соединенных Штатах большинство вспышек происходит на крупных козьих молочных фермах. Уровень заболеваемости и смертности среди детей достигает 90%. 15 M. putrefaciens стал причиной гибели 700 коз на одной молочной ферме в Калифорнии. 16
Ммм обычно попадает на ферму бессимптомно. Бактерии выделяются в молозиве и молоке инфицированных, и считается, что их проглатывание является основным источником заражения детей. 14-16 Во время одной вспышки было отмечено, что примерно половина самок выделяет организмы Mmm с молоком. Некоторые из них были периодическими бессимптомными выделениями, но в конечном итоге у большинства животных развился клинический мастит. 17 Горизонтальная передача инфекции была зарегистрирована среди детей, проживающих вместе, и, вероятно, имеет место среди взрослых, особенно в доильном зале. 18 Болезнь часто возникает после стресса, например, от кастрации, снятия рогов, сопутствующих заболеваний, плохой погоды или перенаселенности. 16,17,19
Некоторые из них были периодическими бессимптомными выделениями, но в конечном итоге у большинства животных развился клинический мастит. 17 Горизонтальная передача инфекции была зарегистрирована среди детей, проживающих вместе, и, вероятно, имеет место среди взрослых, особенно в доильном зале. 18 Болезнь часто возникает после стресса, например, от кастрации, снятия рогов, сопутствующих заболеваний, плохой погоды или перенаселенности. 16,17,19
Патогенез
Инфекция приводит к микоплазмозу с поражением многих систем организма; фибринозный полиартрит, пневмония, перитонит, мастит, конъюнктивит и перикардит являются одними из наиболее частых проявлений.Если животные выздоравливают, организмы могут выделяться с выделениями из глаз и носа, а также с молоком. 20
Клинические признаки
Наиболее восприимчивы дети в возрасте от 3 до 8 недель, но могут пострадать животные любого возраста. Клинические признаки включают лихорадку, теплые опухоли многочисленных суставов, мастит, хромоту, конъюнктивит, потерю веса и пневмонию. У детей описано три синдрома. Сверхострая форма приводит к смерти через 12–24 часа, единственным признаком является лихорадка. Вторая группа детей показала признаки заболевания головного мозга (опистотоноз) и умерла через 24-72 часа.Третий синдром характеризовался лихорадкой, горячими опухшими суставами, хромотой, лежачем и пневмонией. Многие из этой группы умерли в течение нескольких дней, но некоторые хромые дети выздоровели за несколько недель. 15 У взрослых женщин может развиться острый или сверхострый мастит, смерть от последнего наступает через 1–3 дня. Это может привести к фиброзу вымени и периодическому выделению микроорганизмов. У взрослых артрит встречается реже, чем у детей. Мастит и сильная хромота без лихорадки наблюдались у M.Putrefaciens . 16
Диагноз
Лабораторные исследования обычно выявляют лейкоцитоз, нейтрофилию и гиперфибриногенемию. В особо острых случаях может наблюдаться нейтропения со сдвигом влево. Анализ синовиальной жидкости показывает повышенное количество клеток с нейтрофилией и фибриновыми сгустками. Mycoplasma можно культивировать на специальных средах.
В особо острых случаях может наблюдаться нейтропения со сдвигом влево. Анализ синовиальной жидкости показывает повышенное количество клеток с нейтрофилией и фибриновыми сгустками. Mycoplasma можно культивировать на специальных средах.
Патологоанатомические исследования включают гнойный полиартрит, остеомиелит, фибринозный плеврит, пневмонию, перитонит, менингоэнцефалит и перикардит. 15,17,19 Чаще всего поражаются суставы запястья, коленного сустава, предплюсны, бедра и локтя. Суставная жидкость гнойная, содержит фибрин, суставные капсулы утолщены, с эрозиями суставного хряща. Mmm можно культивировать из синовиальной жидкости и из многих внутренних участков. 17
Лечение
Лечение антибиотиками в большинстве случаев не устраняет инфекцию. Некоторым животным кажется, что состояние улучшается, но позже наблюдается рецидив. Чаще всего рекомендуется тилозин (от 10 до 50 мг / кг трижды в день), но его эффективность не определена. 20 Чувствительность к противомикробным препаратам может варьироваться в зависимости от штамма, но исследование in vitro предполагает, что тилозин, эритромицин, окситетрациклин или энрофлоксацин могут быть эффективными. Это приложение представляет собой сверхмаркированное использование энрофлоксацина, которое запрещено Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA). 21
Профилактика
Эффективные профилактические меры для детей включают кормление термообработанным молозивом и пастеризованным козьим молоком. Заболевание у взрослых можно контролировать, выявляя носителей с помощью культивирования молока и либо выбраковывая носителей, либо изолировав инфицированных животных и доив их после неинфицированных животных.Культивирование образцов молока от отдельных самок и резервуара для основной массы следует проводить периодически, чтобы идентифицировать недавно инфицированных животных или периодически выделяющихся животных, а также культивировать молозиво во время освежения. В настоящее время вакцины в продаже нет (см. Главу 15).
В настоящее время вакцины в продаже нет (см. Главу 15).
Candidatus Mycoplasma haemohominis у человека, Япония — Том 26, номер 1 — январь 2020 г. — Журнал Emerging Infectious Diseases
Принадлежность автора: Школа медицины Университета Сева, Токио, Япония (Н.Хаттори, Т. Такума, Н. Араи, Р. Янаи, С. Исии, Ю. Миура, Т. Токунага, Т. Накамаки, Ю. Ники); Национальный институт инфекционных болезней, Токио (М. Курода, Х. Катано, Т. Секизука, Х. Хасегава, Т. Вакита); Больница Кото Тоёсу Университета Сева, Токио (Т. Ито, Х. Ватанабэ, Н. Номура, Дж. Эгути)
Гемотропные микоплазмы (или гемоплазмы; размер <1 мкм) - это некультивируемые грамотрицательные бактерии с дефицитом клеточной стенки, паразитирующие на поверхности эритроцитов многих домашних и диких животных, таких как кошки, собаки, грызуны, свиньи, крупный рогатый скот. , овцы, медведи и летучие мыши ( 1 — 4 ).Эти патогены могут вызывать гипертермию, гемолитическую анемию и желтуху ( 1 , 5 ). Было проведено мало исследований по молекулярной характеристике гемоплазмы для подтверждения инфекций у людей ( 6 — 11 ), возможно потому, что гемоплазмы не культивируются и врачи часто не обращают на них внимания ( 11 , 12 ). ). Стир и др. обнаружили, что предполагаемые виды Mycoplasma виды Candidatus Mycoplasma haemohominis могут инфицировать людей и вызывать гемолитическую анемию и гипертермию ( 9 ).Однако только частичная последовательность Candidatus M. haemohominis (номер доступа в GenBank GU562825) могла быть подтверждена ( 9 ). Более того, клинические проявления инфекции, вызванной Candidatus M. haemohominis, у людей недостаточно изучены.
Мы идентифицировали и охарактеризовали Candidatus M. haemohominis у пациента с гипертермией неизвестного происхождения. У пациента были различные опасные для жизни симптомы, которые не ограничивались гемолитической анемией, и он был инфицирован этой бактерией после случайного укола иглой. Мы также проанализировали геном Candidatus M. haemohominis, выделенный из образцов, полученных от пациента. Это исследование было одобрено институциональным наблюдательным советом Университета Сева (Токио, Япония) и Национальным институтом инфекционных заболеваний (Токио). Мы получили информированное согласие пациента.
Мы также проанализировали геном Candidatus M. haemohominis, выделенный из образцов, полученных от пациента. Это исследование было одобрено институциональным наблюдательным советом Университета Сева (Токио, Япония) и Национальным институтом инфекционных заболеваний (Токио). Мы получили информированное согласие пациента.
Рисунок 1
Рис. 1. Эритема и зуд всего тела у 42-летнего мужчины, инфицированного Candidatus Mycoplasma haemohominis, Япония. На изображениях показана общая эритема и зуд, покрывающие> 80% поверхности тела.А) Грудь, Б) Спинка, …
Пациентом был 42-летний мужчина (врач), у которого не было необычной истории болезни и недавних поездок за границу. Пациент был госпитализирован в больницу Медицинской школы Университета Сева (Токио, Япония) по поводу гипертермии, анемии и нарушения функции печени. За месяц до госпитализации он случайно уколол палец при выполнении пункционной биопсии печени 1 пациенту, который был госпитализирован в эту больницу из-за криптогенного повреждения печени и анемии после поездки за границу.Через две недели после травмы иглой у пациента наблюдались гипертермия и эритема всего тела с кожным зудом (рис. 1). Его сыпь исчезла через 3 дня. Однако он был госпитализирован из-за развития лимфаденопатии, гепатоспленомегалии и гипертермии.
Рисунок 2
Рисунок 2. Клиническое течение 42-летнего мужчины, инфицированного Candidatus Mycoplasma haemohominis, Япония. * Для ALT, AST и LDH левая ось Y соответствует AST и ALT, а правая ось Y — LDH.ALT, …
Мы предоставляем клинический курс для пациента (рис. 2). При поступлении у больного наблюдалась относительная брадикардия (96 уд / мин), температура тела 39,5 ° С. Лабораторные результаты показали повышение уровней аспартатаминотрансферазы (274 Ед / л, референсный диапазон 10-40 Ед / л), лактатдегидрогеназы (664 Ед / л, референсный диапазон 120-245 Ед / л), ферритина (8748 нг / мл). , референсный диапазон 20–400 нг / мл), растворимый рецептор интерлейкина-2 (8 791 Ед / мл, референсный диапазон 122–496 Ед / мл) и С-реактивный белок (8. 45 мг / дл, нормальный диапазон 0,00–0,20 мг / дл). Общий анализ крови показал анемию (концентрация гемоглобина 11,9 г / дл, референсный диапазон 13,6–18,3 г / л), но количество лейкоцитов (4,8 × 10 3 клеток / мкл, референсный диапазон 3,5–9,0 × 10 3 клеток / мкл) и количество тромбоцитов (16,5 × 10 4 / мкл, контрольный диапазон 14,0–37,9 × 10 4 клеток / мкл) находились в пределах контрольных интервалов. Результат теста Кумбса был отрицательным, но были обнаружены низкие концентрации гаптоглобина (<8 мг / дл, диапазон 30–200 мг / дл).
45 мг / дл, нормальный диапазон 0,00–0,20 мг / дл). Общий анализ крови показал анемию (концентрация гемоглобина 11,9 г / дл, референсный диапазон 13,6–18,3 г / л), но количество лейкоцитов (4,8 × 10 3 клеток / мкл, референсный диапазон 3,5–9,0 × 10 3 клеток / мкл) и количество тромбоцитов (16,5 × 10 4 / мкл, контрольный диапазон 14,0–37,9 × 10 4 клеток / мкл) находились в пределах контрольных интервалов. Результат теста Кумбса был отрицательным, но были обнаружены низкие концентрации гаптоглобина (<8 мг / дл, диапазон 30–200 мг / дл).
Результаты тестов на вирусы гепатита A, B, C и E отрицательны; вирус кори; вирус краснухи; парвовирус; и ВИЧ. Результаты тестов на антинуклеарные антитела (титр 1:80) и гладкомышечные антитела (титр 1:40) были положительными, но результаты тестов на антимитохондриальное антитело M2, митохондриальное антитело, двухцепочечное ДНК-антитело и волчаночный антикоагулянт были отрицательными. Нагрузка ДНК вируса Эпштейна-Барра (EBV), определенная с помощью ПЦР, составляла 3,0 × 10 2 копий / мл. Однако гибридизация саузерн-блоттингом не выявила клональности клеток, инфицированных EBV.Уровни вируса простого герпеса, вируса герпеса человека 6 и 8, вируса ветряной оспы и цитомегаловируса были ниже контрольных значений, определенных с помощью ПЦР. Уровень сывороточного IgG составлял 3 967 мг / дл (референсный диапазон 800–1 750 мг / дл). Однако результат теста на легкую цепь без сыворотки был в пределах контрольного предела.
Нашим первоначальным диагнозом был гемофагоцитарный синдром (ГПС), связанный с неустановленным заболеванием, и пациенту была назначена пульс-терапия стероидами (1000 мг) на 1 день. Поскольку симптомы не исчезли, ему назначили этопозид (100 мг / м 2 ), циклоспорин (5 мг / кг) и дексаметазон (20 мг) на 7 день.После того, как это лечение было начато, полногеномное секвенирование образца периферической крови обнаружило новый хемотропный Mycoplasma sp.
Рисунок 3
Рисунок 3. Распределение Candidatus Mycoplasma haemohominis у 42-летнего мужчины, Япония. А) Мазок периферической крови, показывающий кокковидные формы. Небольшие базофильные тельца присутствуют на поверхности и вне эритроцитов (стрелки). Стрелка …
На 11 день мы обнаружили пролонгированное активированное частичное тромбопластиновое время (50.6 с, референсный диапазон 25–45 с), нормальное протромбиновое время (12,6 с), низкая активность фактора свертывания крови VIII (1,8%, референтный диапазон 78–165%) и низкая активность фактора фон Виллебранда (VWF) (кофактор ристоцетина < 10%, эталонный диапазон 50% –150%). Более того, сывороточные уровни фибриногена, антитромбина III, дезинтегрина и металлопротеиназы с мотивом тромбоспондина типа 1, член 13, находились в пределах нормальных значений. Микроскопическое исследование мазка крови, окрашенного по Гимзе, показало кокковидные формы на поверхности эритроцитов (рис. 3, панель A).Аспират костного мозга показал гемофагоцитоз и повышенный уровень реактивных плазматических клеток (19,5%) (Рисунок 3, панели B, C). На 12-й день гипогликемия (уровень глюкозы <5 мг / дл, референсный диапазон 61–139 мг / дл) была отмечена в крови из пробирки для сбора, использованной для серологических тестов, но уровень глюкозы был в пределах референсного диапазона для крови в контейнер, содержащий лимонную кислоту с NaF.
На 13-й день пациенту был поставлен диагноз: Candidatus M. haemohominis, ассоциированный с инфекцией HPS, и ему был назначен левофлоксацин.Гипогликемия уменьшилась после приема левофлоксацина. Однако развилась гипертермия и анемия, и на 37-й день снова наблюдались коккоидные формы на эритроцитах в периферической крови и костном мозге. На 46-й день ему дали моксифлоксацин и миноциклин из-за подозрения на резистентность бактерий к левофлоксацину. После того, как это лечение было начато, его симптомы, такие как гипертермия, анемия и гипогликемия, быстро исчезли, и пациент был выписан на 61 день. Через год после прекращения лечения пациент оставался здоровым, а Candidatus M.В его сыворотке была обнаружена ДНК haemohominis.
Несмещенное секвенирование РНК с высокой пропускной способностью
Мы очистили общую РНК из образца сыворотки крови пациента с помощью набора RNeasy Mini Kit (QIAGEN, https://www.qiagen.com). Мы подготовили библиотеки RNA-Seq с помощью набора для подготовки библиотеки RNA-Seq ScriptSeq версии 2 (Illumina, https://www.illumina.com) и секвенировали эти библиотеки как односторонние 151-мерные с помощью секвенатора NextSeq 500 (Illumina ) ( 13 , 14 ).
Полногеномный анализ
Мы выполнили метагеномное короткое считывание ДНК с использованием NextSeq 500 (Illumina) с ДНК, выделенной из образцов сыворотки.Мы исключили короткие чтения, связанные с человеком, с помощью программы картирования Берроуза-Уиллера с параметрами по умолчанию для последовательностей генома человека (GRCh48.p13) ( 15 ).
Мы получили черновую последовательность генома Candidatus M. haemohominis путем сборки de novo с использованием коротких считываний метагеномной ДНК-Seq. Во-первых, мы исключили последовательности геномной ДНК человека (≈58,3%) с помощью анализа считывания-картирования с последующей сборкой de novo с оставшимися короткими считываниями. Общее количество контигов 703, общая длина ≈1.42 Mb, что позволяет предположить, что целые контиги включали последовательности ДНК бактерий и человека. Поэтому для извлечения бактериальных последовательностей мы учитывали глубину считывания и охват,% GC для каждого контига и быстрый поиск (https://blast.ncbi.nlm.nih.gov). В общей сложности 23 контига показали заметный охват глубины чтения (в среднем × 5500) и 30% -ное содержание GC, хотя анализ бластн-поиска показал, что 4 контига были отнесены к геному Mycoplasma , а 19 контигов были отнесены к неизвестным последовательностям.
Электронная микроскопия
Мы использовали отрицательное окрашивание образцов сыворотки. Небольшие аликвоты образцов сыворотки абсорбировали на сверхмощных медных медных сетках с углеродным покрытием 300 меш (Veco Grids; Nisshin EM, http://nisshin-em.co.jp) с тлеющим разрядом в течение 2 минут, а избыток жидкость промокали фильтровальной бумагой Whatman (GE Healthcare, https: ///www.gehealthcare.com). Затем мы дважды промывали сетки водой Milli-Q (http://emdmillipore.com) и отрицательно окрашивали их 2% уранилацетатом.Мы наблюдали образцы с помощью просвечивающего электронного микроскопа H7700 (Hitachi, https://www.hitachi.com) при 80 кВ и увеличении × 10 000.
Мы фиксировали образцы ткани 2,5% глутаральдегида и 2% параформальдегида в 0,1 моль / л фосфатного буфера (pH 7,4) в течение 2 часов при комнатной температуре, затем фиксировали эти образцы в 1% тетроксиде осмия и заливали их смолой Epon. Мы окрашивали ультратонкие срезы уранилацетатом и цитратом свинца и наблюдали их под просвечивающим электронным микроскопом (HT7700; Hitachi) при 80 кВ.
Гибридизация на месте
Мы использовали гены 16S и 23S рРНК для анализа гибридизации in situ. Мы амплифицировали целевой фрагмент с помощью ПЦР с праймерами дигоксигенин-11-dUTP и MHaemohominis1F (5′-AATTAACGCTGATGGCATGC-3 ‘) и MHaemohominis600R (5′-TCCTACCGTATTCTAGACGGAC-3’). Мы очистили ампликон ПЦР с помощью набора для очистки ПЦР (QIAGEN) и денатурировали его тепловым шоком перед гибридизацией. Мы обрабатывали депарафинированные слайды 0,3% H 2 O 2 / метанол в течение 30 мин и 0.2 моль / л HCl в течение 20 минут, затем инкубировали предметные стекла с протеиназой K (3–10 мкг / мл) в течение 30 минут при 37 ° C. После прегибридизации мы гибридизировали слайды с 2 пмоль / л денатурированного зонда на слайд в буфере для гибридизации (20% формамид; 5 × физиологический раствор – цитрат натрия [SSC], 5 × раствор Денхардта; 50 ммоль / л буфера HEPES [pH 7,0], и 40 мкг / мл ДНК спермы лосося) в течение ночи при 42 ° C. Мы дважды промывали предметные стекла 2 × SSC при 50 ° C в течение 15 минут и дважды 0,2 × SSC при 50 ° C в течение 15 минут, добавляли моноклональные антитела к дигоксигенину (Sigma, https: // www.sigmaaldrich.com) и инкубировали предметные стекла в течение 45 мин. Затем мы усилили сигналы с помощью набора GenPoint (Dako Agilent, https://www.agilent.com) и детектировали эти сигналы, используя 3,3′-диаминобензидин в качестве хромогена.
ПЦР в реальном времени
Мы использовали фрагмент ДНК гена 16S рРНК Candidatus M. haemohominis в ПЦР в реальном времени Taqman ( 16 ). Затем мы выполнили ПЦР-амплификацию в 25-мкл реакционных смесях, содержащих QuantiTect Probe PCR Master Mixture (QIAGEN), 0.4 мкмоль / л каждого праймера, 0,2 мкмоль / л зонда TaqMan и 100 нг выделенной ДНК. Условиями ПЦР были 95 ° C в течение 15 минут, затем 45 циклов при 94 ° C в течение 15 с и 60 ° C в течение 1 минуты в аппарате Mx3005P (Dako Agilent).
Данные последовательности
Мы депонировали метагеномные последовательности короткого чтения для ДНК-Seq в DDBJ (BioProject PRJDB7871; BioSample SAMD00156464; номер доступа DRR DRR164892). Мы депонировали проект аннотированной последовательности генома Candidatus M. haemohominis SWG34-3 в Банк данных ДНК Японии (инвентарные номера.SAMD00156495 и BIMN01000001–23). Последовательность 16S рРНК депонирована под номером доступа. MHSWG343_r0010. Предсказанная нуклеотидная последовательность гена гиразы A депонирована под номером доступа. MHSWG343_02220, а кодирующая последовательность депонирована под номером доступа. GCE63237.1.
Идентификация и полногеномное секвенирование
Candidatus M. haemohominisРисунок 4
Рисунок 4. Прогноз наличия Candidatus Mycoplasma haemohominis в образцах сыворотки 42-летнего мужчины, Япония.А) Относительный процент бактерий-кандидатов. Б) Процент Mycoplasma spp. обнаружен.
Рисунок 5
Рис. 5. Анализ на Candidatus Mycoplasma haemohominis в сыворотке 42-летнего мужчины, Япония. А) Прогноз, что сборки de novo содержат последовательности ДНК бактерий и человека. Последовательности, связанные с бактериями, были идентифицированы с помощью чтения …
Метагеномный глубокий анализ последовательности РНК убедительно показал, что, а не другие патогены или вирусные инфекции, вирус Mycoplasma spp.может быть связано с признаками и симптомами пациента. Короткие чтения RNA-Seq, относящиеся к Mycoplasma spp. все чаще обнаруживались в сыворотке пациента (рис. 4). Всего было извлечено 41,7% некартированных считываний человека, которые затем подверглись сборке de novo для идентификации чернового генома микоплазмы (23 контига, 967 846 пар оснований) (рис. 5, панель A). Проект последовательности генома идентифицировал потенциальный патоген, которым мог быть Candidatus M. haemohominis на основе гомологии последовательности 16S рРНК.Кроме того, этот патоген показал сходство с близкородственными видами, такими как M. haemofelis и M. haemocanis (рис. 5, панель B).
Рисунок 6
Рисунок 6. Морфологические особенности Candidatus Mycoplasma haemohominis, выделенного из образца сыворотки 42-летнего мужчины, Япония . A) Сферы — это бактериальные частицы диаметром 300–600 нм. Негативное окрашивание; шкала показывает …
Негативное окрашивание и электронная микроскопия Candidatus M.частицы haemohominis идентифицировали рибосомы, ДНК и растворимую РНК в цитоплазме (рис. 6, панель A). Гибридизация in situ идентифицировала Candidatus M. haemohominis на поверхности эритроцитов и в цитоплазме макрофагов в костном мозге (рис. 6, панель B).
Мониторинг и лечение
Candidatus Инфекция M. haemohominisРисунок 7
Рис. 7. Номер копии генома Candidatus Mycoplasma haemohominis в образцах сыворотки объемом 1 мкл от 42-летнего мужчины, Япония.Число копий определяли с помощью ПЦР в реальном времени. LVFX, левофлоксацин; МИНО, миноциклин; MLFX, …
Рисунок 8
Рисунок 8. Обнаружение мутации gyrA в QFDR генома Candidatus Mycoplasma haemohominis, выделенного у 42-летнего мужчины из Японии, которому давали левофлоксацин. Анализ чтения-картирования идентифицировал несинонимичную аминокислоту …
Мы определили уровень ДНК Candidatus M. haemohominis в сыворотке с помощью ПЦР в реальном времени (рис. 7).Высокое количество копий ДНК Candidatus M. haemohominis было обнаружено через 18 дней после случайного укола иглой. Бактериальная нагрузка в сыворотке снизилась ниже предела обнаружения (<10 копий / реакция) через 14 дней после того, как пациенту дали левофлоксацин, но снова увеличилась. Метагеномный анализ также показал высокий уровень обнаружения Mycoplasma spp. читается в сыворотке крови до и после лечения левофлоксацином. Анализ чтения-картирования показал, что только 2-нуклеотидные мутации были идентифицированы в образцах после лечения левофлоксацином.Более того, 1 из 2 мутаций была несинонимичной мутацией в областях, определяющих устойчивость к хинолонам (QRDR) субъединицы A ДНК-гиразы GyrA (то есть Gly95Cys, соответствующего aa 81 по нумерации для Escherichia coli ) (Рисунок 8). Бактериальная нагрузка быстро снизилась после комбинированной терапии моксифлоксацином и миномицином. Мы также идентифицировали Candidatus M. haemohominis с помощью ПЦР в реальном времени и гибридизации in situ с образцами из биопсии печени пациента.
Заражение Candidatus M.haemohominis необходимо отличать от других гемоплазм с точки зрения клинических симптомов. Как описано ранее, инфицирование возможными гемоплазмами приводит к гемолитической анемии и пирексии ( 6 — 11 ). Наши результаты показали, что инфицирование Candidatus M. haemohominis может вызывать у людей различные опасные для жизни симптомы, такие как HPS, повреждение печени и кровотечение.
Мы идентифицировали Candidatus M. haemohominis у пациента и выяснили клинические особенности Candidatus M.haemohominis следующим образом. Во-первых, инфекция Candidatus M. haemohominis может вызвать ГФС. Во-вторых, эта инфекция может вызвать реактивный плазмоцитоз. В-третьих, увеличение плазматических клеток может вызвать выработку антител и гипергаммаглобулинемию. В-четвертых, у инфицированных пациентов могут быть коккоидные бактериальные формы на поверхности эритроцитов и псевдогипогликемия in vitro. В-пятых, эта инфекция также может сопровождаться эпизодами геморрагии от легкой до тяжелой степени.
Мы полагаем, что наши результаты помогут в диагностике Candidatus M.haemohominis, что дает возможность раннего терапевтического вмешательства, которое может вылечить пациентов с этими инфекциями. Candidatus Пациенты с M. haemohominis очень подвержены ошибочному диагнозу с другими заболеваниями, такими как коллагеновые заболевания (например, системная красная волчанка) и вирусные инфекции (например, тяжелая лихорадка с синдромом тромбоцитопении и ВЭБ-ассоциированный HPS) из-за широкого диапазона осложнений.
Обычно противомикробная лекарственная терапия фторхинолонами или тетрациклинами эффективна против гемоплазм у животных.Комбинированная терапия ( 9 ) или последовательное лечение ( 19 ) этими препаратами может быть более эффективным против гемоплазмы, поскольку одного агента часто недостаточно для последовательного устранения бактериемии ( 19 ). Более того, обнаружение мутаций в QRDR гиразы A (Gly95Cys) позволило предположить, что Candidatus M. haemohominis устойчив к более старым фторхинолонам (например, левофлоксацину) ( 20 , 21 ). Напротив, новые фторхинолоны, такие как моксифлоксацин или ситафлоксацин, и тетрациклины, эффективны против микоплазм, несущих эту мутацию ( 21 ).
Лабораторные тесты нашего случая-пациента показали низкий уровень глюкозы в крови (<5 мг / дл, референсный диапазон 61–139 мг / дл), но не выявили клинических признаков. Гипогликемия, связанная с гемоплазмой, при отсутствии каких-либо связанных клинических признаков была описана у различных видов животных ( 22 ). Это явление пропорционально степени тяжести бактериемии и зависит от вида гемоплазмы ( 22 ). Поскольку возможно, что глюкоза будет полезна только для метаболизма углеводов у видов гемоплазмы ( 23 ), это открытие может вызвать прикрепление в эпиеритроцитарной среде, богатой глюкозой, и привести к альтернативным источникам энергии, которые становятся избыточными.
У этого пациента наблюдались эпизоды геморрагии от умеренной до тяжелой. Хотя патогенез кровотечений у пациентов, инфицированных Candidatus M. haemohominis, полностью не изучен, у этого пациента наблюдалось резкое снижение активности фактора свертывания VIII и VWF, что аналогично наблюдаемому у пациентов с приобретенным заболеванием фон Виллебранда. синдром ( 24 , 25 ). Учитывая гипергаммаглобулинемию и повышенные уровни плазматических клеток, наблюдаемые в этом случае у пациента и других пациентов.Возможные механизмы инфекции — это адсорбция vWF на плазматических клетках или активированных тромбоцитах, помимо присутствия vWF-специфических антител и ингибиторов ( 24 , 25 ).
В заключение, мы идентифицировали и охарактеризовали Candidatus M. haemohominis у человека. Хотя наше исследование имеет ограничения, наши результаты дают полезные сведения об этой инфекции. Другие пациенты, инфицированные Candidatus M. haemohominis, могли умереть до того, как был поставлен подтвержденный диагноз.Таким образом, инфекция Candidatus M. haemohominis может встречаться чаще, чем принято считать. Дальнейшие эпидемиологические исследования инфекции Candidatus M. haemohominis у людей и промежуточных хозяев (ов) для этого патогена позволят прояснить масштабы заражения человека и возможные пути передачи.
Д-р Хаттори — научный сотрудник Медицинской школы Университета Сева, Токио, Япония. Его основной исследовательский интерес — гематология.
верхний
Мы благодарим пациента за участие в этом исследовании, клинический персонал, который поддерживал и заботился об этом пациенте, а также Юко Сато и Мичие Катаока за оказание технической помощи в проведении иммуногистохимического анализа, гибридизации in situ и электронной микроскопии.
Это исследование было поддержано Программой исследований возникающих и повторно возникающих инфекционных заболеваний Японского агентства медицинских исследований и разработок (гранты JP19fk0108048, JP19fk0108103 и JP19fk0108104).
N.H., T.T. (Такахиро Такума), T.I., M.K., T..S., H.K., H.H., T.N., T.W. и Y.N. разработал исследование и интерпретировал данные; М.К. выполнен метагеномный анализ; Т.С. проведенная биоинформатика; H.K. и H.H. выполнили патологический анализ; Н.А., Х.В., Н.Н., Дж.E., R.Y., S.I., Y.M. и T.T (Takahiro Tokunaga) оказали помощь в разработке исследования и охарактеризовали образцы пациентов; Н.Х., М.К., Х.К., Т.С. и Х.Х. написали рукопись; и T.N., T.W. и Y.N. критически рассмотрел рукопись. Все авторы одобрили окончательную версию представленной к публикации рукописи.
Выводы, выводы и мнения, высказанные авторами, пишущими для этого журнала, не обязательно отражают официальную позицию U.S. Министерство здравоохранения и социальных служб, Служба общественного здравоохранения, Центры по контролю и профилактике заболеваний или аффилированные с авторами учреждения. Торговые наименования используются только для идентификации и не подразумевают одобрения какой-либо из вышеперечисленных групп.
ScienceCentral
Аннотация
Цель:
Основная цель этого клинического случая — представить случай гемотропного микоплазмоза кошек, который возник одновременно с бактериальным циститом после укуса.
Материалы и методы:
3-летний интактный домашний короткошерстный кот весом 3,7 кг был направлен в ветеринарную клинику Университета Малайзии Келантан с клиническими признаками гематурии и дизурии. История показала, что они содержались на открытом воздухе, питались сухими кормами и влажной пищей, но без вакцинации и дегельминтизации. При медицинском осмотре кошка имела тусклый вид, бледность слизистой оболочки, нормальную частоту дыхания, переохлаждение и брадикардию. При обследовании мочеполовой системы были обнаружены ожоги мочой в анальной области, некротизированный кончик полового члена и наличие укушенной раны в области промежности.При пальпации выявлен опухший и увеличенный мочевой пузырь.
Результатов:
Диагностическое исследование выявило гемотропный микоплазмоз под микроскопом, а посев мочи оказался положительным на инфекцию Escherichia coli . Кошка успешно лечилась симптоматически.
Вывод:
Однако прогноз для этой кошки был осторожным, учитывая, что анемия не исчезла на момент выписки.
Ключевые слова: гемотропный микоплазмоз кошек, бактериальный цистит, кошка
Введение
Гемотропная микоплазма кошек — это часто диагностируемая инфекционная анемия у кошек в Малайзии.Это может происходить одновременно с другими заболеваниями, такими как панлейкопения кошек, лейкемия кошек и комплекс заболеваний верхних дыхательных путей. Микоплазмы — это небольшие свободноживущие бактерии, у которых отсутствует жесткая и защитная клеточная стенка, они процветают в окружающей среде [1]. Гемотропные микоплазмы — это небольшие грамотрицательные, не кислотоустойчивые некультивируемые бактерии без стенки, которые выживают на поверхности эритроцитов, ранее классифицированные как риккетсии под родом Hemobartonella. Однако результаты секвенирования генов 16S рРНК (рибосомная РНК) и рибонуклеазной (РНКазы) РНК повлияли на переклассификацию в род Mycoplasma [2].Он состоит из двух родов классификации: гемотропных с приставкой «гемо» и неполностью классифицированных с приставкой «кандидатус» [3]. Гемотропная микоплазма плеоморфна, поэтому ее можно найти во многих формах, таких как сферическая (коккоидная), кольцевая (печатка) или стержневая. Это безстеночные бактерии, которые прикрепляются и растут на поверхности эритроцитов. Он воспроизводится путем двойного деления и может происходить по отдельности или в цепочках. Гемотропная микоплазма может поражать кошек любого возраста [4]. Существует три основных пути передачи гемотропной микоплазмы у кошек; вертикальная передача (от матери к потомству), прямая передача от инфицированных кошек через слюну, десны или когти в результате царапин или укусов во время драки, а также от членистоногих-переносчиков, таких как ушные клещи, блохи, клещи, а также от комаров [5].Бактериальный цистит — это воспаление мочевого пузыря в результате бактериальной инфекции. Это вызвано рядом грамположительных (таких как Staphylococcus aureus ) и грамотрицательных бактерий (таких как Escherichia coli ). Клинически он проявляется поллакиурией, гематурией, дизурией и мочеиспусканием в неподходящих местах [6].Рисунок 1.
Рентгенография брюшной полости, (A) вентродорсальный вид и (B) правый боковой вид, показывающий гепатомегалию в ответ на гемолиз (маленькая белая стрелка) и растяжение мочевого пузыря (большая белая стрелка), вызывающее краниальное смещение содержимого брюшной полости.
Таблица 1.
Показывает биохимический профиль сыворотки.
| Биохимия | Результат | Номер ссылки |
|---|---|---|
| BUN | 30 мг / дл | 16–36 |
| CREA | 1,1 мг / дл | 0,8–2,4 |
| TP | 6,7 г / дл | 5,7–8,9 |
| ALB | 3.8 г / дл | 2,2–4,0 |
| GLB | 2,9 г / дл | 2,5–4,5 |
Таким образом, цель данного отчета — продемонстрировать случай гемотропного микоплазмоза кошек, сочетающегося с бактериальным циститом, у домашней короткошерстной кошки. В настоящее время имеется мало сообщений о возникновении обоих заболеваний у одной кошки в рутинной ветеринарной клинической практике.
История болезни
Трехлетний неповрежденный домашний короткошерстный кот, вес 3.7 кг были направлены в ветеринарную клинику Universiti Malaysia Kelantan из частной ветеринарной клиники. Направлен из-за стойкой дизурии и гематурии; следовательно, кошка пришла с постоянным мочевым катетером.
Диагностические осмотры
Клинический осмотр
При медицинском осмотре кошка была тупой, подавленной и жаропонижающей. Также наблюдались нормопноэ, брадикардия, выраженная бледность слизистой оболочки. Обследование мочеполовой системы выявило некротизированный кончик полового члена, укушенные раны и ожог мочой в промежности, а также опухший и увеличенный мочевой пузырь.Рентгенологическое исследование брюшной полости показало значительно увеличенный мочевой пузырь, охватывающий пять тел поясничных позвонков; таким образом, вызывая краниальное смещение органов брюшной полости и потерю рентгенографических деталей, как показано на рисунке 1. Ультрасонография брюшной полости показала растянутый мочевой пузырь (5 см × 5 см), содержащий взвешенные эхогенные материалы, и утолщенную стенку мочевого пузыря.Гематология и биохимия сыворотки
Общий анализ крови выявил гранулоцитоз, лимфопению, моноцитопению, макроцитарную гипохромную анемию, тромбоцитопению и признаки тромбопоэза, как показано в таблице 1-2.Быстро окрашенный мазок периферической крови выявил эперитроцитарные палочковидные организмы, весьма подозрительные на Mycoplasma haemofelis (рис. 2). Образец крови подвергали полимеразной цепной реакции для обнаружения генетического материала M. haemofelis , и результат был положительным.Общий анализ мочи
Моча темного цвета наблюдалась при цистоцентезе (рис. 3) с pH 7,0. Цитология мочи показала присутствие кокков и бактерий в форме палочки, а также нейтрофилов, однако кристаллов мочи не наблюдалось.Также наблюдались протеинурия, билирубинурия и гематурия. Посев мочи выявил E. coli . На основании вышеуказанных исследований у животного диагностирован гемотропный микоплазмоз кошек на фоне бактериального цистита.Таблица 2.
Показан гематологический профиль на 1 и 6 день госпитализации.
| Гемограмма | Результат | Номер ссылки | |
|---|---|---|---|
| День 1 | День 6 | ||
| Лейкоциты (10 3 / мкл) | 26.5 | 28,3 | 6,0–15,5 |
| Гранулоциты (10 3 / мкл) | 20,3 | 17,5 | 2,0–8,0 |
| Лимфоциты | 5,5 | 8,6 | 5,7–8,9 |
| Моноциты | 0,6 | 2,2 | 2,2–4,0 |
| Эритроциты (10 6 / мкл) | 4,54 | 4,38 | 6.50–10.00 |
| Гемоглобин (г / дл) | 6,6 | 6,8 | 10,0–15,0 |
| Гематокрит (%) | 26,5 | 27,3 | 30,0–45,0 |
| Средний корпускулярный объем (мкм 3 ) | 58,4 | 56,1 | 39,0–55,0 |
| Средний корпускулярный гемоглобин (пг) | 14,5 | 13,8 | 25,9–34,0 |
| Средняя концентрация корпускулярного гемоглобина (г / дл) | 24.9 | 26,4 | 30,0–35,9 |
| Ширина распределения ретикулоцитов (%) | 16,2 | 16,5 | 10–16.00 |
| Тромбоциты (10 3 / мкл) | 181 | 198 | 300–800 |
| Тромбокрит (%) | 0,066 | 0,145 | 0.200–0.500 |
Рисунок 2.
Мазок периферической крови, показывающий присутствие палочковидных эперитроцитов.
Диагностика
На основании анамнеза, физического осмотра, диагностической визуализации, клинической патологии, бактериологии и результатов полимеразной цепной реакции у кошки был диагностирован гемотропный микоплазмоз, сочетающийся с бактериальным циститом.
Рисунок 3.
Центрифугированная моча показывает красный оттенок надосадочной жидкости (гемоглобинурия) с осадками.
Лечение
Как показано в таблице 3, лечение было начато для достижения целей по устранению микоплазмы из крови (с использованием системных антибиотиков), восстановлению адекватной перфузии тканей и излечению бактериального цистита (с помощью антибиотиков).Катетеризация мочи была проведена для уменьшения растяжения мочевого пузыря и эффективного проведения ретроградной промывки мочевого пузыря метронидазолом и холодным физиологическим раствором в течение 5 дней. Для регидратации кошки и восстановления почечной потери электролитов была назначена медленная внутривенная инфузия раствора Хартмана. Гематология, проведенная на 6-й день госпитализации, показала уменьшение гранулоцитоза и изменение лимфоцитопении и моноцитопении. Рентгенография стенки мочевого пузыря показала уменьшение толщины. Общий прогноз был хорошим.Таблица 3.
Лекарство, которое дали кошке во время госпитализации.
| Наркотик | Дозировка | Маршрут | Частота | Продолжительность | Индикация |
|---|---|---|---|---|---|
| Амоксициллин-клавулановая кислота | ,0025 мг / кг | PO | BID | 5 дней | Лечить бактериальную инфекцию мочевого пузыря |
| Метронидазол | 10 мг / кг | IUT | BID | 5 дней | Лечить бактериальную инфекцию мочевого пузыря |
| Кошачий цистейд | |||||
| 1 вкладка | PO | BID | 10 дней | Защита стенки мочевого пузыря | |
| Мелоксикам | 0.3 мг / кг | PO | SID | 4 дня | Для уменьшения воспаления мочевого пузыря |
| Гель Hypermix | Актуальные | BID | 5 дней | Заживление ран некротизированного кончика полового члена, а также раны от укуса | |
| Ливоферол | |||||
| 2 мл | PO | BID | 12 дней | В качестве добавки для печени при анемии |
| Ветри DMG | |||||
| 0.5 мл | PO | 14 дней | Повышение иммунитета | |
| Доксициклин | 10 мг / кг | PO | SID | 21 день | Лечить Mycoplasma haemofelis |
Обсуждение
Основываясь на анамнезе, диагностике клинических признаков и реакции на лечение, подтверждающим диагнозом в этом случае был гемотропный микоплазмоз кошек, сочетающийся с бактериальным циститом.Гемотропный микоплазмоз диагностировали на основе сочетания истории борьбы и наличия инвазии блох [7,8] и, что более важно, клинических признаков анемии, летаргии, гипертермии и желтухи [9,10]. Будучи заболеванием, характеризующимся иммуноопосредованной гемолитической анемией, в некоторых случаях также наблюдается желтуха. При этом наблюдалась гепатомегалия, свидетельствующая об активном ответе печени на гемолиз (рис. 1). Наблюдение за эперитроцитарной микоплазмой на тонком мазке крови при диагностическом обследовании (рис.2), и обнаружение генетического материала микоплазмы с помощью полимеразной цепной реакции подтвердило диагноз гемотропного микоплазмоза в этом случае [11]. Для клинического лечения микоплазмоза используются несколько режимов антибиотиков [12]. Доксициклин в дозе 5 мг / кг массы тела два раза в день per os в течение 28 дней является режимом выбора как при остром, так и при хроническом микоплазмозе. Это было начато сразу после подтверждения наличия у кошки гемотропного микоплазмоза. Однако кошкам, не чувствительным к доксициклину, обычно назначают марбофлоксацин в дозе 2 мг / кг b.wt два раза в день в течение 14 дней [13]. Из-за иммуноопосредованного характера патогенеза микоплазмоза введение преднизона было приостановлено, несмотря на его стратегическое значение для снижения гуморального иммунного ответа, жизненно важного для патогенеза внесосудистого гемолиза [7]. Кроме того, из-за лимфоцитопенического состояния этой кошки преднизон не вводили, чтобы не вызывать в дальнейшем иммуносупрессию. Возникновение бактериального цистита также повлияло на решение не вводить стероид, а заменить его несколькими добавками, чтобы помочь печени и костному мозгу (таблица 3). Через 6 дней параметры начали нормализоваться, и количество лимфоцитов также начало расти. .Кошки на открытом воздухе обычно участвуют в драках, в которых могут участвовать кошки, инфицированные Mycoplasma spp. или заражены возможными переносчиками [7]. У этой кошки была укушенная рана в области промежности, а также в области полового члена; следовательно, предполагается передача микоплазмоза и бактериального цистита через укус в паховой области. Бактериальный цистит возник в результате восходящей инфекции из зараженной раны от укуса в нижние мочевыводящие пути. Бактериальный цистит купировался ретроградной промывкой катетеризованного мочевого пузыря метронидазолом в дозе 10 мг / кг b.wt и холодный физиологический раствор в течение 5 дней, а также введение per os амоксициллин-клавулановой кислоты в дозе 25 мг / кг веса тела два раза в день в течение 5 дней [14]. Этот режим был направлен на борьбу с инфекцией E. coli , поскольку может существовать риск множественной лекарственной устойчивости E. coli с вероятностью рецидива, если не лечить с помощью синергической антибактериальной терапии [15]. Рентгенография после лечения показала хороший ответ в виде уменьшения толщины стенки мочевого пузыря (рис. 4).Рисунок 4.
Рентгенография брюшной полости сбоку после лечения, показывающая нормальный размер мочевого пузыря (стрелка) и наличие запора.
Подавление иммунитета, вызванное иммуноопосредованным гемолизом, вызванным микоплазмами, еще больше усиливает прогрессирование бактериального цистита. Стресс от укуса и цистита, вызванный болью, также приводит к анорексии и снижению иммунного ответа. Исследование показало, что наличие сопутствующего заболевания вместе с микоплазмозом кошек является отрицательным прогностическим показателем для кошек [16].Однако в этом отчете прогноз выглядит неплохим, потому что гематологические параметры начали улучшаться и, что наиболее важно, лимфоциты поднялись до нормального уровня в течение недели.Септицемия может возникнуть из-за восходящей инфекции от этого случая; следовательно, необходимость усердно преподносить им антибиотик и дополнительное покрытие. Неразрешенная анемия может прогрессировать до множественных осложнений, связанных с гипоксическим повреждением тканей. Поэтому проводился постоянный мониторинг гематологической картины для упреждающего контроля состояния, и прогноз был осторожным.
Заключение
Гемотропный микоплазмоз кошек и бактериальный цистит были диагностированы у домашних короткошерстных кошек на основании анамнеза, клинических признаков, гематологии, бактериального посева и выделения, рентгенографии и молекулярного обнаружения. Было назначено лечение с использованием доксициклина (от микоплазмоза), амоксициллин-клавулановой кислоты (от бактериального цистита) и добавок для поддерживающей терапии, но прогноз для этой кошки осторожен, так как гематологическая картина на момент выписки все еще не соответствовала норме.Гемотропный микоплазмоз кошек, поэтому необходимо исследовать возможность возникновения одновременно с другими заболеваниями, чтобы правильно лечить кошек с этим заболеванием. Клиницисты также должны быть внимательны к E. coli с множественной лекарственной устойчивостью как возможное осложнение гемотропного микоплазмоза кошек, связанное с ранами от укусов.
Конфликт интересов
Нет конфликта интересов, о котором следует заявлять.
Вклад авторов
Сукумаран Хемасри и Ибрагим Абдул-Азиз Окене придумали и составили рукопись, Мохаммед Дауда Гони рецензировал рукопись.
Список литературы
1. Уэйтс К.Б., Сяо Л., Лю Ю., Балиш М.Ф., Аткинсон Т.П. Mycoplasma pneumoniae из дыхательных путей и за их пределами. Clin Microbiol Rev.2017; 30 (3): 747–809. https://doi.org/10.1128/CMR.00114-16.[CrossRef] [Google Scholar]
2. Sykes JE. Гемотропные микоплазмы кошек. Ветеринарная клиника Малая анимационная практика. 2010; 40 (6): 1157–70.
[CrossRef] [Google Scholar]
3. Roura X, Peters IR, Altet L, Tabar MD, Barker EN, Planellas M, et al. Распространенность гемотропных микоплазм у здоровых и нездоровых кошек и собак в Испании.J Vet Diagn Investig. 2010; 22 (2): 270–4. https://doi.org/10.1177/104063871002200219.
[CrossRef] [Google Scholar]
4. Хушьяр Ш., Ахтарданеш Б., Фард СРН, Халили М. Гемотропные микоплазмы у бездомных кошек в Кермане, Иран. J Med Bacteriol. 2017; 5 (3–4): 1–8.
[Google Scholar]
5. Сото Ф., Уокер Р., Сепульведа М., Биттенкур П., Акоста-Джаметт Г., Мюллер А. Возникновение гемотропных микоплазм собак у домашних собак из городских и сельских районов провинции Вальдивия на юге Чили.Comp Immunol Microbiol Infect Dis. 2017; 50: 70–7. https://doi.org/10.1016/j.cimid.2016.11.013.
[CrossRef] [Google Scholar]
6. Лев-Койрис С., Микульска-Скупьен Э., Снарска А., Кристкевич В. Оценка клинических признаков и причин заболеваний нижних мочевыводящих путей у польских кошек. Vet Med. 2017; 62 (7): 386–93. https://doi.org/10.17221/170/2016-VETMED.
[CrossRef] [PDF] [Google Scholar]
7. Нибблетт BMD, Снид Е.К., Валднер С., Тейлор С.М., Джексон М.Л., Кнорр Л.М. Анемия у кошек с гемотропной инфекцией mycoplasma : ретроспективная оценка 23 случаев (1996–2005).Canad Vet J. 2009; 50 (11): 1181.
[Google Scholar]
8. Сентил Н., Нагараджан К., Падманатх К., Субаприя С., Вайрамуту С., Тилагар М.Б. и др. Редкий случай микоплазмоза кошек. Int J Adv Vet Sci Technol. 2014; 3 (1): 106–8.
[CrossRef] [Google Scholar]
9. Мазахери Н.Ф., Вахеди С.М., Мохаммадхан Ф. Гемотропные микоплазмы (гемоплазмы): обзор. Int J Adv Biol Biomed Res. 2014; 2 (5): 1484–503.
[Google Scholar]
10. Вилли Б., Новакко М., Мели М., Вольф-Джекель Г., Боретти Ф., Венги Н. и др.Гемотропные микоплазмы кошек и собак: передача, диагностика, распространенность и значение в Европе. Schweiz Arch Tierheilkd. 2010; 152 (5): 237–44. https://doi.org/10.1024/0036-7281/a000055.
[CrossRef] [Google Scholar]
11. Дуарте А., Маркес В., Коррейя Дж. Х., Нето И., Браз Б. С., Родригес С. и др. Молекулярное обнаружение гемотропных видов Mycoplasma у городских и сельских кошек из Португалии. J Feline Med Surg. 2015; 17 (6): 516–22. https://doi.org/10.1177/1098612X14550172.
[CrossRef] [Google Scholar]
12.Таскер С. Гемотропные микоплазмы: каково их реальное значение для кошек? J Feline Med Surg. 2010; 12 (5): 369–81. https://doi.org/10.1016/j.jfms.2010.03.011.
[CrossRef] [Google Scholar]
13. Новакко М., Сугиарто С., Вилли Б., Бауманн Дж., Спири А.М., Остманн А. и др. Последовательное лечение антибиотиками доксициклином и марбофлоксацином устраняет бактериемию у кошек, инфицированных Mycoplasma haemofelis . Vet Microbiol. 2018; 217: 112–20. https://doi.org/10.1016/j.vetmic.2018.03.006.
[CrossRef] [Google Scholar]
14.Cray M, Berent AC, Weisse CW, Bagley D. Лечение пионефроза с помощью устройства подкожного обхода мочеточника у четырех кошек. J Am Vet Med Assoc. 2018; 252 (6): 744–53. https://doi.org/10.2460/javma.252.6.744.
[CrossRef] [Google Scholar]
15. Лай С.К., Чен С.К., Хуанг Х.Л., Чуанг Ю.К., Тан Х.Дж. Роль доксициклина в терапии множественной лекарственной устойчивости E. coli — исследование in vitro. Научный представитель 2016; 6: 31964. https://doi.org/10.1038/srep31964.
[CrossRef] [Google Scholar]
16.Reynolds CA, Lappin MR. Инфекция « Candidatus Mycoplasma haemominutum » у 21 кошки, принадлежащей клиенту. J Am Anim Hosp Assoc. 2007; 43 (5): 249–57. https://doi.org/10.5326/0430249.
[CrossRef] [Google Scholar]
Генетическая структура, устойчивость к противомикробным препаратам и частота ассоциированных с человеком типов последовательностей Escherichia coli среди фекальных изолятов здоровых собак и кошек, живущих в Канберре, Австралия
Abstract
Внекишечный патоген Escherichia coli (ExPEC) вызывает клинические инфекции у людей.Понимание эволюции и распространения штаммов ExPEC через потенциальные резервуары важно из-за связанной с ними заболеваемости, затрат на здравоохранение и смертности. Для дальнейшего понимания в этом исследовании были изучены изоляты, выделенные из фекалий 221 здоровой собаки и 427 здоровых кошек. Распределение филогрупп варьировалось в зависимости от вида-хозяина и зависело от того, живет ли животное в приюте или доме. Связанные с человеком ST 69, 73, 95, 131 и 127 были преобладающими, с 30,5% изолятов кошек и 10.3% изолятов собак, представляющих эти типы последовательностей ExPEC. Устойчивость к антибиотикам ампициллину и тетрациклину была обычным явлением, но устойчивость к другим противомикробным препаратам была незначительной.
Цитирование: Bourne JA, Chong WL, Gordon DM (2019) Генетическая структура, устойчивость к противомикробным препаратам и частота ассоциированных с человеком типов последовательностей Escherichia coli среди фекальных изолятов от здоровых собак и кошек, живущих в Канберре, Австралия. PLoS ONE 14 (3): e0212867.https://doi.org/10.1371/journal.pone.0212867
Редактор: Читрита Деброй, Университет штата Пенсильвания, США
Поступила: 29 июля 2018 г .; Одобрена: 11 февраля 2019 г .; Опубликовано: 4 марта 2019 г.
Авторские права: © 2019 Bourne et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в документе и его файлах с вспомогательной информацией.
Финансирование: Авторы не получали специального финансирования на эту работу.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Escherichia coli является обычным членом микробиоты нижнего отдела кишечника млекопитающих и, в меньшей степени, птиц [1].Вид генетически разнообразен и обладает значительной генетической субструктурой [2]. Вид разделен на восемь филогрупп [3]. E . Изоляты coli , скорее всего, принадлежат к филогруппам A, B1, B2 и D, тогда как штаммы, принадлежащие к филогруппам C, E, F и Clade I, встречаются реже [1]. Штаммы, принадлежащие к разным филогруппам, различаются по размеру генома, вариабельному содержанию генов, ассоциации с заболеванием, экологической нише и характеристикам жизненного цикла [4].
Хотя большинство штаммов E . coli ведут себя как комменсалы нижнего отдела кишечника позвоночных, некоторые способны вызывать кишечные и внекишечные заболевания. Штаммы, вызывающие кишечные заболевания, имеют разнообразное филогенетическое происхождение [5]. Однако большинство штаммов, ответственных за внекишечные заболевания, такие как инфекции мочевыводящих путей (ИМП) или сепсис, являются членами филогруппы B2 и, в меньшей степени, филогруппы D [6, 7]. Техника многолокусного типирования последовательностей (MLST) [8] показала, что существуют сотни типов последовательностей (ST) внутри филогрупп B2 и D.Однако, несмотря на это разнообразие, очень небольшая часть ЗТ ответственна за подавляющее большинство внекишечных инфекций. Это ST филогруппы B2, ST73, ST95 и ST131 и филогруппа D ST, ST69, которые в значительной степени связаны с человеком [9]. По крайней мере, один (ST 95) редко выделяется от домашнего скота, диких птиц или млекопитающих [10]. Частота, с которой эти общие ассоциированные с человеком ST наблюдаются у домашних животных, неясна.
Внекишечные инфекции также встречаются у собак и кошек, в основном как неосложненные ИМП.Как и у людей, E . coli — наиболее частая причина таких инфекций у собак [11]. Инфекция мочевыводящих путей у кошек относительно редко [12], но если она действительно возникает, E . coli также является наиболее частой причиной. Как и у людей, изоляты, принадлежащие к филогруппам B2 и D, с большей вероятностью будут извлечены от внекишечных инфекций домашних животных [13, 14]. Четыре ST, обычно ответственные за внекишечную инфекцию у людей (ST 69, 73, 95 и 131), были выделены от здоровых или больных животных-компаньонов.ST131 обычно встречается у собак и кошек [15–17], но имеется немного сообщений о других ST: ST69 у собак, ST73 у кошек и собак, ST127 у собак и один изолят ST95 у собак [18–21]. Какие исследования были предприняты, в основном основывались на клинических изолятах, проявляющих устойчивость к определенным противомикробным препаратам, таким как фторхинолоны [15, 17, 22].
Хотя связанные с человеком ST 69, 73, 95 и 131 наблюдались у домашних животных, имеется относительно мало данных, позволяющих оценить степень, в которой животные-компаньоны представляют собой зоонозный резервуар этих связанных с человеком ST.Было показано, что члены семьи, в том числе домашнее животное, с большей вероятностью разделяют E . coli , чем у лиц, не проживающих в одном домохозяйстве [23]. В то время как в одном исследовании было обнаружено, что штамм ST73 является общим для членов семьи, включая собаку, и сохраняется в семье более трех лет [24].
Целью настоящего исследования была оценка генетической структуры, разнообразия, а также частоты человеческих ассоциированных ST E . coli в фекалиях собак и кошек, живущих в регионе Канберра в Австралии, и для определения чувствительности выделенных изолятов к антибиотикам.
Результаты
Е . coli разнообразиеЕ . coli был обнаружен у 334 (78,2%) из 427 кошек и у 203 (91,9%) из 221 собаки. Таким образом, E . coli было значительно менее вероятно обнаружено у кошек по сравнению с собаками (анализ таблицы непредвиденных обстоятельств: P> X 2 <0.001).
Относительная численность филогрупп варьировалась в зависимости от типа хозяина (кошка или собака) и различалась в зависимости от того, было ли животное домашним животным или проживало в приюте для животных (номинальная логистическая регрессия: кошка / собака, P> X 2 <0,01; Домашнее животное / приют P> X 2 <0,001: Кошка / собака * Домашнее животное / приют P> X 2 <0,82) (Таблица 1). Было небольшое различие в относительной численности штаммов филогруппы B1, D, E или F у кошек по сравнению с собаками, но штаммы филогруппы B2 были чрезмерно представлены у кошек, в то время как филогруппа A была чрезмерно представлена у собак (Таблица 1).Сравнение кошек и собак, живущих в приюте для животных, с животными, живущими в приюте, показывает, что люди, живущие в приюте, имеют более низкую частоту штаммов филогруппы A и повышенную частоту штаммов B1 по сравнению с животными, не живущими в приюте (таблица 1). Относительная численность филогрупп B2, D, E и F не различалась между животными, живущими в доме, и животными, живущими в приюте.
Для кошек, проживающих в приюте для животных, относительная численность филогрупп не зависела от пола животного (анализ таблицы непредвиденных обстоятельств: P> X 2 <0.16) (данные не представлены). Для собак относительная численность филогрупп не различалась между полами (номинальная логистическая регрессия: пол, P> X 2 <0,051; Pet / Shelter P> X 2 <0,12) (данные не представлены).
Из 334 изолятов от кошек 30,5% представляли один из ST, ассоциированных с человеком (ST 69, 73, 95, 127, 131), значительно более высокая частота ассоциированных с человеком ST, чем наблюдалась у собак, так как только 10,3% 203 изолята от собак представляли эти ST (анализ таблицы непредвиденных обстоятельств: P> X 2 <0.0001).
Если кошка или собака имели штамм филогруппы D, то вероятность того, что этот штамм был штаммом ST69, не зависела от хозяина, от которого был выделен изолят (анализ таблицы непредвиденных обстоятельств; P> X 2 = 0,17) ( Таблица 2). Аналогичным образом, если кошка или собака имели штамм филогруппы B2, то вероятность того, что штамм филогруппы B2 был штаммом ST95, ST127 или ST131, не зависела от вида хозяина, от которого был выделен изолят (анализ таблицы непредвиденных обстоятельств; ST95, P > Х 2 = 0.09; ST127, P> X 2 = 0,19; ST131, P> X 2 = 0,15) (таблица 2). Однако штамм филогруппы B2 с большей вероятностью был штаммом ST73, если он был получен от кошки, а не изолирован от собаки (анализ таблицы непредвиденных обстоятельств; P> X 2 <0,0001) (таблица 2).
Таблица 2. Частота основных ассоциированных людей E . coli типов последовательностей (ST) по отношению к количеству изолятов филогруппы D (ST69), количеству изолятов B2 (ST 73, 95, 127, 131) или общему количеству E . изолятов кишечной палочки выделено из группы хозяев.
https://doi.org/10.1371/journal.pone.0212867.t002
Общее разнообразие генотипов (REP-типов) было высоким, что указывает на то, что у большинства животных был другой генотип (Таблица 3). Из этого паттерна были два исключения: изоляты филогрупп B2 и F от кошек. Более низкий уровень разнообразия, наблюдаемый среди изолятов B2, был в значительной степени обусловлен высокой частотой штаммов ST73, в то время как один генотип представлял 70% обнаруженных изолятов филогруппы F.
Чувствительность к противомикробным препаратам
За исключением ампициллина и тетрациклина, большинство изолятов были чувствительны ко всем протестированным антибиотикам (таблица 4). Среди кошек и собак, живущих в доме, 62,5% из 64 изолятов от кошек были чувствительны как к ампициллину, так и к тетрациклину, в то время как 70,5% из 173 изолятов собак были чувствительны, и не было различий в профилях чувствительности к ампициллину / тетрациклину изолятов от кошек или собак. с домом (Анализ таблицы непредвиденных обстоятельств: P> X 2 = 0.30), а устойчивость к ампициллину / тетрациклину была редкостью (3,4%). Среди собак и кошек, проживающих в приюте для животных, 65,2% из 270 изолятов от кошек были чувствительны как к ампициллину, так и к тетрациклину, а 83,3% из 30 изолятов собак были чувствительны. Наблюдалась значительная разница в профилях чувствительности к ампициллину / тетрациклину изолятов от животных, проживающих в приюте (анализ таблицы непредвиденных обстоятельств: P> X 2 = 0,034), при этом собачьи изоляты были более чувствительны к обоим антибиотикам, а 10 % изолятов от кошек были устойчивы как к ампициллину, так и к тетрациклину, ни один из изолятов собак не был устойчив к обоим антибиотикам.
Частота изолятов, чувствительных как к ампициллину, так и к тетрациклину, значительно снижалась с увеличением количества дней, проведенных кошкой в приюте для животных, в то время как частота изолятов, устойчивых к обоим антибиотикам, увеличивалась (номинальная логистическая регрессия: P> X 2 = 0,004) (Рисунок 1). Наблюдалось умеренное увеличение частоты изолятов, устойчивых только к тетрациклину (рис. 1).
Рис 1. Прогнозируемое изменение частоты E . coli изолятов кошек, устойчивых к ампициллину, тетрациклину или обоим противомикробным препаратам, в зависимости от количества дней, в течение которых кошка находилась в приюте для животных.
https://doi.org/10.1371/journal.pone.0212867.g001
Обсуждение
Несколько других исследований изучали относительную численность E . coli филогрупп в фекалиях здоровых собак и кошек, и сравнение этих исследований показывает небольшое совпадение между исследованиями (таблица 5). Было показано, что относительное количество филогрупп в образцах фекалий человека зависит от географического местоположения [25]: в образцах, взятых у людей, живущих в умеренном климате / в развитых странах, наиболее распространены изоляты, принадлежащие к филогруппе B2, тогда как штаммы филогруппы A или B1 преобладают. в выборках от людей, живущих в тропическом климате / развивающихся странах [25, 26].Все исследования генетической структуры E . coli у здоровых собак находились в районах с умеренным климатом / в развитых странах. Хотя типичные диеты для собак могут отличаться в Японии и других странах, маловероятно, что есть большие различия между диетами, которыми кормят собак в Австралии, Канаде и Соединенном Королевстве. Настоящее исследование показало различия в структуре филогрупп в зависимости от того, были ли собаки домашними животными или проживали в приюте для животных.Собаки, отобранные в исследованиях в Канаде и Великобритании, были домашними животными. У здоровых кошек, живущих в Торонто, Канада, фекальный E . coli Представленность филогрупп составила 76,2%, 14,3%, 9,5% и 21% соответственно для филогрупп A, B1, B2 и D [27]. Представление филогруппы E . coli , выделенная из ректальных мазков здоровых кошек в Иране (n = 90) групп A, B1, B2 и D, составила 66,7%, 1,2%, 13,4% и 18,9% [28]. Напротив, частота штаммов филогрупп B1 и B2 у австралийских кошек была намного выше (Таблица 1).Если мы хотим понять различия в структуре филогрупп E , необходимы дальнейшие исследования. coli популяций, выделенных от одного вида-хозяина, взятых из разных мест.
ТипированиеREP выявило высокое разнообразие среди доминантных изолятов. Всего было обнаружено 185 уникальных ДНК-отпечатков пальцев среди 334 изолятов кошек и 158 уникальных типов среди 201 изолята собак. Этот результат сопоставим с сообщением [32] с 48 уникальными типами среди 108 изолятов от 37 кошек и 106 типами среди 196 изолятов от 71 собаки.
Связанные с человеком ExPEC ST составляют около трети от всех E . coli изолятов, выделенных из образцов фекалий человека в регионе Канберры [[10]; неопубликованные данные] (таблица 6). Собаки с такой же вероятностью, как и люди, являются носителями штаммов ST127, но значительно реже являются носителями штаммов, принадлежащих к другим связанным с человеком ST (таблица 6). Напротив, в то время как кошки с меньшей вероятностью являются носителями штаммов ST95, ST131 или ST69, они с такой же вероятностью являются носителями штаммов ST127 и почти в два раза чаще несут штаммы ST73 по сравнению с носителями этих ST у людей (таблица 6).
Все связанные с человеком ExPEC ST были выделены от здоровых или больных собак, но подавляющее большинство предыдущих исследований было сосредоточено на клинических изолятах, использовалось селекция антибиотиков (особенно фторхинолонов) или и то, и другое. ST131 является наиболее распространенным ExPEC ST у собак и кошек [15, 16, 33], но есть несколько сообщений о других ST: ST69 у собак, ST73 у кошек и собак, ST127 у собак и один изолят ST95 в собака [18–20].
Есть опасения, что устойчивость к противомикробным препаратам в E . coli , содержащиеся в штаммах животных-компаньонов, может передаваться людям, что еще больше ограничивает возможности лечения инфекций ExPEC у людей. Признавая, что нет прямых доказательств передачи устойчивости к противомикробным препаратам от E . coli у домашних животных и людей, несколько авторов [34–36] отмечают, что тесные отношения между людьми и их домашними животными предоставляют возможности для обмена штаммами; что устойчивые бактерии и гены были получены от здоровых домашних животных [35]; что одни и те же классы противомикробных препаратов используются в медицине и ветеринарии [37]; сообщалось о случаях возможной передачи ExPEC от домашних животных человеку [38, 39].
Скрининг доминанта E . Изоляты coli в этом исследовании обнаружили фенотипическую устойчивость к ампициллину у 31,1% изолятов кошек и 20,2% изолятов собак и к тетрациклину в 13,2% изолятов кошек и 9,9% изолятов собак. Устойчивость к ампициллину и тетрациклину является обычным явлением, и этот результат согласуется с большинством предыдущих исследований. Недавний обзор E . coli фекальных изолятов собак, посещающих ветеринаров в Великобритании, показали, что 37,2% изолятов были устойчивы к ампициллину, а 30% — к тетрациклину [40].Обследование собак и кошек в Португалии обнаружило гораздо более низкую распространенность устойчивости к ампициллину в E . coli фекальных изолятов с устойчивостью 16,7% изолятов кошек и 7,7% изолятов собак: уровни устойчивости к тетрациклину составляли 20,5% для фекальных изолятов от изолятов собак и 18,2% для изолятов фекалий кошек [35]. Обследование здоровых собак в питомнике в Бельгии выявило устойчивость 12% к ампициллину и 17% к тетрациклину, а также очень низкие или не определяемые уровни устойчивости к хлорамфениколу, энрофлоксацину и гентамицину [41].Канадское клиническое исследование E . coli изолятов инфекций ИМП у собак обнаружили низкий уровень устойчивости ко всем антибиотикам, с ампициллином 8,8% и тетрациклином 7,1%, а бета-лактамаз расширенного спектра не обнаружено [42]. Другие недавние клинические исследования E . coli изолятов инфекций мочевых путей у собак и кошек сообщили об устойчивости к более широкому спектру антибиотиков, включая хинолоны и бета-лактамазы расширенного спектра действия (БЛРС) [43, 44].
Прямой контакт с домашними животными, живущими в тесном контакте со своими хозяевами, считается источником заражения человека бета-лактамазой расширенного спектра (БЛРС), продуцирующей E . coli [23, 45]. Однако в этом исследовании очень мало E . Изоляты кишечной палочки от собак и кошек были устойчивы к цефалоспоринам третьего поколения на основании скрининга с использованием цефтазидима. Этот антибиотик считается одним из цефалоспоринов третьего поколения с самой высокой чувствительностью для обнаружения БЛРС [46].Чувствительность к БЛРС, обнаруженная в этом исследовании, контрастирует с сообщениями в других странах Австралии и за рубежом о высоких уровнях устойчивости к БЛРС в E . coli , выделенная как от собак, так и от кошек [17, 40, 47–54]. Однако в этих исследованиях использовались селективные среды или клинические изоляты из разных мест.
Как и в другом отчете, в котором не использовались селективные среды для антибиотиков [55], не было доказательств устойчивости к карбапенемам среди изолятов канберрских собак и кошек.
Частота E . coli изолятов от кошек, устойчивых как к ампициллину, так и к тетрациклину, увеличивалась по мере того, как животные находились в приюте для животных до отбора проб. Тетрациклины (доксициклин) обычно использовались для эмпирического лечения кошек, проживающих в приюте, с симптомами кошачьей инфекции верхних дыхательных путей (возбудители включают вирус герпеса кошек, калицивирус, Mycoplasma felis , Chlamydophila felis и , вторичную бактериальную инфекцию Bordatella0006). в соответствии с рекомендациями Консультативной группы по инфекционным заболеваниям Австралии — антибиотики (http: // www.ava.com.au/sites/default/files/AVA_website/pdfs/AIDAP%20prescribing%20guidelines.pdf). Изоляты, устойчивые к ампициллину, тетрациклину или обоим, наблюдались среди штаммов, принадлежащих к филогруппам A, B1, B2, D и F. Такие результаты предполагают, что эволюция изолятов, устойчивых к обоим антибиотикам, могла быть связана с переносом плазмиды R между изолятами. принадлежат к разным линиям, а не к независимым эволюционным событиям, происходящим в изолятах, принадлежащих к каждой из филогрупп. Последовательный отбор проб у одних и тех же людей во время их пребывания в приюте для животных в сочетании с полногеномным секвенированием изолятов потребуется для определения того, как возникает частота изолятов, устойчивых к обоим антибиотикам.
Это исследование показало, что домашние животные несут E . coli изолятов, принадлежащих к одной из человеческих линий. Однако известно, что значительная субструктура встречается в клональных комплексах 73, 95 и 131 [10, 56, 57]. Клональный комплекс 95 состоит по крайней мере из пяти четко определенных подгрупп, и хотя штаммы CC95 могут быть выделены от домашней птицы и человека [10], подавляющее большинство изолятов от домашней птицы принадлежит только к одной из подгрупп CC95. Такой результат предполагает, что изоляты, принадлежащие к одному и тому же клональному комплексу, могут иметь некоторую степень «предпочтения хозяина».Субструктура также присутствует в ST131 [57] и ST73 [56], но четкие специфические особенности хозяина до настоящего времени не описаны [58, 59]. Исследования по секвенированию всего генома необходимы для определения степени различий, проявляемых изолятами, принадлежащими к одному и тому же клональному комплексу, но изолированными от разных видов хозяев.
Материалы и методы
Источник образцов
С 2015 по 2017 год было собранообразцов фекалий 221 собаки и 427 кошек в городе Канберра и его окрестностях (Австралийская столичная территория, Австралия).Образцы кошек были собраны в приюте для животных и пунктах краткосрочного пребывания. Образцы собак были собраны владельцем у домашних собак в собачьем парке, в питомниках краткосрочного пребывания или в питомниках долгосрочного пребывания; в том числе собак, содержащихся в приюте для животных. Информация о возрасте и массе тела хозяина была недоступна для большинства животных, но изоляты, как правило, брали от взрослых особей.
Е . coli изоляцияСвежий фекальный материал разводили штрихами на чашки с агаром MacConkey [60] и инкубировали в течение ночи при 35 ° C.По одной хорошо изолированной лактозоположительной колонии из каждого образца переносили в чашки с цитратом Симмонса и агаром Luria Bertani [60] и инкубировали в течение ночи при 35 ° C. Предполагаемый E . Было подтверждено, что изоляты coli (положительные по лактозе и отрицательные по цитрату) являются E . coli с помощью генетического анализа (см. Ниже). Изоляты инокулировали в 5 мл лизогенного бульона (LB) и инкубировали при 36 ° C при встряхивании в течение 18 часов. Аликвоту этой суспензии объемом 1 мл объединяли с 0.5 мл стерильного глицерина и хранить при -80 ° C.
Е . coli характеристикаВ результате процедуры выделения было получено 203 изолята от 221 собаки и 334 изолята от 427 кошек. ДНК экстрагировали из ночной культуры LB каждого изолята с использованием реагента для выделения геномной ДНК DNAzol (Invitrogen) в соответствии с инструкциями производителя. Осажденную этанолом ДНК ресуспендировали в буфере Tris-EDTA, и эту матричную ДНК хранили при -20 ° C.
ДНК-отпечатка различных штаммов были получены с помощью полимеразной цепной реакции (ПЦР) для амплификации повторяющихся экстрагенных палиндромных (REP) элементов и последовательностей повторяющегося межгенного консенсуса энтеробактерий (ERIC) [61, 62].ПЦР-амплификацию выполняли в термоциклере Applied Biosystems 2720. Реакционная смесь REP для ПЦР (20 мкл) содержала около 10 нг ДНК-матрицы, 1 x буфер для полимеризации для ПЦР (Fisher Biotech), MgCl2 при 3,5 мМ, N 6 (CGG) 4 праймер [62] при 0,4 мМ и 1,0 ДНК-полимераза U MyTaq Red (Биолин). Условия цикла были следующими: денатурация при 95 ° C в течение 3 минут, с последующей амплификацией в течение 35 циклов при 95 ° C в течение 1 минуты и 72 ° C в течение 3 минут, с последующей стадией заключительного удлинения при 72 ° C в течение 8 минут.Реакционная смесь для ПЦР ERIC (20 мкл) содержала приблизительно 10 нг ДНК-матрицы, 1 x буфер для полимеризации для ПЦР (Биолин), ERIC1 и ERIC2 [61] каждый при 0,4 мМ и 1,0 Ед ДНК-полимеразы MyTaq Red (Биолин). Условия цикла ERIC были следующими: начальная денатурация в течение 2 минут при 95 ° C, затем 30 циклов по 3 секунды при 94 ° C, 30 секунд при 92 ° C, отжиг при 50 ° C в течение 1 минуты и удлинение при 65 ° C в течение 8 мин. Продукты ПЦР разделяли и визуализировали на 1,2% агарозных гелях в буфере 1-трисборат-ЭДТА (ТВЕ) с использованием окрашивания бромидом этидия.
изолята были отнесены к филогруппе по методу Клермона [3]. Реакционная смесь (20 мкл) содержала около 10 нг ДНК-матрицы, 1 x MyTaq Red PCR-буфер (Bioline), праймеры (arpA.f, arpA.r, Chua.1b, Chua.2, Yja.1b, Yja.2b. , Tsp.1b и Tsp.2 каждый в концентрации 0,4 мМ и 1,0 ед. ДНК-полимеразы MyTaq Red (Bioline). Условия цикла были следующими: начальная денатурация 5 мин при 94 ° C, затем 30 циклов по 5 с при 94 ° C, 25 с при 59 ° C; с последним продлением на 5 мин при 72 ° C.Продукты ПЦР были разделены и визуализированы на 1.2% агарозные гели в буфере 1-трисборат-ЭДТА (ТВЕ) с использованием окрашивания бромидом этидия.
Изолятыфилогрупп B2 и D были проверены на наличие 4 типов последовательностей (ST) 69, 73, 95 и 131 человека, используя метод Думита [9]. Метод Клермонта [63] был использован для определения того, можно ли отнести изоляты филогруппы B2 к какому-либо из девяти основных E . coli клонов филогруппы B2, вовлеченных в штаммы внекишечных инфекций человека.
Чувствительность к противомикробным препаратам
Все изоляты были проверены с использованием процедуры BD BBL Sensi-Disc (http: // legacy.bd.com/ds/technicalCenter/inserts/8840621(201107).pdf) на чашках с агаром Мюллера-Хинтона (Merck) и с использованием дисков для тестирования чувствительности к противомикробным препаратам BBL Sensi-Disc (Becton, Dickinson and Company). Противомикробными средствами, представляющими восемь основных классов противомикробных препаратов, были ампициллин (10 мкг), ципрофлоксацин (5 мкг), тетрациклин (30 мкг), хлорамфеникол (30 мкг), гентамицин (120 мкг), эртапенем (10 мкг), налидиксовая кислота (30 мкг). и цефтазидин (30 мкг). Диаметры зон ингибирования измеряли на приборе ProtoCol 3 (Synbiosis).Модель E . Штаммы coli были классифицированы как чувствительные, промежуточные или устойчивые к противомикробным препаратам на основании диаметра их зоны после 18–24 часов инкубации при 35 ° C с использованием контрольных точек BBL Sensi-Disc.
Метаданные хозяина и обозначение типа REP, филогруппа, связанный с человеком ST и профиль чувствительности к антимикробным препаратам для всех изолятов Escherichia coli представлены в таблице S1.
Благодарности
Это исследование не могло быть проведено без помощи многих людей, которые позволили мне взять образцы своих домашних и приютных животных.Их помощь была важна для успеха этого исследования и очень ценится.
Список литературы
- 1. Гордон Д.М., Коулинг А. Распространение и генетическая структура Escherichia coli у австралийских позвоночных: хозяин и географические эффекты. Микробиология. 2003. 149 (12): 3575–86.
- 2. Tenaillon O, Skurnik D, Picard B, Denamur E. Популяционная генетика комменсальной Escherichia coli. Обзоры природы микробиологии. 2010. 8 (3): 207–17. pmid: 20157339
- 3.Клермон О., Кристенсон Дж. К., Денамур Е., Гордон Д. М.. Пересмотр метода филотипирования Clermont Escherichia coli: улучшение специфичности и обнаружение новых филогрупп. Отчеты по микробиологии окружающей среды. 2013. 5 (1): 58–65. pmid: 23757131
- 4. Гордон Д. Влияние экологических факторов на распространение и генетическую структуру Escherichia coli. EcoSal Plus. 2004; 1 (1).
- 5. Croxen MA, Law RJ, Scholz R, Keeney KM, Wlodarska M, Finlay BB.Последние достижения в понимании кишечной патогенной кишечной палочки. Обзоры клинической микробиологии. 2013; 26 (4): 822–80.
- 6. Пикард Б., Гарсия Дж. С., Гуриу С., Дурье П., Брахими Н., Бинген Е. и др. Связь филогении и вирулентности внекишечной инфекции Escherichia coli. Инфекция и иммунитет. 1999. 67 (2): 546–53. pmid: 97
- 7. Джонсон-младший, Делавари П., Кусковски М., Стелл А.Л. Филогенетическое распределение признаков, связанных с внекишечной вирулентностью, у Escherichia coli.Журнал инфекционных болезней. 2001. 183 (1): 78–88. pmid: 11106538
- 8. Maiden MC, Bygraves JA, Feil E, Morelli G, Russell JE, Urwin R и др. Мультилокусное типирование последовательностей: портативный подход к идентификации клонов в популяциях патогенных микроорганизмов. Труды Национальной академии наук. 1998. 95 (6): 3140–5.
- 9. Думит М., Дэй М., Чесельчук Х., Хоуп Р., Андервуд А., Рейнольдс Р. и др. Быстрая идентификация основных типов последовательностей Escherichia coli, вызывающих инфекции мочевыводящих путей и кровотока.Журнал клинической микробиологии. 2015; 53 (1): 160–6. pmid: 25355761
- 10. Гордон Д.М., Гейик С., Клермон О., О’Брайен С.Л., Хуанг С., Абаясекара С. и др. Анализ структуры в мелком масштабе показывает характер эпидемии клонального комплекса 95, космополитической линии происхождения Escherichia coli, ответственной за внекишечную инфекцию. Msphere. 2017; 2 (3): e00168–17. pmid: 28593194
- 11. Томпсон М.Ф., Литстер А.Л., Плателл Дж.Л., Тротт Д. Бактериальные инфекции мочевыводящих путей у собак: новые разработки в отношении старых патогенов.Ветеринарный журнал. 2011; 190 (1): 22–7. pmid: 21239193
- 12. Литстер А., Томпсон М., Мосс С., Тротт Д. Кошачьи бактериальные инфекции мочевыводящих путей: обновленная информация о развивающейся клинической проблеме. Ветеринарный журнал. 2011. 187 (1): 18–22. pmid: 20044282
- 13. Хаттон Т.А., Иннес Г.К., Харел Дж., Гарно П., Куккьяра А., Шифферли Д.М. и др. Филогруппа и связь гена вирулентности с клиническими характеристиками инфекций мочевыводящих путей, вызванных Escherichia coli, у собак и кошек.Журнал ветеринарных диагностических исследований. 2018; 30 (1): 64–70.
- 14. Клермон О, Олиер М., Ходе С., Дайанкур Л., Брисс С., Кероудин М. и др. Штаммы Escherichia coli, патогенные для животных и человека, имеют общий генетический фон. Инфекция, генетика и эволюция. 2011. 11 (3): 654–62. pmid: 21324381
- 15. Guo S, Brouwers HJ, Cobbold RN, Platell JL, Chapman TA, Barrs VR, et al. Устойчивые к фторхинолонам внекишечные патогенные бактерии Escherichia coli, включая O25b-ST131, выделенные из фекалий госпитализированных собак в австралийском ветеринарном центре.Журнал антимикробной химиотерапии. 2013. 68 (5): 1025–31. pmid: 23299573.
- 16. Platell JL, Cobbold RN, Johnson JR, Heisig A, Heisig P, Clabots C, et al. Общность между устойчивыми к фторхинолонам последовательностями типа ST131 внекишечных изолятов Escherichia coli от людей и домашних животных в Австралии. Противомикробные средства и химиотерапия. 2011; 55 (8): 3782–7. pmid: 21646486
- 17. Эверс С., Гроббель М., Штамм И., Копп П.А., Диль И., Семмлер Т. и др.Появление пандемии человека O25: h5-ST131 CTX-M-15 Escherichia coli, продуцирующей β-лактамазу расширенного спектра действия, среди домашних животных. Журнал антимикробной химиотерапии. 2010. 65 (4): 651–60.
- 18. Эверс С., Бете А., Семмлер Т., Гюнтер С., Вилер Л., Escherichia coli, продуцирующая β-лактамазы и AmpC с расширенным спектром действия, у домашнего скота и домашних животных и их предполагаемое влияние на общественное здоровье: глобальная перспектива. Клиническая микробиология и инфекции. 2012. 18 (7): 646–55.
- 19. Джонсон Дж. Р., Джонстон Б., Клаботс С. Р., Кусковски М. А., Робертс Е., Деброй С. Генотипы вирулентности и филогенетический фон изолятов серогруппы О6 Escherichia coli от людей, собак и кошек. Журнал клинической микробиологии. 2008. 46 (2): 417–22. pmid: 18003805
- 20. Tamang MD, Nam H-M, Jang G-C, Kim S-R, Chae MH, Jung S-C и др. Молекулярная характеристика β-лактамазы расширенного спектра и плазмиды, опосредованной AmpC β-лактамазой, продуцирующей Escherichia coli, выделенной от бездомных собак из Кореи.Противомикробные средства и химиотерапия. 2012: AAC. 05598–11.
- 21. Лю X, Thungrat K, Boothe DM. Мультилокусное типирование последовательностей и профили вирулентности уропатогенной Escherichia coli, выделенной от кошек в США. ПлоС один. 2015; 10 (11): e0143335. pmid: 26587840
- 22. Platell JL, Cobbold RN, Johnson JR, Trott DJ. Распределение клональных групп устойчивой к фторхинолонам Escherichia coli среди людей и домашних животных в Австралии. Журнал антимикробной химиотерапии.2010. 65 (9): 1936–8. pmid: 20570998
- 23. Джонсон Дж. Р., Оуэнс К., Гаевски А., Клаботс С. Модели колонизации кишечной палочки среди членов семьи и домашних животных с уделением внимания острой инфекции мочевыводящих путей. Журнал инфекционных болезней. 2008. 197 (2): 218–24. pmid: 18179385
- 24. Ривз П.Р., Лю Б., Чжоу З., Ли Д., Го Д., Рен Й и др. Скорость мутации и передачи вируса хозяину для клона Escherichia coli за 3 года. ПлоС один. 2011; 6 (10): e26907.pmid: 22046404
- 25. Эскобар-Парамо П., Гренет К., Ле Менак А., Роде Л., Сальгадо Е., Аморин С. и др. Крупномасштабная популяционная структура комменсальных изолятов Escherichia coli человека. Прикладная и экологическая микробиология. 2004. 70 (9): 5698–700. pmid: 15345464
- 26. Blyton MD, Cornall SJ, Kennedy K, Colligon P, Gordon DM. Зависимое от пола конкурентное доминирование штаммов филогенетической группы B2 Escherichia coli в организме человека-хозяина. Отчеты по микробиологии окружающей среды.2014. 6 (6): 605–10. pmid: 25756113
- 27.
Уайт А., Сибли К., Сибли С., Васмут Дж., Шефер Р., Сюретт М. и др. Сравнение межгенных последовательностей изолятов Escherichia coli выявляет адаптацию к образу жизни, но не специфичность к хозяину. Прикладная и экологическая микробиология. 2011. 77 (21): 7620–32. pmid: 21
5 - 28. Ахтарданеш Б., Ганбарпур Р., Гянджалихани С., Газанфари П., редакторы. Определение генов устойчивости к антибиотикам в зависимости от филогенетического фона в изолятах Escherichia coli из образцов фекалий здоровых домашних кошек в городе Керман.Форум ветеринарных исследований; 2016: Факультет ветеринарной медицины, Университет Урмия, Урмия, Иран.
- 29. Харада К., Окада Е., Симидзу Т., Катаока Ю., Савада Т., Такахаши Т. Устойчивость к противомикробным препаратам, профили вирулентности и филогенетические группы фекальных изолятов Escherichia coli: сравнительный анализ собак и их владельцев в Японии. Сравнительная иммунология, микробиология и инфекционные болезни. 2012. 35 (2): 139–44. pmid: 22252047
- 30. Шмидт В.М., Пинчбек Г.Л., Наттолл Т., Макьюэн Н., Доусон С., Уильямс, штат Нью-Джерси.Факторы риска устойчивости к противомикробным препаратам и характеристика фекальной кишечной палочки, выделенной от здоровых лабрадоров-ретриверов в Соединенном Королевстве. Профилактическая ветеринария. 2015; 119 (1): 31–40.
- 31. Клермон О, Бонакорси С., Бинген Э. Быстрое и простое определение филогенетической группы Escherichia coli. Прикладная и экологическая микробиология. 2000. 66 (10): 4555–8. pmid: 11010916
- 32. Джонсон Л.К., Браун МБ, Каррутерс Е.А., Фергюсон Дж.А., Домбек П.Е., Садовски М.Дж.Размер выборки, состав библиотеки и генотипическое разнообразие среди природных популяций Escherichia coli от разных животных влияют на точность определения источников фекального загрязнения. Прикладная и экологическая микробиология. 2004. 70 (8): 4478–85. pmid: 15294775
- 33. Джонсон Дж. Р., Миллер С., Джонстон Б., Клэботс С., Деброй С. Совместное использование последовательности Escherichia coli типа ST131 и других штаммов E. coli с множественной лекарственной устойчивостью и уровнем вирулентности среди собак и кошек в домашнем хозяйстве. Журнал клинической микробиологии.2009. 47 (11): 3721–5. pmid: 19710261
- 34. Гуардабасси Л., Шварц С., Ллойд Д.Х. Домашние животные как резервуары устойчивых к противомикробным препаратам бактерий. Журнал антимикробной химиотерапии. 2004. 54 (2): 321–32. pmid: 15254022
- 35. Коста Д., Поэта П., Саенс Й., Коэльо А.С., Матос М., Винуэ Л. и др. Распространенность антимикробной устойчивости и генов устойчивости в фекальных изолятах Escherichia coli, выделенных от здоровых домашних животных. Ветеринарная микробиология. 2008. 127 (1): 97–105.
- 36.Ллойд DH. Резервуары устойчивости к противомикробным препаратам у домашних животных. Клинические инфекционные болезни. 2007; 45 (Приложение_2): S148 – S52.
- 37. Шабан Р., Саймон Дж., Тротт Д., Тернидж Дж., Джордан Д. Наблюдение и отчетность по устойчивости к противомикробным препаратам и использованию антибиотиков у животных и сельского хозяйства в Австралии. Канберра, Австралия: Министерство сельского хозяйства Австралии. 2014.
- 38. Джонсон JR, Clabots C, Kuskowski MA. Совместное использование нескольких хозяев, длительная персистентность и вирулентность клонов Escherichia coli, полученных от членов семьи человека и животных.Журнал клинической микробиологии. 2008. 46 (12): 4078–82. pmid: 18945846
- 39. Дамборг П., Нильсен С.С., Гуардабасси Л. Паттерны выделения Escherichia coli у людей и собак: понимание передачи внутри домохозяйства филотипов, связанных с инфекциями мочевыводящих путей. Эпидемиология и инфекции. 2009. 137 (10): 1457–64. pmid: 19272200
- 40. Ведли А.Л., Доусон С., Мэддокс Т.В., Койн К.П., Пинчбек Г.Л., Клегг П.и др. Носительство кишечной палочки, устойчивой к противомикробным препаратам, у собак: распространенность, связанные факторы риска и молекулярные характеристики.Ветеринарная микробиология. 2017; 199: 23–30. pmid: 28110781
- 41. Де Грэф Э., Декостер А, Девризе Л., Хезбрук Ф. Устойчивость к антибиотикам среди индикаторных бактерий фекалий от здоровых собак, находящихся в индивидуальном владении и в питомнике. Устойчивость к микробным препаратам (Ларчмонт, Нью-Йорк). 2004. 10 (1): 65–9.
- 42. Куртис Р., Снятински М., Рубин Дж. Устойчивость к противомикробным препаратам и продукция бета-лактамаз Escherichia coli, вызывающая инфекции мочевыводящих путей собак: пассивное наблюдение за лабораторными изолятами в Саскатуне, Канада, 2014.Канадский ветеринарный журнал = La revue veterinaire canadienne. 2016; 57 (11): 1166. pmid: 27807380
- 43. Зогг А.Л., Зурфлух К., Шмитт С., Нюеш-Индербинен М., Стефан Р. Устойчивость к противомикробным препаратам, типы мультилокусных последовательностей и профили вирулентности уропатогенной Escherichia coli, продуцирующей ESBL и не продуцирующей ESBL, изолированной от кошек и собак в Швейцарии. Ветеринарная микробиология. 2018; 216: 79–84. pmid: 29519530
- 44. Сапутра С., Джордан Д., Митчелл Т., Сан Вонг Х., Абрахам Р.Дж., Кидсли А. и др.Клиническая устойчивость к противомикробным препаратам Escherichia coli, выделенных от домашних животных в Австралии. Ветеринарная микробиология. 2017; 211: 43–50. pmid: 220
- 45. Marques C, Belas A, Franco A, Aboim C, Gama LT, Pomba C. Повышение устойчивости к противомикробным препаратам и появление основных международных клональных линий высокого риска у собак и кошек с инфекцией мочевыводящих путей: 16-летнее ретроспективное исследование. Журнал антимикробной химиотерапии. 2017.
- 46. CDC. Лабораторное обнаружение β-лактамаз расширенного спектра (БЛРС) 2010.https://www.cdc.gov/hai/settings/lab/lab_esbl.html.
- 47. Рубин Дж. Э., Питу Дж. Д. Β-лактамаза, карбапенемаза и AmpC с расширенным спектром действия, продуцирующая Enterobacteriaceae, у домашних животных. Ветеринарная микробиология. 2014; 170 (1): 10–8.
- 48. Хубер Х, Цвайфель С., Виттенбринк М., Стефан Р. Уропатогенная кишечная палочка, продуцирующая ESBL, выделенная от собак и кошек в Швейцарии. Ветеринарная микробиология. 2013. 162 (2–4): 992–6. pmid: 23177909
- 49. Ljungquist O, Ljungquist D, Myrenås M, Rydén C, Finn M, Bengtsson B.Доказательства передачи в домашних условиях энтеробактерий, продуцирующих ESBL / pAmpC, между людьми и собаками — пилотное исследование. Инфекционная экология и эпидемиология. 2016; 6 (1): 31514.
- 50. Карвалью А., Барбоса А., Арайс Л., Рибейро П., Карнейро В., Серкейра А. Паттерны устойчивости, гены ESBL и генетическое родство Escherichia coli от собак и владельцев. бразильский микробиологический журнал. 2016; 47: 150–8. pmid: 26887238
- 51. Pomba C, Rantala M, Greko C, Baptiste KE, Catry B, Van Duijkeren E, et al.Риск для общественного здравоохранения передачи устойчивости к противомикробным препаратам от домашних животных. Журнал антимикробной химиотерапии. 2017; 72 (4): 957–68. pmid: 27999066
- 52. Qekwana DN, Phophi L, Naidoo V, Oguttu JW. Устойчивость к противомикробным препаратам изолятов Escherichia coli от собак, перенесших инфекцию мочевыводящих путей в ветеринарной клинике в Южной Африке. Ветеринарные исследования BMC. 2018; 14 (1): 228. pmid: 30064417
- 53. Zogg AL, Simmen S, Zurfluh K, Stephan R, Schmitt SN, Nüesch-Inderbinen M.Высокая распространенность энтеробактерий, продуцирующих β-лактамазы расширенного спектра, среди клинических изолятов от кошек и собак, госпитализированных в ветеринарную больницу в Швейцарии. Границы ветеринарии. 2018; 5: 62.
- 54. Русди Б., Лэрд Т., Абрахам Р., Эш А., Робертсон И.Д., Мукерджи С. и др. Носительство критически важных устойчивых к противомикробным препаратам бактерий и зоонозных паразитов среди походных собак в отдаленных общинах коренных народов Западной Австралии. Научные отчеты. 2018; 8 (1): 8725.pmid: 29880792
- 55. Нам Х-М, Ли Х-С, Бьюн Дж-В, Юн С.-С, Юнг С.-Си, Джу И-С и др. Распространенность устойчивости к противомикробным препаратам в фекальных изолятах Escherichia coli от бездомных домашних собак и госпитализированных домашних собак в Корее. Устойчивость к микробным препаратам. 2010. 16 (1): 75–9. pmid: 20192822
- 56. Каллонен Т., Бродрик Х. Дж., Харрис С. Р., Корандер Дж., Браун Н. М., Мартин В. и др. Систематическое продольное обследование инвазивной Escherichia coli в Англии демонстрирует стабильную популяционную структуру, которая лишь временно нарушается из-за появления ST131.Геномные исследования. 2017; 27 (8): 1437–49.
- 57. Закур Н.Л., Альшейх-Хуссейн А.С., Эшкрофт М.М., Нху НТК, Робертс Л.В., Стэнтон-Кук М. и др. Последовательное приобретение вирулентности и устойчивости к фторхинолонам сформировало эволюцию Escherichia coli ST131. MBio. 2016; 7 (2): e00347–16. pmid: 27118589
- 58. де Бин М., Ланца В.Ф., де Торо М., Шарринга Дж., Домен В., Ду И и др. Распространение генов устойчивости к цефалоспорину между штаммами Escherichia coli от сельскохозяйственных животных и людей с помощью определенных плазмидных линий.PLoS генетика. 2014; 10 (12): e1004776. pmid: 25522320
- 59. МакНалли А., Орен Ю., Келли Д., Паско Б., Данн С., Сричаран Т. и др. Комбинированный анализ вариаций в основных, дополнительных и регуляторных областях генома обеспечивает сверхвысокое разрешение эволюции бактериальных популяций. PLoS генетика. 2016; 12 (9): e1006280. pmid: 27618184
- 60. Power DA, McCuen PJ. Руководство по продуктам BBL и лабораторным процедурам: Becton Dickinson Microbiology Systems; 1988 г.
- 61. Версалович Дж., Коут Т., Лупски Р. Распределение повторяющихся последовательностей ДНК в эубактериях и применение для более тонкого определения бактериальных эномов. Исследование нуклеиновых кислот. 1991. 19 (24): 6823–31.
- 62. Адамус-Биалек В., Войтасик А., Майчжак М., Сосновски М., Парневски П. (CGG) 4-основанная ПЦР как новый инструмент для дискриминации уропатогенных штаммов Escherichia coli: сравнение с энтеробактериальными повторяющимися межгенными консенсус-ПЦР. Журнал клинической микробиологии.2009. 47 (12): 3937–44. pmid: 19846645
- 63. Clermont O, Christenson JK, Daubié A-S, Gordon DM, Denamur E. Разработка аллель-специфической ПЦР для подтипирования Escherichia coli B2, быстрой и простой в выполнении замены мультилокусного типирования последовательностей. Журнал микробиологических методов. 2014; 101: 24–7. pmid: 24685601
(PDF) Mycoplasma pulmonis грызунов как возможный патоген для человека
Распространенность M. pulmonis среди людей
В целом, 26 из 44 (59.09%) сыворотки человека были серологически-
положительными на M. pulmonis. Сюда входят 4 из 9 техников,
, 8 из 12 ветеринаров и 15 из 23 владельцев домашних крыс. Высокий титр антител
с OD> 1 был обнаружен у 4 человек (2 домашних животных
крысолюдей и 2 ветеринара), тогда как средний и низкий титры антител
были обнаружены у 8 и 14 человек соответственно
. (Рисунок 1).
Обсуждение
M. pulmonis является естественным респираторным патогеном у
крыс и мышей.Эти животные действуют как переносчики организмов,
распространяют бактерии при тесном контакте или в виде аэрозолей
по воздуху. Выражение инфекций M. pulmonis у
крыс сильно различается. Чаще всего респираторный микоплазмоз
мышей является хроническим заболеванием и протекает без клинических признаков
, что означает, что он может избежать клинического наблюдения и иметь риск передачи M. pulmonis. Распространенность M.pulmonis у лабораторных крыс значительно варьируется —
, от примерно 3% (Schoondermark-van de Ven et al.
2006, Ma
¨hler и Ko
hl 2009) до почти 100% (Barreto et al.
2002). В этом исследовании высокая распространенность M. pulmonis была
, обнаруженная у крыс в Польше, в диапазоне от 49% у лабораторных крыс
до 70,5% у домашних крыс.
Высокая распространенность M. pulmonis у крыс соответствовала
с высокой распространенностью M.pulmonis у технических специалистов, работающих с инфицированными животными
. Ранее M. pulmonis была обнаружена
только один раз из 12 человек (технический персонал лаборатории
домашнего хозяйства животных), которые контактировали с инфицированными крысами
(Ferreira et al. 2008). В этом исследовании M. pulmunis также был обнаружен
почти у 25% домашних крысолюдей и ветеринаров. Присутствие
M. pulmonis у человека может указывать на то, что
M. pulmonis обладает способностью колонизировать ротоглотку человека.
Однако неизвестно, связано ли присутствие M. pulmonis
у людей с этим заболеванием. Интересно, что в этом исследовании
почти 60% здоровых людей, имевших прямой контакт
с инфицированными крысами, были серопозитивными к M. pulmonis.
Хотя ни один человек не сообщил о каких-либо клинических признаках респираторного заболевания
, высокий уровень IgG anti-M. Pulmonis, обнаруженный у человека
, может указывать на активную инфекцию.
В течение многих лет считалось, что M. pulmonis в высшей степени специфична для хозяина
, и на сегодняшний день этот патоген никогда не был выделен из ротоглотки человека с использованием методов культивирования.
Однако хозяином может быть просто тот вид, у которого
M. pulmonis обнаруживается наиболее часто. Глотка человека
обычно содержит микоплазмы человеческого происхождения, поэтому
трудно выделить микоплазмы мышиного происхождения в ротоглотке человека
; следовательно, его можно не заметить во время медицинского осмотра
.Кроме того, иммуномодулирующий эффект
комменсальных бактерий в дыхательных путях человека (Henriks-
son et al. 2004) может быть задействован в местной иммунной защите и устранении
M. pulmonis из ротоглотки человека до тех пор, пока агент
не может быть идентифицировано. Релевантные вопросы заключаются в том, может ли
M. pulmonis долго выживать в новой среде и
, может ли присутствие M. pulmonis у людей быть связано с заболеванием.Это требует дальнейшей оценки.
Заключение
В этом исследовании высокая распространенность M. pulmonis у людей
и крыс была показана с помощью ПЦР-скрининга. Более того, более
более 50% людей, регулярно контактировавших с инфицированными крысами
, были серопозитивными к M. pulmonis. Хотя ни один из
человек не сообщил о каких-либо синдромах заболевания, высокий титр антител IgG
, обнаруженный у четырех человек, может указывать на активную инфекцию
.
Заявление об раскрытии информации об авторе
Не существует конкурирующих финансовых интересов.
Ссылки
Barreto ML, Nascimento ER, Campos CAM, Nascimento MGF,
et al. Обнаружение Mycoplasma pulmonis у лабораторных крыс.
Braz J Microbiol 2002; 270: 260–264.
Delgado MO, Timenetsky J. Профили иммуноблоттинга сывороток
лабораторных крыс, естественно инфицированных Mycoplasma pulmonis
, и технических специалистов, контактировавших с помещениями для инфицированных животных.Braz J
Microbiol 2001; 32: 301–304.
Феррейра Дж.Б., Ямагути М., Маркес Л.М., Оливейра Р.С. и др.
Обнаружение Mycoplasma pulmonis у лабораторных крыс и
технических специалистов. Общественное здравоохранение по зоонозам, 2008 г .; 55: 229–234.
Хенрикссон Г., Хельгеланд Л., Мидтведт Т., Стирна П. и др. Ответ Im-
на Mycoplasma pulmonis в слизистой оболочке носа составляет
, модулируемый нормальной микробиотой. Am J Respir Cell Mol
Biol 2004; 31: 657–662.
Ma
hler M, Ko
hl W. Серологическое исследование для оценки современной распространенности вирусных агентов и Mycoplasma pulmonis
у лабораторных мышей и крыс в Западной Европе. Lab Anim
(Нью-Йорк) 2009 г .; 38: 161–165.
Manjunath S, Kulkarni PG, Nagavelu K, Samuel RJ, et al. Sero-
распространенность патогенов грызунов в Индии. PLoS One 2015; 10:
e0131706.
Mikola I, Balogh G, Nagy A, Ma
´tya
´s M, et al.Эпидемия Mycoplasma
pneumoniae как зооноз. Orv Hetil 1997; 138:
2933–2935.
Rothenburger JL, Himsworth CG, Clifford CB, Ellis J, et al.
Респираторные патологии и патогены у диких городских крыс
(Rattus norvegicus и Rattus rattus). Vet Pathol 2015; 52:
1210–1219.
Schoondermark-van de Ven EM, Philipse-Bergmann IM, фургон
der Logt JT. Распространенность естественных вирусных инфекций —
, Mycoplasma pulmonis и Clostridium piliforme среди
лабораторных грызунов в Западной Европе, обследованных с 2000 по
2003.Lab Anim 2006; 40: 137–143.
Van Kuppeveld FJM, Van Der Logt JTM, Angulo AF, Van
Zoest MJ, et al. Родовая и видовая идентификация
Mycoplasmas с помощью амплификации 16S рРНК. Appl Environ
Microbiol 1992; 58: 2606–2615.
Адрес для корреспонденции:
Tomasz Piasecki
Отделение эпизоотологии
и Клиника птиц и экзотических животных
Факультет ветеринарной медицины
Вроцлавский университет наук об окружающей среде и жизни
Pl.Grunwaldzki 45
50-366 Wrocław
Польша
Эл. Почта: [email protected]
УЗОТЫ ДЛЯ МИКОПЛАЗМЫ 477
Загружено USDA ARS MULTISITE с сайта online.liebertpub.com 14.07.17 . Только для личного пользования.
Инфекции верхних дыхательных путей у кошек (URI)
Большинство URI кошек вызываются очень заразными вирусами. Самый распространенный вирус — это кошачий герпесвирус (FHV-1), но мы также видим калицивирус кошек (FCV), Chlamydolphila felis (C.felis), Mycoplasma и Bordetella bronchiseptica. Кошки также могут заразиться вторичными бактериальными инфекциями, включая виды Pasteurella, E. coli, Enterobacter и Staphylococcus.
• FHV-1 : Также называемый вирусом кошачьего ринотрахеита, FHV-1 часто встречается у котят и в местах скопления кошек, таких как приюты, хозяйства с несколькими кошками и племенные колонии. Передача вируса происходит при прямом контакте с выделениями, такими как чихание или выделения из глаз или носа, или через загрязнение окружающей среды.Если кошка заражена FHV-1, она всегда будет переносить вирус. Это называется латентным периодом вируса, когда вирус часто прячется в тройничном нерве. Мы можем наблюдать периодическое повторение симптомов, особенно во время стресса. FHV-1 также может приводить к хроническим симптомам URI.
• FCV : Как и FHV-1, FCV также часто встречается у котят и в местах скопления кошек. Передача происходит при прямом контакте с инфицированной кошкой или загрязнением окружающей среды. Существует множество штаммов FCV.Помимо возникновения URI, FCV также может вызывать язвы во рту, хромоту и заболевание десен, называемое стоматитом.
• C. felis : C. felis — это бактерия, которая может вызывать инфекционные заболевания дыхательных путей у кошек, но мы часто видим, что она поражает глаза и вызывает конъюнктивит. Передача происходит при прямом контакте с больной кошкой.
• Mycoplasma : Mycoplasma — это бактерия, которая может способствовать развитию симптомов URI у кошек и даже может вызывать симптомы, подобные астме. Сам по себе он редко вызывает заболевание, но может усугубить клинические признаки, если в URI вовлечен другой организм.
• Bordetella bronchiseptica : Bordetella — это бактерия, которая может вызывать симптомы URI, а также увеличение лимфатических узлов и кашель. Передача происходит при прямом контакте и даже может передаваться от инфицированных собак кошкам. Бактерии могут распространяться через долгое время после того, как исчезнут признаки URI.
NORD (Национальная организация по редким заболеваниям)
Заболевания людей, которые были определены как вызываемые одним из видов Bartonella, включают болезнь кошачьих царапин, болезнь Карриона и окопную лихорадку.
Болезнь кошачьих царапин (CSD):
CSD, вызываемая Bartonella henselae ( B. henselae ), является инфекционным заболеванием, симптомы которого могут варьироваться от легких до тяжелых. Хотя у большинства пациентов болезнь проходит спонтанно в течение 2-4 месяцев без лечения, людям с тяжелыми случаями и / или пациентам с подавленной иммунной системой, такой как ВИЧ / СПИД, рекомендуется лечение антибиотиками.
Основные симптомы болезни кошачьих царапин могут не проявляться в течение нескольких дней или недель после воздействия.На коже в месте заражения может появиться красное пятно (пятно), которое может стать выпуклым (папула) через 3–10 дней после заражения. Папула безболезненна и не чешется. Он может заполниться жидкостью (пузырьком), затем покрыться коркой и зажить рубцом, похожим на те, которые остались после ветряной оспы. Папула сохраняется от 1 до 3 недель, но может остаться незамеченной или быть связана с травмой.
В течение 1-3 недель опухоль лимфатических узлов (лимфаденопатия) развивается в отдельном узле или группе регионарных узлов рядом с местом укуса или царапины.Увеличенные лимфатические узлы часто возникают под мышками, на шее или в паховой области. Эти узлы обычно становятся очень болезненными, а поверхность кожи может казаться красной и горячей на ощупь. Гной может образовываться в пораженных лимфатических узлах (нагноение) и становиться неустойчивым. Лимфаденопатия остается регионарной и обычно проходит в течение 2-4 месяцев, но может длиться до 6-12 месяцев.
Другие симптомы болезни кошачьих царапин могут включать боль и общий дискомфорт (недомогание), утомляемость, головную боль, а у некоторых пациентов — лихорадку.Менее распространенные симптомы включают потерю аппетита, боль в горле и потерю веса. В некоторых случаях сообщалось об ознобе, боли в спине и / или боли в животе.
Редкие осложнения инфекции Bartonella henselae чаще возникают у людей с ослабленным иммунитетом, например, у тех, кто проходит иммуносупрессивное лечение рака, у пациентов с трансплантацией органов и у людей с ВИЧ / СПИДом, хотя они все чаще встречаются и у иммунокомпетентных людей. . Все чаще об этих атипичных проявлениях сообщалось у пациентов без типичных симптомов CSD.В частности, у детей развивается воспаление печени (гранулематозный гепатит) или селезенки (сплен) и инфекция костей (остеомиелит). Другие атипичные проявления CSD включают бациллярный ангиоматоз, энцефалопатию (воспаление головного мозга), нейроретинит (воспаление сетчатки и зрительного нерва глаза), окуландулярный синдром Парино (конъюнктивит) и эндокардит (инфекция сердечного клапана), бациллярный ангиоматоз, вызванный B. quintana или B.henselae — это кожное заболевание, которое характеризуется красноватыми возвышающимися очагами, которые часто окружены чешуйчатым кольцом и легко кровоточат. Состояние может распространяться и вызывать более распространенное системное заболевание, которое может поражать кости, печень, селезенку, лимфатические узлы, желудочно-кишечный тракт, дыхательные пути и костный мозг. Иногда сообщалось о бациллярном ангиоматозе у иммунокомпетентных пациентов.
Бациллярный пелиоз, форма пелиоза гепатита, представляет собой сосудистое заболевание, вызываемое B.hensela e. Для него характерно наличие в печени полостей, заполненных кровью.
Окулогландулярный синдром Парино, поражающий глаз, встречается примерно у 5% пациентов с CSD. Симптомы включают покраснение, раздражение и болезненность глаз (похоже на конъюнктивит или «розовый глаз»), лихорадку, общее плохое самочувствие и отек близлежащих лимфатических узлов, часто перед ухом (преаурикулярная лимфаденопатия).
Неврологические осложнения возникают примерно у 2% инфицированных пациентов, причем энцефалопатия является наиболее частым проявлением.Симптомы обычно возникают через 2–3 недели после начала лимфаденопатии, хотя известно, что у некоторых пациентов наблюдаются неврологические симптомы без истории болезни CSD. Более чем у 90% этих пациентов наблюдается полное самопроизвольное выздоровление без каких-либо негативных последствий.
Другие редкие симптомы бартонеллеза могут включать отек самой большой слюнной железы (околоушной железы), сердечные проявления с воспалением внутренней оболочки сердца и его клапанов (эндокардит), воспаление почек (гломерулонефрит), гранулематозное воспаление печени (гепатит). ), сплен и / или абсцессы селезенки.В очень редких случаях бартонеллез был связан с атипичной пневмонией, воспалительной реакцией на инфекцию, характеризующейся образованием шишек на нижних конечностях (узловатая эритема) и / или обесцвечиванием кожи, связанным со снижением количества тромбоцитов (тромбоцитопения пурпура).
Болезнь падальщиков:
Болезнь падальщиков, вызываемая Bartonella bacilliformi s ( B. bacilliformis ), является редкой инфекционной болезнью, которая первоначально считалась распространенной только в перуанских Андах.Другие страны Южной Америки были включены совсем недавно. Новые случаи заболевания были обнаружены у людей, побывавших в других частях света.
У большинства пораженных людей болезнь Карриона характеризуется двумя четко определенными стадиями: внезапная острая фаза, известная как лихорадка Оройя, и хроническая доброкачественная кожная (кожная) сыпь, состоящая из выпуклых красновато-пурпурных узелков, известных как verruga peruana ( Перуанские бородавки). Первая стадия обычно развивается через 3–12 недель после воздействия B.bacilliformis .
Лихорадка оройя может характеризоваться внезапным появлением высокой температуры, обильного потоотделения, сильной головной боли, озноба, слабости и бледности кожи. Кроме того, у многих пораженных людей могут развиваться психические изменения, включая спутанность сознания и дезориентацию или кому. Такие нарушения возникают в связи с быстро развивающимся снижением уровня красных кровяных телец (эритроцитов) из-за бактериальной инвазии и разрушения этих клеток (гемолитическая анемия).Первая фаза болезни очень похожа на малярию.
Дополнительные связанные результаты могут включать боль в животе, сильные мышечные боли (миалгию) и артралгию, лимфаденопатию, воспаление мозга и его защитных мембран (менингоэнцефалит), судороги и / или другие аномалии. Кроме того, у некоторых пострадавших людей может развиться боль в груди из-за недостаточного поступления кислорода в сердечную мышцу (стенокардия), тромбоцитопении, затрудненного дыхания (одышка), нарушения пищеварения и функции печени и / или других аномалий.Считается, что такие результаты являются результатом тяжелой гемолитической анемии и аномального образования тромбов в мелких кровеносных сосудах (микрососудистый тромбоз), что приводит к недостаточному снабжению тканей кислородом (ишемия), нарушению функционирования органов и потенциально опасным для жизни осложнениям. .
Кроме того, у некоторых пациентов острая стадия болезни Карриона может осложняться и усиливаться из-за наличия других инфекций, таких как сальмонеллез или малярия (т.е., интеркуррентные инфекции). (Подробнее о сальмонеллезе см. Ниже. Для получения дополнительной информации о малярии, пожалуйста, выберите «малярия» в качестве поискового запроса в базе данных редких заболеваний.)
В самой легкой форме болезнь Карриона не может быть замечена до тех пор, пока не появится характерная кожа. поражения (verruga peruana). В таких случаях он может иметь постепенное начало и первоначально характеризоваться лихорадкой, которая может сохраняться менее недели и не распознаваться как проявление болезни Карриона.
У больных лихорадкой Оройя период выздоровления обычно связан с постепенным снижением температуры и исчезновением бактерий, как видно при микроскопическом исследовании небольших образцов крови. Однако некоторые люди остаются постоянно инфицированными в течение многих лет; Исследование мазка крови, являющееся исторически стандартным диагностическим тестом в Перу, является очень нечувствительным тестом. Кроме того, некоторые пораженные люди могут временно иметь повышенную восприимчивость к определенным последующим инфекциям, например, бактериям Salmonella (сальмонеллез).Заражение определенными штаммами бактерий Salmonella может вызвать высокую температуру, боль в животе, кровавую диарею, тошноту, рвоту, сыпь и / или другие симптомы и симптомы. Кроме того, в некоторых случаях без соответствующей антибактериальной терапии B. bacilliformis может оставаться в крови (бактериемия) в течение нескольких месяцев или лет без видимых симптомов (бессимптомно), что может привести к дальнейшему распространению болезни среди других (т. Е. как «резервуар» или постоянный источник инфекционного заболевания).Сообщения предполагают, что рецидивы или рецидивы лихорадки Оройя случаются редко. По мнению экспертов, рецидив лихорадки после начального улучшения симптомов считается признаком вторичной инфекции.
После разрешения острой стадии инфекции (лихорадка Оройя) у нелеченных людей обычно появляются характерные кожные поражения в течение недель или месяцев. Эта вторая стадия известна как перуанская верруга. Как отмечалось выше, перуанская верруга может развиться у людей, которые ранее имели или не имели симптомов лихорадки Оройя.
Verruga peruana обычно характеризуется красноватыми, пурпурными поражениями кожи, возникающими в результате серии вспышек, которые могут развиваться в одной области по мере заживления в другой и повторяться в определенных местах. Поражения могут первоначально быть небольшими, в конечном итоге стать узловатыми и иметь диаметр от 0,2 до 4 сантиметров и потенциально кровоточить, изъязвлять или превращаться в гнойные пузыри (пустулы). Хотя они обычно появляются на открытых участках кожи, например на лице, руках и ногах, они также могут иногда развиваться на слизистых оболочках и внутренних органах.У нелеченных людей Verruga peruana может сохраняться в течение от месяцев до лет.
Траншейная лихорадка:
Траншейная лихорадка, вызванная Bartonella quintan a ( B. quintan a), проявляет симптомы в течение нескольких дней или до пяти недель после контакта с бактерией. У больных может развиться внезапная лихорадка, озноб, слабость, головная боль, головокружение, боль в ногах и спине и / или другие аномалии. Первоначальная лихорадка может длиться от четырех до пяти дней и может повторяться один или несколько раз, причем каждый эпизод длится около пяти дней.Дополнительные признаки могут включать временную кожную сыпь, состоящую из плоских (макулярных) или выпуклых (папулезных) поражений, и / или увеличение печени или селезенки (гепатомегалия или спленомегалия).
Iconic One Theme | Powered by Wordpress