Вирусный лейкоз кошек 🐱 симптомы и лечение лейкемии крови
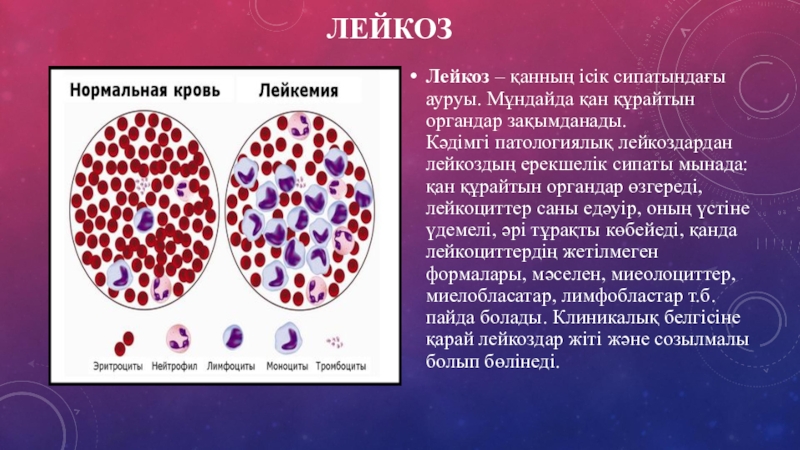
Вирусный лейкоз у кошек (или вирусная лейкемия, вирусный иммунодефицит) — инфекционное заболевание, поражающее иммунную систему, органы кроветворения и вызывающее рост опухолей.
Патология может протекать скрыто, подавляя резистентность организма и маскируясь под инфекции, возникшие на фоне иммуносупрессии (угнетения иммунитета). Кроме того, кошка становится носителем вируса, выделяет его во внешнюю среду, заражая других животных. Давайте поговорим на эту тему подробнее.
Что такое вирусная лейкемия у кошек
Заболевание распространено по всему миру. Возбудителем является РНК-содержащий вирус семейства Retroviridae, рода Gammaretrovirus. Он нестабилен в окружающей среде. Чувствителен ко всем известным дезинфектантам, ультрафиолету, низким и высоким температурам. Например, при 100°С погибает мгновенно. Поэтому возможность “принести” его с улицы чрезвычайно мала.
Вирус впервые был описан описан в 1964 году. Патологию изначально связывали с лейкемией (раком крови), однако позже было выяснено, что первыми признаками являются анемия и снижение иммунитета.
Патологию изначально связывали с лейкемией (раком крови), однако позже было выяснено, что первыми признаками являются анемия и снижение иммунитета.
Первый диагностический тест стал доступен в 1974-м, что резко снизило количество инфицированных кошек. Первая вакцина выпущена в 1986 году.
Вирус лейкоза у кошек (FeLV) разделяется на 4 типа, которые могут вызывать разную симптоматику:
- А — основной патоген, которым инфицируются почти все заболевшие особи. Вызывает снижение иммунитета.
- В — образуется в результате рекомбинации типа А с эндогенным FeLV (непатогенным). Вызывает аномальный рост тканей и образование опухолей.
- С — характеризуется тяжелой анемией, не поддающейся лечению. Обнаруживается примерно у 1% больных
- T — встречается крайне редко, обладает “тропизмом” (склонностью) к Т-лимфоцитам и приводит к нарушению иммунного ответа.
Причины
Больное животное распространяет вирус со всеми выделениями: слюной, мочой, калом, кровью, молоком. Восприимчивость к FeLV зависит от иммунного статуса питомца и количества попадающего возбудителя. Поэтому при длительном и непосредственном контакте с инфицированной особью вероятность заболеть намного выше.
Восприимчивость к FeLV зависит от иммунного статуса питомца и количества попадающего возбудителя. Поэтому при длительном и непосредственном контакте с инфицированной особью вероятность заболеть намного выше.
К группе риска заражения вирусной лейкемией у кошек относятся следующие животные:
- молодые — до 2-х лет, особенно котята до 4-х месяцев,
- возрастные,
- ослабленные,
- доноры,
- некастрированные,
- свободно гуляющие,
- дерущиеся,
- содержащиеся группами — в приютах, питомниках, у владельцев нескольких кошек,
- бродячие, бездомные.
После проникновения в организм, в основном через ротовую полость, возбудитель попадает миндалины, где инфицирует B-лимфоциты и макрофаги.
Здесь происходит первичная репликация (или размножение) вируса. Зараженные клетки попадают в лимфатические узлы и далее в кровоток. Возникает так называемая первичная виремия.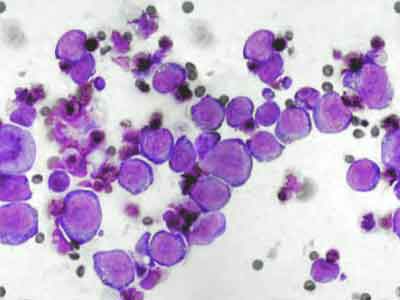
Если по каким-либо причинам этого не происходит, развивается вторичная виремия, когда FeLV проникает в костный мозг, где образуются клетки крови. С инфицированными кровяными тельцами (нейтрофилами, моноцитами, лимфоцитами, эозинофилами) вирус разносится по всему телу.
Заражаются преимущественно клетки слизистых оболочек внутренних органов: рта, носа, глотки, пищевода, желудка, кишечника, трахеи, бронхов, канальцев почек, мочевого пузыря, а также выводные протоки желез (слюнных, сальных, молочных). Вторичная виремия необратима, вирус остается с кошкой навсегда.
Симптомы лейкоза у кошек
Первая симптоматика вирусной лейкемии у кошек может появиться через несколько месяцев, а иногда и лет после заражения. Этому может способствовать стресс, изменение условий кормления и содержания, переохлаждение, появление других патологий.
Кошка становится вялой, плохо ест, теряет вес.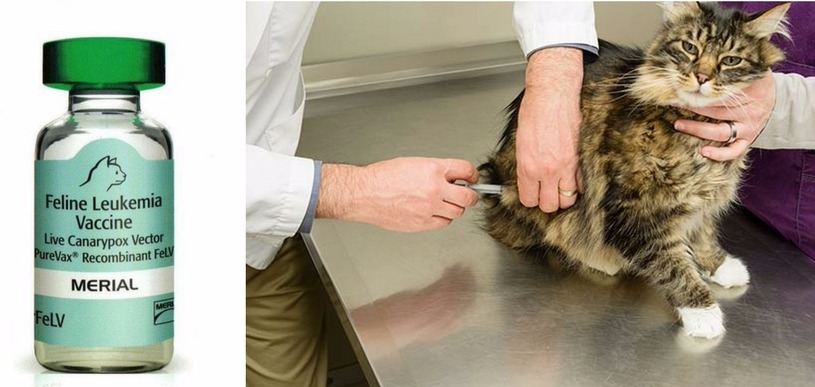
- Частые заболевания верхних дыхательных путей, органов пищеварения и мочевыделения, кожи, глаз, которые не поддаются терапии,
- вирусные болезни при наличии вакцины от них,
- поражение ротовой полости (стоматит), десен (гингивит),
- увеличение подчелюстных, подмышечных, паховых лимфоузлов,
- регулярные диареи (жидкий стул),
- аборты у беременных, рождение мертвых или ослабленных котят, погибающих через несколько недель,
- истощение,
- плохое состояние шерсти — тусклая, с колтунами,
- постоянная лихорадка,
- неврологические нарушения — судороги, парезы,
- лейкоз крови у кошек — рак крови и костного мозга,
- лимфома или лимфосаркома — доброкачественные или злокачественные новообразования лимфоидной ткани,
- увеличение селезенки, почек,
- анемия — снижение числа эритроцитов в крови,
- скопление жидкости в грудной и брюшной полости,
- сердечная недостаточность — выражается одышкой, бледностью или синюшностью кожи.

По течению различают три формы заболевания:
- Прогрессирующая — инфицируется костный мозг, что приводит к заражению следующих видов лейкоцитов: лимфоцитов, гранулоцитов и моноцитов. Развиваются сопутствующие заболевания и симптоматика. Животное постоянно выделяет вирус во внешнюю среду.
- Регрессная — костный мозг не поражается, из лейкоцитов инфицированы лишь лимфоциты. Характеризуется скрытым течением. Кошка является носителем, но выделение вируса может происходить только при его активации. Форма может переходить в прогрессирующую.
- Абортивная — благодаря сильному иммунитету происходит элиминация (удаление) возбудителя из организма еще до внедрения в геном клеток. Наступает выздоровление.
Лечение вируса лейкоза кошек
Терапия затруднена, так как развитие симптомов лейкоза у кошки свидетельствует о поражении костного мозга. Это означает, что даже при удачном исходе кошка останется носителем вируса на всю жизнь. Прогноз будет зависеть от клинической картины.
Для облегчения общего состояния проводят симптоматическое и поддерживающее лечение:
- химиотерапию — при новообразованиях,
- антибиотики — чтобы устранить бактериальные инфекции, возникшие после,
- глюкокортикоиды — для регуляции иммунного ответа,
Диагностика
Диагноз ставится после сбора анамнеза (сведений, предоставленных владельцем об условиях содержания и кормления питомца, начале и развитии заболевания) и получения данных лабораторных исследований.
Заподозрить патологию можно при наличии вышеперечисленных признаков. Особенно если кошка взята из питомника, приюта или с улицы, содержится скученно, имеет свободный выгул.
Из средств диагностики используются:
- Для выявления возбудителя — экспресс-тесты, ПЦР (или полимеразная цепная реакция). Исследуются смывы из полости рта, зева, а также кровь. При получении первичного отрицательного результата, проводится повторное исследование, так как развитие заболевания у каждой кошки происходит по-разному.

- Для обнаружения антител к FeLV — ИФА (или иммуноферментный анализ), реже РИФ (реакция иммунофлюоресценции). Нужно помнить, что результат ИФА будут положительными у вакцинированных пациентов.
Из дополнительных методов показаны:
- Общий и биохимический анализ крови — при анемии картина может серьезно меняться, в частности будет снижено количество красных кровяных телец (эритроцитов) и гемоглобина.
- УЗИ (ультразвуковое исследование) органов грудной и брюшной полости — для обнаружения опухолей, их метастазов или скопления жидкости.
- Биопсия и гистология — взятие и анализ участка ткани для диагностики онкопатологии.
Как передается
Наибольшее количество вируса содержится в слюне, поэтому основной путь заражения ороназальный: через взаимное вылизывание, укусы, царапины, а также через общие миски, лотки, предметы ухода. Менее распространен половой путь. Котята заражаются от лейкозопозитивной матери через молоко.
Сколько живут кошки с лейкозом?
Лейкоз у кошек — не приговор. Продолжительность жизни инфицированного питомца будет зависеть от формы и течения заболевания, условий содержания и кормления, статуса иммунной системы. Более точный прогноз можно дать только после получения результатов обследований. В целом кошки с таким диагнозом могут жить несколько лет.
Продолжительность жизни инфицированного питомца будет зависеть от формы и течения заболевания, условий содержания и кормления, статуса иммунной системы. Более точный прогноз можно дать только после получения результатов обследований. В целом кошки с таким диагнозом могут жить несколько лет.
Общие рекомендации по содержанию инфицированных кошек
Больного питомца необходимо изолировать от других кошек, по возможности ограничить, а лучше исключить стресс-факторы: резкое изменение корма, переохлаждение, смену владельца, переезд. Заболевшую кошку нельзя вязать, так как беременность будет отнимать силы, возможно абортирование, рождение нежизнеспособного потомства. Даже если котята появятся здоровыми, при кормлении они заразятся вирусом через молоко.
Вакцинация и профилактика
Чтобы обезопасить питомца от возможного заражения, необходимо его вакцинировать. Иммунная защита вырабатывается через 2-3 недели после введения вакцины и сохраняется в течение года.
Однако следует понимать, что ни одна вакцина от лейкоза кошек не дает 100%-ной гарантии, поэтому нужно соблюдать другие профилактические меры:
- тщательно промывать миски, лотки, предметы ухода,
- обрабатывать помещения, где живет кошка, дезинфицирующими средствами — повышенное внимание обращать на те места, где остаются следы мочи или слюны,
- мыть руки с мылом после общения с другими кошками,
- периодически стирать при высокой температуре или отдавать в химчистку подстилки, кошачьи домики, амуницию,
- ограничивать свободный выгул,
- не допускать общения с бездомными животными,
- по возможности кастрировать или стерилизовать животное, так как заражение может происходить во время драк или укусов при спаривании.
Всех новоприбывших помещать на карантин и проводить тест на вирусоносительство. До получения отрицательных результатов, избегать контактов с другими питомцами.
До получения отрицательных результатов, избегать контактов с другими питомцами.
При обнаружении в группе лейкозопозитивной кошки, тщательно промывать миски и туалеты, обеспечить строго раздельное содержание, не вводить новых питомцев.
Помните, что специфического лечения лейкоза у кошек не существует. Только своевременная иммунизация, хорошие условия содержания, полноценное питание, периодические ветеринарные осмотры помогут защитить вашего любимца от серьезного заболевания.
Лейкоз у кошек — симптомы и лечение вирусной лейкемии
Ветклиника ВетОстров > Услуги > Инфекционные болезни животных > Вирус лейкоза кошекСуществует множество инфекционных заболеваний кошек: одни могут пройти практически самостоятельно, не нанеся значительного ущерба животному, другие — наоборот — оставят животному слишком мало шансов на выживание. Лейкоз, он же вирусная лейкемия, относится к последним.
Лечение вирусного лейкоза у кошек в сети клиник ВЕТОСТРОВ
- У нас можно сдать все виды анализов, сделать тест для диагностики лейкемии.

- Наши врачи обладают необходимым опытом для того, чтобы своевременено заподозрить и выявить болезнь.
Звоните и приезжайте
+7 (812) 355-50-86
+7 (812) 305-21-21
+7 (812) 678-98-58
Вирус лейкоза кошек поражает красный костный мозг, нарушая производство лейкоцитов. Размножаясь очень быстро, он оказывает серьезное влияние на иммунитет животного.
Как передается лейкемия кошек
Заражение питомца происходит через контакт с биологическими жидкостями носителя (через слюну, мочу, во время случки или драки), насекомых (блохи, комары), общие емкости для воды и питья. Также, с учетом высокой устойчивости в окружающей среде (до 2х суток), вирус может быть перенесен на одежде и обуви человека.
Многие владельцы беспокоятся, заразна ли данная инфекция для человека. Лейкозом кошек болеют только кошки. Ни человеку, ни собакам он не передается.
Формы заболевания
Выделяют три формы течения лейкоза:
- Транзиторную.
 Встречается крайне редко. При данной форме имунная система организма сразу отвечает на внедрение вируса и успешно с ним справляется до того, как он поразит костный мозг. Единственное, что может свидетельствовать о протекающем процессе — временное повышение температуры и вялость животного.
Встречается крайне редко. При данной форме имунная система организма сразу отвечает на внедрение вируса и успешно с ним справляется до того, как он поразит костный мозг. Единственное, что может свидетельствовать о протекающем процессе — временное повышение температуры и вялость животного. - Латентную. Скрытая форма заболевания, характеризующаяся отсутствием клинических признаков, однако, при данной форме животное является источником инфекции. Отсутствие признаков можно объяснить тем, что хоть вирус и проник в ткани организма, но успешно размножаться не может ввиду сильного иммунитета носителя.
- Персистентную. Самая тяжелопротекающая и самая распространенная форма. Характеризуется быстрым размножением инфекции в тканях организма, что приводит к необратимым последствиям и смерти животного.
Симптомы болезни
Поскольку затрагивается иммуннная система организма, даже те заболевания, с которыми бы раньше животное справилось самостоятельно, начинают протекать довольно тяжело.
Наиболее частовстречающимися симптомами являются:
- вялость;
- потеря аппетита;
- снижение массы тела;
- частое повышение температуры;
- увеличение лимфоузлов;
- истечение из глаз и носа;
- расстройство системы пищеварения;
- болезни репродуктивной системы;
- анемия.
Также вирусная лейкемия очень часто приводит к появлению злокачественных опухолей.
В некоторых случаях может возникать скопление жидкости в грудной или брюшной полостях животного.
Прогноз
Продолжительность жизни животного сильно зависит от формы течения и обычно составляет от 3 до 10 лет. Однако, с учетом того, что владельцы обычно обращают внимание на самочувствие своего питомца примерно на 3-4 году болезни (период появления первых серьезных клинических признаков), времени у животного остается намного меньше.
Диагностика
Так как специфических симптомов лейкоз кошек не имеет, дифференцировать его от других заболеваний бывает крайне сложно. Для постановки верного диагноза в ветеринарных клиниках ВетОстров применяют следующие виды диагностики:
Для постановки верного диагноза в ветеринарных клиниках ВетОстров применяют следующие виды диагностики:
- Анализ крови. Поскольку одним из частовстречающихся признаков заболевания является анемия, необходимо проводить контроль состояния крови не только для диагностики, но и для составления плана лечения. Также очень важно количество лейкоцитов в крови животного, так как при лейкозе оно может серьезно изменятся. То же самое касается биохимического анализа крови, так как при данном заболевании могут страдать такие органы, как печень и почки, работу которых необходимо поддерживать.
- УЗИ грудной и брюшной полости. Как было сказано выше, лейкемия часто провоцирует появление злокачественных опухолей, некоторые из которых могут быть найдены на ультразвуковом исследовании. Так же по УЗИ можно судить о наличии жидкости в грудной и брюшной полостях.
- ИФА диагностика может применяться для определения антител к вирусу лейкоза.
- ПЦР диагностика является наиболее достоверным способом диагностировать заболевание, однако стоит помнить, что однократный отрицательный результат не является гарантией здоровья вашего любимца.
 Также существует 2 вида пцр диагностики: пцр формы вируса — носительство и пцр формы болезни.
Также существует 2 вида пцр диагностики: пцр формы вируса — носительство и пцр формы болезни. - В ветеринарной клинике ВетОстров имеется специальный экспресс — тест на обнаружение инфекции, занимающий всего 15 минут. При отрицательном тесте, но подозрении на заболевание, лучше дополнительно провести диагностику методом ПЦР, так как в некоторые периоды болезни тест к инфекции не чувствителен.
Для эффективной диагностики лучше проводить исследование на вирус лейкемии двумя разными способами двукратно с интервалом 6 недель, так как, во-первых, при разных стадиях болезни более эффективно свое исследование, а во-вторых, заболевание может как регрессировать, так и прогрессировать.
Лечение
При наличии нескольких кошек в доме, питомца, положительного по ИФА или экспресс тесту изолируют, здоровые животные подлежат вакцинации. При наличии клинических признаков лечение зависит от вида этих самых симптомов. К сожалению, исследования по применению иммуномодуляторов весьма противоречивы и не обещают хороших результатов.
Профилактика
Владельцам необходимо предпринять следующие меры профилактики:
- Изоляция больных животных;
- Тщательная обработка мисок, подстилок, лотков;
- Мытье рук после контакта с питомцами;
- Вакцинация (данные об эффективности относительные)
Статья написана ветеринарным врачом-терапевтом Михеевой О.А.
Инфекция как причина детской лейкемии: обнаружение вируса с использованием полногеномное секвенирование
Haematologica. 2017 май; 102(5): e179–e183.
doi: 10.3324/гематол.2016.155382
, 1 , * , 2 , * , 9 0007 3 , 4 , 5 , 6 , 2 , 2, 7 , 2 , 2 , 8 , 8 , 9 , 7 , 3 , 1, * и 2, *
Информация об авторе Информация об авторских правах и лицензии Отказ от ответственности
- Дополнительные материалы
Острый лимфобластный лейкоз (ОЛЛ) является наиболее распространенным типом рака в детском и его
заболеваемость в последние десятилетия неуклонно росла. Растущие доказательства из
эпидемиологические исследования убедительно свидетельствуют о том, что повышенный уровень лейкемии, вероятно,
связаны с аномальным иммунным ответом на инфекции в раннем возрасте. 1 , 2 Недавнее экспериментальное подтверждение гипотезы
«отсроченная инфекция», предложенная Мелом Гривзом как причина детского
лейкемия произошла от Мартина-Лоренцо и др. . и Сваминатан и др.
номер . которые продемонстрировали, что воздействие генетически предрасположенных мышей к
инфекция может вызвать лейкемию. 3 , 4 Мартин-Лоренцо et
номер . показали, что мыши с моноаллельной потерей транскрипции В-клеток
фактора PAX5 генетически предрасположены к развитию предшественника В-клеточного ОЛЛ, но
лейкемия развивается только при контакте с обычными возбудителями. 3 Сваминатан и др. . продемонстрировал
что прелейкемические пре-В клетки, несущие транслокацию ETV6-RUNX1 , реагируют
к бактериальному липополисахариду (в отсутствие защитного ИЛ-7) с сильным
индукция ферментов, активирующих рекомбинацию генов, и ускоренный мутагенез в
предлейкемические клетки, приводящие к лейкемии у мышей.
Растущие доказательства из
эпидемиологические исследования убедительно свидетельствуют о том, что повышенный уровень лейкемии, вероятно,
связаны с аномальным иммунным ответом на инфекции в раннем возрасте. 1 , 2 Недавнее экспериментальное подтверждение гипотезы
«отсроченная инфекция», предложенная Мелом Гривзом как причина детского
лейкемия произошла от Мартина-Лоренцо и др. . и Сваминатан и др.
номер . которые продемонстрировали, что воздействие генетически предрасположенных мышей к
инфекция может вызвать лейкемию. 3 , 4 Мартин-Лоренцо et
номер . показали, что мыши с моноаллельной потерей транскрипции В-клеток
фактора PAX5 генетически предрасположены к развитию предшественника В-клеточного ОЛЛ, но
лейкемия развивается только при контакте с обычными возбудителями. 3 Сваминатан и др. . продемонстрировал
что прелейкемические пре-В клетки, несущие транслокацию ETV6-RUNX1 , реагируют
к бактериальному липополисахариду (в отсутствие защитного ИЛ-7) с сильным
индукция ферментов, активирующих рекомбинацию генов, и ускоренный мутагенез в
предлейкемические клетки, приводящие к лейкемии у мышей. 4
4
Идентификация инфекционного агента при ОЛЛ остается неясной, в то время как достигнут значительный прогресс. было сделано для понимания вклада инфекции в агрессивную В-клеточную лимфому где Plasmodium falciparum , вирус Эпштейна-Барр (ВЭБ), Helicobacter pylori и вирус гепатита С были идентифицированы как триггеры трансформации. 5 , 6
Предполагается, что вирусы играют роль в патогенезе ОЛЛ. Преобразование вирусы могут интегрироваться в геном В-клеток-предшественников, нарушая дифференцировку и контроль за распространением. 2 В качестве альтернативы, обычные патогены могут действовать косвенно, вызывая необычную реакцию в организме. генетически и иммунологически восприимчивые дети, что приводит к автономным предшественникам В-клеточная пролиферация. 1
Предыдущие попытки идентифицировать вирусы-кандидаты с помощью предвзятых низкопроизводительных методов были
неудачные или обнаруженные известные распространенные патогены человека (рассмотрено в). Репрезентативная разница
анализ (RDA), наиболее чувствительный метод на сегодняшний день, достиг 95% вероятности
обнаружения вирусных геномов размером более 9 т.п.н. Но многие геномы онкогенных вирусов
меньший размер (например, вирус полиомы клеток Меркеля размером 5,3 т.п.н. или геном вируса саркомы Рауса размером 3,5 т.п.о.) и
низкое число копий вируса, низкое содержание опухолевых клеток и субклональность являются дополнительными
проблемы с ограниченной чувствительностью обнаружения используемых методов.
Репрезентативная разница
анализ (RDA), наиболее чувствительный метод на сегодняшний день, достиг 95% вероятности
обнаружения вирусных геномов размером более 9 т.п.н. Но многие геномы онкогенных вирусов
меньший размер (например, вирус полиомы клеток Меркеля размером 5,3 т.п.н. или геном вируса саркомы Рауса размером 3,5 т.п.о.) и
низкое число копий вируса, низкое содержание опухолевых клеток и субклональность являются дополнительными
проблемы с ограниченной чувствительностью обнаружения используемых методов.
Таблица 1.
Обзор предыдущих исследований по обнаружению вируса при острых лимфобластных заболеваниях у детей лейкемия.
Открыть в отдельном окне
Высокопроизводительное секвенирование следующего поколения (NGS), напротив, является высокочувствительным
подход, который, как было доказано, имеет потенциал для обнаружения известных и новых
вирусы. 21 Недавний
Исследование на основе NGS, в котором была предпринята попытка определить сайты вирусной интеграции во всем геноме. данные секвенирования 10 пациентов с TCF3 -перестроенное детство ВСЕ имеет
не удалось обнаружить ни одной настоящей химеры вируса/хозяина. 20 Поэтому мы разработали новую биоинформатику.
конвейер для обнаружения вирусных последовательностей в данных, полученных из всего генома
секвенирование, которое не ограничивается обнаружением редких сайтов интеграции
( Дополнительный онлайн Рисунок S1 и Дополнительный онлайн
Методы ). Во-первых, пять наборов данных, полученных из базы данных 1000 геномов.
(www.1000genomes.org) использовались в качестве тестовых наборов для конвейера. Больше, чем
25 000 вирусных геномов депонированы в базе данных Genome Information Broker for Viruses.
были протестированы. Оценки вероятности и in silico моделирования
продемонстрировали, что конвейер имеет очень высокую вероятность обнаружения вирусных геномов
(≥2 kb) и сайты вирусной интеграции (и , дополнительная онлайн-рисунок S2 ).
данные секвенирования 10 пациентов с TCF3 -перестроенное детство ВСЕ имеет
не удалось обнаружить ни одной настоящей химеры вируса/хозяина. 20 Поэтому мы разработали новую биоинформатику.
конвейер для обнаружения вирусных последовательностей в данных, полученных из всего генома
секвенирование, которое не ограничивается обнаружением редких сайтов интеграции
( Дополнительный онлайн Рисунок S1 и Дополнительный онлайн
Методы ). Во-первых, пять наборов данных, полученных из базы данных 1000 геномов.
(www.1000genomes.org) использовались в качестве тестовых наборов для конвейера. Больше, чем
25 000 вирусных геномов депонированы в базе данных Genome Information Broker for Viruses.
были протестированы. Оценки вероятности и in silico моделирования
продемонстрировали, что конвейер имеет очень высокую вероятность обнаружения вирусных геномов
(≥2 kb) и сайты вирусной интеграции (и , дополнительная онлайн-рисунок S2 ).
Открыть в отдельном окне
Распространенные вирусы выявлены при В-предшественнике острого лимфобластного лейкоза (ОЛЛ)
и здоровые подобранные контроли примерно с той же частотой. (А и Б)
Биоинформатическое обнаружение интегрированных вирусов и имитация вируса
обнаруживаемость в наборах данных полногеномного секвенирования с использованием разработанного конвейера.
(A) Вероятность обнаружения вируса увеличивается с размером его генома.
вероятность обнаружения в зависимости от размера генома в пределах 10 000 000 секвенирований
представлены риды генома человека. Типичный размер вируса 2 КБ или более составляет
указано (синяя заштрихованная рамка). (B) Вирусная генетическая нестабильность ухудшает обнаружение
только когда частота мутаций превышает 10%. Десять распространенных вирусов были
отобранных для имитационных экспериментов ( Дополнительная онлайн-таблица
S1 ). Уменьшается процент обнаруженных сайтов интеграции вирусов
с увеличением частоты мутаций аннотированных последовательностей вируса. Для каждого
вируса, 20 сайтов интеграции были случайным образом распределены по всему телу человека.
хромосома 1. Соответствующие последовательности вируса дикого типа соответствуют 0%
скорость мутации.
(А и Б)
Биоинформатическое обнаружение интегрированных вирусов и имитация вируса
обнаруживаемость в наборах данных полногеномного секвенирования с использованием разработанного конвейера.
(A) Вероятность обнаружения вируса увеличивается с размером его генома.
вероятность обнаружения в зависимости от размера генома в пределах 10 000 000 секвенирований
представлены риды генома человека. Типичный размер вируса 2 КБ или более составляет
указано (синяя заштрихованная рамка). (B) Вирусная генетическая нестабильность ухудшает обнаружение
только когда частота мутаций превышает 10%. Десять распространенных вирусов были
отобранных для имитационных экспериментов ( Дополнительная онлайн-таблица
S1 ). Уменьшается процент обнаруженных сайтов интеграции вирусов
с увеличением частоты мутаций аннотированных последовательностей вируса. Для каждого
вируса, 20 сайтов интеграции были случайным образом распределены по всему телу человека.
хромосома 1. Соответствующие последовательности вируса дикого типа соответствуют 0%
скорость мутации. Результаты для смоделированных парных концевых прочтений длиной 50 п.н. и 5-кратным
показана глубина секвенирования. (C) Во ВСЕХ вирусная ДНК соответствует обычным человеческим
патогенов (Anelloviridae, Herpesviridae и Parvoviridae) был обнаружен у 11 из
14 кейсов. Аналогичная картина наблюдалась и в контрольной группе того же возраста и пола.
когорта. Только ВГЧ7 чаще выявлялся в контрольной когорте (14 из 14 человек).
здоровых случаев по сравнению с 7 из 14 ВСЕХ случаев), но это было не так в
взрослый здоровый набор тестов на 1000 геномов (5 из 7 положительных случаев HHV-7).
Результаты для смоделированных парных концевых прочтений длиной 50 п.н. и 5-кратным
показана глубина секвенирования. (C) Во ВСЕХ вирусная ДНК соответствует обычным человеческим
патогенов (Anelloviridae, Herpesviridae и Parvoviridae) был обнаружен у 11 из
14 кейсов. Аналогичная картина наблюдалась и в контрольной группе того же возраста и пола.
когорта. Только ВГЧ7 чаще выявлялся в контрольной когорте (14 из 14 человек).
здоровых случаев по сравнению с 7 из 14 ВСЕХ случаев), но это было не так в
взрослый здоровый набор тестов на 1000 геномов (5 из 7 положительных случаев HHV-7).
По сравнению с невирусными геномами вирусы имеют повышенную скорость мутагенеза, что позволяет
большую генетическую изменчивость и быструю адаптацию к изменяющимся условиям, которые могут
вредно для идентификации последовательности. Мы выбрали десять клинически значимых вирусов:
обезьяний вирус 40, вирус полиомы клеток Меркеля, аденовирус-1, вирус папилломы человека-16,
вирус ветряной оспы, ВЭБ, цитомегаловирус, вирус иммунодефицита человека, парвовирус
4, Т-лимфотропный вирус человека-1 ( Онлайн-дополнительная таблица S1 ) ранжирование
от 5,2 до 235,6 т. п.н. в размере генома и смоделированной частоте мутаций до 30%.
Качество выравнивания и количество чтений выровненного секвенирования снижались с увеличением
частота мутаций, но последовательности вирусов и сайты интеграции, мутировавшие на 10%, были
по-прежнему хорошо поддаются обнаружению (> 60% для всех смоделированных вирусов) (и Дополнительный рисунок в Интернете
S3 ). Мутагенез вируса на 20% стал губительным для
анализы.
п.н. в размере генома и смоделированной частоте мутаций до 30%.
Качество выравнивания и количество чтений выровненного секвенирования снижались с увеличением
частота мутаций, но последовательности вирусов и сайты интеграции, мутировавшие на 10%, были
по-прежнему хорошо поддаются обнаружению (> 60% для всех смоделированных вирусов) (и Дополнительный рисунок в Интернете
S3 ). Мутагенез вируса на 20% стал губительным для
анализы.
Мы использовали NGS в сочетании с этим конвейером, чтобы проверить, обнаруживается ли вирусная ДНК в 14
педиатрические В-клеточные ВСЕ случаи. Мы выбрали ETV6-RUNX1 — положительный (n=7) и высокий
гипердиплоидный (n=7) ВСЕ, поскольку на эти два подтипа приходится
50–60% всех случаев В-клеточного ОЛЛ. Общепризнанно
что оба первичных поражения ( ETV6-RUNX1 — транслокация или высокая
гипердиплоидия) недостаточны для индукции явного лейкоза. Оба подтипа имеют длинную
латентный период после рождения и инфекция обсуждались как вероятные трансформирующие
курок. Мы провели полногеномное секвенирование для диагностики, ремиссии и (если
применимо) повторные образцы. С этой целью мононуклеарные клетки были получены Фиколлом.
центрифугированием плотности из костного мозга ДНК выделяли по стандартным протоколам и
было проведено секвенирование ( Дополнительные онлайн-методы ). В среднем,
мы произвели 442 миллиона считываний секвенирования на образец пациента ( Online
Дополнительная таблица S2 ). Примерно 10% этих чтений не удалось
быть сопоставлены с эталоном человека и потенциально могут кодировать вирусные последовательности. Как
набор контрольных данных, данные полногеномного секвенирования (сопоставимые по качеству секвенирования и
охват) нелейкемических образцов крови от 14 детей соответствующего возраста и пола.
[выбрано из когорты PedBrain Международного консорциума генома рака (ICGC);
www.pedbraintumor.org] ( Дополнительная онлайн-таблица
S3 ).
Мы провели полногеномное секвенирование для диагностики, ремиссии и (если
применимо) повторные образцы. С этой целью мононуклеарные клетки были получены Фиколлом.
центрифугированием плотности из костного мозга ДНК выделяли по стандартным протоколам и
было проведено секвенирование ( Дополнительные онлайн-методы ). В среднем,
мы произвели 442 миллиона считываний секвенирования на образец пациента ( Online
Дополнительная таблица S2 ). Примерно 10% этих чтений не удалось
быть сопоставлены с эталоном человека и потенциально могут кодировать вирусные последовательности. Как
набор контрольных данных, данные полногеномного секвенирования (сопоставимые по качеству секвенирования и
охват) нелейкемических образцов крови от 14 детей соответствующего возраста и пола.
[выбрано из когорты PedBrain Международного консорциума генома рака (ICGC);
www.pedbraintumor.org] ( Дополнительная онлайн-таблица
S3 ).
Вирусы, интегрированные в геном В-клеток-предшественников, могут непосредственно способствовать
лейкемогенез, действуя на дифференцировку и пролиферацию. В этом случае вирусная ДНК
должны быть стойкими и обнаруживаться в лейкемических клетках. Применение разработанного
биоинформатики к образцам пациентов с лейкемией, мы обнаружили вирусную ДНК в 11 из
14 случаев ( и ). Однако обнаруженный вирус
последовательности соответствовали исключительно известным, распространенным человеческим патогенам
( Anelloviridae, Herpesviridae и Parvoviridae ).
Аналогичная картина наблюдалась и в контрольной группе того же возраста и пола. Доказательств не найдено
на наличие других вирусов.
В этом случае вирусная ДНК
должны быть стойкими и обнаруживаться в лейкемических клетках. Применение разработанного
биоинформатики к образцам пациентов с лейкемией, мы обнаружили вирусную ДНК в 11 из
14 случаев ( и ). Однако обнаруженный вирус
последовательности соответствовали исключительно известным, распространенным человеческим патогенам
( Anelloviridae, Herpesviridae и Parvoviridae ).
Аналогичная картина наблюдалась и в контрольной группе того же возраста и пола. Доказательств не найдено
на наличие других вирусов.
Таблица 2.
Вирусы, обнаруженные в 14 спорадических случаях острого B-предшественника у детей лимфобластный лейкоз (ALL) с использованием секвенирования всего генома.
Открыть в отдельном окне
Интегрированные вирусы, которые действительно важны для характеристик лейкемических клеток, могут быть
ожидается, что он будет стойким при рецидиве. Проанализирована персистенция вирусов у 6 пациентов
для которых были доступны как диагностика, так и костный мозг рецидива.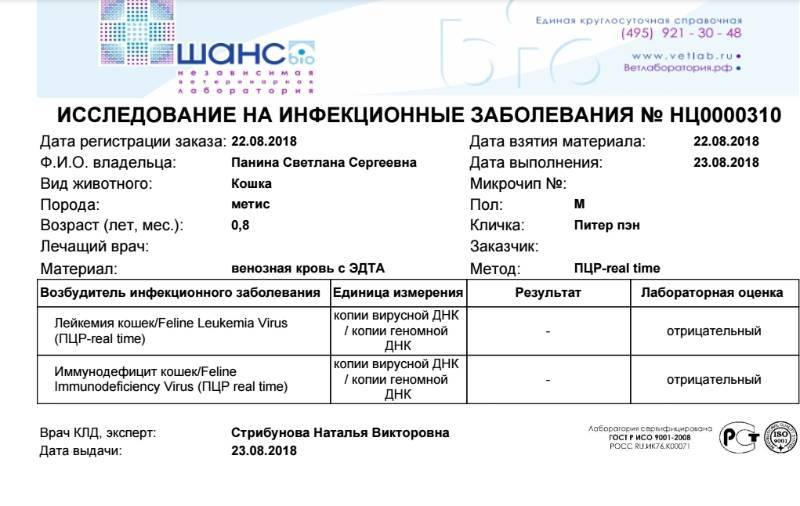 Пять пациентов были
положительный результат по крайней мере на один вирус, но ни в одном из этих случаев не было одного и того же вируса.
при постановке диагноза и рецидиве.
Пять пациентов были
положительный результат по крайней мере на один вирус, но ни в одном из этих случаев не было одного и того же вируса.
при постановке диагноза и рецидиве.
Вирусы могут способствовать лейкемогенезу косвенно, вызывая аномальные иммунологические
реакция, приводящая к автономной пролиферации предшественников В-клеток. В этом случае вирус
ДНК может сохраняться во время ремиссии или обнаруживаться только во время ремиссии, и в этом случае
могут встречаться широко распространенные малопатогенные вирусы. Аналогично результатам при лейкемии
образцов мы обнаружили только известные распространенные патогены человека в образцах ремиссии.
заболеваемость Anelloviridae увеличилась с одного случая при постановке диагноза до 6 в период ремиссии; этот
Вероятно, это произошло из-за переливания зараженной крови. Многие из обнаруженных
вирусы были обнаружены только в период ремиссии, а не в лейкемических образцах того же
пациент. У 3 пациентов вирусная ДНК не была идентифицирована ни в один из моментов времени.
В совокупности анализ 14 ВСЕХ случаев показал, что только обычные человеческие патогены ( Anelloviridae , Herpesviridae и Parvoviridae ) были обнаружены в большинстве случаев В-ОЛЛ и аналогичные вирусы и частота встречаемости наблюдались в контрольной группе того же возраста и пола (и Online Supplementary Таблицы S4–S7 ). Прямое сопоставление с базой данных вирусных последовательностей или выравнивание с помощью Blast-подобного инструмента не повлияло на этот результат ( Online Дополнительные таблицы S8 и S9 и Онлайн Дополнительный рисунок S3 ). Однако неинтегрирующиеся вирусы и вирусы работа в режиме «бей-беги» не будет обнаружена нашим подходом, а для вирусов с низким числом копий обнаружение на уровне РНК может быть более чувствительным.
Эпидемиологические исследования показали, что искомый вирус должен постоянно инфицировать
В-лимфоциты, вызывают минимальные симптомы первичной инфекции и обладают длительным
виремия; например, трансформирующий вирус EBV, обнаруженный в нашем исследовании, выполняет
предложенные критерии. Заражение может произойти внутриутробно и реактивация
материнской инфекции EBV был связан с повышенным риском детского
ВСЕ. 22 Плод
клетки-предшественники и пре-В-клетки восприимчивы к трансфекции ВЭБ, 23 , хотя рецептор ВЭБ CD21
(рецептор комплемента 2) более известен как маркер зрелых В-клеток, которые могут
аберрантно экспрессироваться на бластных клетках. 24 Кроме того, ранние исследования трансплантаций показали, что ВЭБ
присутствует в костном мозге, где, как считается, покоящиеся предлейкемические клетки
проживать. 25
Заражение может произойти внутриутробно и реактивация
материнской инфекции EBV был связан с повышенным риском детского
ВСЕ. 22 Плод
клетки-предшественники и пре-В-клетки восприимчивы к трансфекции ВЭБ, 23 , хотя рецептор ВЭБ CD21
(рецептор комплемента 2) более известен как маркер зрелых В-клеток, которые могут
аберрантно экспрессироваться на бластных клетках. 24 Кроме того, ранние исследования трансплантаций показали, что ВЭБ
присутствует в костном мозге, где, как считается, покоящиеся предлейкемические клетки
проживать. 25
К трем годам примерно 95% детей заражаются
с минимальными симптомами. Инфекция обычно протекает латентно, но может иметь место реактивация
люди с ослабленным иммунитетом или генетически предрасположенные. В соответствии с этим,
реактивация EBV была идентифицирована как основной фактор посттрансплантационного
лимфопролиферативное заболевание 26 и нокдаун Ikaros (главный регулятор развития B-клеток, аналогичный PAX5 и
часто удаляется при B-ALL) или вмешательство в его функцию фактора транскрипции
приводит к реактивации ВЭБ. 27
27
В случае лимфомы Ходжкина, отсутствие последовательностей вирусного генома, но убедительные доказательства для вирусного патогенеза было примирено методом «бей-беги». механизм. 28 ДНК ВЭБ в эписомальной (не интегрированной) форме может инициировать трансформацию, но впоследствии утрачивается. Это может быть возможным сценарием в случае человеческого pre-B-ALL и объясняет более низкая, чем ожидалось, частота EBV-положительных образцов пациентов. Альтернативно, цитомегаловирус, другой распространенный герпесвирус с трансформирующим потенциалом, может играть роль, как это предлагается в текущих исследованиях. 29
Наш анализ ВСЕХ случаев показывает, что искомый агент может быть обычным вирусом или другой инфекционный агент (например, бактерии-трансформеры или одноклеточные организмы).
Bartenhagen et al. Дополнительное приложение:Щелкните здесь для просмотра.
Раскрытие информации и вклады: Нажмите здесь для просмотра.
Авторы благодарят Монику Шмитц за сбор данных и помощь.
Финансирование: исследование финансировалось за счет гранта Katharina-Hardt-Stiftung и Немецкий «Kinderkrebsstiftung». UF был поддержан «Deutsche Krebshilfe – Фонд доктора Милдред Шил» (грант 108613) и два очных гранта (05/2014 и 2016–70) исследовательская комиссия медицинского факультета Университета Генриха Гейне Дюссельдорф.
Информация об авторстве, взносах, раскрытии финансовой и иной информации был предоставлен авторами и доступен в электронной версии этого статья на сайте www.haematologica.org.
1. Гривз М.Ф., Александр Ф.Е. Инфекционная этиология распространенных острых лимфобластных лейкемия в детстве? Лейкемия. 1993;7(3):349–360. [PubMed] [Google Scholar]
2. Кинлен Л.Дж. Эпидемиологические доказательства инфекционной основы в детстве лейкемия. Бр Дж Рак. 1995;71(1):1–5. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Martin-Lorenzo A, Hauer J, Vicente-Duenas C, et al. Воздействие инфекции является причинным фактором в предшественниках В-клеток
Острый лимфобластный лейкоз как результат Pax5-унаследованного
Восприимчивость. Раковый диск.
2015;5(12):1328–1343. [PubMed] [Академия Google]
Воздействие инфекции является причинным фактором в предшественниках В-клеток
Острый лимфобластный лейкоз как результат Pax5-унаследованного
Восприимчивость. Раковый диск.
2015;5(12):1328–1343. [PubMed] [Академия Google]
4. Сваминатан С., Клемм Л., Парк Э. и др. Механизмы клональной эволюции в детском возрасте лимфобластный лейкоз. Натура Иммунол. 2015;16(7):766–774. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Kugelberg E. Иммунология опухолей: малярия изменяет В-клетки лимфомогенез. Нат Рев Иммунол. 2015;15(9):528. [PubMed] [Google Scholar]
6. Foster LH, Portell CA. Роль инфекционных агентов, антибиотиков и противовирусных терапия при лечении экстранодальной лимфомы маргинальной зоны и других низкозлокачественные лимфомы. Curr Treat Opt Oncol. 2015;16(6):28. [PubMed] [Академия Google]
7. Лука Дж., Пирруччелло С.Дж., Керси Дж.Х. Геном HHV-6 в остром Т-клеточном лимфобластном лейкемия. Ланцет. 1991; 338: 1277–1278. [PubMed] [Google Scholar]
8. Бендер А.П., Робисон Л.Л., Кашмири С.В. и соавт.
Отсутствие вовлечения вируса лейкемии крупного рогатого скота в острый детский период
лимфобластный лейкоз и неходжкинская лимфома.
Рак рез.
1988;48(10):2919–2922. [PubMed] [Google Scholar]
Бендер А.П., Робисон Л.Л., Кашмири С.В. и соавт.
Отсутствие вовлечения вируса лейкемии крупного рогатого скота в острый детский период
лимфобластный лейкоз и неходжкинская лимфома.
Рак рез.
1988;48(10):2919–2922. [PubMed] [Google Scholar]
9. Маккензи Дж., Перри Дж., Форд А.М., Джарретт Р.Ф., Гривз М. Последовательности вирусов JC и BK не обнаруживаются при лейкемии. образцы от детей с общим острым лимфобластным лейкемия. Бр Дж Рак. 1999;81(5):898–899. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Smith MA, Strickler HD, Granovsky M, et al. Исследование лейкозных клеток у детей с острый лимфобластный лейкоз для геномных последовательностей приматов полиомавирусы вирус JC, вирус BK и обезьяний вирус 40. Мед Педиатр Онкол. 1999;33(5):441–443. [PubMed] [Google Scholar]
11. Ma XT, Song YH, Lu DM и др. Вирус герпеса человека 6 при гематологических заболеваниях Китай. Гематология. 2000; 85: 458–463. [PubMed] [Академия Google]
12. MacKenzie J, Gallagher A, Clayton RA, et al. Скрининг геномов герпесвирусов при общих острых
лимфобластный лейкоз. Лейкемия.
2001;15(3):415–421. [PubMed] [Google Scholar]
Скрининг геномов герпесвирусов при общих острых
лимфобластный лейкоз. Лейкемия.
2001;15(3):415–421. [PubMed] [Google Scholar]
13. Ширамидзу Б., Ю К., Ху Н., Янагихара Р., Неруркар В. Р. Изучение вируса ТТ в этиологии острого детского лимфобластный лейкоз. Педиатр Гематол Онкол. 2002;19(8):543–551. [PubMed] [Google Scholar]
14. Priftakis P, Dalianis T, Carstensen J, et al. ДНК полиомавируса человека не обнаружена в карточках Гатри (засохшие пятна крови) от детей, у которых развилась острая лимфобластная лейкемия. Мед Педиатр Онкол. 2003;40(4):219–223. [PubMed] [Google Scholar]
15. Hermouet S, Sutton CA, Rose TM, et al. Качественный и количественный анализ вирусов герпеса человека при хроническом и остром В-клеточном лимфоцитарном лейкозе и множественном миелома. Лейкемия. 2003;17(1):185–195. [PubMed] [Google Scholar]
16. Богданович Г., Йернберг А.Г., Прифтакис П., Гриллнер Л., Густафссон Б.
Вирус герпеса человека 6 или вирус Эпштейна-Барр не обнаружены
в карточках Гатри от детей, которые позже развили
лейкемия. Бр Дж Рак.
2004;91(5):913–915. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Бр Дж Рак.
2004;91(5):913–915. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17. Иса А., Прифтакис П., Бролиден К., Густафссон Б. ДНК парвовируса человека В19 не обнаружена на карточках Гатри от детей, у которых развилась острая лимфобластная лейкемия. Детский рак крови. 2004;42(4):357–360. [PubMed] [Google Scholar]
18. Густафссон Б., Джернберг А.Г., Прифтакис П., Богданович Г. Нет ДНК ЦМВ в карточках Гатри от детей, у которых позже развился ВСЕ. Педиатр Гематол Онкол. 2006;23(3):199–205. [PubMed] [Академия Google]
19. MacKenzie J, Greaves MF, Eden TO, et al. Предполагаемая роль трансформирующих вирусов в острой детской лимфобластный лейкоз. Гематология. 2006; 91: 240–243. [PubMed] [Google Scholar]
20. Forster M, Szymczak S, Ellinghaus D, et al. Vy-PER: устранение ложных срабатываний при обнаружении вируса события интеграции в данных секвенирования следующего поколения. Научный представитель 2015;5:11534. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Tang P, Chiu C.
Метагеномика для открытия нового человека
вирусы. Будущая микробиология.
2008; 5 (2): 177–189.. [PubMed] [Google Scholar]
Tang P, Chiu C.
Метагеномика для открытия нового человека
вирусы. Будущая микробиология.
2008; 5 (2): 177–189.. [PubMed] [Google Scholar]
22. Lehtinen M, Koskela P, Ogmundsdottir HM, et al. Материнские герпесвирусные инфекции и риск острого лимфобластный лейкоз у потомства. Ам Дж Эпидем. 2003;158(3):207–213. [PubMed] [Google Scholar]
23. Katamine S, Otsu M, Tada K, et al. Вирус Эпштейна-Барр трансформирует В-клетки-предшественники еще до реаранжировка генов иммуноглобулинов. Природа. 1984;309(5966):369–372. [PubMed] [Google Scholar]
24. Кампана Д., Кустан-Смит Э. Успехи в иммунологическом мониторинге острого детского лимфобластный лейкоз. Best Pract & Res Clin Гематол. 2002; 15(1):1–19. [PubMed] [Google Scholar]
25. Gratama JW, Oosterveer MA, Zwaan FE, Lepoutre J, Klein G, Ernberg I. Эрадикация вируса Эпштейна-Барра аллогенным костным мозгом трансплантация: последствия для участков вирусной латентности. Proc Natl Acad Sci USA. 1988;85(22):8693–8696. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Dharnidharka VR, Webster AC, Martinez OM, Preiksaitis JK, Leblond V, Choquet S.
Посттрансплантационная лимфопролиферативная
расстройства. Праймеры Nat Rev Dis.
2016;2:15088. [PubMed] [Академия Google]
Dharnidharka VR, Webster AC, Martinez OM, Preiksaitis JK, Leblond V, Choquet S.
Посттрансплантационная лимфопролиферативная
расстройства. Праймеры Nat Rev Dis.
2016;2:15088. [PubMed] [Академия Google]
27. Iempridee T, Reusch JA, Riching A, et al. Вирус Эпштейна-Барр использует Икарос для регуляции своего латентно-литическое переключение в В-клетках. Дж Вирол. 2014;88(9):4811–4827. [бесплатная статья PMC] [PubMed] [Google Scholar]
28. Амбиндер РФ. Гаммагерпесвирусы и «бей-беги» онкогенез. Ам Джей Патол. 2000;156(1):1–3. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Francis SS, Wallace AD, Wendt GA, et al. Внутриутробная цитомегаловирусная инфекция и развитие детский острый лимфобластный лейкоз. Кровь. 2016. DOI: 10.1182/blood-2016-07-723148. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Т-лимфотропный вирус человека типа 1
Т-лимфотропный вирус человека типа 1- Все темы »
- A
- B
- C
- D
- E
- F
- G 90 319 H
- I
- J
- K
- L
- M
- N
- O
- P
- Q
- R
- S
- T
- U
- V
- W
- X 903 20
- Д
- З
- Ресурсы »
- Бюллетени
- Факты в картинках
- Мультимедиа
- Публикации
- Вопросы и Ответы
- Инструменты и наборы инструментов
- Популярный »
- Загрязнение воздуха
- Коронавирусная болезнь (COVID-19)
- Гепатит
- оспа обезьян
- Все страны »
- A
- B
- C
- D
- E
- F
- G
- H
- I
- J
- K
- L
- M
- N
- O
- P
- Q
- R
- S
- T
- U
- V
- W
- X
- Y
- Z 9032 0
- Регионы »
- Африка
- Америка
- Юго-Восточная Азия
- Европа
- Восточное Средиземноморье
- Западная часть Тихого океана
- ВОЗ в странах »
- Статистика
- Стратегии сотрудничества
- Украина ЧП
- все новости »
- Выпуски новостей
- Заявления
- Кампании
- Комментарии
- События
- Тематические истории
- Выступления
- Прожекторы
- Информационные бюллетени
- Библиотека фотографий
- Список рассылки СМИ
- Заголовки »
- Сосредоточиться на »
- Афганистан кризис
- COVID-19 пандемия
- Кризис в Северной Эфиопии
- Сирийский кризис
- Украина ЧП
- Вспышка оспы обезьян
- Кризис Большого Африканского Рога
- Последний »
- Новости о вспышках болезней
- Советы путешественникам
- Отчеты о ситуации
- Еженедельный эпидемиологический отчет
- ВОЗ в чрезвычайных ситуациях »
- Наблюдение
- Исследовать
- Финансирование
- Партнеры
- Операции
- Независимый контрольно-консультативный комитет
- Призыв ВОЗ о чрезвычайной ситуации в области здравоохранения 2023 г.

- Данные ВОЗ »
- Глобальные оценки здоровья
- ЦУР в области здравоохранения
- База данных о смертности
- Сборы данных
- Панели инструментов »
- Информационная панель COVID-19
- Приборная панель «Три миллиарда»
- Монитор неравенства в отношении здоровья
- Основные моменты »
- Глобальная обсерватория здравоохранения
- СЧЕТ
- Инсайты и визуализации
- Инструменты сбора данных
- Отчеты »
- Мировая статистика здравоохранения 2022 г.
- избыточная смертность от COVID
- DDI В ФОКУСЕ: 2022 г.
- О ком »
- Люди
- Команды
- Состав
- Партнерство и сотрудничество
- Сотрудничающие центры
- Сети, комитеты и консультативные группы
- Трансформация
- Наша работа »
- Общая программа работы
- Академия ВОЗ
- Деятельность
- Инициативы
- Финансирование »
- Инвестиционный кейс
- Фонд ВОЗ
- Подотчетность »
- Аудит
- Программный бюджет
- Финансовые отчеты
- Портал программного бюджета
- Отчет о результатах
- Управление »
- Всемирная ассамблея здравоохранения
- Исполнительный совет
- Выборы Генерального директора
- Веб-сайт руководящих органов
- Портал государств-членов
- Главная/
- Отдел новостей/
- Информационные бюллетени/
- Деталь/
- Т-лимфотропный вирус человека типа 1
- Т-лимфотропный вирус человека типа 1 также известен под аббревиатурой HTLV-1 или как вирус Т-клеточного лейкоза человека типа 1.

- Вирус может вызывать тип рака, называемый Т-клеточной лейкемией/лимфомой взрослых (ATL).
- HTLV-1 передается главным образом через инфицированные жидкости организма, включая кровь, грудное молоко и сперму.
- Факторы риска включают незащищенный секс, употребление инъекционных наркотиков и трансплантацию тканей, крови и продуктов крови.
- По оценкам, от 5 до 10 миллионов человек во всем мире инфицированы HTLV-1, хотя это число, вероятно, выше из-за отсутствия надежных данных.
Обзор
Т-лимфотропный вирус человека типа 1 (HTLV-1) был первым обнаруженным онкогенным ретровирусом человека. Впервые он был изучен в 1977 году. Вирус может вызывать у взрослых Т-клеточный лейкоз/лимфому (ATL) и прогрессирующее заболевание нервной системы, известное как HTLV-1-ассоциированная миелопатия или тропический спастический парапарез (HAM/TSP).
Текущие наилучшие оценки общего числа людей, живущих с инфекцией HTLV-1, составляют от 5 до 10 миллионов человек. Нехватка надежных данных указывает на то, что это, вероятно, занижение фактических глобальных цифр.
Нехватка надежных данных указывает на то, что это, вероятно, занижение фактических глобальных цифр.
Передача
Считается, что HTLV-1 передается главным образом при прямом контакте через содержащие клетки биологические жидкости, включая кровь, грудное молоко и сперму. Передача через прямой контакт также считается возможной, хотя вирус обычно существует во внутриклеточной форме.
Матери могут передавать вирус детям через грудное вскармливание, и существует ограниченное количество данных о передаче вируса до или во время родов. Предполагаемый уровень передачи инфекции от матери ребенку колеблется от 3,9% до 27%.
HTLV-1 обнаружен в цервикальном секрете и сперме. Сообщалось о повышенном присутствии вируса среди половых партнеров людей с инфекцией HTLV-1, что подтверждает доказательства передачи половым путем. Незащищенный секс в анамнезе, более ранний возраст начала половой жизни и большее количество партнеров повышают риск передачи инфекции.
В нескольких исследованиях сообщалось о частоте передачи до 63% при переливании крови от донора с HTLV-1. В одном исследовании сообщалось о скорости передачи 87% от трансплантатов тканей от положительных доноров.
Употребление инъекционных наркотиков также является фактором риска инфицирования HTLV-1.
Скрининг и диагностика
В соответствии с существующей практикой за скрининговыми тестами на HTLV-1 должны следовать подтверждающие тесты для диагностики HTLV-1. В большинстве скрининговых тестов используются иммуноанализы, основанные на обнаружении антител к HTLV-1. Обычно используемые подтверждающие тесты обнаруживают ответы антител на специфические антигены HTLV-1. Типы тестов включают вестерн-блоттинг, радиоиммунопреципитацию (РИА) и линейный иммуноанализ; однако было обнаружено, что вестерн-блоттинг дает ненадежные результаты. В нескольких исследованиях предлагалось перейти от использования вестерн-блоттинга для подтверждения в рутинных тестах к использованию линейного иммуноанализа или NAT.
Тестирование может быть усложнено из-за продолжительности времени между заражением вирусом и сероконверсией, необходимой для появления вируса в тестах. Сообщается, что этот период составляет 65 дней. Сообщалось также об отсроченной сероконверсии в течение нескольких лет. Сообщалось, что дети, рожденные от серопозитивных матерей, сероконвертировали в возрасте 1–3 лет.
Симптомы
У большинства людей с инфекцией HTLV-1 симптомы отсутствуют, и у них не развиваются состояния, которые могут быть причинно связаны с инфекцией. Однако считается, что несколько серьезных заболеваний вызваны вирусом или тесно связаны с ним. Каждое из этих заболеваний имеет специфические симптомы, которые могут указывать на наличие HTLV-1.
Например, пожизненный риск развития Т-клеточного лейкоза/лимфомы (АТЛ) у взрослых среди людей с инфекцией HTLV-1 составляет около 5% (хотя это может быть консервативным из-за незарегистрированных случаев). АТЛ представлен четырьмя клиническими подтипами: острым, лимфоматозным, хроническим и вялотекущим, причем более агрессивные подтипы (острый и лимфоматозный) составляют большинство случаев. Клиническая картина зависит от подтипа. У людей могут проявляться лимфаденопатия, гепатоспленомегалия, гиперкальциемия из-за поражения кожи, легких, костей и других органов.
АТЛ представлен четырьмя клиническими подтипами: острым, лимфоматозным, хроническим и вялотекущим, причем более агрессивные подтипы (острый и лимфоматозный) составляют большинство случаев. Клиническая картина зависит от подтипа. У людей могут проявляться лимфаденопатия, гепатоспленомегалия, гиперкальциемия из-за поражения кожи, легких, костей и других органов.
Другим заболеванием является миелопатия, ассоциированная с HTLV-1, или тропический спастический парапарез (HAM/TSP). Это хроническое воспалительное заболевание центральной нервной системы, характеризующееся прогрессирующей спастической слабостью нижних конечностей, болями в пояснице, нарушением функции кишечника и мочевого пузыря. Клинические признаки могут включать мышечную слабость, гиперрефлексию и клонус нижних конечностей, а также подошвенные разгибатели и спастическую походку. Оценки пожизненного риска HAM/TSP среди людей с инфекцией HTLV-1 варьировались от 0,18% до 1,8%.
Другие заболевания, связанные с инфекцией HTLV-1, включают HTLV-1-ассоциированный увеит (HAU), инфекционный дерматит, бронхоэктазы, бронхит и бронхиолит, себорейный дерматит, синдром Шегрена, ревматоидный артрит, фибромиалгию и язвенный колит. Существует мало доказательств того, что инфекции HTLV-1 вызывают другие формы рака.
Существует мало доказательств того, что инфекции HTLV-1 вызывают другие формы рака.
Профилактика
В нескольких обсервационных исследованиях изучались специфические меры профилактики HTLV-1. Отсутствуют отчеты, касающиеся профилактики передачи инфекции половым путем или профилактики среди лиц, употребляющих инъекционные наркотики. В настоящее время изучаемые стратегии включают:
Прекращение грудного вскармливания. На основании обсервационных исследований передачи инфекции от матери к ребенку было установлено, что сокращение продолжительности грудного вскармливания или даже его полное прекращение может позволить женщинам с HTLV-1 ограничить степень воздействия младенцы.
Метод замораживания-оттаивания грудного молока: Метод замораживания-оттаивания эффективно уничтожает клетки грудного молока, инфицированные HTLV-1 и, следовательно, являющиеся источником передачи инфекции.
Скрининг на антитела среди доноров крови: Обязательный скрининг на антитела к HTLV-1 всех доноров крови был проведен в 23 странах.
Лейкоредукция: Поскольку HTLV-1 почти всегда связан с клетками, лейкоредукция может быть столь же эффективной, как скрининг донорской крови для предотвращения передачи инфекции.
В настоящее время вакцины против HTLV-1 не существует, хотя разработка вакцины считается возможной. Однако модели на животных могут оказаться непригодными для изучения действия вакцины на HTLV-1. Ни одна вакцина-кандидат HTLV-1 до сих пор не прошла клинические испытания с конечной точкой эффективности.
Лечение
В настоящее время лечение для людей с бессимптомной инфекцией HTLV-1 не рекомендуется. Вместо этого лечение должно быть сосредоточено на симптомах сопутствующих заболеваний, а именно ATL и HAM/TSP, а также на скрининге сопутствующих заболеваний и коинфекции.
В настоящее время ни один биологический маркер или клинический признак не позволяет точно предсказать развитие или количественно оценить риск заболеваний, связанных с HTLV-1, хотя в качестве возможного индикатора предлагались уровни провирусной нагрузки HTLV-1. Улучшения в прогнозировании риска помогут в клиническом ведении.
Ответ ВОЗ
В сотрудничестве с государствами-членами и партнерами ВОЗ работает над разработкой руководства по методам эпиднадзора за HTLV-1, включая методы определения распространенности и методы мониторинга вмешательств. Сюда входят методы экспресс-оценки и оценки бремени болезней. Для условий с ограниченными ресурсами также необходимо специальное руководство по подходам и стратегиям тестирования для обнаружения HTLV-1, которые соответствуют условиям и цели.
Дальнейшее тестирование и анализ позволят определить, существует ли уровень провирусной нагрузки, ниже которого риск передачи является незначительным, а также конкретные данные для более точного определения риска передачи HTLV-1 от матери ребенку и эффективности стратегий профилактики.