Поведение диких крыс | Cell Biology.ru
Социальные отношения и система спаривания
Дикие крысы живут в колониях. Самки образуют небольшие группы (до шести животных). Одна группа имеет одну собственную систему нор (подробнее о норах ниже). У каждой самки есть отдельная гнездовая камера, и они могут растить своих крысят одиночно или заботиться об общих детенышах всей группой. Вскоре после перехода на самостоятельное питание молодые самцы уходят из колонии.
Система отношений самцов и система спаривания крыс изменяется в зависимости от плотности населения колонии. При низкой плотности крыса-самец монополизирует нору самок. Он защищает территорию от других самцов и спаривается только с самками своей группы. Такая форма половых отношений, когда один самец спаривается с несколькими представителями противоположного пола, носит название полигиния (разновидность полигамии).
При высокой плотности населения (более одной крысы на пяти кв. метрах) самец-хозяин уже не в состоянии защитить собственную
территорию от других самцов (потому что их становится слишком много).
Итак, при низкой плотности населения самцы серых крыс территориальны и полигамны; при высокой плотности отношения между особями внутри группы регулируются системой социальной иерархии, система спаривания типа промискуитет.
Агонистическое поведение
Иерархические отношения между половозрелыми самцами в колонии устанавливаются в результате их борьбы за доминирующее положение, которая может иметь вид драки с нанесением физических повреждений или оканчиваться очень быстро.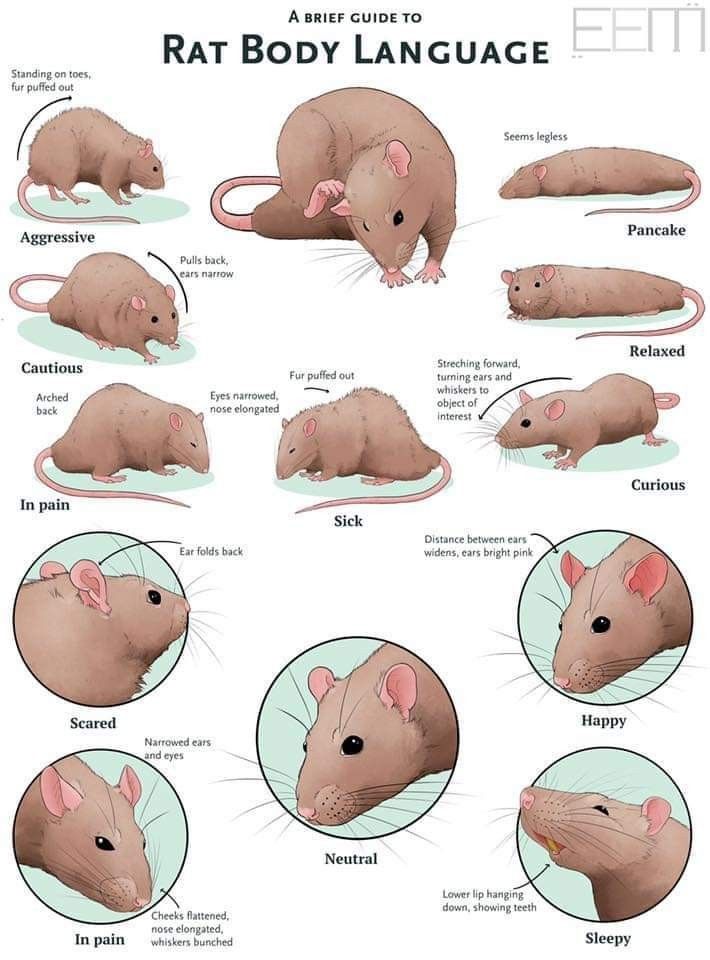 Однако, после того как эти отношения уже установлены, частота и выраженность конфликтов становится незначительной. Доминантом, как правило, становится более крупный самец. Что же касается иерархических отношений между подчиненными особями, то они до сих пор не ясны. Известно, что крысы обоих полов с низким социальным статусом живут в среднем меньше, чем крысы с более высоким рангом. Причина – социальный стресс*, который испытывают первые. Не будем забывать, что и без этого до своего первого дня рождения доживает лишь 5% диких крыс.
Однако, после того как эти отношения уже установлены, частота и выраженность конфликтов становится незначительной. Доминантом, как правило, становится более крупный самец. Что же касается иерархических отношений между подчиненными особями, то они до сих пор не ясны. Известно, что крысы обоих полов с низким социальным статусом живут в среднем меньше, чем крысы с более высоким рангом. Причина – социальный стресс*, который испытывают первые. Не будем забывать, что и без этого до своего первого дня рождения доживает лишь 5% диких крыс.
отсутствуют некоторые виды агонистического поведения (например, переворачивание на спину), которые можно наблюдать у домашних крыс.
Иерархия
В колонии подчиняющиеся самцы используют две стратегии в их отношении с доминирующим самцом: одни (омега-самцы) избегают самца-доминанта, другие (бета-самцы) стремятся постоянно быть рядом с ним.
Когда омега-самцы встречаются с доминирующим самцом, они вызывают у него агрессию. Такие самцы в естественных условиях, как правило, уходят из колонии. Однако, если убрать из колонии главного самца, новым доминантом зачастую становится именно омега-самец. Бета-самцы в такой ситуации становятся полностью покорными новой доминирующей крысе, та, в свою очередь, не возражает против их присутствия.
Выбор крысой одной из стратегий зависит от ее психофизиологических характеристик*.
Пояснение: доминирующим может называться такое животное, которое способно действовать (при половом, агрессивном, пищевом и другом поведении), не считаясь с действиями своих партнеров. Соответственно, подчиненное животное – то, чьи действия вызываются, модифицируются, ограничиваются или подавляются действиями партнеров.
Аллогруминг
Аллогруминг – чистка меха одной особи другой особью. Взаимные чистки широко распространены у млекопитающих, ведущих семейно-групповой образ жизни, в том числе и у крыс. Аллогруминг играет важную роль в поддержании системы социальных связей в группе, в подавлении агрессивных тенденций. Аллогруминг оказывает умиротворяющее воздействие на партнера, вызывая ощущение удовольствия. Одна особь чистит мех у другой особи в тех местах, до которых та не может достать своей мордочкой при автогруминге; аллогруминг также играет роль в создании общего
«запаха колонии». Самки большинства видов млекопитающих вылизывают и чистят мех у детенышей (у моногамных видов или факультативно моногамных видов (джунгарский хомячок) это проделывает и самец). У крыс и других грызунов с семейно-групповым образом жизни (например, монгольская и большая песчанки) существуют особые позы «подставления под чистку», когда соподчиненная особь ищет тактильного контакта с доминантом.
Метки
Учеными обнаружено, что в моче крыс содержатся не только продукты обмена веществ, но целый ряд компонентов – феромонов, которые у крыс служат сигналами, определяющими положение и состояние индивидуума. Поэтому животные оставляют в пределах своего участка обитания капельки мочи (метки), чтобы обозначить пределы своей территории, а также с целью привлечения половых партнеров.
Поэтому животные оставляют в пределах своего участка обитания капельки мочи (метки), чтобы обозначить пределы своей территории, а также с целью привлечения половых партнеров.
отчетливо видны даже старые метки (стоит отметить, что крысы могут видеть часть лучей ультрафиолетового спектра света).
Подчиненные особи и самки метятся относительно редко и не сильно. Однако, в ночь перед течкой самка, чтобы заявить о своей готовности к спариванию, начинает помечать предметы чаще, чем обычно.
Такие мочевые метки — не единственный вид обонятельной коммуникации у крыс. Иногда крысы трутся о вертикальные поверхности (например, о стену) или о край входа в нору, чтобы оставить на них секреты специфических желез, расположенных на боках их тела. Самцы делают это чаще, чем самки (также крысы чаще трутся о поверхности, если чувствуют запах других крыс).

Пища
Вопрос, как крысы узнают, что можно есть, а что нельзя, хорошо изучен. Крысы всеядны, т.е. они могут есть почти все. Такая способность есть что угодно делает крыс очень гибкими в плане приспосабливаемости. Вследствие этого их среды обитания могут быть очень разнообразными. Поскольку
Удивительно, но даже эмбрионы узнают, что съела вынашивающая их самка, и в будущем предпочитают есть те корма, которые она употребляла во время беременности. Далее, когда крысята уже родились, через молоко матери они получают информации о том, чем она питалась. Перейдя на самостоятельное питание, они будут уверенно есть ту же пищу.
Подросшие крысята, встречая незнакомый вид корма, следят, едят ли его взрослые крысы колонии. Если пища помечена взрослой крысой, значит, ее можно есть не опасаясь.
Немалую роль в выборе пищи играет и жизненный опыт.

Следует также отметить, что крысы обладают хорошо развитыми чувствами обоняния и вкуса, поэтому нередко они определяют,
опасна ли пища, даже не попробовав или не проглотив ее.
А что если крыса все-таки съела ядовитую пищу?
Крысы не способны отрыгивать съеденную пищу. Вместо этого, почувствовав тошноту, они ищут и поедают такие вещества, как глину, грязь, а иногда и подстилку гнезда. Эти вещества нейтрализуют токсины, которые и вызывают тошноту.
Значение капрофагии за время перехода крысенка на твердые корма
В формировании способности крысенка к перевариванию твердых кормов большое значение имеет поедание экскрементов матери, привлекательность которых для него резко повышается с двухнедельного возраста.
Оказывается, через 14 дней после родов у самки начинается секреция специального феромона, вызывающего у детенышей соответствующую реакцию. Максимальную реакцию проявляют детеныши 21-дневного возраста, у 27-дневных крысят реакция
Как объем, так и состав фекальных масс самки, когда крысята достигают двухнедельного возраста, сильно изменяются. Вес фекальных масс в этот период в 2 – 3 раза превышает таковой девственных самок. Соответственно увеличивается и потребление ими кормов. В фекалиях резко повышается содержание летучих компонентов, они светлее обычных, сильнее пахнут и менее структурированы.
Оказывается, увеличение уровня пролактина в крови самки приводит к постепенному увеличению концентрации этого гормона в печени, а это, в свою очередь, приводит к увеличению синтеза печенью основной желчной – холиевой кислоты. В слепой кишке крыс под воздействием определенных бактерий из холиевой кислоты синтезируется вторичная желчная – деоксихолиевая кислота.
 Потребность в ней и заставляет крысят поедать экскременты матери, а привлекает их феромон-содержащий компонент фекалий – производное диоксихолиевой кислоты.
Потребность в ней и заставляет крысят поедать экскременты матери, а привлекает их феромон-содержащий компонент фекалий – производное диоксихолиевой кислоты.Вплоть до 28-дневного возраста крысят уровень секреции деоксихолиевой кислоты у них значительно ниже, чем у взрослых крыс.
Потребность в деоксихолиевой кислоте может объясняться по крайней мере двумя основными причинами. Первая — повышение иммунозащиты у крысят, вторая – миелинизация мозга.
Кроме того, можно предположить, что фекалии матери обогащены и кишечной микрофлорой, специфичной для предпочитаемых ею кормов, т.е. капрофагия также способствует физиологической пищевой специализации крысят.
Норы
В природе дикие крысы живут в норах. Крысиная нора может представлять собой гнездовую камеру, соединенную с поверхностью земли коротким туннелем (в самом простом случае), или довольно сложную систему туннелей, проходов и камер.
Размер и структура норы зависит от размера и структуры колонии, использующей эту нору в качестве убежища. Если число особей в колонии вследствие каких-либо причин резко падает, то оставшиеся крысы уже не в состоянии ухаживать за всей норой,
Если число особей в колонии вследствие каких-либо причин резко падает, то оставшиеся крысы уже не в состоянии ухаживать за всей норой,
ее состояние сильно ухудшается.
Вход в нору обычно располагается в защищенном или невидимом для хищников месте. Крысы могут закрывать вход пробкой из травы или земли. Средний диаметр туннеля составляет 8.3 см, средняя длина прямого туннеля – около 30 см (в конце туннель поворачивает в другую сторону, раздваивается или оканчивается тупиком или камерой). Камеры сильно варьируют в размерах. Средняя камера размером 18 на 22 см может вместить 7 крыс. Бывают очень маленькие камеры, способные вместить только трех крыс, или очень большие – в них могут находиться сразу 11 крыс.
Вне норы крысы предпочитают перемещаться по определенным системам троп – это позволяет им быстро сориентироваться в случае опасности и спрятаться в норе или другом убежище.
Литература:
- По материалам сайта «Rat behavior and biology»
- П о материалам книги «Серая крыса.
 Систематика, экология, регуляция численности» (Ред. В.Е.Соколов, Е.В.Карасева)
Систематика, экология, регуляция численности» (Ред. В.Е.Соколов, Е.В.Карасева)
‹ Крыса Вверх Клеточные культуры ›
Социальное поведение и пространственная ориентация у линий крыс с генетической предрасположенностью к кататонии (ГК) и стереотипиям (МД) | Плеканчук
1. Adamczyk A., Mejias R., Takamiya K., Yocum J., Krasnova I.N., Caldero J., Wang T. GluA3-deficiency in mice is associated with increased social and aggressive behavior and elevated dopamine in striatum. Behav. Brain Res. 2012;229(1):265-272. DOI 10.1016/j.bbr.2012.01.007.
2. Alekhina T.A., Kozhemyakina R.V. Modeling of focal seizures with automatisms in rats with pendulum movements. Bull. Exp. Biol. Med. 2019;168(2):300-303. DOI 10.1007/s10517-019-04695-7.
3. Alekhina T.A., Palchikova N.A., Igonina T.N., Kuznetsova N.V. Comparative analysis of imipramine intake reactions in catatonic and wistar rats. Rossiiskii Fiziologicheskii Zhurnal im. I.M. Sechenova = Russian Journal of Physiology. 2015;101(3):249-257. (in Russian)
2015;101(3):249-257. (in Russian)
4. Alekhina T.A., Palchikova N.A., Kozhemyakina R.V., Prokudina O.I. The signs of destabilization in behavioral and somatovegetative parameters of rats selected for catatonia. Russ. J. Genet. Appl. Res. 2016;6(8):798-803. DOI 10.1134/S2079059716080025.
5. Alekhina T.A., Prokudina O.I., Ryazanova M.A., Ukolova T.N., Barykina N.N., Kolpakov V.G. Typological characteristics of behavior in strains of rats bred for enhancement and absence of pendulum movements. Association with brain monoamines. Zhurnal Vysshey Nervnoy Deyatel’nosti im. I.P. Pavlova = I.P. Pavlov Journal of Higher Nervous Activity. 2007;57(3):336-343. (in Russian)
6. Alekhina T.A., Shtilman N.I., Nikulina E.M., Pavlov I.F., Barykina N.N. Aggression and learning in a strain of rats predisposed to catalepsy. Zhurnal Vysshey Nervnoy Deyatel’nosti im. I.P. Pavlova = I.P. Pavlov Journal of Higher Nervous Activity. 1987;37(3):537-541. (in Russian)
7. Anderzhanova E., Kirmeier T. , Wotjak C.T. Animal models in psychiatric research: the RDoC system as a new framework for endophenotype-oriented translational neuroscience. Neurobiol. Stress. 2017;7:47-56. DOI 10.1016/j.ynstr.2017.03.003.
, Wotjak C.T. Animal models in psychiatric research: the RDoC system as a new framework for endophenotype-oriented translational neuroscience. Neurobiol. Stress. 2017;7:47-56. DOI 10.1016/j.ynstr.2017.03.003.
8. Barykina N.N., Chugui V.F., Alekhina T.A., Ryazanova M.A., Ukolova T.N., Sakharov D.G., Kolpakov V.G. Learning of rats predisposed to catalepsy in Morris water test. Zhurnal Vysshey Nervnoy Deyatel’nosti im. I.P. Pavlova = I.P. Pavlov Journal of Higher Nervous Activity. 2009;59(6):728-735. (in Russian)
9. Brooks-Kayal A.R., Bath K.G., Berg A.T., Galanopoulou A.S., Holmes G.L., Jensen F.E., Scharfman H.E. Issues related to symptomatic and disease-modifying treatments affecting cognitive and neuropsychiatric comorbidities of epilepsy. Epilepsia. 2013;54 (Suppl.4):44-60. DOI 10.1111/epi.12298.
10. Crowley W.R., O’Connor L.H., Feder H.H. Neurotransmitter systems and social behavior. In: Balthazart J. (Ed.) Molecular and Cellular Basis of Social Behavior in Vertebrates. Advances in Comparative and Environmental Physiology. Vol. 3. Berlin; Heidelberg; Springer, 1989;161-208. DOI 10.1007/978-3-642-73827-2_4.
Advances in Comparative and Environmental Physiology. Vol. 3. Berlin; Heidelberg; Springer, 1989;161-208. DOI 10.1007/978-3-642-73827-2_4.
11. Deak T., Arakawa H., Bekkedal M.Y., Panksepp J. Validation of a novel social investigation task that may dissociate social motivation from exploratory activity. Behav. Brain Res. 2009;199(2):326-333. DOI 10.1016/j.bbr.2008.12.011.
12. Deb S., Brizard B.A., Limbu B. Association between epilepsy and challenging behaviour in adults with intellectual disabilities: systematic review and meta-analysis. BJPsych Open. 2020;6(5):e114. DOI 10.1192/bjo.2020.96.
13. Desjardins D., Parker G., Cook L.L., Persinger M.A. Agonistic behavior in groups of limbic epileptic male rats: pattern of brain damage and moderating effects from normal rats. Brain Res. 2001;905(1-2): 26-33. DOI 10.1016/S0006-8993(01)02454-4.
14. Fink M., Taylor M.A. The many varieties of catatonia. Eur. Arch. Psychiatry Clin. Neurosci. 2001;251(Suppl.1):I/8-I/13. DOI 10. 1007/pl00014200.
1007/pl00014200.
15. Fuquay J.M., Muha N., Pennington P.L., Ramsdell J.S. Domoic acid induced status epilepticus promotes aggressive behavior in rats. Physiol. Behav. 2012;105(2):315-320. DOI 10.1016/j.physbeh.2011.08.013.
16. Gawel K., Gibula E., Marszalek-Grabska M., Filarowska J., Kotlinska J.H. Assessment of spatial learning and memory in the Barnes maze task in rodents – methodological consideration. NaunynSchmiedeberg’s Arch. Pharmacol. 2019;392(1):1-18. DOI 10.1007/s00210-018-1589-y.
17. Glenn M.J., Batallán Burrowes A.A., Yu W., Blackmer‐Raynolds L., Norchi A., Doak A.L. Progression of behavioral deficits during periadolescent development differs in female and male DISC1 knockout rats. Genes Brain Behav. 2021;e12741. DOI 10.1111/gbb.12741.
18. Gonzalez L.E., Rujano M., Tucci S., Paredes D., Silva E., Alba G., Hernandez L. Medial prefrontal transection enhances social interaction: I: Behavioral studies. Brain Res. 2000;887(1):7-15. DOI 10.1016/S0006-8993(00)02931-0.
19. Harrison F.E., Hosseini A.H., McDonald M.P. Endogenous anxiety and stress responses in water maze and Barnes maze spatial memory tasks. Behav. Brain Res. 2009;198(1):247-251. DOI 10.1016/j.bbr.2008.10.015.
20. Jones C.A., Watson D.J.G., Fone K.C.F. Animal models of schizophrenia. Br. J. Pharmacol. 2011;164(4):1162-1194. DOI 10.1111/j.1476-5381.2011.01386.x.
21. Kaidanovich-Beilin O., Lipina T., Vukobradovic I., Roder J., Woodgett J.R. Assessment of social interaction behaviors. J. Vis. Exp. 2011;48:e2473. DOI 10.3791/2473.
22. Kiser D.P., Rivero O., Lesch K.P. Annual research review: the (epi)genetics of neurodevelopmental disorders in the era of whole‐genome sequencing – unveiling the dark matter. J. Child Psychol. Psychiatry. 2015;56(3):278-295. DOI 10.1111/jcpp.12392.
23. Koolhaas J.M., Coppens C.M., de Boer S.F., Buwalda B., Meerlo P., Timmermans P.J. The resident-intruder paradigm: a standardized test for aggression, violence and social stress. J. Vis. Exp. 2013;77:e4367. DOI 10.3791/4367.
Vis. Exp. 2013;77:e4367. DOI 10.3791/4367.
24. Krueger R.F., Kotov R., Watson D., Forbes M.K., Eaton N.R., Ruggero C.J., Zimmermann J. Progress in achieving quantitative classification of psychopathology. World Psychiatry. 2018;17(3):282-293. DOI 10.1002/wps.20566.
25. Li M., Zhang M. SU10. Behavioral characteristics of a DISC1 knockout rat model. Schizophr. Bull. 2017;43(Suppl.1):S164. DOI 10.1093/schbul/sbx024.009.
26. McAllister K.H. D-cycloserine enhances social behaviour in individually-housed mice in the resident-intruder test. Psychopharmacology. 1994;116(3):317-325. DOI 10.1016/0031-9384(86)90007-7.
27. McLntyre D.C., McLeod W.S., Anisman H. Working and reference memory in seizure-prone and seizure-resistant rats: impact of amygdala kindling. Behav. Neurosci. 2004;118(2):314-323. DOI 10.1037/0735-7044.118.2.314.
28. Nam H., Clinton S.M., Jackson N.L., Kerman I.A. Learned helplessness and social avoidance in the Wistar-Kyoto rat. Front. Behav. Neurosci. 2014;8:109. DOI 10.3389/fnbeh.2014.00109.
2014;8:109. DOI 10.3389/fnbeh.2014.00109.
29. Nani J.V., Rodríguez B., Cruz F.C., Hayashi M.A.F. Animal models in psychiatric disorder studies. In: Tvrdá E., Yenisetti S.C. (Eds.) Animal Models in Medicine and Biology. IntechOpen, 2019. DOI 10.5772/intechopen.89034.
30. Neill J.C., Barnes S., Cook S., Grayson B., Idris N.F., McLean S.L., Harte M.K. Animal models of cognitive dysfunction and negative symptoms of schizophrenia: focus on NMDA receptor antagonism. Pharmacol. Ther. 2010;128(3):419-432. DOI 10.1016/j.pharmthera.2010.07.004.
31. Nelson E.E., Panksepp J. Brain substrates of infant–mother attachment: contributions of opioids, oxytocin, and norepinephrine. Neurosci. Biobehav. Rev. 1998;22(3):437-452. DOI 10.1016/S0149-7634(97)00052-3.
32. Nikulina E.M., Popova N.K., Kolpakov V.G., Alekhina T.A. Brain dopaminergic system in rats with a genetic predisposition to catalepsy. Biog. Amines. 1987;4(4-6):399-406.
33. Nosek K., Dennis K., Andrus B.M., Ahmadiyeh N. , Baum A.E., Woods L.C.S., Redei E.E. Context and strain-dependent behavioral response to stress. Behav. Brain Funct. 2008;4(1):1-8. DOI 10.1186/1744-9081-4-23.
, Baum A.E., Woods L.C.S., Redei E.E. Context and strain-dependent behavioral response to stress. Behav. Brain Funct. 2008;4(1):1-8. DOI 10.1186/1744-9081-4-23.
34. O’Tuathaigh C.M.P., Babovic D., O’Sullivan G.J., Clifford J.J., Tighe O., Croke D.T., Waddington J.L. Phenotypic characterization of spatial cognition and social behavior in mice with ‘knockout’of the schizophrenia risk gene neuregulin 1. Neuroscience. 2007;147(1): 18-27. DOI 10.1016/j.neuroscience.2007.03.051.
35. Petrova E.V. Features of changes in congenital and acquired forms of behavior in rats with genetic catalepsy. Zhurnal Vysshey Nervnoy Deyatel’nosti im. I.P. Pavlova = I.P. Pavlov Journal of Higher Nervous Activity. 1990;40(3):475-480. (in Russian)
36. Plekanchuk V.S., Ryazanova M.A. Expression of glutamate receptor genes in the hippocampus and frontal cortex in GC rat strain with genetic catatonia. J. Evol. Biochem. Physiol. 2021;57(1):156-163. DOI 10.1134/s0022093021010154.
37. Poletaeva I. I., Zorina Z.A. A genetic approach to the study of simple cognitive abilities in animals. Rossiyskiy Zhurnal Kognitivnoy Nauki = Russian Journal of Cognitive Science. 2014;1(3):31-55.
I., Zorina Z.A. A genetic approach to the study of simple cognitive abilities in animals. Rossiyskiy Zhurnal Kognitivnoy Nauki = Russian Journal of Cognitive Science. 2014;1(3):31-55.
38. Powell C.M., Miyakawa T. Schizophrenia-relevant behavioral testing in rodent models: a uniquely human disorder? Biol. Psychiatry. 2006;59(12):1198-1207. DOI 10.1016/j.biopsych.2006.05.008.
39. Ryazanova M.A., Igonina T.N., Alekhina T.A., Prokudina O.I. The increase in the proportion of nervous animals bred for catatonia: the participation of central adrenoreceptors in catatonic reactions. Russ. J. Genet. 2012;48:1141-1147. DOI 10.1134/S1022795412100092.
40. Ryazanova M.A., Prokudina O.I., Plekanchuk V.S., Alekhina T.A. Expression of catecholaminergic genes in the midbrain and prepulse inhibition in rats with a genetic catatonia. Vavilovskii Zhurnal Genetiki i Selektsii = Vavilov Journal of Genetics and Breeding. 2017;21(7):798-803. DOI 10.18699/VJ17.296. (in Russian)
41. Sams-Dodd F. , Lipska B.K., Weinberger D.R. Neonatal lesions of the rat ventral hippocampus result in hyperlocomotion and deficits in social behaviour in adulthood. Psychopharmacology. 1997;132(3): 303-310. DOI 10.1007/s002130050349.
, Lipska B.K., Weinberger D.R. Neonatal lesions of the rat ventral hippocampus result in hyperlocomotion and deficits in social behaviour in adulthood. Psychopharmacology. 1997;132(3): 303-310. DOI 10.1007/s002130050349.
42. Samsom J.N., Wong A.H.C. Schizophrenia and depression co-morbidity: what we have learned from animal models. Front. Psychiatry. 2015;6:13. DOI 10.3389/fpsyt.2015.00013.
43. Shevelkin A.V., Terrillion C.E., Abazyan B.N., Kajstura T.J., Jouroukhin Y.A., Rudow G.L., Pletnikov M.V. Expression of mutant DISC1 in Purkinje cells increases their spontaneous activity and impairs cognitive and social behaviors in mice. Neurobiol. Dis. 2017;103:144-153. DOI 10.1016/j.nbd.2017.04.008.
44. Smolensky I.V., Zubareva O.E., Kalemenev S.V., Lavrentyeva V.V., Dyomina A.V., Karepanov A.A., Zaitsev A.V. Impairments in cognitive functions and emotional and social behaviors in a rat lithiumpilocarpine model of temporal lobe epilepsy. Behav. Brain Res. 2019;372:112044. DOI 10. 1016/j.bbr.2019.112044.
1016/j.bbr.2019.112044.
45. Stansley B.J., Yamamoto B.K. Behavioral impairments and serotonin reductions in rats after chronic L-dopa. Psychopharmacology. 2015;232(17):3203-3213. DOI 10.1007/s00213-015-3980-4.
46. Sultana R., Lee C.C. Expression of behavioral phenotypes in genetic and environmental mouse models of schizophrenia. Front. Behav. Neurosci. 2020;14:29. DOI 10.3389/fnbeh.2020.00029.
47. Timofeeva A.S. (Ed.) Genetic and Evolutionary Problems in Psychiatry. Novosibirsk: Nauka Publ., 1985. (in Russian)
48. Varlinskaya E.I., Spear L.P., Spear N.E. Acute effects of ethanol on behavior of adolescent rats: role of social context. Alcohol. Clin. Exp. Res. 2001;25(3):377-385. DOI 10.1111/j.1530-0277.2001.tb02224.x.
49. Vekovischeva O.Y., Aitta‐aho T., Echenko O., Kankaanpää A., Seppälä T., Honkanen A., Korpi E.R. Reduced aggression in AMPA-type glutamate receptor GluR-A subunit-deficient mice. Genes Brain Behav. 2004;3(5):253-265. DOI 10.1111/j.1601-1848. 2004.00075.x.
2004.00075.x.
50. Volavka J., Citrome L. Heterogeneity of violence in schizophrenia and implications for long‐term treatment. Int. J. Clin. Pract. 2008;62(8):1237-1245. DOI 10.1111/j.1742-1241.2008.01797.x.
51. Wilson J.E., Niu K., Nicolson S.E., Levine S.Z., Heckers S. The diagnostic criteria and structure of catatonia. Schizophr. Res. 2015;164(1-3): 256-262. DOI 10.1016/j.schres.2014.12.036.
52. Winship I.R., Dursun S.M., Baker G.B., Balista P.A., Kandratavicius L., Maia-de-Oliveira J.P., Howland J.G. An overview of animal models related to schizophrenia. Can. J. Psychiatry. 2019;64(1): 5-17. DOI 10.1177/0706743718773728.
53. Yassine N., Lazaris A., Dorner-Ciossek C., Després O., Meyer L., Maitre M., Mathis C. Detecting spatial memory deficits beyond blindness in tg2576 Alzheimer mice. Neurobiol. Aging. 2013;34(3):716730. DOI 10.1016/j.neurobiolaging.2012.06.016.
ПОВЕДЕНИЕ КРЫС С ВЫСОКИМ И НИЗКИМ УРОВНЯМИ ЗАМИРАНИЯ В ОБОРОНИТЕЛЬНЫХ СИТУАЦИЯХ И ПРИ ВЫБОРЕ ПИЩЕВОГО ПОДКРЕПЛЕНИЯ
Вайдо А. И., Жданова И. В., Ширяева Н. В. Реакция эмоционального резонанса у крыс с различным уровнем возбудимости нервной системы. Журн. высш. нерв. деятельности. 37(3): 575—577. 1987.
И., Жданова И. В., Ширяева Н. В. Реакция эмоционального резонанса у крыс с различным уровнем возбудимости нервной системы. Журн. высш. нерв. деятельности. 37(3): 575—577. 1987.
Жуков Д. А. Психогенетика стресса. Поведенческие и эндокринные корреляты генетических детерминант стресс-реактивности при неконтролируемой ситуации. СПб. СПбЦНТИ. 1997.
Жуков Д. А., Виноградова Е. П. Пороги болевой чувствительности у крыс, генетически селектированных по скорости выработки активного избегания. Журн. высш. нерв. деятельности. 47(1): 167—169. 1997.
Зайченко М. И., Мержанова Г. Х., Демина А. В. Исследование поведения «импульсивных» и «самоконтролирующих» животных методом «эмоционального резонанса». Журн. высш. нерв. деятельности. 60(2):192—200. 2010.
Зайченко М. И., Ванециан Г. Л., Мержанова Г. Х. Различия в поведении импульсивных и самоконтролирующих крыс при исследовании их в тестах открытого поля и светло-темной камеры. Журн. высш. нерв. деятельности. 61(3): 340—350. 2011.
Зайченко М. И., Шаркова А. В., Григорьян Г. А., Мержанова Г. Х. У высоко импульсивных крыс сигнальная память в 8-канальном радиальном лабиринте проявляется лучше, чем у низко импульсивных животных. Журн. высш. нерв. деятельности. 66(5): 600—610. 2016.
Левандовская А. А., Зайченко М. И., Мержанова Г. Х., Саложин С. В. Оценка исследовательской активности и тревожности крыс, различающихся по выраженности импульсивного поведения. Журн. высш. нерв. деятельности. 63(6): 719—729. 2013.
Ливанова Л. М., Левшина И. П., Ноздрачева Л. В., Курочкина Е. В., Элбанидзе М. Г., Айрапетянц Н. Г. Профилактическое влияние отрицательно заряженных аэроионов при остром стрессе у крыс с разными типологическими особенностями поведения. Журн. высш. нерв. деятельности. 46(3): 564—570. 1996.
Павлова И. В., Рысакова М. П. Проявление тревожности крыс Вистар при выработке условнорефлекторного страха. Журн. высш. нерв. деятельности. 65(6): 719—735. 2015.
Павлова И. В., Рысакова М. П. Влияние введения лигандов рецепторов серотонина 5-НТ1А в миндалину на поведение крыс с разным проявлением условнорефлекторного страха. Журн. высш. нерв. деятельности. 66(6): 710—724. 2016.
Журн. высш. нерв. деятельности. 66(6): 710—724. 2016.
Павлова И. В., Рысакова М. П., Сергеева М. И. Влияние блокады D1 и D2 рецепторов в базолатеральной миндалине на поведение крыс с высоким и низким уровнем тревожности и страха. Журн. высш. нерв. деятельности. 65(4): 471—485. 2015.
Степаничев М. Ю., Тишкина А. О., Новикова М. Р., Левшина И. П., Пискунов А. К., Лазарева Н. А., Гуляева Н. В. Эффекты хронического комбинированного стресса: изменения поведения крыс с разной реакцией на новизну. Журн. высш. нерв. деятельности. 66(5): 611—625. 2016.
Ширяева Н. В., Вайдо А. И., Петров Е. С., Хофман Г. Н., Забродин И. Ю., Макарова Т. М. Поведение в открытом поле крыс с различным уровнем возбудимости нервной системы. Журн. высш. нерв. деятельности. 37(6): 1064—1069. 1987.
An X. L., Zheng X. G., Liang J., Bai Y. J. Corticosterone combined with intramedial prefrontal cortex infusion of SCH 23390 impairs the strong fear response in high-fear-reactivity rats. Psychol. J. 2(1): 1—10. 2013.
2013.
Blanchard D. C., Blanchard R. J. Ethoexperimental approaches to the biology of emotion. Annu. Rev. Psychol. 39: 43—68. 1988.
Borta A., Schwarting R. K. Inhibitory avoidance, pain reactivity, and plus-maze behavior in Wistar rats with high versus low rearing activity. Physiol. Behav. 84(3): 387—396. 2005.
Bush D. E., Sotres-Bayon F., LeDoux J. E. Individual differences in fear: isolating fear reactivity and fear recovery phenotypes. J. Trauma Stress. 20(4): 413—422. 2007.
Coyner J., McGuire J. L., Parker C. C., Ursano R. J., Palmer A. A., Johnson L. R. Mice selectively bred for High and Low fear behavior show differences in the number of pMAPK (p44/42 ERK) expressing neurons in lateral amygdale following Pavlovian fear conditioning. Neurobiol. Learn. Mem. 112: 195—203. 2014.
Deroche V., Piazza P. V., Le Moal M., Simon H. Individual differences in the psychomotor effects of morphine are predicted by reactivity to novelty and influenced by corticosterone secretion. Brain Res. 623(2): 341—344. 1993.
Brain Res. 623(2): 341—344. 1993.
Diaz-Moran S., Palencia M., Mont-Cardona C., Canete T., Blazquez G., Martinez-Membrives E., Lopez-Aumatell R., Tobena A., Fernandez-Teruel A. Coping style and stress hormone responses in genetically heterogeneous rats: comparison with the Roman rat strains. Behav. Brain Res. 228(1): 203—210. 2012.
Gozzi A., Jain A., Giovannelli A., Bertollini C., Crestan V., Schwarz A. J., Tsetsenis T., Ragozzino D., Gross C. T., Bifone A. A neural switch for active and passive fear. Neuron. 67(4): 656—666. 2010.
Gray J. A. The psychology of fear and stress. Cambridge. Cambridge Univ. Press. 1987.
Koolhaas J. M. Coping style and immunity in animals: making sense of individual variation. Brain Behav. Immun. 22(5): 662—667. 2008.
Koolhaas J. M., de Boer S. F., Buwalda B., van Reenen K. Individual variation in coping with stress: a multidimensional approach of ultimate and proximate mechanisms. Brain Behav. Evol. 70(4): 218—226. 2007.
Ledoux J. E., Sakaguchi A., Reis D. J. Strain differences in fear between spontaneouslu hypertensive and normotensive rats. Brain Res. 277(1): 137—143. 1983.
E., Sakaguchi A., Reis D. J. Strain differences in fear between spontaneouslu hypertensive and normotensive rats. Brain Res. 277(1): 137—143. 1983.
Lehner M., Taracha E., Skorzewska A., Maciejak P., Wislowska-Stanek A., Zienowicz M., Szyndler J., Bidzinski A., Plaznik A. Behavioral, immunocytochemical and biochemical studies in rats differing in their sensitivity to pain. Behav. Brain Res. 171(2): 189—198. 2006.
Lehner M., Wislowska-Stanek A., Maciejak P., Szyndler J., Sobolewska A., Krzascik P., Plaznik A. The relationship between pain sensitivity and conditioned fear response in rats. Acta Neurobiol. Exp. 70(1): 56—66. 2010.
Rorick L. M., Finn P. R., Steinmetz J. E. Heart rate reactivity an HAD and LAD rats during Pavlovian fear conditioning. Integr. Physiol. Behav. Sci. 39(1): 24—41. 2004.
Satinder K. P., Hill K. D. Effects of genotype and postnatal experience on activity, avoidanceshock threshold, and open-field behavior of rats. J. Сomp. Physiol. Psychol. 86: 363— 374. 1974.
1974.
Shuhama R., Del-Ben C. V., Loureiro S. R., Graeff F. G. Animal defense strategies and anxiety disorders. An. Acad. Bras. Cienc. 79(1): 97—109. 2007.
Skorzewska A., Lehner M., Wislowska-Stanek A., Turzynska D., Sobolewska A., Krzascik P., Plaznik A. Midazolam treatment before re-exposure to contextual fear reduces freezing behavior and amygdale activity differentially in high- and low-anxiety rats. Pharmacol. Biochem. Behav. 129: 34—44. 2015.
Stiedl O., Radulovic J., Lohmann R., Birkenfeld K., Palve M., Kammermeier J., Sananbenesi F., Spiess J. Strain and substrain differences in context- and tone-dependent fear conditioning of inbred mice. Behav. Brain Res. 104(1—2): 1—12. 1999.
Szklarczyk K., Korostynski M., Golda S., Piechota M., Ficek J., Przewlocki R. Endogenous opioids regulate glucocorticoid-dependent stress-coping strategies in mice. Neuroscience. 330: 121—137. 2016.
Zozulya A. A., Gabaeva M. V., Sokolov O. Y., Surkina I. D., Kost N. V. Personality, coping style, and constitutional neuroimmunology. J. Immunotoxicol. 5(2): 221—225. 2008.
J. Immunotoxicol. 5(2): 221—225. 2008.
Поведение крыс и биология
Поведение крыс и биология| Дом | |
(крыса Энн стр.)
Добро пожаловать на мой сайт о крысах. Я написал ряд
статьи о поведении крыс и
биология. Эти статьи основаны на моем исследовании научных
литературы, доступной по крысам, и по моим собственным наблюдениям за крысами.
поведение.
Поведение крыс
| Сенсорный мир Крысы
| Крысиная биология
|
Систематика крыс
| Дикие крысы
| Заметки о здоровье крыс
|
Я также написал кое-что забавное о крысах —
иллюстрированные рассказы, розыгрыши, рисунки крыс и интерактивная викторина.
Наслаждаться!
Крысиный юмор
- Крыса арт
- Лапа Картина
Крысы: Widget, Cricket и Snip отображают свои
художественные навыки с росписью лап.
Посетите за Сцены и роспись хвоста и крысы на холсте, чтобы увидеть великих мастеров за работой.
- Лапа Картина
Крысы: Widget, Cricket и Snip отображают свои
художественные навыки с росписью лап.
- Интерактивный
- Викторина: крыса или мышь?
- Викторина: Норвежская крыса или крыса на крыше?
- Симулятор крысиного лабиринта
- Подделки
- ПЭТ-кирпич Часто задаваемые вопросы
- Прачечная для крыс
- Крысино-английский Словарь
- Курсы от Крысы Университет
- Продукты для крыс
- Крысиная недвижимость
- 88 Строки около 44 Крысы
- Мышиная сказка
- Истории
- Крысы и яичная скорлупа
- Горох, горох горох
- Щелкунчик
- Время свободного диапазона с Виджет, крикет и снип
- Приключение с лапшой
- Этим зимним утром
- Крысиный фотоальбом
Обновления: Последнее обновление: 29 ноября 2012 г.
Части этого сайта были переведены
на другие языки:
- Русский
Дом • Крыса Поведение • Крыса Сенсорный мир • Крысиная биология • Систематика крыс • Дикие крысы • Крыса Заметки о здоровье • Крысиный юмор • Ссылки • Обновления • О
Пожалуйста, запросите разрешение, если вы хотите использовать какие-либо изображения или контент на этот сайт
Контактное лицо: [email protected] (где x = веб-мастер, y = крысиное поведение)
http://www.ratbehavior.org
10 распространенных моделей поведения крыс | BeChewy
Те, кто живет вместе с домашними крысами, могут подтвердить, что эти маленькие динамо-машины умны, активны и любопытны. Если вы плохо знакомы с крысами или озадачены поведением вашей домашней крысы, вот краткое изложение распространенного поведения крыс и их значения.
1. Писк, писк и визг!
Если ваша крыса громко шумит, скорее всего, она недовольна. Он может протестовать против того, что вы обращаетесь с ним, или показывать свое недовольство тем, что его вытащили из клетки. Если вы слышите продолжительный сильный писк, возможно, ваша крыса испытала некоторую боль, например, ущипнула ее за хвост. Если вы слышите крик, исходящий из места обитания вашей крысы, проверьте, все ли с вашим маленьким зверьком в порядке.
2. Урчание в ночи
Не ждите, что крыса будет спать по тому же графику, что и вы. Крысы ведут ночной образ жизни, а это означает, что их нормальный цикл сна – это бодрствование ночью и сон днем. Так что с того момента, как вы закончите ужин, и до того, как вы отправитесь спать, самое время поиграть со своей крысой, и снова утром. Вы не будете возражать против того, чтобы ваша крыса спала весь день после того, как взглянете на нее во сне — крысы спят в нескольких забавных позах, в том числе свернувшись в клубок, частично свисая из трубы или гамака, на спине или в кресле. формация «собачья куча», если у вас их больше одной.
формация «собачья куча», если у вас их больше одной.
3. Охота на мусорщиков
Крысы — маленькие падальщики природы: они берут все, что могут, а затем возвращаются в свое логово. В домашней обстановке эти маленькие оппортунисты могут улизнуть с чем-то, что достаточно легко для них, чтобы нести. Они особенно склонны воровать предметы, которые они могут жевать, например, сделанные из дерева, пластика или резины, или сделанные из удобного материала, такого как бумага, ткань и ткань, чтобы обшить их дом. Крысы также копят пищу; так что не удивляйтесь, обнаружив небольшой съедобный тайник, спрятанный в клетке вашей крысы.
4. Бокс
Коробка кенгуру и крысы тоже! Крысы в разгар боксерского поединка встают на задние лапы и стоят лицом к лицу и лапают друг друга. Крысы не боксируют для развлечения или игры. Они боксируют, чтобы показать, кто альфа-крыса. Крысы имеют естественную социальную иерархию, в которой доминирующая крыса выходит из стаи. Крысы иногда сталкиваются лицом к лицу, боксируя или «отрывая нос», когда две крысы стоят лицом к лицу, но вместо того, чтобы лапать друг друга, они стоят, как будто застывшие. Есть варианты с закрытым носом — крысы могут стоять всеми лапами к земле, одной лапой вниз или обеими лапами вверх. Крыса, пытающаяся укрепить свое господство, может также прислоняться к другим крысам, что, можно сказать, является ее способом перебрасывать свой вес.
Есть варианты с закрытым носом — крысы могут стоять всеми лапами к земле, одной лапой вниз или обеими лапами вверх. Крыса, пытающаяся укрепить свое господство, может также прислоняться к другим крысам, что, можно сказать, является ее способом перебрасывать свой вес.
5. Покусывание вас
Если ваша крыса кусает или лижет вас, возможно, она проявляет к вам привязанность, ухаживая за вами. Крысы также обладают отличным обонянием, поэтому они могут кусать или лизать вашу руку или чувствовать ваш запах после того, как вы едите или готовите еду. Ваша крыса может вас укусить, если найдет остатки еды на ваших руках, например, крошки или соус, поэтому вы можете мыть руки после еды или приготовления пищи!
6. Копание и копание
Крысы в дикой природе живут в подземных норах, в которые они прячутся после поиска пищи. Домашние крысы также роют норы, особенно если им предлагают постельные принадлежности или стопку измельченной бумаги, чтобы создать безопасное и удобное место для сна.
7. Покачивающиеся усы
У нас есть GPS, чтобы добраться из пункта А в пункт Б; у крыс есть усы, которые они используют для навигации по объектам, а также для поддержания равновесия. Крыса шевелит усами, чтобы буквально лучше чувствовать свое окружение, например, чтобы увидеть, является ли объект подвижным или статичным, и собрать другую пространственную информацию.
8. Движения хвоста
Если вы вдруг подхватите свою крысу, она может махнуть хвостом, пытаясь почувствовать, что происходит. Крыса также использует свой хвост для равновесия, который она держит прямо во время бега или близко к поверхности того, на что она может карабкаться. Крысы даже используют свой хвост, чтобы поддерживать себя в положении стоя.
9. Выпученные глаза
Да, вы только что видели, как глаза вашей крысы вылезли из орбит! Выпячивание глаз, также называемое ошеломлением, происходит, когда глаза крысы двигаются в глазницах и выходят из них. Не волнуйся; ваша крыса еще не совсем сошла с ума. На самом деле он может быть вполне расслабленным и счастливым.
На самом деле он может быть вполне расслабленным и счастливым.
10. Скрежетание зубами
Выпячивание глаз обычно происходит вместе со скрежетанием зубами, также называемое бруксизмом. Зубы крыс постоянно растут, поэтому скрежетание зубами помогает держать их под контролем. Крыса более склонна скрипеть зубами, когда она расслаблена и довольна, подобно тому, как кошка мурлычет. Вибрации от движения его челюсти вперед и назад, когда он скрипит зубами, создают вибрации, которые перемещают глазное яблоко в глазницу и из нее, что вызывает выпячивание глаз. Крыса также может бруксировать, чтобы успокоить себя, когда она боится или испытывает боль, поэтому обратите внимание на язык ее тела и обстоятельства, чтобы определить, довольна ли она (например, сидит на вас, пока вы ее гладите) или боится (например, если пылесосить рядом с его клеткой).
Автор: Лаура Деринг
Поделиться:
The Rat Report
Эта статья взята из журнала Rat
Буклет Здравоохранение . Закажите один сегодня! Ознакомьтесь с информацией в Rat Books
Закажите один сегодня! Ознакомьтесь с информацией в Rat Books
Rat Behavior in Relation to Health
Дебби «The Rat Lady» Ducommun
Вот краткий список моделей поведения крыс, которые имеют отношение к проблемам со здоровьем. Немного нормальное поведение может быть ошибочно принято за проблемы со здоровьем.
Домашние крысы действительно одомашнены животных и рождаются ручными, но их все равно нужно социализировать, чтобы привязаться к люди. С детенышем крысы нужно как можно больше обращаться, начиная с рождения и особенно в возрасте от 2 до 4 недель, чтобы убедиться, что они будут дружелюбными и спокойствие. Это миф, что обращение с младенцами заставит мать убить их.
Крысы, которые не были должным образом социализированы, как
младенцы часто проявляют страх по отношению к людям. Но даже эти крысы могут быть
быстро реабилитируется с помощью метода под названием Trust Training. Эта техника использует
мягкая еда на ложке и как приманка, и как награда за желаемое поведение. Для большего
информация см. в статье на www.ratfanclub.org/trust.html .
Эта техника использует
мягкая еда на ложке и как приманка, и как награда за желаемое поведение. Для большего
информация см. в статье на www.ratfanclub.org/trust.html .
Крысы чрезвычайно общительны и общительны. больные крысы от их владельца и/или соседей по клетке могут вызывать сильный стресс и могут сделать их хуже. Крысы должны быть изолироваться от соседей по клетке только в случае крайней необходимости, например, если соседи по клетке придираются к пациенту. Пациента, которому трудно есть, возможно, придется изолировать. во время кормления. Есть обычно нет необходимости отделять крыс с симптомами респираторного или другого заболевания от своих соседей по клетке, потому что:
1. Если это заразное заболевание, их соседи по клетке уже подверглись воздействию
2. У них все равно есть микоплазма, и
3. Многие вторичные инфекции условно-патогенный, не заразный.
Хирургические пациенты могут быть заменены
соседей по комнате, как только они оправятся от анестезии, если только один из их соседей по комнате
является навязчивым грумером, так как эти крысы будут беспокоить разрез. Большинство крыс будут
однако нет.
Большинство крыс будут
однако нет.
Крысы, инфицированные микоплазмой часто проявлять поведение, похожее на икоту. Это «чихающая зазубрина», хотя обычно он не издает никаких звуков и является симптомом микоплазма (лабораторные крысы, свободные от микоплазмы, не проявляют ее). Если это поведение усиливается, антибиотики специфические для микоплазмы будут постепенно снижать заболеваемость.
Струпья на плечах, шее или лица часто считаются признаками драки, но обычно самопричинение и вызвано зудом, чаще всего от меховых клещей.
Небольшой процент самцов крыс (2-5%)
разовьет избыточный тестостерон в полной зрелости (средний возраст 8 месяцев)
и становятся агрессивными к другим крысам, а иногда и к людям. Решение состоит в том, чтобы стерилизовать крысу, которая
уменьшит или устранит агрессию, хотя это может занять до 8 недель для
их поведение измениться. Стерилизация
также уменьшит маркировку мочи.
Симптомы неврологических нарушений, таких как как плохая координация, падение, неправильное использование рук и рук, ненормальная гиперактивность, натыкание на предметы, кружение, стояние в углу, и странное поведение при еде или жевании, скорее всего, вызвано гипофизом. опухоли, особенно у старых самок крыс. (Наклон головы обычно вызван инфекцией внутреннего уха.) Подробнее смотри статью на www.ratfanclub.org/tumors.html .
Обычный Поведение
Некоторые крысы качают головой вперед-назад когда они пытаются что-то разглядеть. Такое поведение наиболее характерно для красноглазые крысы и является признаком того, что у крыс плохое зрение. Покачивание помогает им сосредоточиться на объектах. лучше через параллакс.
Самка крысы в период течки может стать нервной,
особенно при прикосновении к спине. При прикосновении она также может выгнуть спину.
и вибрировать ее ушами! Самки крыс
в течке может быть весьма решительным и изобретательным в достижении самца крысы, для
например, прыгать на большие расстояния или продираться сквозь прутья клетки, и должно быть надежно
заключенный .
Иногда крыса, обычно самка, начать брать ее хвост в рот и нести его, кружась. Это действие связано с материнским поведения и не является поводом для беспокойства. Крыса видит хвост, и это стимулирует поисковое поведение, как если бы хвост хвост — младенец. Это может быть связано к ложной беременности.
Некоторые крысы в ответ вибрируют хвостом к социальному стрессу или беспокойству, особенно если они видят что-то, что напоминает им змеи. Другие крысы могут вилять их хвосты, когда их гладят, чтобы показать удовольствие.
Большинство крыс молчаливы, но есть некоторые
крысы, которые используют вокализацию для выражения эмоций. Некоторые крысы пищат или хрюкают, чтобы поговорить.
своим людям. Ключ к различению
между вокализацией и хрипом — это когда возникают звуки. Свистящие звуки могут появляться и исчезать, но
они обычно довольно устойчивы, синхронны с дыханием и могут возникать, когда
крыса спит.

 также исследования
статья
также исследования
статья