Кальцивироз у кошек, лечение, симптомы, прогноз
Кальцивироз кошек — это опасный вирус, которому подвержены все кошки, не зависимо от породы и места проживания. Вирус коварный, агрессивный, имеет большое количество штаммов.
Заражение происходит через слюну, выделения из носа, глаз больного животного. Вирус довольно распространен.
Заболеванию подвержены и домашние животные, заражение которых может произойти через грязную обувь или одежду, даже руки человека, который контактировал с больной кошкой.
Для того чтобы обезопасить питомца необходима ежегодная вакцинация, однако заболеть может и привитый котик.
Для собак и человека вирус не опасен.
В данной статье я расскажу о симптомах кальцицвироза и распишу схему лечения кальцивироза в домашних условиях. Это схема прописана ветеринаром и проверена мной лично, если у вас есть вопросы, спрашивайте. Однако, данная статья не заменяет очного осмотра ветеринара. И помните, что положительный результат в лечении зависит от вас!
А может у кошки Панлейкопения?
Признаки кальцивироза
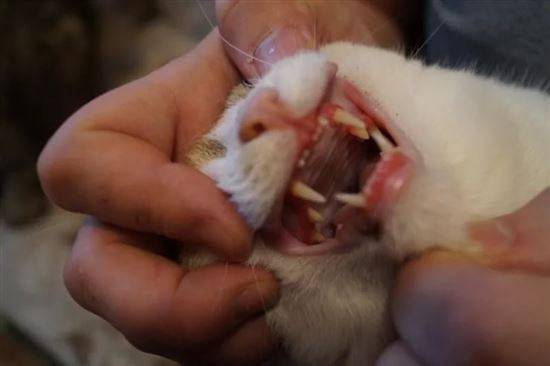
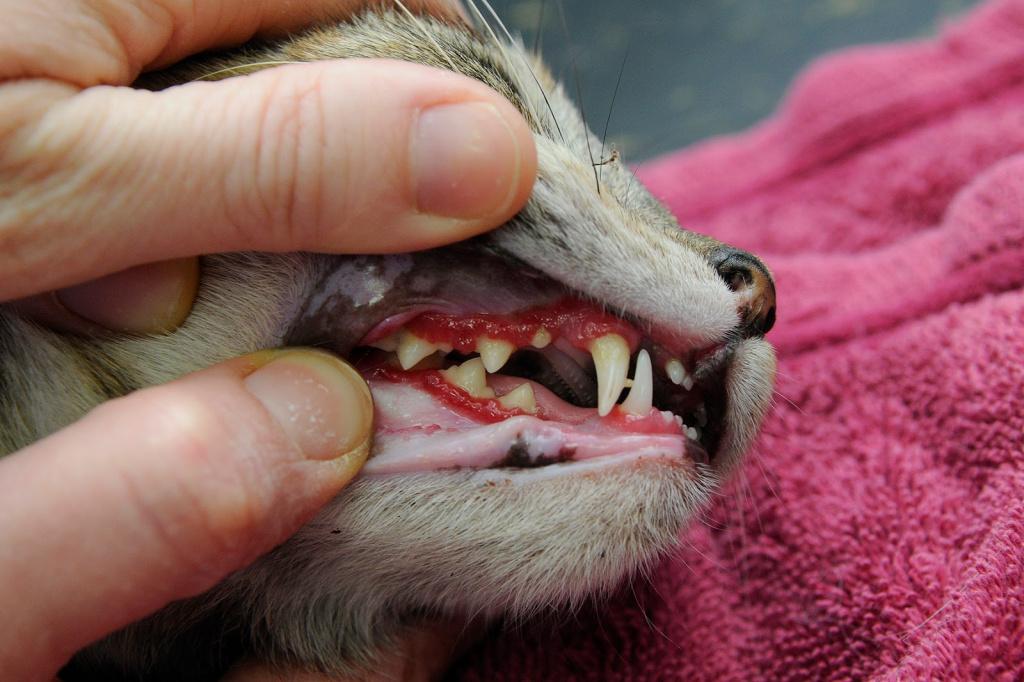
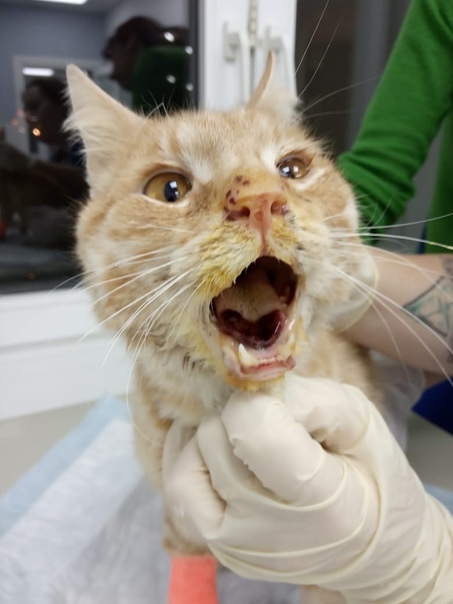
- ярким признаком кальцивироза является появление язвочек в ротовой полости, так же на губах, носу, чаще всего на средней щели носика.

- на первых стадиях заболевания питомец вялый, отказывается от еды
- кот много спит
- поднимается температура тела
- могут увеличиваться подчелюстные лимфоузлы
- отекает горло
- может присутствовать неприятный запах изо рта
- появляются выделения из носа и глаз, чихание
- коту становится трудно дышать
- кот может вести себя так, словно он подавился, кашлять, пытаться достать из рта невидимый предмет
- может появится рвота и диарея
- может пропасть голос
- при осложнениях появляется хромота и поражение легких
Симптомы могут появиться не сразу, развиваться постепенно, какие-то могут быть ярче, какие-то слабее. Поэтому важна правильная и ранняя диагностика. Если картина яркая, симптомы выражены приступаем к лечению. Лечение составит из антибактериальной терапии, повышения иммунитета и смягчения симптомов. При правильном лечении тяжелое состояние снимается примерно за 5 дней, общий курс лечения и восстановления составляет две-три недели.
- Антибиотик, например, цефтриаксон 1,0 г. Антибиотик разводим 5 мл новокаина 0,5%, делаем раз в сутки, в заднюю лапу. На кота 4,5 кг нам понадобится 1,3 мл готового препарата. Подробно о тонкостях разведения препарата и дозировках можно прочитать в этой статьей: Цефтриаксон для кошек и собак
- Фелиферон Первые три дня делаем по 1 мл в заднюю лапу, 1 раз в день. Затем по 0,5 мл, в заднюю лапу, так же 1 раз в день — длительность 4 дня.
- Витамин С дозировка 0,5 мл, в этот же шприц 5% глюкоза 10 мл. Делаем в холку 5 дней
- При сильном обезвоживании, если животное слабое, не пьет и не ест делаем раствор Рингера Локка. По 20 мл два раза в день. Возможно больше, до 100 мл в день, перерывами, возможно введение за один раз. Делаем в холку.
- Болтушка для рта, та самая болтушка, из аптеки. Её используем для заживления язвочек, минимум 4-5 раз в день по 1 мл вводит шприцем без иголки в рот. Так же наносим на язвочки, если они есть на носу, губах и других местах.
 Нанесение данного лекарства возможно и чаще, каждый час-два. Примерно 5 дней, к этому моменту все язвочки должны пройти. Возможно кот будет сопротивляться, будет пена, чихание, это нормальная реакция. Если животное в плохом состоянии, то сопротивляться не будет, однако, по мере выздоровления сопротивления будет всё больше. Важно не бросать и доводить всё до конца, иначе болезнь может вернуться.
Нанесение данного лекарства возможно и чаще, каждый час-два. Примерно 5 дней, к этому моменту все язвочки должны пройти. Возможно кот будет сопротивляться, будет пена, чихание, это нормальная реакция. Если животное в плохом состоянии, то сопротивляться не будет, однако, по мере выздоровления сопротивления будет всё больше. Важно не бросать и доводить всё до конца, иначе болезнь может вернуться. - Постоянная обработка мирамистином или хлоргексидином. После каждый еды обязательно обеззараживаем. И наносим болтушку.
- Локсиком — на корень языка по 0,2 мл — 1 раз в день, на 3 дня.
Кошка ослаблена, сейчас для выздоровления важно хорошее, легкоусвояемое питание, например, куриный бульон или детское питание (индейка, курица, говядина), возможны специализированные корма, для больных, ослабленных животных, обязательно в форме паштета. Пища должна быть мягкой, теплой. Если кот не ест сам, кормить необходимо насильно. Вводим питание через шприц без иглы. Обязательно поить животное.
Кошке необходимо обеспечить тихое, спокойное место для сна, хорошее питание, полное, своевременное, правильное лечение и конечно же окружить питомца любовью и заботой.
Кошка должна находится в чистом помещении, где нет пыли.
Миски моем с хлоргексидином после каждого приёма пищи
Если в семье есть другие кошки, то необходим карантин, нельзя допускать общение, у заболевшей кошки должны быть отдельные миски, отдельное место для сна. Исключаем все контакты со здоровыми котами.
Выздоровление зависит от нескольких факторов:
- состояние иммунитета
- наличие прививок
- постановка правильного диагноза и назначение адекватного лечения
- общее состояние животного
И самое главное:
- действия хозяина, выздоровление будет зависеть от того, насколько точно, усердно и полно хозяин будет лечить своего питомца. Важно не пропускать прием лекарств, не давать животному голодать. При тяжелом течении кальцивироза будьте готовы к тому, что 3-4 дня кота буквально необходимо держать на руках, постоянная санация полости рта, прием лекарств, уколы, кормления.
 Если всё будет сделано правильно, то прогноз положительный. И вероятность, что животное выживет очень высока. Всё зависит от вас!
Если всё будет сделано правильно, то прогноз положительный. И вероятность, что животное выживет очень высока. Всё зависит от вас!
Да, привитые животные могут заболеть кальцивирозом. И не всегда заболевание проходит в скрытой или легкой форме. В таких случаях у хозяев возникает вопрос — а стоит ли делать прививку от кальцивироза. Однозначно да! В большинстве случаев прививка защитит питомца от болезни. Часто при заражении болезнь пройдет спокойно, без каких-либо последствий. Симптоматика может быть более выражена, что поможет поставить диагноз и начать лечение.
Кальцивироз фото
Это интересно:
симптомы и лечение, профилактика, прогноз
Вирусный кальцивироз у кошек — распространенное заболевание, при котором поражаются органы дыхания. Заболевание характеризуется остро протекающей, ярко выраженной симптоматикой. Необходимо как можно скорее начать лечить патологию, так как кальцевирус быстро распространяется по всему организму, вызывая тяжелые осложнения, вплоть до гибели домашнего питомца.
Заболевание характеризуется остро протекающей, ярко выраженной симптоматикой. Необходимо как можно скорее начать лечить патологию, так как кальцевирус быстро распространяется по всему организму, вызывая тяжелые осложнения, вплоть до гибели домашнего питомца.
Причины и механизм развития
Калицивирусная инфекция распространяется такими путями:
- воздушно-капельный;
- контактный;
- от зараженной матери к котятам;
- через контакт с человеком.
Болезнь вызывает вирус Feline calicivirus, зачастую он поражает молодых животных с ослабленным иммунитетом. Пик заболеваемости приходится на холодное время года.
После проникновения кальцевируса в организм, начинается его активное размножение и жизнедеятельность. Инкубационный период длится 5—7 дней, именно в этот период больное животное распространяет инфекцию в окружающую среду, заражая других кошек и котов. Сам по себе кошачий кальцивиоз не является опасным, если лечить его своевременно. Проблемы со здоровьем вызывают осложнения, которые нередко возникают у животных.
Проблемы со здоровьем вызывают осложнения, которые нередко возникают у животных.
Какие симптомы беспокоят?
Одним из первых симптомов болезни у животного ялвяется чихание.У взрослого кота с хорошим иммунитетом развитие болезни можно не заметить, наблюдается слабая симптоматика — слизистые выделения из носа, кашель, чихание. Намного острее проявляется кальцивироз у котят и у беременных кошек. Первые характерные симптомы патологии — повышение температуры тела. Однако, вскоре жар проходит и животное начинают беспокоить следующие признаки:
- насморк, проблемы с дыханием;
- повышенное слюноотделение;
- гнойное выделение в глазах;
- кашель, чихание;
- нарушение общего самочувствия;
- проблемы с пищеварением;
- ухудшение аппетита, на фоне которого наблюдается потеря веса.
При прогрессировании болезни на слизистой рта и носа образуются незаживающие язвочки, которые болят. На запущенной стадии вирус поражает крупные суставы животного и развивается артрит. Появляется хромота, температура тела становится выше нормы. Нередко в качестве осложнения развивается пневмония, от которого кошка может умереть.
Появляется хромота, температура тела становится выше нормы. Нередко в качестве осложнения развивается пневмония, от которого кошка может умереть.
Как проводится диагностика?
Для обнаружения возбудителя болезни у животного берется кровь на анализ.Прежде чем начать лечение кальцивироза у кошек, необходимо определить точный диагноз, поэтому без визита к врачу не обойтись. Доктор проведет первичный осмотр у котенка или взрослого животного, расспросит какие признаки кальцивироза беспокоят. Затем берется анализ крови на антитела кальцевируса. Если инфекция у кошек обнаружена в организме, значит, диагноз подтверждается. Обязательно проводится дифференциальная диагностика. Которая помогает исключить такие патологи с похожими симптомами:
- панлейкопения;
- герпесная инфекция;
- бешенство.
У кошек, которые болеют вирусной патологией, клинический анализ крови покажет стойкое снижение уровня гемоглобина. Если на слизистой глаза и носоглотки образовались обширные болячки, следует провести рентгенологическое обследование, с помощью которого удастся определить состояние легких.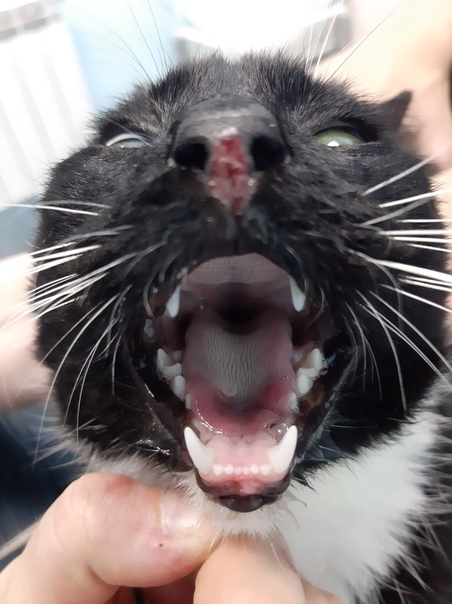
Какое лечение назначается?
Эффективные препараты
Кальцивироз у кошек лечится комплексно, в противном случае прогнозы на успешное восстановление ухудшаются. Схема терапии включает препараты таких групп:
Лечение болезни у питомца может проходить с использованием препарата Максидин.- Противовирусные. Лекарство помогает иммунной системе бороться с вирусом — основной причиной возникновения патологии. Назначаются средства системного и местного воздействия, например, такие:
- «Максидин»;
- «Мастим»;
- «Гамавит».
- Антибиотики. Язва на языке у кошки и болячка в носу могут воспалиться, а бактериальная инфекция распространится на нижние дыхательные пути. Антибиотик поможет предупредить такие последствия. Врачи ветеринарного центра «Зоостатус» рекомендуют лечить патологию такими препаратами:
- «Ципровет»;
- «Ципрофлоксацин»;
- «Ципронат».
- Иммуностимулирующие. Кошачья вирусная инфекция будет уничтожена быстрее, если помочь организму активнее вырабатывать защитные антитела.
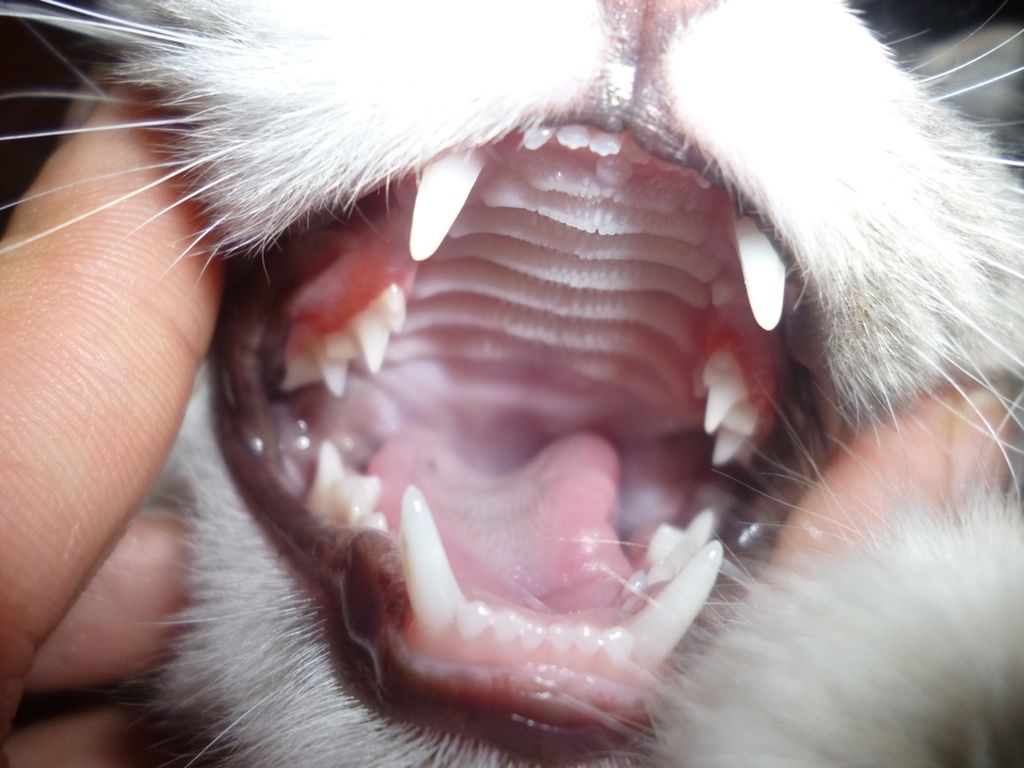 Для стимулирования иммунной системы назначаются:
Для стимулирования иммунной системы назначаются:- «Ронколейкин»;
- «Виферон»;
- «Альтевир».
- Вспомогательные средства. Обширные язвы во рту у кошки являются причиной отказа от еды, вследствие чего животное становится истощенным, обессиленным. В этой ситуации назначают внутривенные инфузии витаминов, глюкозы, кальция, раствора Рингера.
Народные средства
Настой ромашки поможет заживить ранки, образовавшиеся в пасти животного.Для ускорения выздоровления питомца в качестве вспомогательной терапии можно применять природные лекарства, приготовленные в домашних условиях. Язвочка во рту и гнойные болячки исчезнут быстрее, если давать кошке настой из ромашки, который готовится так:
- Залить 250 мл кипятка 1 ст. л. цветков растения.
- Накрыть емкость крышкой и настоять 20 мин.
- Готовое средство процедить, остудить.
Вернуться к оглавлениюЕсли кошка отказывается пить, ветеринары рекомендуют попробовать закапывать раствор в рот с помощью шприца без иглы.
Лечебная диета
При кошачьем кальцивирозе особое внимание следует уделить питанию. Из-за язв и болячек в носоглотке животное может отказываться от пищи, так как она раздражает и ранит болезненные участки, провоцируя развития обостренной симптоматики. Чтобы питомец не истощал, следует давать ему мягкую, перетертую в блендере пищу, например, детское питание, куриный бульон, легкоусвояемые измельченные овощные блюда. Не стоит забывать о питье, воду нужно регулярно менять.
Вернуться к оглавлениюПоследствия
В случае развития пневмонии животное может умереть.Самым опасным осложнением вирусной патологии является воспаление легких, которое является основной причиной летального исхода. Если болезнь не долеченная или схема терапии некорректна, возрастает риск возникновения хронического кальцивироза, при котором случаются частые рецидивы, а иммунитет питомца постепенно ослабляется. Кроме этого, хронический недуг приводит к прогрессированию артрита, кошку мучают сильные боли в суставах и хромота. Постоянное воспаление ротовой полости становится основной причиной выпадения зубов, нередко беспокоит неизлечимый стоматит.
Постоянное воспаление ротовой полости становится основной причиной выпадения зубов, нередко беспокоит неизлечимый стоматит.
Профилактика и прогноз
Кальцивироз — тяжелое заболевание, которое долго лечится и может рецидивировать. Если своевременно диагностировать болезнь и начать лечение, кошка выздоравливает, риск развития осложнений сводится к минимуму. В противном случае животное погибает, так как инфекция быстро распространяется по организму, поражая внутренние органы, суставы. Основной профилактикой патологии является вакцинация домашнего любимца. Прививка поможет создать надежный иммунитет, который уничтожит инфекцию сразу после внедрения в организм.
Также в качестве профилактики важно следить за чистой и гигиеной кошки, предотвращать контакт с бездомными животными, правильно кормить и давать достаточно жидкости, при первых симптомах сразу ехать в больницу, а не заниматься самолечением. Борьба с вирусной инфекцией должна быть комплексной, в противном случае полностью уничтожить ее не удастся. Кальцивироз перейдет в хроническую форму, при которой осложнений не избежать.
Кальцивироз перейдет в хроническую форму, при которой осложнений не избежать.
Кальцивироз у котят — симптомы и лечение
Кальцивироз у котят считается распространенным вирусным заболеванием, которое поражает дыхательные пути. Во время данного недуга у котенка образуются кровоточащие ранки, язвенные образования, которые могут покрывать нос, полость рта, язык. При этом отмечаются неприятные ощущения, котенок чувствует постоянно дискомфорт.
Если своевременно не приступить к лечению болезни, то у питомца могут проявиться серьезные осложнения – пневмония и артрит.
Пути заражения
Известно всего 4 формы кальцивироза, но при этом они считаются распространёнными. С ними может столкнуть и взрослые животные, и котята.
Для того чтобы заразиться кальцивирозом совсем не обязательно видеть переносчика. Кошка может заболеть при обнюхивании каловых масс и мочи инфицированного животного. В результате этого вирус с легкостью проникает в организм животного.
Стоит отметить! Чтобы вирус передался при помощи воздушно-капельного пути достаточно расстояния всего 1 метр между инфицированным и здоровым животным.
Чтобы произошло заражение, не требуется прямой контакт с инфицированным животным. Кот может подцепить этот недуг даже во время прогулки на улице, при отдыхе на траве, на которую до этого попала слюна зараженного животного.
Инфицирование данной болезнью может произойти у тех котят, которые постоянно находятся дома и не выходят на улицу. Вирус может занести человек в дом на одежде, обуви, волосах.
Симптомы кальцивироза у котят
Инкубационный период кальцивироза длится в среднем 5-7 дней. В это время симптомы обычно не проявляются. После того как он проходит у котят могут возникнуть определенная симптоматика, которая наиболее характерно для непривитых животных.
В это время симптомы обычно не проявляются. После того как он проходит у котят могут возникнуть определенная симптоматика, которая наиболее характерно для непривитых животных.
Обязательно нужно знать особенности протекания заболевания у котят. Выделяют следующие явные признаки кальцивироза:
- первое время может наблюдаться резкое повышение температуры, которая может наблюдаться на протяжении нескольких дней. Примерно через 3 дня наблюдается снижение температуры и возникает гнилостный запах;
- из глаз и носа у котят со временем возникают выделения. На начальном этапе болезни выделения имеют прозрачную структуру, а через некоторое время они начинают темнеть, дополнительно появляется не приятный запах;
- повышенное отделение слюны, это приводит к сильной влажности области груди у кошки;
- в ротовой полости, на области губ, языка возникают язвенные образования с болезненной структурой, внутри которых наблюдается жидкость;
- наличие пузырьков с жидкостью приводит к появлению постоянного кашля;
- при осложнениях и при длительном течении недуга происходит сильное воспаление пузырьков, которые начинают лопаться.
 Это приводит к появлению неприятного запаха из ротовой полости;
Это приводит к появлению неприятного запаха из ротовой полости; - питомец отказывается от еды;
- у котенка наблюдается расстройство стула. Вначале возникает понос, а затем появляются запоры;
- при запущении заболевания повышается риск возникновения бронхита, воспаления легких;
- при проникновении кальцивироза в головной мозг возникает потеря ориентации, судорожные припадки, агрессивность, хромота.
Узнайте про симптомы, диагностику и лечение кальцивироза у взрослых кошек.
Лечение кальцивироза у котят
При обнаружении первых признаков кальцивироза у питомца хозяин должен сразу же обратиться к ветеринарному специалисту. Стоит учитывать, что болезнь у кошек и котят кошек достаточно тяжело диагностируется.
Обратите внимание! Для того чтобы выявить заболевание кальцивироз при обследовании ветеринар берет кровь. Если наблюдается низкий уровень лейкоцитов, то диагноз подтверждается.
Чтобы лечение кальцивироза было успешным, необходимо при выявлении первых признаков посетить сразу же к ветеринарного специалиста. Если данный недуг находится на начальной стадии, то можно провести лечебную терапию дома.
Если данный недуг находится на начальной стадии, то можно провести лечебную терапию дома.
При осложнениях, переходе заболевания в тяжелую форму рекомендуется обратиться к врачу, потому что домашнее лечение не даст положительного результата. Но в этих случаях назначается определенная схема лечебной терапии:
- Обязательно ветеринарный специалист рекомендует применять антибиотик обширного воздействия;
- Для обработок язвенных поражений в полости рта используется средство с антисептическим действием;
- Выделения из носа и глаз лечат различными каплями и мазями;
- Применение лекарств антигистаминного действия позволяет снизить воспалительный процесс, устраняет отечность;
- При наличии риска дыхательной недостаточности рекомендуется принимать препараты с отхаркивающим действием;
- Для снижения температуры, воспалительного процесса рекомендуется применять препараты с обезболивающим действием и антибиотики;
- Если питомец отказывается от еды, воды, то ветеринар назначает схему капельниц, которая помогает справиться с обезвоживанием организма;
- Для поддержания организма котенка, повышения иммунитета, защитных свойств рекомендуется применять иммуностимуляторы и витаминные препараты;
- Обязательно нужно изолировать инфицированное животное от здоровых особей;
- Питомец должен находиться в помещении с повышенной влажностью.

Какие препараты требуется применять для лечения кальцивироза:
- для предотвращения кальцивироза у котят и устранения воспалительного процесса легких стоит использовать антибиотические препараты — Тилозин и Тетрациклин;
- 4 раза в сутки в область носовых проходов кошки следует закапывать капли Нафтизин. Применение капель поможет избавить животное от повышенных течений из носа;
- для того чтобы устранить язвенные образования ротовую полость необходимо обрабатывать Мирамистином или другими дезинфицирующими средствами.
На протяжении всего периода лечения питомца требуется кормить жидкой пищей. Если питомец не хочет кушать и отказывается от еды, то его нужно кормить насильно. В этих случаях можно набирать еду в шприц и заливать ему в область горла.
Кормить котенка следует нежной, мягкой едой, это ускорит процесс заживления язвенных образований. Подходящим вариантом будут специальные паштеты для больных и слабых животных.
Стоит отметить! Обязательно должна быть сделана прививка от кальцивироза после болезни, которая поможет предотвратить повторное возникновение недуга. Также необходимо некоторое время давать котенку антибиотики, которые защитят питомца от неприятных проявлений заболевания.
Уход за котенком после перенесенного заболевания
Общий уход и питание являются важными условиями, которые должны соблюдаться после перенесенного заболевания. В этот период организм животного сильно ослаблен, по этой причине все силы должны быть направлены на повышение иммунной системы.
Обязательно соблюдайте следующие рекомендации:
- Желательно в этот период кормить питомца питательной и полезной едой;
- Хорошее действие оказывает специальная ветеринарная диета, которая ускорит процесс восстановления котенка;
- Каждый день проводите осмотр животного, особое внимание уделите ротовой полости, глазам, носу;
- Регулярно проветривайте помещение, в котором содержится животное;
- Проводите хорошую очистку и дезинфекцию лотка животного;
- Первое время будут наблюдаться выделения из глаз и носа, их необходимо убирать при помощи чистой салфетки;
- Обязательно первое время необходимо давать питомцу витаминно-минеральные комплексы, это требуется для повышения иммунной системы животного.

Осложнения
Кальцивироз считается опасным заболеванием для кошек со сниженной иммунной системой, для пожилых животных и маленьких котят. Если произойдет заражение животных, входящих в эту группу, то повышается риск летального исхода. Также болезнь предоставляет серьезную опасность, для беременных кошек, в этих случаях повышается риск мертворождения.
Кальцивироз может спровоцировать развитие двух осложнений:
- Интерстициальная пневмония. Во время этого заболевания наблюдается серьезное нарушение дыхательных функций;
- Артрит и боли в конечностях. Зачастую у животных, которые переболели кальцивирозом, встречаются с проблемами суставов, это происходит из-за поражения вирусом суставной ткани.
Профилактика
Обязательно нужно соблюдать профилактические меры из списка ниже:
- оградите питомца от общения с уличными животными;
- не стоит допускать контакта здорового питомца с инфицированными котами, кошками;
- после контакта с зараженным животным тщательно промывайте руки с мылом;
- после выздоровления кошка считается зараженной еще на протяжении месяца, в это время ее стоит изолировать от других животных;
- лоток, миску больного животного рекомендуется обработать хлоркой, но лучше всего их выбросить.

Кальцивироз считается кошачьим заболеванием, оно не предоставляет опасность для человека и других животных. Желательно в этот период создать все необходимые условия, которые ускорят процесс выздоровления питомца. А правильно подобранная схема лечения в домашних условиях и препараты помогут быстро устранить неприятный недуг.
Автор и ведущий рубрики: Ветеринарный врач Санаев Игорь Викторович
Хотите задать вопрос по статье или что-то уточнить? Звоните +79774692712, проконсультируем.
Кальцивироз у кошек: симптомы, лечение и причины
Это чрезвычайно контагиозная вирусная инфекция, характеризующаяся лихорадкой, поражением органов дыхания и стоматитом. Болеют кошачьи всех возрастов, кроме сосунов.
Болеют кошачьи всех возрастов, кроме сосунов.
Групповое содержание является причиной возникновения эпизоотий. Переболевшие животные приобретают пожизненный иммунитет, но становятся вирусоносителями. Клинические признаки наблюдают у кошек 2…24 месячного возраста. Смертность заболевших при отсутствии адекватного лечения составляет 30%.
Причины
Среди факторов риска, провоцирующих возникновения кальцивироза, выделяются следующие:
рекомендуемые статьи:- Воспаление легких у кошек
- Как лечить абсцесс у кошки?
- Отсутствие качественной вентиляции способствует накоплению вирионов.
- Скученное групповое содержание.
- Ослабление организма паразитами:
- Глистами.
- Блохами.
- Отсутствие вакцинации.
Большинство заражений происходит аэрозольным путём — при чихании вирусоносителя. Кроме того, возбудитель передаётся через слюну, экскременты, контакт с заболевшими.
Кроме того, возбудитель передаётся через слюну, экскременты, контакт с заболевшими.
Симптомы
Взрослые обладают иммунитетом к вирусу, поэтому заболевание протекает бессимптомно или со стёртыми признаками. Кальцивироз молодых кошек характеризуется острой формой. Вирус проникает в клетки, питается содержимым, разрушает их, что сопровождается нижеперечисленными проявлениями:
- Лихорадка. Температура возрастает до 40,50°C. Удерживается трое суток.
- Из носа и органа зрения выделяется жидкость, сначала прозрачная, спустя несколько дней — мутная, неприятно пахнущая.
- Обильная саливация.
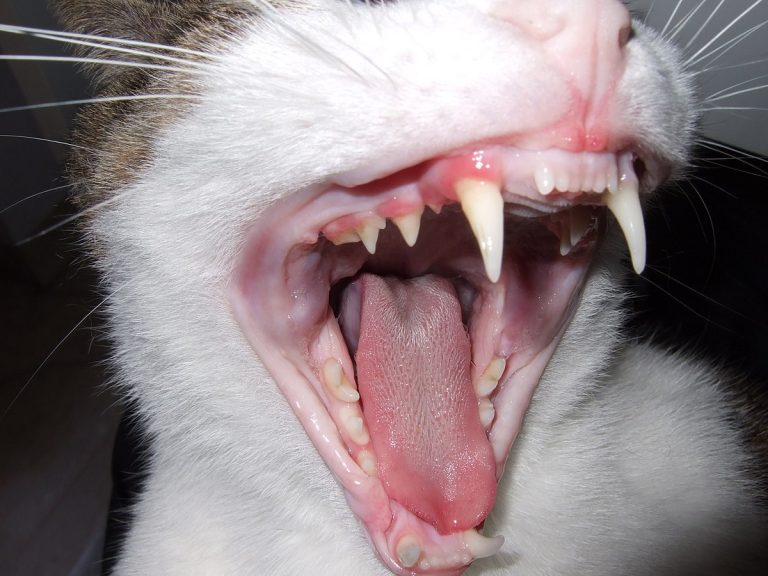
- Формируются многочисленные язвочки языка, губ, нёба, кончика носа.
- Дефекты кровоточат, предоставляют дискомфорт — кошке трудно глотать.
- Анорексия. Кошка отказывается от пищи.
- Из пасти дурно пахнет.
- Развивается гингивит. Воспаляются дёсны.
- Заболевания суставов. Хромота появляется внезапно и самопроизвольно прекращается спустя несколько дней.

- Кашель.
- Чихание.
- Развивается бронхопневмония, заканчивающаяся отёком лёгких и гибелью кошки.
- Вирусы способны проникнуть в мозг. В этих обстоятельствах возможны судороги, шаткая походка, агрессия, страх.
Острое течение кальцивироза способно переходить в скрытую форму и осложниться из-за стрессового состояния или возникновения другого заболевания.
ГингивитДиагностика
Идентификацию вируса проводят серологическими методами с учётом клинических симптомов. Чтобы назначить правильное лечение необходимо исключить следующие заболевания с похожими признаками:
- Хламидиоз.
- Бордетеллез.
- Вирусный ринотрахеит.
Лечение
Положительные результаты приносит комплексное лечение по следующим направлениям:
- Противомикробные средства:
- Витафел — иммуноглобулин, содержащий антитела против кальцивируса, ринотрахеита, панлейкопении.
- Витафел-С — трёхвалентная сыворотка, предназначенная для лечения вышеупомянутых заболеваний.
- Иммуномодуляторы — Фосфпренил, Иммунофан, Циклоферон и пр. Усиливают противовирусный иммунный ответ.
- Универсальные антибиотики предотвращают развитие вторичной микрофлоры.
- Регидратационная терапия. Анорексия и отказ от воды, а также диарея приводят к обезвоживанию. Для восстановления водно-солевого резерва, внутривенно или подкожно вводят следующие препараты:
- Физраствор (0,90% р-р NaCl).
- Рингера или Рингер-Локка раствор.
- Глюкоза 5%.
- Иммуностимулирующие вещества:
- Гамавит.
- Витаминно минеральные смеси.
- Противовоспалительные медикаменты. Необходимы при развитии артритов. Востребован Кетофен, обладающий жаропонижающим и анальгезирующим действием.
- Средства санации рта. Проводят промывание очага изъязвления противомикробными медикаментами.
- Регулярная обработка глаз и носа противовоспалительными каплями или лосьонами.
- Специальной диеты не требуется, но консистенцию корма следует поменять, если кошка потребляла сухие корма.
 Пока не заживут язвы в пасти, больного нужно кормить мягкой пищей.
Пока не заживут язвы в пасти, больного нужно кормить мягкой пищей. - Если животное длительное время отказывается от воды и еды, практикуют принудительное кормление питательными растворами.
Уход за больной кошкой нельзя прекращать, если её состояние улучшилось. Курс лечения назначенный ветеринарным специалистом следует исполнить. В противной ситуации болезнь может возвратиться. Шансов на выздоровление у кошки с рецидивом кальцивироза немного.
Истечения из глаз и носаПрофилактика
Для предотвращения заражения кальцивирозом выполняют следующие мероприятия:
- Соблюдение санитарных правил.
- Рациональное кормление.
- Регулярная дегельминтизация.
- Предотвращение контактов с беспризорными кошками.
- Вакцинация. Используют препараты Мультифел или Нобивак. За неделю до иммунизации животных дегельминтизируют.
 Котят прививают дважды:
Котят прививают дважды:
- Впервые в 8…12 недельном возрасте.
- Иммунизацию закрепляют спустя 3…4 недели.
Взрослых иммунизируют ежегодно.
Похожие статьи:устранение признаков болезни в домашних условиях
Одна из распространенных вирусных патологий — кальцивироз у кошек. Симптомы болезни человеку не передаются, но животному требуется срочная помощь. Заболевание отражается на функционировании всех органов и систем питомца и может привести к летальному исходу. Признаки инфицирования иногда проявляются даже у привитых кошек, но в более мягкой или скрытой форме.
Причины патологии
Вирус кальцивироза может поразить как питомцев, которых хозяева регулярно выпускают погулять на свежем воздухе, так и животных, никогда не покидающих дом. Заражение происходит такими путями:
- Общение с больным котом.
 Бактерии могут передаваться не только в результате касаний, но и при нахождении на небольшом расстоянии, с выдыхаемым воздухом и при чихании.
Бактерии могут передаваться не только в результате касаний, но и при нахождении на небольшом расстоянии, с выдыхаемым воздухом и при чихании. - Обследование меток, оставленных сородичами.
- Спаривание.
- Через грязные руки хозяина, предметы его одежды.
- При выгуливании.
- Котятам вирус может передаться от матери.
Заразиться можно даже от животного, не имеющего видимых проявлений болезни. Риск распространения вируса существенно повышается при содержании нескольких кошек в плохо проветриваемом помещении.
Основные симптомы
У животных болезнь развивается стремительно. На присутствие патологии указывают следующие признаки:
- лихорадка, повышение температуры тела до 40 0C и выше;
- отсутствие аппетита;
- язвы на носу и слизистой оболочке рта, от которых может исходить неприятный запах;
- чихание;
- кашель;
- обильное слюноотделение, слюна может стекать на грудь кошки и смачивать шерсть;
- поражение суставов, хромота.

Наиболее опасное осложнение заболевания — интерстициальная пневмония. Именно такой исход является причиной большинства смертей животных. Также у кошек могут развиться вторичные бактериальные инфекции, поражающие дыхательную систему. В тяжелом случае у питомца наблюдается поражение головного мозга и нервной системы, выражающееся в проявлении агрессии и потере координации движений.
Методы диагностики
Опытный специалист способен понять, что животное болеет кальцивирозом, уже после первичного осмотра. Для уточнения диагноза используются такие способы:
- общее и биохимическое исследование состава крови в лабораторных условиях;
- полимеразная цепная реакция;
- отслеживание количества вырабатываемых для борьбы с вирусом антител при помощи метода парных сывороток;
- рентген.
При обследовании врач также должен исключить другие болезни с похожими симптомами: герперовирусную инфекцию, гастрит, хламидиоз, бордетеллез.
Принципы терапии
Лечение патологии необходимо начать незамедлительно. Тяжесть состояния животного зависит от вида вируса. Специалисты рекомендуют использовать следующие препараты:
- Фоспренил укрепляет иммунную защиту организма, борется с патогенной микрофлорой, обладает комплексным противовирусным действием.
- Обрабатывать язвочки можно Максидином.
- В глаза животному надо закапывать капли на основе антибиотика «Ципровет». Средство подходит для лечения кальцивироза в домашних условиях, его разрешено использовать не только для взрослых особей, но и для котят. Дозировка — по одной капле в каждый глаз 4 раза в сутки в течение 14 дней.
- Для устранения симптомов вирусных инфекций применяется Фоспренил. Для взрослой кошки достаточно одной таблетки в сутки. Длительность терапии — от 3 до 5 дней.
 Это средство имеет природное происхождение, его получают из хвойных деревьев. Препарат действует на клеточном уровне и способствует быстрому выздоровлению питомца.
Это средство имеет природное происхождение, его получают из хвойных деревьев. Препарат действует на клеточном уровне и способствует быстрому выздоровлению питомца. - Лозеваль — эффективный противовирусный медикамент. Обладает неприятным вкусом, поэтому в лекарство нужно добавить немного сахара, прежде чем дать кошке.
- Для предупреждения обезвоживания во время тяжелого течения заболевания используется раствор Рингера-Локка в виде инъекций.
- Если животное страдает от болей, ему дают Бутофранол или Налбуфин. Также ветеринар может ввести Но-шпу в виде инъекции.
- Язвы необходимо обрабатывать антисептиками, например, Фурацилином или Мирамистином. Следует смочить средством ватный тампон, осторожно убрать с ранок корочки и оросить ротовую полость. При этом надо следить, чтобы кошка не проглотила раствор.
При содержании нескольких кошек заболеть может только одна из них. В этом случае второму животному надо давать Фоспренил с целью профилактики.
Больным питомцам необходим особый уход:
- нужно каждый день мыть пол с хлорсодержащим средством;
- не следует лишний раз беспокоить кошку, ей нужен покой;
- помещение, в котором находится питомица, должно обогреваться и проветриваться;
- подстилку, на которой лежит кошка, надо ежедневно стирать и проглаживать.
Если кальцивирозом заражаются котята, около 80% из них не выживают. Такая неутешительная статистика связана с тем, что у детенышей инкубационный период длится сутки. За это время слабый организм котенка сильно повреждается вирусом. Подросшие молодые коты поправляются в 70% случаев. Половина ослабленных и старых особей умирают от болезни.
Меры профилактики
Несмотря на выраженное проявление симптомов болезни, при условии грамотного лечения выздоровление наступает быстро. Но необходимо учитывать, что, даже полностью поправившись, животное остается носителем патологии. У ослабленной кошки возможно возникновение рецидива кальцивироза. Предотвратить повторное развитие заболевания и минимизировать риск заражения позволяют такие меры:
Но необходимо учитывать, что, даже полностью поправившись, животное остается носителем патологии. У ослабленной кошки возможно возникновение рецидива кальцивироза. Предотвратить повторное развитие заболевания и минимизировать риск заражения позволяют такие меры:
- Своевременная вакцинация.
- Укрепление иммунитета.
- Отсутствие стрессовых ситуаций.
- Сбалансированное кормление.
- Воздержание от выгула животного в период эпидемий кальцивироза.
- Регулярное проветривание помещения.
- Обеспечение ежедневной физической активности, необходимой для психического и физического здоровья кота.
При приобретении еще одного животного надо удостовериться, что ему поставлена прививка, или выдержать карантин в течение недели, а уже потом знакомить кошек.
Особенности вакцинирования
Введение вакцины является самым надежным способом уберечь любимца от болезни. Прививки от кальцивироза ставятся по следующей схеме:
Прививки от кальцивироза ставятся по следующей схеме:
- Через 8−12 недель после появления на свет.
- Через месяц после первой процедуры.
- В возрасте 1 год и далее один раз в году.
В первые сутки после укола кошка может быть вялой, плохо есть. Возможен жар и аллергические реакции. Если состояние кота ухудшается, надо обратиться к ветеринару. К наиболее распространенным вакцинам относятся:
- Феловакс-4. Помимо возбудителей заболевания в состав средства входит антиген хламидии. Жидкость вводится внутримышечно или подкожно. Прививку можно ставить во время первого триместра беременности кошки. Устойчивость к вирусу формируется уже после двух уколов и сохраняется в течение года.
- Нобивак Трикет Трио. Защищает также от заражения вирусным ринотрахеитом и панлейкопенией. Не подходит для животных, вынашивающих потомство и выкармливающих котят. Эффект достигается через 10 дней после двукратного введения медикамента. Животное на целый год обретает устойчивость к патологии и еще в течение 3 лет в случае заражения болеет в легкой форме.
- Леукорифелин. Включает антиген кальцивироза, герпесвируса, панлейкопении. Иммунный ответ наблюдается через 14−21 день после использования средства. Запрещено совмещать с другими прививками.
Проводить вакцинацию самостоятельно не рекомендуется. Каждый из препаратов имеет свои особенности использования и хранения. Прививать разрешается только здоровое животное. Если у котенка растут зубы, процедуру необходимо отложить. За 10 суток до вакцинации следует сделать профилактику от глистов, клещей и блох.
Провести профилактику кальцивироза значительно проще, чем бороться с тяжелой патологией, угрожающей жизни животного. Если заражение все-таки произошло, терапию надо начать незамедлительно.
Кошачий грипп — инфекция верхних дыхательных путей
Кошачий грипп или инфекция верхних дыхательных путей (URI) — очень распространенное заболевание, которое может значительно различаться по степени тяжести, а иногда даже опасно для жизни.
В подавляющем большинстве случаев заболевание возникает в результате инфицирования калицивирусом кошек (FCV) или вирусом кошачьего герпеса (FHV или FHV-1). Клинические признаки включают чихание, выделения из носа, конъюнктивит (воспаление слизистой оболочки глаз), выделения из глаз, потерю аппетита, лихорадку и депрессию.Также могут наблюдаться язвы во рту, кашель, чрезмерное слюноотделение и язвы на глазах. Очень молодые, очень старые кошки с ослабленным иммунитетом более склонны к развитию тяжелого заболевания и, возможно, смерти в результате их URI, обычно из-за вторичных инфекций (таких как пневмония), отсутствия питания и обезвоживания.
Клинические признаки включают чихание, выделения из носа, конъюнктивит (воспаление слизистой оболочки глаз), выделения из глаз, потерю аппетита, лихорадку и депрессию.Также могут наблюдаться язвы во рту, кашель, чрезмерное слюноотделение и язвы на глазах. Очень молодые, очень старые кошки с ослабленным иммунитетом более склонны к развитию тяжелого заболевания и, возможно, смерти в результате их URI, обычно из-за вторичных инфекций (таких как пневмония), отсутствия питания и обезвоживания.
Типичные выделения из глаз и носа при кошачьем гриппе
Заражение вирусом кошачьего герпеса может вызвать серьезное повреждение глаз
Какие кошки подвержены риску заражения URI?
URI являются обычным явлением, поскольку эти вирусы широко распространены в популяциях кошек.Типичные факторы риска включают:
- Кошки, содержащиеся в больших группах или колониях, таких как питомники, центры спасения и колонии диких кошек — в этих ситуациях вирусы могут легко распространяться
- Кошки непривитые
- Котята
- Пожилые кошки и кошки с ослабленным иммунитетом (например, кошки с инфекцией FeLV или FIV, или кошки, получающие иммуносупрессивную терапию) более уязвимы для развития тяжелого заболевания
Причины URI у кошек
Большинство кошачьих URI вызваны заражением одним или обоими вирусами кошачьего гриппа:
Считается, что эти два вируса ответственны за более чем 90% URI у кошек. В некоторых случаях могут быть задействованы и другие важные организмы:
В некоторых случаях могут быть задействованы и другие важные организмы:
Клинические признаки URI
Инкубационный период после заражения FCV или FHV обычно составляет всего несколько дней (2-10 дней). После этого развиваются типичные клинические признаки, которые включают:
- Чихание
- Выделения из носа
- Выделения из глаза
- Летаргия
- Отсутствие аппетита
- лихорадка
Степень выраженности этих признаков значительно различается — у некоторых кошек они очень легкие и преходящие, у других они могут быть очень выраженными и серьезными.Существуют некоторые различия в клинической картине между двумя вирусами, но их недостаточно, чтобы отличить их просто по клиническим признакам:
- Инфекция FHV имеет тенденцию быть более серьезной, часто вызывая более выраженный конъюнктивит (глазная инфекция и выделения из глаз) и некоторые изъязвления роговицы (прозрачная часть в передней части глаза).
 FHV может также вызвать: тяжелый фарингит, приводящий к анорексии; воспаление в трахее; и кашель. Инфекция
FHV может также вызвать: тяжелый фарингит, приводящий к анорексии; воспаление в трахее; и кашель. Инфекция - FCV часто протекает легче, с неявными или менее серьезными глазными признаками, но FCV часто вызывает изъязвление языка (а иногда и неба или губ).FCV может вызывать преходящий артрит («синдром хромоты»), обычно наблюдаемый у маленьких котят, а у очень маленьких котят может вызывать тяжелую вирусную пневмонию.
Хотя FCV и FHV являются вирусными инфекциями, вторичное инфицирование бактериями является обычным явлением и может способствовать конъюнктивиту ринита (инфекции в носу) и даже инфекций легких. Хотя большинство кошек выздоравливают от URI, иногда они могут быть опасными для жизни, а при тяжелых инфекциях выздоровление может занять несколько недель.У некоторых кошек также может остаться необратимое повреждение носа и могут быть постоянные или повторяющиеся выделения из носа (так называемый «хронический ринит»).
В редких случаях может развиться гораздо более тяжелая и часто летальная форма инфекции FCV. Это связано с определенными штаммами вируса, которые обладают высокой вирулентностью и называются «вирулентной системной FCV» (vsFCV) инфекцией. К счастью, такие инфекции очень редки (см .: Инфекция, вызванная калицивирусом кошек (FCV)).
Это связано с определенными штаммами вируса, которые обладают высокой вирулентностью и называются «вирулентной системной FCV» (vsFCV) инфекцией. К счастью, такие инфекции очень редки (см .: Инфекция, вызванная калицивирусом кошек (FCV)).
Диагностика
Диагностика ветеринаром обычно основана на типичных признаках, связанных с URI, и исключении других причин.Подтвердить диагноз и выяснить, какой вирус (ы) вовлечены, можно, но часто в этом нет необходимости.
Тестирование на FCV или FHV включает взятие мазка из ротовой полости или глаза, который затем отправляется в специализированную ветеринарную лабораторию. Здесь вирус может быть идентифицирован путем культивирования или с помощью ПЦР-теста (молекулярный тест, показывающий наличие вирусных генов).
Лечение
Лечение URIs в основном симптоматическое и поддерживающее. Ваш ветеринар может провести дополнительные тесты, если его беспокоит степень заболевания (например,g., возможность пневмонии) или если они обеспокоены осложнениями (такими как инфекция FIV или FeLV).
Антибиотики показаны для лечения вторичных бактериальных инфекций и для уменьшения ущерба, наносимого инфекцией. Если заложенность носа серьезная и затруднено дыхание, ветеринар может также посоветовать вдыхание пара или распыление, чтобы выделения стали более жидкими и легче снимались при чихании.
Больные кошки часто не хотят есть — у них будет плохое обоняние, и еда также может быть неудобной.Использование мягких, очень ароматных кормов (например, корма для котят, рыбы в масле), мягко подогретых, поможет соблазнить непривлекательную кошку. Однако, если анорексия тяжелая, вашей кошке может потребоваться госпитализация, чтобы ветеринар мог кормить ее через зонд. Это может быть важно, так как плохое питание значительно усугубит болезнь и замедлит заживление. Если ваша кошка не пьет должным образом, может потребоваться внутривенное введение жидкости, чтобы избежать обезвоживания. Также могут потребоваться анальгетики.
Интерфероны — это белки, которые вырабатываются в организме отчасти для борьбы с вирусными инфекциями.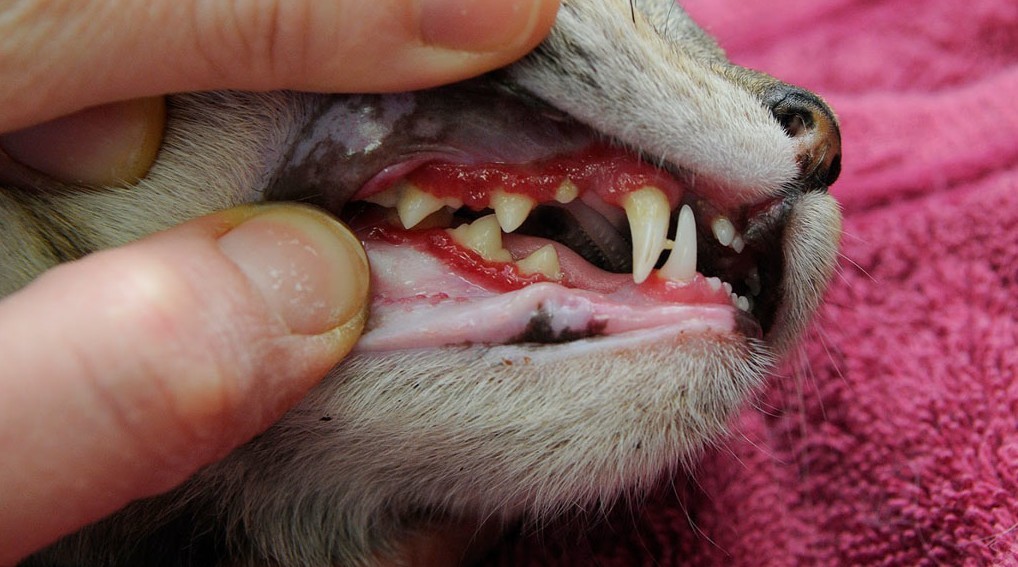 Инъекционные интерфероны могут использоваться в качестве поддерживающего лечения (либо высокие дозы рекомбинантных человеческих интерферонов, либо рекомбинантный кошачий интерферон) — есть некоторые свидетельства того, что это может быть полезно, но, вероятно, для достижения наилучшего эффекта его, вероятно, необходимо назначать на ранней стадии заболевания. .
Инъекционные интерфероны могут использоваться в качестве поддерживающего лечения (либо высокие дозы рекомбинантных человеческих интерферонов, либо рекомбинантный кошачий интерферон) — есть некоторые свидетельства того, что это может быть полезно, но, вероятно, для достижения наилучшего эффекта его, вероятно, необходимо назначать на ранней стадии заболевания. .
Существует ряд противовирусных агентов для местного применения, которые могут помочь в лечении глазных заболеваний, связанных с FHV (например, трифторидин, идоксуридин и цидофовир). Совсем недавно было показано, что препарат, используемый для лечения инфекций вируса герпеса человека — фамцикловир — безопасен и эффективен для кошек при пероральном применении.Это важный шаг вперед в лечении тяжелой инфекции FHV у кошек.
Общий уход также важен — выделения из глаз и носа следует аккуратно стереть влажной ватой, а кошке должно быть тепло и комфортно.
Перевозчики
Большинство кошек, выздоравливающих после заражения вирусами URI, становятся «носителями».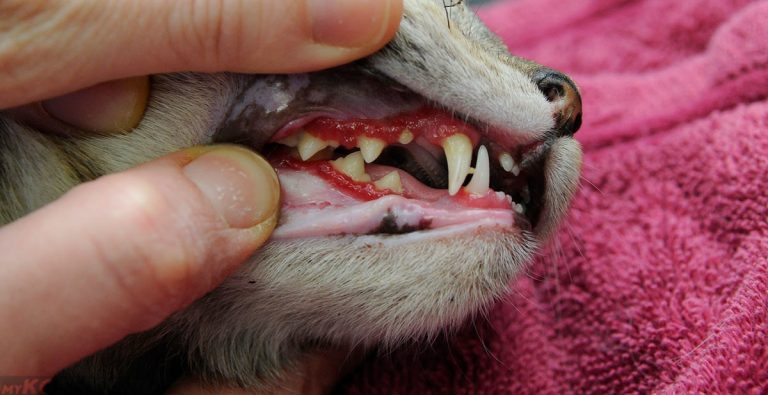 Кошки-носители обычно не проявляют никаких признаков болезни, но могут выделять вирус со слюной, слезами и выделениями из носа, а также могут быть источником инфекции для других кошек.
Кошки-носители обычно не проявляют никаких признаков болезни, но могут выделять вирус со слюной, слезами и выделениями из носа, а также могут быть источником инфекции для других кошек.
Хотя почти все кошки, инфицированные FHV, останутся долгосрочными носителями, многие из них никогда не распространят значительное количество вируса. Другие могут периодически выделять вирус, особенно во время стресса. Некоторые кошки могут снова показать легкие признаки URI, когда они распространяют вирус, но большинство этого не делает. Кошки-носители в племенной колонии представляют собой источник риска для своих котят, так как стресс, связанный с появлением котят, может вызвать выделение FHV.
Большинство кошек, инфицированных FCV, остаются носителями вируса и продолжают выделять вирус в течение недель или месяцев после заражения, но большинство (хотя и не все) в конечном итоге элиминируют вирус в течение нескольких месяцев.
Распространение инфекции
Вирусы, связанные с URI, распространяются тремя способами:
- Прямой контакт с инфицированной кошкой с признаками URI
- Прямой контакт с вирусом распространения кошачьего носителя
- Контакт с вирусом через одежду, миски с едой и другие предметы.
 Большое количество вируса присутствует в слюне, слезах и выделениях из носа, и вирусы могут выжить в окружающей среде и на объектах от 2 (FHV) до 10 (FCV) дней.
Большое количество вируса присутствует в слюне, слезах и выделениях из носа, и вирусы могут выжить в окружающей среде и на объектах от 2 (FHV) до 10 (FCV) дней.
Профилактика
- Вакцинация: Риск URI можно значительно снизить путем вакцинации против FHV и FCV. Эти вакцины важны для всех кошек , независимо от того, как они содержатся (даже если они находятся полностью в помещении), поскольку болезни настолько распространены. Хотя вакцинация обычно предотвращает развитие тяжелого заболевания, она не всегда может предотвратить возникновение инфекции, поэтому у некоторых кошек может развиться легкое заболевание. FCV имеет много различных штаммов, и это может вызвать дополнительные проблемы с вакцинацией, поскольку вакцины не обязательно будут работать против всех этих штаммов.Новые вакцины против FCV содержат в вакцине более одного штамма, чтобы помочь решить эту проблему. Это не проблема FHV, поскольку существует только один штамм вируса.

- Барьерный уход и дезинфекция: Если в доме более одной кошки, важно минимизировать риск распространения инфекции на других кошек. Это не всегда возможно, но в дополнение к обеспечению вакцинации всех кошек, по возможности, кошку с клиническими признаками следует держать изолированной от других кошек (например,г., приурочен к одной комнате). Следует использовать отдельные миски для корма и подносы для туалета, и в идеале кошку следует держать в комнате с очень легко дезинфицируемыми поверхностями (то есть без мягкой мебели и ковров). Эти вирусы восприимчивы к большинству дезинфицирующих средств, но обязательно проконсультируйтесь с ветеринаром — некоторые дезинфицирующие средства (например, продукты на основе фенола) небезопасны для кошек. Дезинфицирующие средства на основе гипохлорита (на основе отбеливателя) (например, 5% -ный отбеливатель, разведенный 1:32) эффективны против этих вирусов, но будьте осторожны при использовании любых дезинфицирующих средств — большинство из них вызывают раздражение кошек, если они вступают в прямой контакт с дезинфицирующим средством.
Инфекция вируса гриппа у кошек |
Отредактировано в ноябре 2020 г.
Это руководство было опубликовано в J Feline Med Surg 2009; 11: 615-618 (Thiry et al., 2009). Автором этой совершенно новой версии является Тадеуш Фримус.
Введение
Грипп — очень заразная острая инфекция, обычно поражающая верхние дыхательные пути, обнаруживаемая во всем мире у многих позвоночных-хозяев (Krammer et al., 2018). Респираторные заболевания кошек, по-видимому, редки и обычно проходят самостоятельно, но вторичные бактериальные инфекции могут привести к осложнениям и могут быть связаны со смертельным исходом. Очень редко высокопатогенные штаммы вируса гриппа могут вызывать у кошек тяжелое генерализованное вирусное заболевание с высокой летальностью (Thiry et al., 2007).
Вирус
Вирус принадлежит к семейству Orthomyxoviridae . Известно четыре типа (A, B, C и D) этого агента.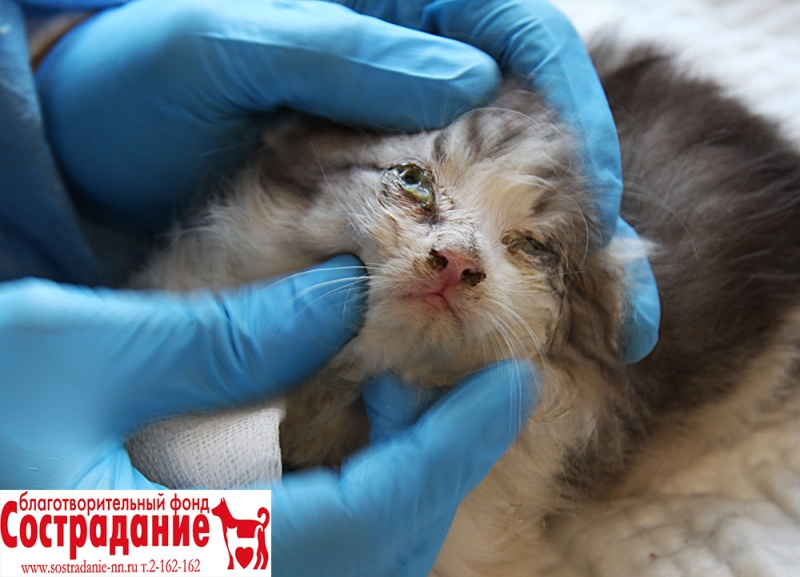 Вирус гриппа типа A (IAV) является наиболее важным вирусом, вызывающим массовые заболевания людей во всем мире и широкий спектр животных, включая птиц, лошадей, свиней, норку, хорьков, летучих мышей и морских млекопитающих. Кроме того, могут быть затронуты собаки и кошки.
Вирус гриппа типа A (IAV) является наиболее важным вирусом, вызывающим массовые заболевания людей во всем мире и широкий спектр животных, включая птиц, лошадей, свиней, норку, хорьков, летучих мышей и морских млекопитающих. Кроме того, могут быть затронуты собаки и кошки.
Типы IAV далее классифицируются как подтипы на основании антигенности двух вирусных поверхностных белков, гемагглютинина (H) и нейраминидазы (N). Существует не менее 16 антигенов H и 9 N (Krammer et al., 2018), и их различные комбинации приводят к 144 подтипам IAV (например,грамм. h2N1, h4N8, H5N2 и т. д.).
Вирусы гриппа генетически сильно изменчивы, поэтому их антигены, вирулентность и способность к репликации быстро меняются у новых видов хозяев (Wille and Holmes, 2019). За это ответственны два механизма: генетический дрейф и генетический сдвиг. Генетический дрейф является результатом мутаций в генах, кодирующих N или H, в результате чего возникает новый антигенный вариант данного подтипа. Если репликация такого варианта менее эффективно подавляется иммунитетом хозяина, который устранил инфекцию, вызванную исходным штаммом, мутировавший вирус может снова заразить ту же самую популяцию.Напротив, антигенный сдвиг — это внезапное появление нового подтипа в результате обмена (перегруппировки) фрагментов РНК между 2 или более подтипами IAV, реплицирующимися одновременно в хозяине (Wille and Holmes, 2019). Общепризнанными хозяевами «сосуда-смесителя» для ВГА человека являются свиньи и птицы, но недавние данные показывают, что собаки и кошки потенциально могут играть такую роль (Chen et al., 2018; Zhao S et al., 2020). Такие новые подтипы, которые имеют общие патогенные свойства со своими родительскими линиями и имеют смесь поверхностных антигенов исходных штаммов, могут быть очень опасными.Поскольку целевая популяция-хозяин часто иммунологически наивна по отношению к новому подтипу, эпидемии или даже пандемии у разных видов животных и людей были результатом в прошлом (Krammer et al.
Если репликация такого варианта менее эффективно подавляется иммунитетом хозяина, который устранил инфекцию, вызванную исходным штаммом, мутировавший вирус может снова заразить ту же самую популяцию.Напротив, антигенный сдвиг — это внезапное появление нового подтипа в результате обмена (перегруппировки) фрагментов РНК между 2 или более подтипами IAV, реплицирующимися одновременно в хозяине (Wille and Holmes, 2019). Общепризнанными хозяевами «сосуда-смесителя» для ВГА человека являются свиньи и птицы, но недавние данные показывают, что собаки и кошки потенциально могут играть такую роль (Chen et al., 2018; Zhao S et al., 2020). Такие новые подтипы, которые имеют общие патогенные свойства со своими родительскими линиями и имеют смесь поверхностных антигенов исходных штаммов, могут быть очень опасными.Поскольку целевая популяция-хозяин часто иммунологически наивна по отношению к новому подтипу, эпидемии или даже пандемии у разных видов животных и людей были результатом в прошлом (Krammer et al. , 2018). Из-за дальнейшего давления отбора (генетического дрейфа) новый подтип может развиться во множество антигенных вариантов, сгруппированных в подлинии или клады (He et al., 2019). Все эти механизмы генетической изменчивости ответственны за постоянную циркуляцию IAV в популяциях птиц и млекопитающих.
, 2018). Из-за дальнейшего давления отбора (генетического дрейфа) новый подтип может развиться во множество антигенных вариантов, сгруппированных в подлинии или клады (He et al., 2019). Все эти механизмы генетической изменчивости ответственны за постоянную циркуляцию IAV в популяциях птиц и млекопитающих.
Вирусы гриппа быстро инактивируются ультрафиолетовым светом, моющими и дезинфицирующими средствами.Однако в воде IAV остается заразным от нескольких недель до месяцев в зависимости от pH, солености и температуры (Irwin et al., 2011, Keeler et al., 2012).
Тираж ВПА
Среди 144 возможных подтипов IAV подавляющее большинство обнаружено у водоплавающих птиц (особенно уток, гусей и лебедей), их естественного хозяина (Sonnberg et al., 2013). Птицы, часто инфицированные субклинически, могут выделять ВГА также с фекалиями, и их сезонные миграции имеют решающее значение для циркуляции ВМА в мире (рис.1). Во льдах (например, северных озер) вирус может перезимовать, что делает возможным повторное появление гриппа в следующем сезоне.
Рис. 1. Появление вируса гриппа А из водоемов с водными дикими птицами (по Krammer et al., 2018) .
Как правило, IAV, выделенные от данного вида, способны эффективно реплицироваться в этом хозяине. Таким образом, обычно используются термины «линии человека», «линии птиц», «линии лошадей» и т.д. Однако их высокая генетическая изменчивость облегчает адаптацию к другим видам хозяев, вызывая у них «новые» вспышки гриппа.Примерами этого являются хорошо задокументированные эпидемии гриппа людей, возникшие у свиней (Krammer et al., 2018), или вспышки среди собак, вызванные IAV h4N8 лошадей (Crawford et al., 2005; Crawford et al., 2011), и особенно несколько эпидемии гриппа у различных млекопитающих, вызванные птичьими вирусами, например, вспышки гриппа у собак и кошек, вызванные IAV h4N2 или H7N2 (Song et al., 2008; Newbury et al., 2017).
С другой стороны, изменчивость позволяет не только появлению новых вирусных штаммов, но и исчезновению уже существующих, таких как ВГА лошадей H7N7, который не выделялся от лошадей с 1979 г. (Webster, 1993), или вирус собачьего гриппа h4N8 ( CIV), который постоянно циркулировал среди собак в США в течение 15 лет, но с 2016 года встречается очень редко (Wille and Holmes, 2019).
(Webster, 1993), или вирус собачьего гриппа h4N8 ( CIV), который постоянно циркулировал среди собак в США в течение 15 лет, но с 2016 года встречается очень редко (Wille and Holmes, 2019).
Патогенез гриппа
Большинство штаммов IAV вызывают острые инфекции верхних дыхательных путей, которые являются самоограничивающимися или субклиническими (Krammer et al., 2018). Хотя вторичные бактериальные инфекции или другие осложнения могут быть результатом инфекции IAV, эти агенты называются «низкопатогенными штаммами». У людей, лошадей, свиней, собак и некоторых других видов млекопитающих они размножаются только в верхних дыхательных путях, вызывая обычный «сезонный» грипп.После инкубационного периода от 1 до нескольких дней воспаление бронхиального эпителия приводит к некротическим поражениям, экссудату и гиперемии легких. Большинство случаев выздоравливает через 1–3 недели, но в некоторых случаях бактериальные осложнения могут привести к пневмонии; это происходит особенно в плохих условиях, во время стресса, как у очень молодых, так и у старых. Летальность при большинстве инфекций составляет <1% (Wasik et al., 2019). Такое естественное заболевание кошек встречается очень редко (Song et al., 2011; Fiorentini et al., 2011; Jeoung et al., 2013). Экспериментальная инфекция кошек низкопатогенными ВГА практически никогда не вызывала заболевания, но субклиническая репликация обычно происходила в течение нескольких дней (Hinshaw et al., 1981; Paniker and Nair, 1970; Romváry et al., 1975).
Летальность при большинстве инфекций составляет <1% (Wasik et al., 2019). Такое естественное заболевание кошек встречается очень редко (Song et al., 2011; Fiorentini et al., 2011; Jeoung et al., 2013). Экспериментальная инфекция кошек низкопатогенными ВГА практически никогда не вызывала заболевания, но субклиническая репликация обычно происходила в течение нескольких дней (Hinshaw et al., 1981; Paniker and Nair, 1970; Romváry et al., 1975).
В отличие от этого высокопатогенные штаммы ВМА, появляющиеся в основном у птиц, способны реплицироваться не только в дыхательных путях, но также в желудочно-кишечном тракте, мышцах, сердце, головном мозге и других органах, что приводит к острым системным заболеваниям, которые могут быть с высокой летальностью.Они часто вызывают внезапную массовую гибель кур, индеек и других домашних птиц, но и у диких птиц часто встречаются субклинические инфекции. У млекопитающих такой грипп встречается очень редко. Однако в 1918-1920 годах всемирная пандемия «испанского гриппа» среди людей, унесшая примерно 20-40 миллионов смертей, была вызвана высокопатогенным вирусом иммунодефицита человека (h2N1).
Кроме того, у кошек высокопатогенный птичий IAV H5N1 может вызывать тяжелое генерализованное заболевание после инкубационного периода продолжительностью 1-2 дня (Kuiken et al., 2004). Распространение вируса через дыхательные пути и с фекалиями начинается на 3-й день после заражения и сохраняется 4 дня или дольше (Rimmelzwaan et al., 2006). После оральной и, возможно, респираторной инфекции, репликация начинается, скорее всего, в желудочно-кишечном тракте и / или верхних дыхательных путях, а затем в легких, что приводит к очагам альвеолярного повреждения (van Riel et al., 2006). В конечном итоге вирус достигает печени, сердца, головного мозга, почечных клубочков, коры надпочечников, а иногда и селезенки, поджелудочной железы и толстой кишки (Rimmelzwaan et al., 2006; Songserm et al., 2006; Yingst et al., 2006). У некоторых кошек наблюдались негнойный энцефалит и ганглионеврит кишечного plexus nervosus (Keawcharoen et al., 2004; Rimmelzwaan et al., 2006). Мультифокальные кровотечения и некрозы в различных органах, а также бронхоинтерстициальная пневмония являются причиной острой смертности (Reperant et al., 2012).
Мультифокальные кровотечения и некрозы в различных органах, а также бронхоинтерстициальная пневмония являются причиной острой смертности (Reperant et al., 2012).
Эпидемиология инфекций IAV у кошек
Долгое время считалось, что кошки устойчивы к гриппу.Теперь ясно, что кошки, собаки, хорьки и другие плотоядные животные вовлечены во всемирное распространение ВГА (Wasik et al., 2019).
Низкопатогенные штаммы
Ранние эксперименты показали, что кошки восприимчивы к некоторым IAV, изолированным от людей, птиц и тюленей, которые обычно вызывают только субклинические инфекции или легкую лихорадку (Paniker and Nair, 1970; Romváry et al., 1975; Hinshaw et al., 1981).
Кроме того, иногда кошкам может передаваться вирус собачьего гриппа (CIV).Первая вспышка тяжелого гриппа у собак произошла в 2002 году у английских гончих и была вызвана вирусом иммуноглобулина h4N8 лошади (Daly et al., 2008).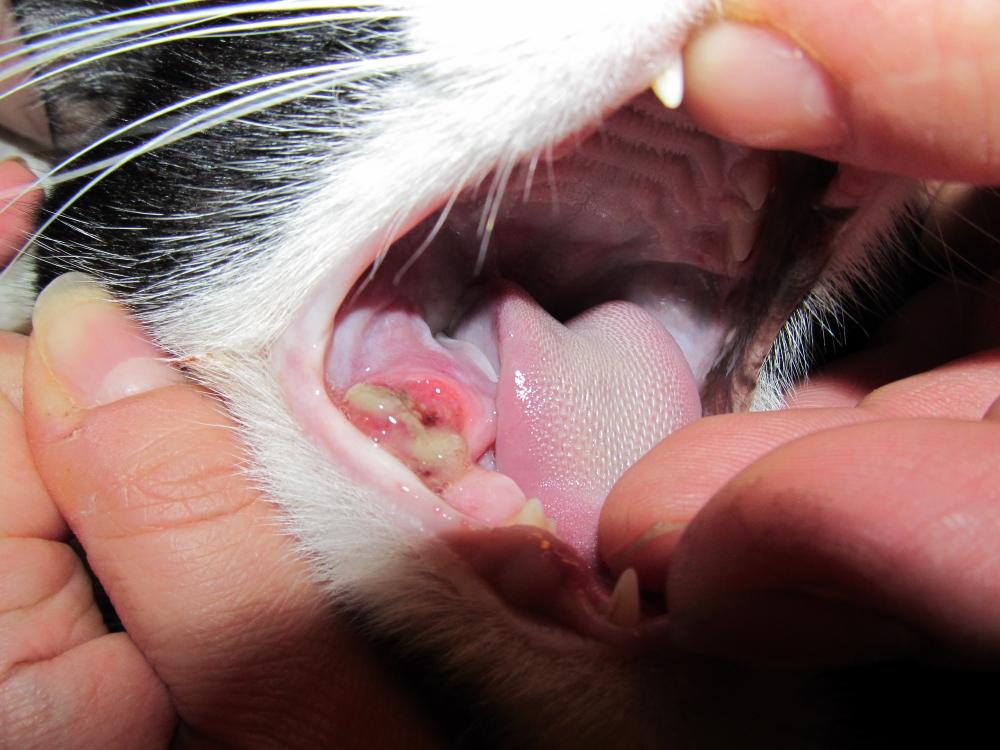 Серологические исследования показали, что этот агент, адаптированный для собак как CIV, циркулировал среди гоночных борзых в США с начала 2000-х годов (Anderson et al., 2012). После вспышки во Флориде этот вирус распространился на другие породы и регионы США, особенно в приюты (Crawford et al., 2005; Payungporn et al., 2008). Другая межвидовая передача вируса h4N8 собакам была зарегистрирована во время эпидемии гриппа лошадей в Австралии в 2007 г. (Kirkland et al., 2010; Crawford et al., 2011). Природный ВГА h4N8 лошадей до сих пор не был обнаружен у кошек, но после экспериментального заражения кошки заболели, распространили вирус и передали инфекцию другим кошкам при контакте (Su et al., 2014).
Серологические исследования показали, что этот агент, адаптированный для собак как CIV, циркулировал среди гоночных борзых в США с начала 2000-х годов (Anderson et al., 2012). После вспышки во Флориде этот вирус распространился на другие породы и регионы США, особенно в приюты (Crawford et al., 2005; Payungporn et al., 2008). Другая межвидовая передача вируса h4N8 собакам была зарегистрирована во время эпидемии гриппа лошадей в Австралии в 2007 г. (Kirkland et al., 2010; Crawford et al., 2011). Природный ВГА h4N8 лошадей до сих пор не был обнаружен у кошек, но после экспериментального заражения кошки заболели, распространили вирус и передали инфекцию другим кошкам при контакте (Su et al., 2014).
В Южной Корее и Китае около 2004–2005 гг. Вирус h4N2 CIV возник у собак, скорее всего, птичьего происхождения, и стал там энзоотическим (Song et al., 2008; Zhu et al., 2015). С 2015 года этот агент неоднократно завозился в США и Канаду собаками, спасенными с азиатских мясных ферм, что привело к нескольким вспышкам (Voorhees et al. , 2017; Васик и др., 2019). Возможна межвидовая передача этого вируса, поскольку после экспериментальных прививок были инфицированы хорьки, морские свинки, а также кошки (Kim et al., 2013). Кроме того, в 2 приютах были отмечены естественные вспышки у кошек с лихорадкой, тахипноэ, чиханием, кашлем, одышкой и летаргией (Song et al., 2011; Jeoung et al., 2013). В одном из них заболеваемость составила 100%, а летальность — 40%. Хотя кошки могут быть инфицированы путем прямого переноса от собаки к кошке или от кошки к кошке, этот вирус, очевидно, реплицируется у кошек менее эффективно, чем у собак, поскольку естественные вспышки среди кошачьих, по-видимому, очень редки.В основном они были помещены в приюты, и вирус, похоже, не подвергается длительной передаче от домашних кошек (Voorhees et al., 2017).
, 2017; Васик и др., 2019). Возможна межвидовая передача этого вируса, поскольку после экспериментальных прививок были инфицированы хорьки, морские свинки, а также кошки (Kim et al., 2013). Кроме того, в 2 приютах были отмечены естественные вспышки у кошек с лихорадкой, тахипноэ, чиханием, кашлем, одышкой и летаргией (Song et al., 2011; Jeoung et al., 2013). В одном из них заболеваемость составила 100%, а летальность — 40%. Хотя кошки могут быть инфицированы путем прямого переноса от собаки к кошке или от кошки к кошке, этот вирус, очевидно, реплицируется у кошек менее эффективно, чем у собак, поскольку естественные вспышки среди кошачьих, по-видимому, очень редки.В основном они были помещены в приюты, и вирус, похоже, не подвергается длительной передаче от домашних кошек (Voorhees et al., 2017).
В 2016-2017 гг. Птичий IAV H7N2 заразил кошек в приюте в Нью-Йорке и быстро распространился в другие приюты в Нью-Йорке и Пенсильвании, вероятно, в результате перемещения кошек между приютами (Newbury et al. , 2017; Blachere et al. ., 2018). Вирус легко передавался от кошек, но не от собак, цыплят или кроликов, содержащихся в одних и тех же помещениях (Lee et al., 2017). Всего было обнаружено около 500 инфицированных кошек, у которых чаще всего наблюдались легкие респираторные заболевания (Hatta et al., 2018). У одной пожилой кошки с сопутствующими заболеваниями развилась тяжелая пневмония, и ее усыпили. Кроме того, ветеринар и работник приюта, подвергшиеся многократному прямому контакту с кошкой без использования средств индивидуальной защиты, заразились и показали легкое преходящее респираторное заболевание (Belser et al., 2017, Poirot et al., 2019).
, 2017; Blachere et al. ., 2018). Вирус легко передавался от кошек, но не от собак, цыплят или кроликов, содержащихся в одних и тех же помещениях (Lee et al., 2017). Всего было обнаружено около 500 инфицированных кошек, у которых чаще всего наблюдались легкие респираторные заболевания (Hatta et al., 2018). У одной пожилой кошки с сопутствующими заболеваниями развилась тяжелая пневмония, и ее усыпили. Кроме того, ветеринар и работник приюта, подвергшиеся многократному прямому контакту с кошкой без использования средств индивидуальной защиты, заразились и показали легкое преходящее респираторное заболевание (Belser et al., 2017, Poirot et al., 2019).
Экспериментальные прививки подтвердили, что кошки были восприимчивы к вирусу h4N2 человека, который вызвал пандемию гриппа «Гонконг» в 1968 году (Paniker and Nair, 1970).Кроме того, несколько исследований показали, что в 2009 году кошки (и собаки) могут быть инфицированы во всем мире во время следующей пандемии человеческого гриппа, вероятно, путем прямой передачи от их владельцев (Löhr et al. , 2010; Sponseller et al., 2010; Ali et al. , 2011; Campagnolo et al., 2011; Lin et al., 2012; Zhao FR et al., 2014; Zhao S et al., 2020). В Италии этот вирус вызвал вспышку респираторных и желудочно-кишечных заболеваний в колонии из 90 кошек, что привело к 25 смертельным исходам (Fiorentini et al., 2011). Подозревалась передача от кошки к кошке (van den Brand et al., 2010; Fiorentini et al., 2011).
, 2010; Sponseller et al., 2010; Ali et al. , 2011; Campagnolo et al., 2011; Lin et al., 2012; Zhao FR et al., 2014; Zhao S et al., 2020). В Италии этот вирус вызвал вспышку респираторных и желудочно-кишечных заболеваний в колонии из 90 кошек, что привело к 25 смертельным исходам (Fiorentini et al., 2011). Подозревалась передача от кошки к кошке (van den Brand et al., 2010; Fiorentini et al., 2011).
Имеются также сообщения о случайных случаях гриппа у кошек, вызванных другими штаммами ВГА (Cao et al., 2017; Wasik et al., 2019; Borland et al., 2020). Недавнее исследование подтвердило, что наличие антител к IAV как птичьего, так и человеческого происхождения не является редкостью у европейских кошек из приютов (Zhao S et al., 2020). В их сыворотках были обнаружены антитела против h2, h4, H5, H7 и H9.
Высокопатогенный штамм H5N1
В Азии в 1996 г. появился высокопатогенный штамм H5N1, который вызвал огромную эпидемию «птичьего гриппа» с высокой смертностью домашних птиц в начале 21-го -го и -го века. Были уничтожены сотни миллионов домашних птиц (Всемирная организация здравоохранения животных, 2020). Спорадически поражались млекопитающие, в том числе более 860 человек с уровнем смертности более 50% (Всемирная организация здравоохранения, 2020). Также были отмечены тяжелые случаи у домашних кошек (Kuiken et al., 2004; Thiry et al., 2007), а также у диких кошачьих (Keawcharoen et al., 2004), которые кормились или имели другой контакт с инфицированными цыплятами. В одной из вспышек среди диких кошачьих подозревалась передача от тигра к тигру (Thanawongnuwech et al., 2005). Когда эта эпидемия достигла Европы и Африки, там также наблюдались случайные случаи заболевания кошачьими (Thiry et al., 2007), а также субклинические инфекции (Leschnik et al., 2007). Обычно они были связаны с инфицированными дикими птицами или домашними птицами. Тем не менее, даже в районах, где птицы инфицированы вирусом H5N1, кошки редко бывают положительными при серологическом исследовании или ПЦР (Marschall et al.
Были уничтожены сотни миллионов домашних птиц (Всемирная организация здравоохранения животных, 2020). Спорадически поражались млекопитающие, в том числе более 860 человек с уровнем смертности более 50% (Всемирная организация здравоохранения, 2020). Также были отмечены тяжелые случаи у домашних кошек (Kuiken et al., 2004; Thiry et al., 2007), а также у диких кошачьих (Keawcharoen et al., 2004), которые кормились или имели другой контакт с инфицированными цыплятами. В одной из вспышек среди диких кошачьих подозревалась передача от тигра к тигру (Thanawongnuwech et al., 2005). Когда эта эпидемия достигла Европы и Африки, там также наблюдались случайные случаи заболевания кошачьими (Thiry et al., 2007), а также субклинические инфекции (Leschnik et al., 2007). Обычно они были связаны с инфицированными дикими птицами или домашними птицами. Тем не менее, даже в районах, где птицы инфицированы вирусом H5N1, кошки редко бывают положительными при серологическом исследовании или ПЦР (Marschall et al.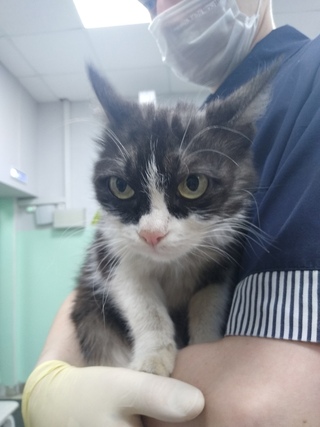 , 2008; Zhao FR et al., 2015). Экспериментальные инфекции подтвердили, что штамм H5N1 может вызывать тяжелое смертельное заболевание у домашних кошек и может передаваться через контакт кошки с кошкой (Kuiken et al., 2004; Риммельцваан и др., 2006; Vahlenkamp et al., 2008). Вирус выводился не только через дыхательные пути, но и с фекалиями.
, 2008; Zhao FR et al., 2015). Экспериментальные инфекции подтвердили, что штамм H5N1 может вызывать тяжелое смертельное заболевание у домашних кошек и может передаваться через контакт кошки с кошкой (Kuiken et al., 2004; Риммельцваан и др., 2006; Vahlenkamp et al., 2008). Вирус выводился не только через дыхательные пути, но и с фекалиями.
Таким образом, представленные выше данные ясно показывают, что домашние кошки восприимчивы к естественным инфекциям IAV других видов. Скорее всего, они возникают в результате тесного контакта с инфицированными людьми или животными, особенно с птицами. Серологические исследования предполагают низкие или умеренные уровни сероконверсии к низкопатогенным сезонным штаммам человека или животных и спорадические сероконверсии к высокопатогенным штаммам птиц.Однако, похоже, что ВГА неэффективно распространяются среди популяций кошек, вероятно, из-за социальной организации, которая ограничивает прямой контакт кошки с кошкой, необходимый для передачи вируса.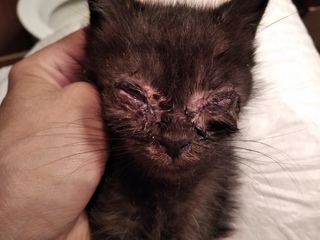 До сих пор эпидемий кошачьего гриппа не наблюдалось, а наблюдались только редкие вспышки в густых популяциях, таких как приюты. Поэтому кошки не считаются резервуаром гриппа. В отличие от людей, лошадей, свиней, летучих мышей, собак и некоторых других видов млекопитающих, адаптация IAV к кошачьим хозяевам еще не произошла.
До сих пор эпидемий кошачьего гриппа не наблюдалось, а наблюдались только редкие вспышки в густых популяциях, таких как приюты. Поэтому кошки не считаются резервуаром гриппа. В отличие от людей, лошадей, свиней, летучих мышей, собак и некоторых других видов млекопитающих, адаптация IAV к кошачьим хозяевам еще не произошла.
Клинические признаки
Низкопатогенные IAV обычно вызывают только субклиническую инфекцию или легкое, самоограничивающееся заболевание верхних дыхательных путей с чиханием, а также выделениями из носа и / или глаз у кошек.Очень редко в приютах или других многолюдных колониях вторичные бактериальные инфекции могут приводить к пневмонии, проявляющейся повышением температуры тела, тахипноэ, одышкой, кашлем, летаргией и смертельным исходом (Fiorentini et al., 2011; Song et al., 2011; Jeoung et al., 2013; Hatta et al., 2018).
Хотя субклиническая инфекция также возможна, высокопатогенный птичий штамм H5N1 обычно вызывает у кошек тяжелые клинические симптомы, включая высокую температуру с первого дня после заражения и летаргию на второй день, выпячивание мигательных перепонок, конъюнктивит, одышку и высокий уровень смертности. Если возникают диффузные геморрагические поражения, у некоторых кошек появляются серозно-кровянистые выделения из носа и желтуха. Также можно увидеть судороги, атаксию или другие неврологические признаки, а также симптомы со стороны желудочно-кишечного тракта (Kuiken et al., 2004; Thanawongnuwech et al., 2005; Rimmelzwaan et al., 2006; Songserm et al., 2006; Vahlenkamp et al. ., 2008).
Если возникают диффузные геморрагические поражения, у некоторых кошек появляются серозно-кровянистые выделения из носа и желтуха. Также можно увидеть судороги, атаксию или другие неврологические признаки, а также симптомы со стороны желудочно-кишечного тракта (Kuiken et al., 2004; Thanawongnuwech et al., 2005; Rimmelzwaan et al., 2006; Songserm et al., 2006; Vahlenkamp et al. ., 2008).
Патологические образования
У кошек, умерших в результате низкопатогенной инфекции IAV (пандемический штамм человека h2N1 / 2009), гистологическое исследование выявило бронхоинтерстициальную пневмонию, гиперплазию эпителиальных бронхов и альвеолярный некроз (Fiorentini et al., 2011; Knight et al., 2016).
Вскрытие трупов кошек, инфицированных высокопатогенным вирусом H5N1, показало мультифокальные легочные поражения и петехиальные кровотечения в легких, сердце, тимусе, желудке, кишечнике, миндалинах, нижнечелюстных и заглоточных лимфатических узлах и печени, а также геморрагический панкреатенит al. , 2004; Yingst et al., 2006). Микроскопически это воспалительные и некротические поражения.
, 2004; Yingst et al., 2006). Микроскопически это воспалительные и некротические поражения.
Диагностика
У кошек с признаками острого воспаления верхних дыхательных путей следует рассмотреть возможность заражения гриппом, если кошачий герпесвирус и калицивирус исключены в качестве этиологических агентов.Факторы риска включают пребывание в приюте и тесный контакт с людьми или животными, страдающими гриппом. Это особенно актуально, когда тяжелое острое респираторное заболевание наблюдается у кошки, находящейся на открытом воздухе во время вспышки высокопатогенной инфекции птичьего гриппа среди домашних птиц и / или водных диких птиц в регионе (Thiry et al., 2007).
IAV могут быть выделены в культуре ткани или яйцеклетках с эмбрионами из мазков из носа или ротоглотки, или при патологоанатомическом исследовании из легочной ткани (и, в случае высокопатогенных штаммов, также из ректальных мазков или фекалий, пораженных органов, содержимого кишечника). и плевральная жидкость).
и плевральная жидкость).
Вирусная РНК может быть обнаружена в мазках из носа с помощью ПЦР с обратной транскриптазой в течение первых 4 дней заражения; также можно использовать другие образцы тканей.
В субклинических случаях серология (тест на ингибирование гемагглютинации или анализ микронейтрализации) может быть полезна для обнаружения антител. Четырехкратное увеличение титра сыворотки в течение 14 дней указывает на недавнюю инфекцию вирусом гриппа. Недавно было опубликовано сравнение серологических анализов во время скрининга антител против IAV у кошек (Zhao S et al., 2020).
Для собак и некоторых других видов животных предлагаются коммерческие тесты на месте для быстрого обнаружения ВГА в мазках из носа. Они пока не прошли валидацию для кошек.
Контроль
В случае вспышки гриппа в питомнике следует соблюдать обычные процедуры изоляции и карантина, чтобы предотвратить распространение, поскольку может произойти передача от кошки к кошке. Заболевание верхних дыхательных путей обычно протекает в легкой форме и проходит самостоятельно.В редких, сложных случаях следует применять симптоматические препараты в сочетании с контролем вторичных бактериальных инфекций, а также другие процедуры, применяемые у кошек, страдающих другими острыми вирусными заболеваниями верхних дыхательных путей. У людей осельтамивир обычно используется для лечения или профилактики инфекций IAV. Этот противовирусный препарат применялся на здоровых тиграх, подверженных риску заражения высокопатогенным вирусом H5N1, но доказательств защиты не было (Thanawongnuwech et al., 2005).
Заболевание верхних дыхательных путей обычно протекает в легкой форме и проходит самостоятельно.В редких, сложных случаях следует применять симптоматические препараты в сочетании с контролем вторичных бактериальных инфекций, а также другие процедуры, применяемые у кошек, страдающих другими острыми вирусными заболеваниями верхних дыхательных путей. У людей осельтамивир обычно используется для лечения или профилактики инфекций IAV. Этот противовирусный препарат применялся на здоровых тиграх, подверженных риску заражения высокопатогенным вирусом H5N1, но доказательств защиты не было (Thanawongnuwech et al., 2005).
Хотя было показано, что вакцина от гетерологичного (H5N6) вируса птичьего гриппа может защитить кошек от летального заражения штаммом H5N1 (Vahlenkamp et al., 2008), коммерческих вакцин для кошек в настоящее время нет. Единственная профилактика кошек — это предотвращение любого контакта с домашними птицами или дикими птицами, инфицированными H5N1 или другими высокопатогенными IAV. Поэтому Европейская комиссия рекомендовала держать кошек в помещениях в районах, где зафиксированы вспышки вирусной инфекции H5N1 среди домашних или диких птиц (Anonymous, 2006; Совет Европейского Союза, 2006).
Поэтому Европейская комиссия рекомендовала держать кошек в помещениях в районах, где зафиксированы вспышки вирусной инфекции H5N1 среди домашних или диких птиц (Anonymous, 2006; Совет Европейского Союза, 2006).
Недавно было показано, что коммерческая инактивированная вакцина против собачьего гриппа h4N2 хорошо переносится и вызывает сероконверсию у кошек (Velineni et al., 2020). Даже если эта вакцина должна была быть лицензирована для кошек, ее использование в Европе не рекомендуется, поскольку собачий вирус h4N2 до сих пор не обнаружен в Европе, и даже в регионах со вспышками у собак инфекции у кошек очень редки.
Зоонозный риск
Кошки не считаются резервуаром ВГА.До сих пор кошки, инфицированные как низкопатогенными, так и высокопатогенными ВГА, оказывались тупиковыми хозяевами (Harder and Vahlenkamp, 2010). На данный момент задокументировано только два случая передачи от кошки человеку низкопатогенного птичьего IAV H7N2 (Belser et al. , 2017, Poirot et al., 2019, Borland et al., 2020). Они произошли в приюте после длительного и незащищенного контакта ветеринара и рабочего с больными кошками и их респираторными выделениями, что указывает на низкий риск передачи вируса от кошки человеку (Lee et al., 2017). Скорее инфицированные люди могут быть источником заражения кошек сезонными ВИА.
, 2017, Poirot et al., 2019, Borland et al., 2020). Они произошли в приюте после длительного и незащищенного контакта ветеринара и рабочего с больными кошками и их респираторными выделениями, что указывает на низкий риск передачи вируса от кошки человеку (Lee et al., 2017). Скорее инфицированные люди могут быть источником заражения кошек сезонными ВИА.
Хотя кошки чувствительны к высокопатогенному птичьему IAV H5N1, который вызвал более 860 случаев заболевания людей во всем мире, ни один случай заболевания человека не был получен от кошек. Тем не менее, если у кошек обнаружены или подозреваются высокопатогенные штаммы IAV, следует снизить риск передачи вируса людям, надев перчатки, маску и очки, сведя к минимуму все ненужные контакты и проведя дезинфекцию (Thiry et al., 2007).
Благодарность
ABCD Europe с благодарностью отмечает поддержку Boehringer Ingelheim (спонсор-основатель ABCD) и Virbac.
Список литературы
Али А.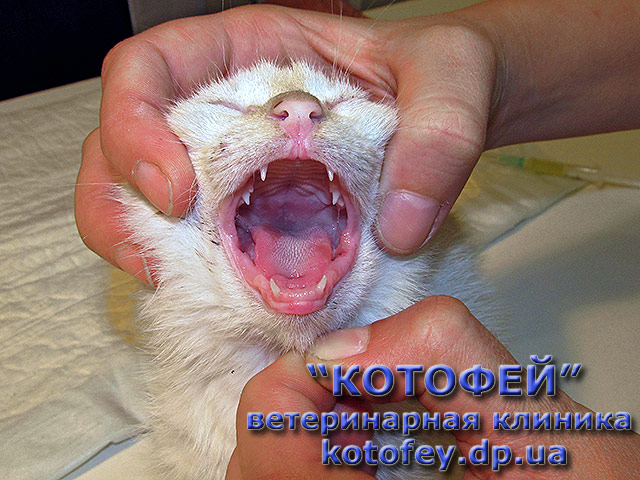 , Дэниэлс Дж. Б., Чжан И. и др. (2011 г.): Пандемические и сезонные инфекции вируса гриппа человека у домашних кошек: распространенность, связь с респираторными заболеваниями и сезонные колебания. Дж. Клин Микробиол 49 (12), 4101-4105.DOI: 10.1128 / JCM.05415-11
, Дэниэлс Дж. Б., Чжан И. и др. (2011 г.): Пандемические и сезонные инфекции вируса гриппа человека у домашних кошек: распространенность, связь с респираторными заболеваниями и сезонные колебания. Дж. Клин Микробиол 49 (12), 4101-4105.DOI: 10.1128 / JCM.05415-11
Anderson TC, Bromfield CR, Crawford PC, Dodds WJ, Gibbs EP, Hernandez JA (2012): серологические доказательства циркуляции собачьего гриппоподобного вируса h4N8 у собак в США до 2004 года. Vet J 191, 312–316.
Anonymous (2006): Европейский совет по птичьему гриппу H5N1 у кошек. Vet Rec 158, 314.
Belser JA, Pulit-Penaloza JA, Sun X и др. (2017): Вирус гриппа нового типа A (H7N2), выделенный ветеринаром, ухаживающим за кошками в приюте для животных Нью-Йорка, вызывает легкое заболевание и плохо передается в модели хорька .J Virol 91 (15), e00672-17. Опубликовано 12 июля 2017 г. doi: 10.1128 / JVI.00672-17.
Blachere FM, Lindsley WG, Weber AM и др. (2018): Обнаружение вируса птичьего гриппа A (H7N2) в образцах воздуха и на поверхности в карантинном учреждении для кошек в Нью-Йорке. Другие респирные вирусы гриппа 12 (5), 613-622. DOI: 10.1111 / irv.12572
(2018): Обнаружение вируса птичьего гриппа A (H7N2) в образцах воздуха и на поверхности в карантинном учреждении для кошек в Нью-Йорке. Другие респирные вирусы гриппа 12 (5), 613-622. DOI: 10.1111 / irv.12572
Borland S, Gracieux P, Jones M, Mallet F, Yugueros-Marcos J (2020): Инфекция вирусом гриппа A у кошек и собак: обзор литературы в свете концепции «единого здоровья».Front Public Health 8, 83. Опубликовано 20 марта 2020 г. doi: 10.3389 / fpubh.2020.00083
Campagnolo ER, Rankin JT, Daverio SA и др. (2011): Пандемия гриппа A со смертельным исходом (h2N1) 2009 у домашней кошки в Пенсильвании. Общественное здравоохранение по зоонозам 58 (7), 500-507. DOI: 10.1111 / j.1863-2378.2011.01390.x
Cao X, Yang F, Wu H, Xu L (2017): Генетическая характеристика новых реассортантных вирусов гриппа подтипа H5N6, выделенных от кошек в восточном Китае.Arch Virol 162 (11), 3501-3505. DOI: 10.1007 / s00705-017-3490-2
Chen Y, Trovão NS, Wang G, et al (2018): Возникновение и эволюция новых реассортантных вирусов гриппа A у собак в Южном Китае. mBio 9 (3), e00909-18. Опубликовано 5 июня 2018 г. doi: 10.1128 / mBio.00909-18.
mBio 9 (3), e00909-18. Опубликовано 5 июня 2018 г. doi: 10.1128 / mBio.00909-18.
Совет Европейского Союза (2006 г.): Директива Совета 2005/94 / EC от 20 декабря 2005 г. о мерах Сообщества по борьбе с птичьим гриппом и отмене Директивы 92/40 / EEC.Официальный журнал Европейского Союза, 14 января 2006 г., L 10/16 – L 10/65.
Crawford PC, Dubovi EJ, Castleman WL и др. (2005): Передача вируса гриппа лошадей собакам. Наука 310 (5747), 482-485. DOI: 10.1126 / science.1117950
Crawford PC, Dubovi EJ, Castleman WL, Stephenson I, Gibbs EP, Chen L, Smith C, Hill RC, Ferro P, Pompey J, Bright RA, Medina MJ, Johnson CM, Olsen CW, Cox NJ, Klimov AI, Crispe E, Finlaison DS, Hurt AC, Kirkland PD (2011): Инфекция собак вирусом гриппа лошадей: доказательства передачи от лошадей во время австралийской вспышки.Aust Vet J 89, 27–28. DOI: 10.1111 / j.1751-0813.2011.00734.x
Дейли Дж. М., Бланден А. С., Макрэ С., Миллер Дж.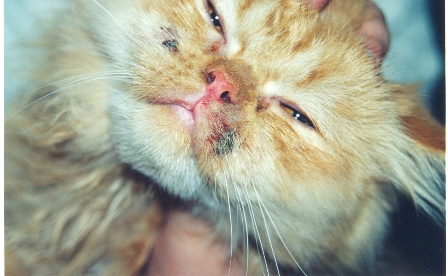 , Боуман С. Дж., Колодзейек Дж., Новотны Н., Смит К. К. (2008 г.): Передача вируса гриппа лошадей английским гончим. Emerg Infect Dis 14, 461–464.
, Боуман С. Дж., Колодзейек Дж., Новотны Н., Смит К. К. (2008 г.): Передача вируса гриппа лошадей английским гончим. Emerg Infect Dis 14, 461–464.
Fiorentini L, Taddei R, Moreno A, et al (2011): Вспышка пандемического вируса гриппа A (h2N1) в 2009 г. в колонии кошек в Италии. Зоонозное здравоохранение 58 (8), 573-581. DOI: 10.1111 / j.1863-2378.2011.01406.х
Harder TC, Vahlenkamp TW (2010): Инфекции вируса гриппа у собак и кошек. Вет Иммунол Иммунопатол 134 (1-2), 54-60. DOI: 10.1016 / j.vetimm.2009.10.009
Hatta M, Zhong G, Gao Y и др. (2018): Характеристика вируса кошачьего гриппа A (H7N2). Emerg Infect Dis 24 (1), 75-86. DOI: 10.3201 / eid2401.171240
He W, Li G, Wang R, Shi W, Li K, Wang S, Lai A, Su S. (2019): Смещение диапазона хозяев вируса собачьего гриппа h4N8: филодинамический анализ его происхождения и адаптации от лошади к собаке хост.Vet Res 50 (1), 87. doi: 10.1186 / s13567-019-0707-2
Hinshaw VS, Webster RG, Easterday BC, Bean WJ Jr (1981): Репликация вирусов птичьего гриппа А у млекопитающих.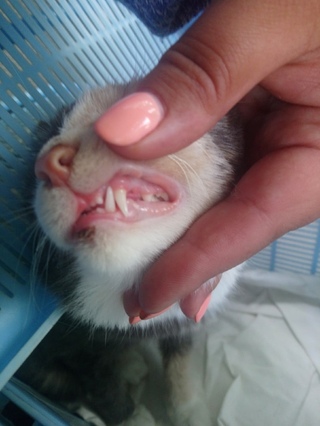 Заражение иммунной 34 (2), 354-361.
Заражение иммунной 34 (2), 354-361.
Ирвин К.К., Юн К.Дж., Ван С., Хофф С.Дж., Циммерман Дж.Дж., Денагамейдж Т., О’Коннор А.М. (2011 г.): Использование методологии систематического обзора для оценки факторов, влияющих на устойчивость вируса гриппа в матрицах окружающей среды. Прикладная и экологическая микробиология 77 (3), 1049–1060.https://doi.org/10.1128/AEM.02733-09
Jeoung HY, Lim SI, Shin BH и др. (2013): новый вирус собачьего гриппа h4N2, выделенный от кошек в приюте для животных. Vet Microbiol 165, 281–286.
Keawcharoen J, Oraveerakul K, Kuiken T., Fouchier RAM, Amonsin A, Payungporn S, Noppornpanth S, Wattanodorn S, Theambooniers A, Tantilertcharoen R, et al (2004): Птичий грипп H5N1 у тигров и леопардов. Emerging Infect Dis 10, 2189–2191. DOI: 10.3201 / eid1012.040759
Keeler SP, Berghaus RD, Stallknecht DE (2012): Персистенция низкопатогенных вирусов птичьего гриппа в фильтрованной поверхностной воде из мест обитания водоплавающих птиц в Джорджии, США. Дж. Уайлдл Дис 48 (4), 999-1009. DOI: 10.7589 / 2011-11-314
Дж. Уайлдл Дис 48 (4), 999-1009. DOI: 10.7589 / 2011-11-314
Ким Х, Сонг Д., Мун Х и др. (2013): Межвидовая и внутривидовая передача вируса собачьего гриппа (h4N2) у собак, кошек и хорьков. Другие респирные вирусы гриппа 7 (3), 265-270. DOI: 10.1111 / j.1750-2659.2012.00379.х
Kirkland PD, Finlaison DS, Crispe E, Hurt AC (2010): Передача вируса гриппа от лошадей собакам, Австралия. Emerg Infect Dis 16 (4), 699-702. DOI: 10.3201 / eid1604.091489
Knight CG, Davies JL, Joseph T, Ondrich S, Rosa BV (2016): Пандемическая инфекция вируса гриппа h2N1 у канадской кошки. Может Ветеринар J 57 (5), 497-500.
Krammer F, Smith GJD, Fouchier RAM, Peiris M, Kedzierska K, Doherty PC, Palese P, Shaw ML, Treanor J, Webster RG, García-Sastre A (2018): Influenza.Nat Rev Dis Primers 4 (1), 3. doi: 10.1038 / s41572-018-0002-y.
Kuiken T, Rimmelzwaan G, van Riel D, et al (2004): Птичий грипп H5N1 у кошек. Наука 306 (5694), 241. doi: 10.1126 / science.1102287
Наука 306 (5694), 241. doi: 10.1126 / science.1102287
Lee CT, Slavinski S, Schiff C и др. (2017): Вспышка гриппа A (H7N2) среди кошек в приюте для животных с передачей от кошки к человеку — Нью-Йорк, 2016. Clin Infect Dis 65 (11) , 1927-1929 гг. DOI: 10.1093 / cid / cix668
Leschnik M, Weikel J, Möstl K, Revilla-Fernández S, Wodak E, Bagó Z, Vanek E, Benetka V, Hess M, Thalhammer JG (2007): Субклиническая инфекция вирусом птичьего гриппа A (H5N1) у кошек.Emerging Infect Dis 13, 243–247. DOI: 10.3201 / eid1302.060608
Лин Д, Сун С., Ду Л, Ма Дж, Фан Л, Пу Дж, Сунь Й, Чжао Дж, Сун Х, Лю Дж (2012): Естественное и экспериментальное заражение собак пандемическим вирусом гриппа h2N1 / 2009. Джен Вирол 93, 119–123.
Löhr CV, DeBess EE, Baker RJ, et al (2010): Патология и распределение вирусных антигенов летальной пневмонии у домашних кошек, вызванной пандемическим вирусом гриппа A (h2N1) 2009 г. Ветеринарный патруль 47 (3), 378-386.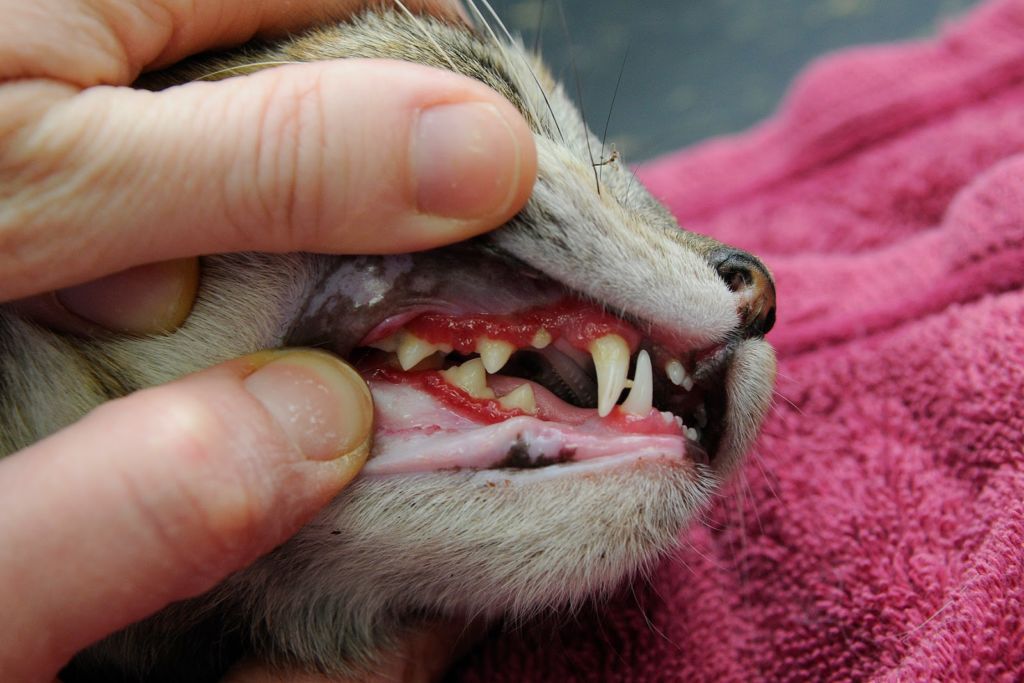 DOI: 10.1177/0300985810368393
DOI: 10.1177/0300985810368393
Маршалл Дж., Шульц Б., Хардер Т.С. и др. (2008): Распространенность вируса гриппа A H5N1 у кошек из районов, где у птиц встречается высокопатогенный птичий грипп. J Feline Med Surg 10 (4), 355-358. DOI: 10.1016 / j.jfms.2008.03.007.
Newbury SP, Cigel F, Killian ML, Leutenegger CM, Seguin MA, Crossley B, Brennen R, Suarez DL, Torchetti M, Toohey-Kurth K (2017): первое обнаружение птичьего происхождения H7N2 в Felis catus .Анонсы генома 5 (23), e00457-17. https://doi.org/10.1128/genomeA.00457-17
Paniker CK, Nair CM (1970): Инфекция гонконгского гриппа A2 у домашних кошек. Bull World Health Organ 43 (6), 859–862.
Payungporn S, Crawford PC, Kouo TS, Chen LM, Pompey J, Castleman WL, Dubovi EJ, Katz JM, Donis RO (2008): Вирус гриппа A (h4N8) у собак с респираторным заболеванием, Флорида. Emerg Infect Dis 14, 902–908.
Пуаро Э., Левин М.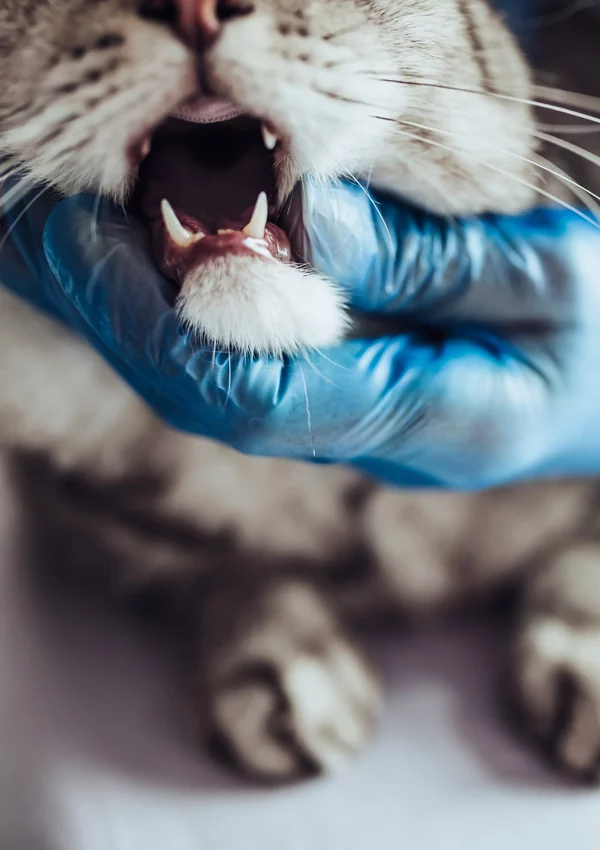 З., Рассел К., Стюарт Р.Дж., Помпей Дж.М., Чиу С., Фрай А.М., Гросс Л., Хейверс Ф.П., Ли З.Н., Лю Ф., Кросса А., Ли С.Т., Бошуизен В., Ракеман Д.Л., Славински С., Харпер С., Гулд Л.Х. (2019): Выявление инфекции вируса птичьего гриппа A (H7N2) среди работников приютов для животных с использованием нового серологического подхода — Нью-Йорк, 2016-2017.J. Infect Dis 219 (11), 1688–1696. DOI: 10.1093 / infdis / jiy595. PMID: 30395249; PMCID: PMC6986351.
З., Рассел К., Стюарт Р.Дж., Помпей Дж.М., Чиу С., Фрай А.М., Гросс Л., Хейверс Ф.П., Ли З.Н., Лю Ф., Кросса А., Ли С.Т., Бошуизен В., Ракеман Д.Л., Славински С., Харпер С., Гулд Л.Х. (2019): Выявление инфекции вируса птичьего гриппа A (H7N2) среди работников приютов для животных с использованием нового серологического подхода — Нью-Йорк, 2016-2017.J. Infect Dis 219 (11), 1688–1696. DOI: 10.1093 / infdis / jiy595. PMID: 30395249; PMCID: PMC6986351.
Reperant LA, van de Bildt MWG, van Amerongen G, Leijten LME, Watson S, Palser A, Kellam P, Eissens AC, Frijlink HW, Osterhaus ADME и др. (2012): Выраженный эндотелиотропизм высокопатогенного вируса птичьего гриппа H5N1 после кишечная инокуляция у кошек. J Virol 86, 1158–1165. DOI: 10.1128 / JVI.06375-11
Rimmelzwaan GF, van Riel D, Baars M, Bestebroer TM, van Amerongen G, Fouchier RAM, Osterhaus ADME, Kuiken T (2006): Инфекция вируса гриппа A (H5N1) у кошек вызывает системное заболевание с потенциальными новыми путями распространения вируса внутри и между хостами. Am J Pathol 168, 176–183. DOI: 10.2353 / ajpath.2006.050466
Am J Pathol 168, 176–183. DOI: 10.2353 / ajpath.2006.050466
Romváry J, Rózsa J, Farkas E (1975): Заражение собак и кошек вирусом гонконгского гриппа A (h4N2) во время эпидемического периода в Венгрии. Acta Vet Acad Sci Hung 25 (2-3), 255-259.
Song DS, An DJ, Moon HJ, et al (2011): Межвидовая передача вируса собачьего гриппа h4N2 домашним кошкам в Южной Корее. J Gen Virol 92, 2350–2355.
Сонг Д., Кан Б., Ли С. и др. (2008 г.): Передача вируса птичьего гриппа (h4N2) собакам.Emerg Infect Dis 14 (5), 741-746. DOI: 10.3201 / eid1405.071471
Сонгсерм Т., Амонсин А., Джем-он Р. и др. (2006): Птичий грипп H5N1 у естественно инфицированных домашних кошек. Emerg Infect Dis 12 (4), 681-683. DOI: 10.3201 / eid1204.051396
Зоннберг С., Вебби Р.Дж., Вебстер Р.Г. (2013): Естественная история высокопатогенного птичьего гриппа H5N1. Virus Res 178 (1), 63-77. DOI: 10.1016 / j.virusres.2013.05.009.
Sponseller BA, Strait E, Jergens A, et al (2010): Инфекция вируса пандемии гриппа A (h2N1) 2009 у домашних кошек. Emerg Infect Dis 16 (3), 534-537. DOI: 10.3201 / eid1603.091737
Emerg Infect Dis 16 (3), 534-537. DOI: 10.3201 / eid1603.091737
Су С., Ван Л., Фу Х и др. (2014): Инфекция кошек вирусом гриппа лошадей A (h4N8). Emerg Infect Dis 20 (12), 2096-2099. DOI: 10.3201 / eid2012.140867
Thanawongnuwech R, Amonsin A, Tantilertcharoen R, Damrongwatanapokin S, Theamboonlers A, Payungporn S, Nanthapornphiphat K, Ratanamungklanon S, Tunak E, Songserm T и др. (2005): Вероятная передача вируса от тигра к тигру5.Emerging Infect Dis 11, 699–701. DOI: 10.3201 / eid1105.050007
Тири Э., Зикола А., Адди Д. и др. (2007): Вирус высокопатогенного птичьего гриппа H5N1 у кошек и других плотоядных животных. Vet Microbiol 122 (1-2), 25-31. DOI: 10.1016 / j.vetmic.2006.12.021
Vahlenkamp TW, Harder TC, Giese M, et al (2008): Защита кошек от заражения смертельным вирусом гриппа H5N1. Дж. Ген Virol 89 (Pt 4), 968-974. DOI: 10.1099 / vir.0.83552-0
van den Brand JM, Stittelaar KJ, van Amerongen G, et al (2010): Экспериментальная пандемия (h2N1) 2009 вирусная инфекция кошек. Emerg Infect Dis 16 (11), 1745-1747. DOI: 10.3201 / eid1611.100845
Emerg Infect Dis 16 (11), 1745-1747. DOI: 10.3201 / eid1611.100845
van Riel D, Munster VJ, de Wit E, et al (2006): Прикрепление вируса H5N1 к нижним дыхательным путям. Наука 312 (5772), 399. doi: 10.1126 / science.1125548
Велинени С., Хайнер Н., Конли Д., Хатчинсон К. (2020): Вакцинация инактивированной вакциной против вируса собачьего гриппа h4N2 безопасна и вызывает иммунный ответ у кошек. J Feline Med Surg 22 (2), 199-202. DOI: 10.1177 / 1098612X19833261
Voorhees IEH, Glaser AL, Toohey-Kurth KL, et al (2017): Распространение вируса собачьего гриппа A (h4N2), США.Emerg Infect Dis 23, 1950–1957.
Wasik BR, Voorhees IEH, Parrish CR (2019): Грипп собак и кошек. Cold Spring Harb Perspect Med pii: a038562. DOI: 10.1101 / cshperspect.a038562
Webster RG (1993): Присутствуют ли все еще вирусы гриппа лошадей 1 у лошадей? Equine Vet J 25 (6), 537-538. DOI: 10.1111 / j.2042-3306.1993.tb03009. x
Вилле М., Холмс ЕС (2019): Экология и эволюция вирусов гриппа. Cold Spring Harb Perspect Med pii: a038489.DOI: 10.1101 / cshperspect.a038489
Всемирная организация здравоохранения (2020 г.): https://www.who.int/influenza/human_animal_interface/2020_10_07_tableH5N1.pdf?ua=1)
Всемирная организация здравоохранения животных (2020 г.): https://www.oie.int/animal-health-in-the-world/avian-influenza-portal/
Yingst SL, Saad MD, Felt SA (2006): Qinghai-подобный H5N1 от домашних кошек, северный Ирак. Emerg Infect Dis 12 (8), 1295-1297. DOI: 10.3201 / eid1708.060264
Zhao FR, Liu CG, Yin X, Zhou DH, Wei P, Chang HY (2014): Серологический отчет о пандемической инфекции (h2N1) 2009 г. среди кошек на северо-востоке Китая в 2012-02 и 2013-03 годах. Virol J 11, 49. Опубликовано 14 марта 2014 г. doi: 10.1186 / 1743-422X-11-49
Zhao FR, Zhou DH, Zhang YG, et al (2015): Распространенность выявления вируса птичьего гриппа H5N1 среди бездомных кошек в восточном Китае. J Med Virol 87 (8), 1436-1440. DOI: 10.1002 / jmv.24216
J Med Virol 87 (8), 1436-1440. DOI: 10.1002 / jmv.24216
Zhao S, Schuurman N, Tieke M, Quist B, Zwinkels S, van Kuppeveld F, de Haan CAM, Egberink H (2020): Серологический скрининг антител к вирусу гриппа A у кошек и собак указывает на частое заражение различными подтипами.Дж. Клин Микробиол JCM.01689-20. DOI: 10.1128 / JCM.01689-20. Epub впереди печати. PMID: 32878956.
Zhu H, Hughes J, Murcia PR (2015): Происхождение и эволюционная динамика вируса собачьего гриппа h4N2. J Virol 89, 5406–5418. DOI: 10.1128 / JVI.03395-14
Модель естественного хозяина для патогенеза альфа-герпеса
Кошачий герпесвирус 1 (FeHV-1) — это альфа-герпесвирус, который вызывает вирусный ринотрахеит кошек, важное вирусное заболевание кошек во всем мире.Острая инфекция FeHV-1 связана как с симптомами со стороны верхних дыхательных путей, так и со стороны глаз. После острой фазы болезни устанавливается пожизненная латентность, прежде всего в сенсорных нейрональных клетках.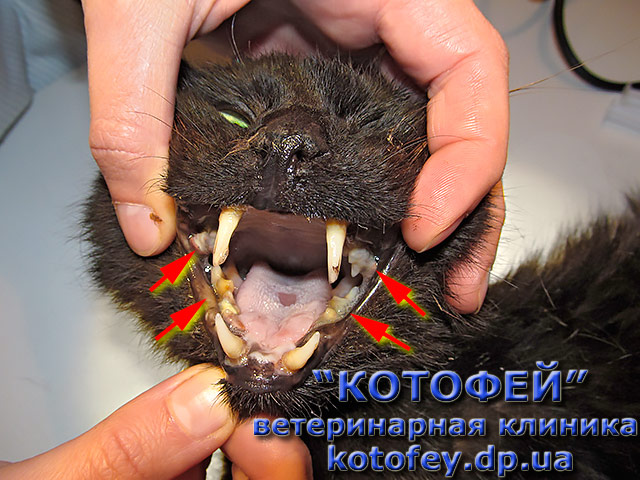 Как и в случае с вирусами простого герпеса человека, латентная реактивация может привести к рецидиву, который может проявляться в виде серьезных поражений глаз. Инфекция FeHV-1 у кошек представляет собой модель естественного хозяина, которая полезна для идентификации генов вирулентности вируса, которые играют роль в репликации через входные пути слизистой оболочки или являются медиаторами установления, поддержания или реактивации латентного периода.Это также модельная система для определения механизмов врожденного и адаптивного иммунитета и стратегий иммунизации, которые могут привести к лучшей защите от этого и других альфа-герпесвирусных инфекций.
Как и в случае с вирусами простого герпеса человека, латентная реактивация может привести к рецидиву, который может проявляться в виде серьезных поражений глаз. Инфекция FeHV-1 у кошек представляет собой модель естественного хозяина, которая полезна для идентификации генов вирулентности вируса, которые играют роль в репликации через входные пути слизистой оболочки или являются медиаторами установления, поддержания или реактивации латентного периода.Это также модельная система для определения механизмов врожденного и адаптивного иммунитета и стратегий иммунизации, которые могут привести к лучшей защите от этого и других альфа-герпесвирусных инфекций.
1. Введение
Вирус герпеса кошачьих 1 (FeHV-1) классифицируется по порядку: Herpesvirales , семейство: Herpesviridae , подсемейство: Alphaherpesvirinae и род: Varicellovirus [1]. Характеристики членов Alphaherpesvirinae заключаются в их коротком цикле репликации, индукции пожизненной латентности, первичности в нейронах и, в большинстве случаев, в узком круге хозяев. Герпесвирусы человека и животных являются членами подсемейства Alphaherpesvirinae . Вирусы простого герпеса человека типа 1 (HSV-1) и 2 (HSV-2), соответственно, вызывают герпес и поражения половых органов. Вирус ветряной оспы (VZV) является возбудителем ветряной оспы, а реактивация скрытой ДНК VZV вызывает опоясывающий лишай. Некоторые из герпесвирусов млекопитающих, помимо FeHV-1, классифицированные в этом семействе, включают бычий герпесвирус-1 (BoHV-1), вызывающий респираторные заболевания и аборты у крупного рогатого скота, вирус герпеса-1 лошадей (EHV-1), который вызывает респираторные заболевания, аборты и, в некоторых случаях, неврологические заболевания у лошадей, вирус суидного герпеса 1, также известный как псевдобешенство (PRV) и вирус болезни Ауески, приводящие к респираторным заболеваниям, абортам, неврологическим заболеваниям свиней и вирусу герпеса собак-1 (CaHV-1), ответственны за неонатальную смертность щенков, а также респираторные и глазные заболевания у молодых и взрослых собак.
Герпесвирусы человека и животных являются членами подсемейства Alphaherpesvirinae . Вирусы простого герпеса человека типа 1 (HSV-1) и 2 (HSV-2), соответственно, вызывают герпес и поражения половых органов. Вирус ветряной оспы (VZV) является возбудителем ветряной оспы, а реактивация скрытой ДНК VZV вызывает опоясывающий лишай. Некоторые из герпесвирусов млекопитающих, помимо FeHV-1, классифицированные в этом семействе, включают бычий герпесвирус-1 (BoHV-1), вызывающий респираторные заболевания и аборты у крупного рогатого скота, вирус герпеса-1 лошадей (EHV-1), который вызывает респираторные заболевания, аборты и, в некоторых случаях, неврологические заболевания у лошадей, вирус суидного герпеса 1, также известный как псевдобешенство (PRV) и вирус болезни Ауески, приводящие к респираторным заболеваниям, абортам, неврологическим заболеваниям свиней и вирусу герпеса собак-1 (CaHV-1), ответственны за неонатальную смертность щенков, а также респираторные и глазные заболевания у молодых и взрослых собак. Примерами птичьих альфа-герпесвирусов являются вирус инфекционного ларинготрахеита (ILTV), вызывающий тяжелое респираторное заболевание у домашней птицы, и вирус болезни Марека (MDV), который вызывает иммуносупрессию, и Т-клеточные лимфомы.
Примерами птичьих альфа-герпесвирусов являются вирус инфекционного ларинготрахеита (ILTV), вызывающий тяжелое респираторное заболевание у домашней птицы, и вирус болезни Марека (MDV), который вызывает иммуносупрессию, и Т-клеточные лимфомы.
Инфекция FeHV-1 вызывает вирусный ринотрахеит у кошек (FVR), который не только составляет приблизительно половину всех диагностированных вирусных инфекций верхних дыхательных путей у кошек, но также является важной причиной поражений глаз у кошек. Как и в случае других альфа-герпесвирусных инфекций, острая фаза FVR сопровождается пожизненным латентным периодом.На латентной стадии вирусная ДНК FeHV-1 сохраняется в эписомальной форме, прежде всего в ядрах нейронов сенсорных ганглиев. Транскрипция вирусной РНК очень ограничена, и инфекционный вирус не продуцируется. Изменение латентного состояния, вызванное естественными стрессорами или введением кортикостероидов, может вызвать реактивацию вируса в латентно инфицированных клетках, что приведет к возобновлению производства инфекционного вируса. Реактивированный инфекционный вирус затем перемещается на периферию посредством антероградного аксонального транспорта, потенциально может вызывать клинические признаки (рецидив) и может привести к передаче вируса [2–5].
Поскольку FeHV-1 является первичным патогеном кошек с компонентами респираторных и глазных заболеваний, аналогичными компонентам герпесвирусов человека, и латентным периодом, который легко реактивируется в естественных условиях, инфекция FeHV-1 у кошек считается хорошим модель естественного хозяина для изучения сравнительного молекулярного патогенеза острых и латентных альфа-герпесвирусных инфекций и тестирования новых стратегий иммунизации.
2. Характеристики вируса
Размер вирионов FeHV-1 колеблется от 120 до 180 нм.Они состоят из ядра, содержащего геном двухцепочечной вирусной ДНК, икосаэдрического капсида, окружающего ядро, слоя тегумента, окружающего капсид, и липидной двухслойной оболочки, из которой выступают гликопротеиновые шипы [6, 7].
FeHV-1 поражает в первую очередь домашних кошек, но львы и гепарды также восприимчивы к нему [3, 8]. In vitro , FeHV-1 реплицируется только в клетках кошачьего происхождения. Альфа-герпесвирусы, которые генетически связаны с FeHV-1, — это вирус герпеса псовых 1 (CaHV-1) и фоцидные вирусы герпеса (PhHV) 1 и 2 [3, 9–11].
3. Геномная организация
Наша лаборатория [12] сообщила о первой карте Sal I генома штамма C-27 FeHV-1 и определила, что ее размер составляет приблизительно 134 т.п.н. Grail et al. [13] впоследствии картировали геном штамма FeHV-1 B927 и определили, что его геном имеет размер всего 126 т.п.н. Было обнаружено, что геномная организация обоих этих штаммов FeHV-1 сходна с таковой у других варицелловирусов. По сути, геном FeHV-1 состоит из двух сегментов уникальной ДНК, называемых уникальной длинной (UL) и уникальной короткой (США) областями.Американская область генома фланкирована парой идентичных, но перевернутых последовательностей, обозначенных как Internal Repeat Short (IRS) и Terminal Repeat Short (TRS).
Мы недавно сообщили о первой полной геномной последовательности FeHV-1, а также о конструировании и характеристике клона ВАС, содержащего весь вирусный геном. Полные геномные последовательности были получены как из ВАС FeHV-1, так и из очищенной ДНК вириона. Эти данные показали, что размер генома FeHV-1 составляет 135 797 п.н., а содержание GC составляет 45%.Всего было предсказано 78 открытых рамок считывания, кодирующих 74 различных белка. Расположение генов оказалось колинеарным с таковым у большинства других варицелловирусов, геномы которых были секвенированы [14].
Считается, что все альфа-герпесвирусы обладают паттерном репликации, аналогичным паттерну репликации HSV-1 [6, 7]. Ранее было показано, что FeHV-1 содержит 23 белка, связанных с вирионом [15]. Первоначально было идентифицировано восемь гликопротеинов, обозначенных как gB, gC, gD, gE, gG, gH, gI и gL.Изучение недавно полученной полной последовательности показало, что геном FeHV-1 на самом деле содержит всего 13 гликопротеинов оболочки [14].
Большинство исследований функции генов FeHV-1 было сосредоточено на роли гликопротеинов оболочки [16] из-за их предполагаемой роли в индукции защитных иммунных ответов хозяина и, следовательно, их потенциала для разработки вакцины.
4. Острая инфекция
FeHV-1 обычно поражает котят и молодых кошек. Большинство котят защищены пассивным иммунитетом примерно до двухмесячного возраста.
Патогенез FHV-1 основан на двух различных механизмах. Во-первых, FeHV-1 — это цитолитический вирус. Примеры его цитолитического действия — изъязвления слизистых оболочек и роговицы. Второй механизм — иммуноопосредованный, клинически проявляющийся в виде стромального кератита. Важным вопросом, связанным со вторым патогенетическим механизмом, является источник антигенной стимуляции, вызывающей эту реакцию [17].
Основными источниками передачи FeHV-1 являются глоточные и глазные выделения от остро инфицированных кошек.Передача вируса также может быть связана с реактивацией латентного периода. Котята с остаточным пассивным иммунитетом могут не проявлять клинических признаков при воздействии, но становятся латентно инфицированными [18].
После проникновения через ороназальный путь FeHV-1 широко реплицируется в слизистых оболочках верхних дыхательных путей и обычно вызывает тяжелые заболевания верхних дыхательных путей у восприимчивых животных. Инкубационный период от 2 до 6 дней. Первичные сайты репликации FeHV-1 включают слизистые оболочки носовой перегородки, носовых раковин, носоглотки, конъюнктивы и верхних отделов трахеи.Репликация также происходит в миндалинах и нижнечелюстных лимфатических узлах.
Острая респираторная инфекция FeHV-1 первоначально характеризуется лихорадкой, отсутствием аппетита и чиханием, за которыми следуют серозные выделения из носа, которые могут стать слизисто-гнойными через 5–7 дней. Кроме того, оральная репликация вируса может привести к чрезмерному слюноотделению и слюноотделению. Иногда может возникать кашель и одышка. Язвы во рту, типичный признак калицивирусной инфекции кошек, могут возникать в результате инфицирования ротовой полости FeHV-1, но редко [3].
Глазные проявления, связанные с инфекцией FeHV-1, были рассмотрены Gould [5]. У новорожденных котят была описана офтальмия новорожденных, которая может привести к серьезным повреждениям роговицы. Острый гиперемический конъюнктивит, приводящий к выделениям из глаз и хемозу, характерному для острой инфекции, возникает в сочетании с симптомами со стороны верхних дыхательных путей. Образование разветвленных эпителиальных язв, называемых дендритными язвами, является патогномоничным признаком острой глазной инфекции FeHV-1.В недавнем обзоре этиологии язв роговицы у кошек Хартли [19] заявил: «Допустим, FHV-1, если не доказано иное». Иногда развиваются более крупные язвы, называемые географическими язвами роговицы. Как дендритное, так и географическое изъязвление роговицы также может быть результатом латентной реактивации. Другим компонентом поражений, связанных с обострением, является воспаление конъюнктивы и / или роговицы, которое более легкое, чем при остром заболевании.
FeHV-1 — это, прежде всего, патоген верхних дыхательных путей и глаз, при котором легкие поражаются лишь спорадически.Уровни виремии низкие, что, как считается, связано с естественной температурной чувствительностью этого вируса, которая способствует репликации в верхних дыхательных путях. Контакт с беременными кошками может привести к аборту, но инфекция FeHV-1 не является частой причиной абортов у кошек. У новорожденных котят инфекция может иметь генерализованный характер и связана с неврологическими признаками и высокой смертностью.
5. Концепции латентности альфа-герпесвируса
Отличительной чертой биологии альфа-герпесвируса является то, что острая инфекция сопровождается пожизненным сохранением вирусного генома в латентной форме в нервной и лимфоидной тканях.Задержка и периодическая реактивация латентности являются неотъемлемыми частями жизненного цикла альфа-герпесвирусов и важными элементами их выживания и передачи.
Цикл реактивации с задержкой в рабочем состоянии состоит из трех основных этапов: установление, обслуживание и повторная активация.
Установка задержки по определению требует, чтобы вирус достиг ткани, в которой будет установлена задержка. Этот процесс начинается во время острой фазы репликации вируса на периферических участках слизистой оболочки.Нервные окончания сенсорных нервов, иннервирующих сайты репликации вируса, захватывают вирусные частицы и субчастицы во время этой фазы. Эти частицы транспортируются в аксоплазме аксонов этих нервов посредством процесса, называемого ретроградным транспортом аксонов. Когда вирус достигает сенсорных ганглиев, он заражает нейроны и другие типы клеток. Эта острая инфекция ганглиозных клеток длится примерно одну неделю. Нейроны — это тип клеток, в которых устанавливается задержка. Для этого экспрессия литического гена подавляется, в то время как транскрипт, связанный с латентностью (LAT), экспрессируется, что дает несколько видов РНК путем сплайсинга.Эти многочисленные виды вместе называются LAT. Низкий уровень или спорадическая транскрипция немедленных и ранних генов может происходить, но этого недостаточно для инициации продуктивной инфекции. При скрытой инфекции в ганглиях не обнаруживаются инфекционные вирионы. LAT РНК сплайсируется, и в ядре продуцируется стабильный интрон в форме лариата, называемый LAT размером 2 т.п.н. Сплайсированная мРНК LAT транспортируется в цитоплазму, где несколько небольших ORF могут транслироваться в белки.
Во время латентной фазы поддержания вирусная ДНК присутствует в нейронах в эписомальной форме. Вирусная ДНК не является полностью статичной во время фазы поддержания латентности, но транскрипционная активность генома ограничена областью, называемой транскриптом, связанным с латентностью, или LAT.
Фаза обслуживания задержки обратима. Другими словами, под действием определенных природных или фармакологических стимулов может происходить реактивация латентной вирусной ДНК.Репликация вируса начинается снова, и инфекционные вирионы затем возвращаются на периферию, используя тот же сенсорный нервный «тракт», который используется для достижения ганглиев. Инфекционный вирус можно снова обнаружить путем выделения вируса или ПЦР из носовых, оральных или глазных мазков. Обычно клинические признаки, связанные с процессом реактивации, значительно мягче, чем при первичной инфекции, и реактивация, безусловно, может быть бессимптомной. Выделение вируса в результате реактивации также обычно происходит на более низком уровне и короче, чем при первичной инфекции.Однако реактивация вируса все еще может быть значительным источником заражения и первичного заболевания у полностью восприимчивых хозяев, находящихся в тесном контакте с животным, у которого произошла реактивация. Реактивация происходит только в небольшом подмножестве латентно инфицированных нейронов, обычно менее 0,05%. Латентно инфицированные нейроны, в которых произошла реактивация, не выживают. Это объясняет, почему сенсорный дефицит не связан с реактивацией ганглиев сенсорных нервов. Поскольку резервуар латентно инфицированных нейронов остается большим в этих условиях, повторная реактивация может происходить на протяжении всей жизни хозяина.
Наше текущее понимание регуляции латентного периода основано в первую очередь на исследованиях HSV-1 и BoHV-1 [20–22]. Следующее резюме основано в основном на прекрасном недавнем обзоре латентности HSV-1, проведенном Пернгом и Джонсом [20].
5.1. Роль транскриптов, связанных с латентностью (LAT)
Острая инфекция нейронов тройничных ганглиев приводит к образованию токсичных продуктов экспрессии генов, которые делают их уязвимыми для повреждения и смерти. Кроме того, повреждение клеточной ДНК, вызванное репликацией вируса, стимулирует митохондриальный путь апоптоза.Герпесвирусы пытаются противодействовать апоптозу и, таким образом, повышать свою репликативную способность, кодируя несколько антиапоптотических генов, одним из которых является ген LAT. Поскольку существует избыточность антиапоптотических возможностей вируса во время острой фазы, апоптоз нейронов во время этой фазы предотвращается достаточно эффективно.
Очень важно, чтобы апоптоз предотвращался также на этапе установления и поддержания латентности. Это особенно важно для пермиссивных нейронов, в которых обширная вирусная репликация имела место во время острой фазы.LAT проявляет свои антиапоптотические свойства через микро-РНК (miRNA). Механизм, с помощью которого LAT-кодируемая miRNA регулирует апоптоз, направлен на трансформирующий фактор роста бета, мощный индуктор апоптоза [23, 24].
Важно понимать взаимодействия между латентным вирусным геномом и нейроном, которые приводят к реактивации, потому что это предварительное условие для окончательного контроля над этим процессом. LAT играет важную роль в реактивации латентности in vivo .В экспериментальных исследованиях было показано, что спонтанная реактивация серьезно нарушается, если ген LAT удален.
5.2. Роль протеина тегумента VP16
Thompson et al. [25] недавно описали центральную роль, которую играет тегументный белок VP16 во всех фазах латентного периода HSV. Перед установлением латентного периода репликация вируса происходит в разрешающих нейронах. В чувствительных клетках на поверхности слизистой оболочки VP16, компонент вирионов, проникающих в клетку, в сочетании с клеточными факторами активирует непосредственные ранние гены.Аксональный транспорт VP16 в нейроны неэффективен, что может способствовать латентности. Для того, чтобы VP16 инициировал литическую инфекцию, он должен быть синтезирован de novo , процесс, который требует преодоления нейронального ингибирования.
Очень интересно, что локус LAT, как полагают, экспрессирует риборегуляторы, которые обеспечивают синтез VP16. Было показано, что в отсутствие транскрипции LAT половина нейронов, предназначенных для латентного инфицирования, вместо этого вступает в литический цикл и умирает.Напротив, когда репрессия преодолена, нейроны становятся литически инфицированными, и продуцируемый инфекционный вирус распространяется как внутри ганглиев, так и обратно на поверхность слизистой оболочки, где инфекция была инициирована. Целью литического заражения является увеличение количества латентно инфицированных клеток.
Предполагается, что стресс, ведущий к реактивации, увеличивает производство нового VP16 с помощью механизма, который все еще исследуется. Затем продуцируемый VP16 инициирует петлю обратной связи с генами IE и приводит к реактивации вируса в очень ограниченном количестве латентно инфицированных нейронов.
5.3. Роль локальных клеточно-опосредованных иммунных ответов
Т-лимфоциты, особенно CD8 + Т-лимфоциты, оказались критически важными для борьбы с острой инфекцией ВПГ в сенсорных ганглиях. Продукция вирусного антигена в ганглиях тройничного нерва увеличивается до 3 дней после заражения, но уже не обнаруживается через 7 дней после заражения. По мере снижения выработки антигена увеличивается количество различных типов лимфоидных клеток, таких как макрофаги, естественные клетки-киллеры (NK) и определенные CD8 + Т-клетки, окружающие инфицированные нейроны.
Считается, что Т-клетки, особенно CD8 + Т-лимфоциты, подавляют реактивацию после латентного периода. Устойчивость иммунных эффекторных клеток в ганглиях тройничного нерва (TG) означает, что экспрессируются низкие уровни вирусных белков и что возникает иммунный ответ. На модели HSV-1 мыши было продемонстрировано, что репликация вирусной ДНК, транскрипция и продукция вирусного белка имеют место в 1 нейроне на 10 TG. Считается, что эти отдельные нейроны подвергаются «спонтанной молекулярной реактивации» и постоянно окружены манжетами проникающих лейкоцитов.Двумя механизмами, с помощью которых эти инфильтрирующие клетки предотвращают реактивацию, являются продукция гамма-интерферона и цитотоксичность, опосредованная лимфоцитами.
6. Реактивация латентности
Ганглий тройничного нерва считается первичным сайтом латентности для FeHV-1, хотя недавние исследования предполагали другие ткани в качестве потенциальных мест [26, 27].
Самопроизвольная реактивация возможна, но происходит нечасто. Чаще всего реактивация латентного FeHV-1 возникает в результате экологических или физиологических стрессов, таких как изменение условий содержания или период лактации.Сообщается, что частота реактивации составляет 18% в результате переселения кошек в новую среду и 40% в результате лактации [28–30]. Лаг-фаза между стрессором, приводящим к реактивации, и фактическим выделением инфекционного вируса составляет около 4–11 дней, а выведение вируса длится в среднем около 6 дней. Экскреция вируса кошками, у которых произошло событие реактивации, колеблется от 1 до 13 дней [29, 31]. За это время инфекционный вирус может быть обнаружен в секретах глаз и полости носа.Реактивация может быть бессимптомной или связанной с клиническими признаками. Симптоматическая реактивация называется обострением. Реактивация латентной вирусной ДНК у взрослых кошек может привести к изъязвлению роговицы, сопровождающемуся конъюнктивитом различной степени [32]. Поскольку герпетический стромальный кератит, вызванный HSV-1, является основной причиной инфекционной слепоты в промышленно развитых странах, глазная инфекция FeHV-1 у кошек считается очень хорошей естественной моделью хозяина.
Сообщалось, что введение кортикостероидов приводит к реактивации у 70% латентно инфицированных кошек [3].Инфекционный вирус переносится через антероградный аксональный транспорт к периферическим тканям, обычно к клеткам в месте первоначальной инфекции или рядом с ним, и является потенциальным источником передачи вируса [6, 7].
Роль реактивации в эпидемиологии альфа-герпесвирусов напрямую связана с частотой, с которой она происходит. Некоторые вирусы герпеса, в том числе FeHV-1, гораздо легче реактивируются из латентного состояния, чем другие, как в естественных, так и в экспериментальных условиях. Легкость реактивации латентной ДНК FeHV-1 является важным элементом в обосновании заражения кошек FeHV-1 как естественной модели хозяина для изучения молекулярного патогенеза латентного периода вируса герпеса и подходов к его предотвращению.
7. Диагноз
Клинически наблюдается совпадение симптоматики острого FeHV-1 и калицивируса кошек (FCV), другого серьезного респираторного заболевания кошек. Отличительными чертами инфекции FeHV-1 являются высокая температура и изъязвления роговицы. Напротив, язвы языка, неба и глотки более типичны или встречаются чаще при калицивирусных инфекциях.
Наиболее распространенные лабораторные диагностические методы для демонстрации присутствия FeHV-1 или вирусных компонентов в тканевых гомогенатах или мазках включают тест с прямым флуоресцентным антителом (FA), выделение вируса (VI) и ПЦР [3, 5, 18].
Тестирование флуоресцентных антител проводится на ткани конъюнктивы или роговицы. Сейчас этот тест используется гораздо реже, чем раньше. Перед забором образцов следует избегать местного применения флуоресцеина, используемого для визуализации язв.
Лабораторная диагностика острого FeHV-1 в настоящее время чаще всего выполняется путем выделения вируса (VI) или ПЦР с использованием экстрактов мазков из полости носа и конъюнктивы в качестве образцов. VI обнаруживает инфекционный вирус и является золотым стандартом лабораторной диагностики [4, 28].
Было описано использование множественных ПЦР-анализов для обнаружения ДНК FeHV-1. Превосходный анализ ПЦР в реальном времени на основе TaqMan, описанный Vögtlin et al. [33], нацелена на консервативную часть гена gB FeHV-1. Было установлено, что анализ очень специфичен для FeHV-1, а его предел обнаружения составляет от 0,6 до 6TCID 50 . Титры инфекционных вирусов и вирусная ДНК коррелировали в широком диапазоне разведений. ПЦР в реальном времени (КПЦР) оценивали на последовательно собранных экстрактах глазной жидкости.На ранней стадии заражения, называемой фазой 1, корреляция между титрами вируса и сигналами КПЦР была очень высокой. Затем, во время так называемой фазы 2, наблюдалось быстрое снижение титров инфекционных вирусов, в то время как сигналы количественной ПЦР оставались высокими. Во время последней фазы, называемой фазой 3, инфекционный вирус больше не обнаруживался, и количественные сигналы ПЦР также снижались. Анализ комбинированных результатов обнаружения вируса и количественной ПЦР на 20 клинических образцах позволил авторам достоверно определить фазу инфекции, во время которой были взяты образцы.Осознавая стоимость комбинированного тестирования, для достижения этой цели было предложено тестировать последовательные образцы методом qPCR.
Maggs [4] указал на 3 аспекта лабораторной диагностики FeHV-1, которые могут быть очень неприятными для клинициста. В то время как подтверждение острого FeHV-1 не всегда требуется, важно подтвердить, что хронические поражения вызваны FeHV-1. К сожалению, обнаружение FeHV-1 или вирусных компонентов в этих поражениях может быть затруднено. Второй аспект лабораторной диагностики, который приводит к неверным истолкованиям, — это тот факт, что ДНК FEHV-1 или вирусной l можно обнаружить в образцах клинически здоровых кошек.Было указано, что обнаружение FeHV-1 или его компонентов может быть случайным, последовательным или причинным. Очевидно, что важно различать эти возможности.
Титры нейтрализующих вирусов антител определяются с помощью тестов VN, которые обычно используются для выявления предшествующей инфекции или эффективности вакцинации. Антитела, нейтрализующие вирус, могут быть низкими и медленно развиваться. Как указано Dawson et al. [34], низкий уровень нейтрализующих антител не означает отсутствие защиты от клинического заболевания.
8. Лечение и контроль
8.1. Поддерживающее лечение
Рекомендации по ведению болезни, вызванной FeHV-1, были опубликованы Европейским консультативным советом по болезням кошек (ABCD) [18]. Как и в случае многих вирусных инфекций, рекомендуется поддерживающая терапия. Антибиотики широкого спектра действия, которые хорошо проникают в дыхательные пути, следует назначать во всех острых случаях для предотвращения вторичных бактериальных инфекций. Также важно принимать вкусную и ароматную пищу, поскольку у инфицированных кошек анорексия развивается из-за потери обоняния или, что реже, из-за наличия язв в полости рта.У кошек с тяжелыми клиническими признаками требуется восстановление жидкости, электролитов и кислотно-щелочного баланса, предпочтительно внутривенно. Назальные деконгестанты, муколитики и распыление солевым раствором могут улучшить клинические симптомы. Глазные капли или мази при использовании следует вводить несколько раз в день.
8.2. Противовирусная терапия
Противовирусная терапия состоит из местного или системного введения противовирусных препаратов или использования дополнительных методов лечения. Сравнение 8 противовирусных препаратов, вводимых местно, продемонстрировало, что наивысшая эффективность была получена с трифлуридином, исходя из его активности и проникновения через роговицу.На втором месте по эффективности оказался идоксуридин, который имеет более низкую стоимость и менее раздражает [4].
Противовирусные препараты — аналоги нуклеозидов обычно используются для лечения инфекций HSV и VZV. Они превращаются в трифосфаты вирусной тимидинкиназой и другими ферментами хозяина в инфицированных клетках и конкурентно ингибируют вирусную ДНК-полимеразу. Это предотвращает удлинение цепи ДНК [35] и, как следствие, нарушает репликацию вируса.
Использование этих агентов против инфекции FeHV-1 в основном ограничивалось местным введением.Аналоги нуклеозидов первого поколения, включая ацикловир и его пролекарство валацикловир, обладают низкой эффективностью против FeHV-1 in vitro и умеренным эффектом in vivo . Что еще более важно, при системном применении они вызывают у кошек серьезные побочные эффекты, включая миелосупрессию, гепатотоксичность и нефротоксичность на терапевтических уровнях [36, 37].
В соответствии с рекомендациями Европейского консультативного совета по болезням кошек (ABCD), трифлуридин является лучшим препаратом для местного лечения кошек с глазными проявлениями FHV-1.Ацикловир, ганцикловир и идоксуридин также рекомендуются для местного применения. Было отмечено, что, за исключением ацикловира, в литературе отсутствует контролируемое исследование эффективности in vivo для этих агентов [18]. Была продемонстрирована эффективность местного применения цидофовира при первичной глазной инфекции FeHV-1 [38].
Несмотря на то, что исследование не было контролируемым, оральное введение фамцикловира, как сообщается, безопасно и эффективно при лечении глазных признаков, кожных заболеваний и риносинусита, вызванных инфекцией FeHV-1 [39].
Дополнительными видами терапии, которые используются для лечения инфекции FeHV-1, являются L-лизин, лактоферрин и интерфероны. L-лизин является антагонистом аргинина; последний, как было показано, необходим для синтеза белков HSV-1 и FeHV-1 [40]. Таким образом, лечение L-лизином снижает репликацию вируса и, как было показано, оказывает некоторый ингибирующий эффект как в отношении вируса герпеса человека, так и инфекции FeHV-1. Проблема с низкими концентрациями аргинина в рационе — выраженная предрасположенность кошек к дефициту аргинина [40, 42].
Пероральный прием L-лизина снижает тяжесть экспериментально индуцированного конъюнктивита FeHV-1 [42] и выделение глазного вируса, связанное с реактивацией латентной инфекции [40]. Было предложено использовать его на ранних этапах острого заболевания или как средство уменьшения тяжести заболевания и распространения вируса во время стресса [3]. Было продемонстрировано, что L-лизин безопасен при относительно высоких пероральных дозах.
Лактоферрин представляет собой железосвязывающий гликопротеин млекопитающих. Было показано [43], что он ингибирует репликацию FeHV-1 in vitro, потенциально в результате вмешательства в связывание связывания FeHV-1 с его клеточным рецептором и / или проникновения вируса в чувствительные клетки.
Интерфероны — это цитокины, выделяемые лейкоцитами и препятствующие распространению вируса от клетки к клетке. Было показано, что введение интерферона-альфа (IFN- α ) снижает клинические признаки, связанные с острой инфекцией [3].
9. Иммунитет и вакцинация
Первичная инфекция FeHV-1 вызывает как гуморальный, так и клеточный иммунный ответ. Активный иммунитет, вызванный естественной инфекцией FeHV-1 или иммунизацией, защищает кошек от болезни, но не от инфекции.Легкие клинические признаки наблюдались при повторном контакте уже через 150 дней после первичной инфекции [18, 44, 45]. Титры нейтрализующих вирусов антител обычно низкие и в некоторых случаях не обнаруживаются после первичного инфицирования; хотя после дальнейшего воздействия вируса они, как правило, повышаются до более умеренных уровней и после этого остаются достаточно стабильными [3, 46]. Поскольку FeHV-1 нацелен на глаза и верхние дыхательные пути, иммунные ответы слизистых оболочек также играют важную роль [47].
Пассивный иммунитет сохраняется от 2 до 10 недель, в зависимости от концентрации и приема молозива.У некоторых котят с низким уровнем материнских антител, подвергшихся воздействию полевого вируса, может развиться субклиническая инфекция и латентный период [48]. В качестве альтернативы, такие котята также ответят на раннюю вакцинацию. Напротив, у некоторых котят материнские антитела достаточно высоки, чтобы оставаться на мешающем уровне в возрасте 12–14 недель [3, 49].
Рекомендации по вакцинации были предоставлены Европейским консультативным советом по болезням кошек (ABCD) и Консультативным советом по вакцинам для кошек Американской ассоциации практикующих кошек.
Группа ABCD рекомендует начальную схему вакцинации двумя дозами: первая доза вводится в возрасте 9 недель, а вторая — в возрасте 12 недель. Далее следуют ежегодные бустеры [18].
Консультативная группа по вакцинам для кошек Американской ассоциации практикующих врачей-кошек рекомендует вводить дозу первичной иммунизации уже в возрасте 6 недель с дополнительными дозами каждые 3-4 недели до достижения возраста 16 недель. Бустерная доза вводится через 1 год после последней дозы первичной серии.Последующие бустерные дозы вводятся каждые 1–3 года [50].
Все современные коммерческие вакцины против FVR также содержат компоненты калицивируса кошек (FCV) и вируса панлейкопении кошек (FPV) и в совокупности называются вакцинами FVRCP. Защита, индуцированная этими трехвалентными вакцинами, обычно самая низкая против компонента FeHV-1 [51, 52].
И модифицированные живые, и инактивированные вакцины против FVRCP для системного применения доступны в США [50, 53]. Модифицированные живые вакцины (МЖВ) обычно используются, но они обладают остаточной вирулентностью и могут вызывать клинические признаки при неправильном введении [54].Из соображений безопасности инактивированные вакцины в основном предпочтительны для беременных кошек и кошек, инфицированных вирусом лейкемии кошек (FeLV) или вирусом иммунодефицита кошек (FIV) [50].
Помимо вакцин, предназначенных для системной иммунизации, коммерчески доступны интраназальные поливалентные вакцины, содержащие компонент FeHV-1. Испытания в экспериментальных условиях показали, что эта вакцина безопасна и обеспечивает защиту от клинических признаков воздействия полевого вируса в течение недели после вакцинации [53] по сравнению с 2-3 неделями при системном введении вакцины [55].
10. Новые подходы к иммунизации
10.1. Гены вирулентности и вакцины с делеционным мутантом
Как обсуждалось ранее, доступные в настоящее время вакцины не могут полностью защитить кошек от заражения полевым вирусом и, как следствие, от латентного периода полевого вируса [56–60].
Лучшее понимание факторов вирулентности вируса герпеса является предпосылкой для создания безопасных и эффективных вакцин с делеционными мутантами. Гены-кандидаты на удаление — это гены, кодирующие несущественные гликопротеины gC, gE и gG, ген US3, кодирующий протеинкиназу, ген UL 23, кодирующий тимидинкиназу.Комбинация ВАС-клонирования геномов герпесвирусов и внедрение рекомбинирования для быстрого создания мутантов в альфа-герпесвирусах, клонированных как ВАС, были очень полезными инструментами для создания мутантов с вакцинным потенциалом.
Гликопротеин E (gE) является фактором вирулентности FeHV-1. Гликопротеин E (gE) и гликопротеин I (gI) образуют гетеродимер, который участвует в межклеточном распространении вируса и транссинаптическом распространении инфекции по нервной системе хозяина, что является важным компонентом нейровирулентности.gE / gI — несущественные гликопротеины, за исключением MDV [61]. В качестве индикатора in vitro пониженной вирулентности мутанты gE / gI имеют меньший размер бляшек и пониженную способность к распространению от клетки к клетке [62–66]. Функциональный гетеродимер gE / gI, по-видимому, играет еще большую роль в распространении VZV [67–69].
Мы ранее сконструировали мутант с делецией gE / gI с помощью стандартной рекомбинации in vivo и сообщили, что кошки, вакцинированные подкожно высокими дозами рекомбинантного штамма FeHV-1, отвечали только легкими клиническими признаками и развили сильный иммунитет против последующего заражения вирулентным вирусом [ 70].Мы также сравнили интраназальный и подкожный способы введения этого штамма и оценили его способность вызывать защитный иммунитет и предотвращать распространение вируса после заражения. Единственное, что нас беспокоило, это то, что этот мутант обладал некоторой остаточной вирулентностью при интраназальном введении в высоких дозах [54].
Kaashoek et al. [71] сконструировали мутанты BoHV-1 с делецией gE-, TK- и gE-TK и исследовали их вирулентность и иммуногенность у телят. После интраназальной инокуляции мутант TK показал некоторую остаточную вирулентность, тогда как мутанты gE и gE-TK были полностью авирулентными.Телята, инокулированные этими делеционными мутантами, были защищены от клинического заболевания после заражения и выделяли значительно меньше заражающего вируса, чем контрольные телят.
Недавно мутант gE EHV-1 был оценен как вакцина модифицированного живого вируса (MLV). Лишенные молозива жеребята, инокулированные интраназально (IN) или внутримышечно (IM) мутантом gE, не проявляли каких-либо клинических признаков респираторного заболевания, за исключением умеренных выделений из носа у одного из жеребят, инокулированных IN на 1 и 3 дни после заражения.Напротив, у жеребят, которым инокулировали ИН ревертантом, наблюдались двухфазная лихорадка, слизисто-гнойные выделения из носа и опухоль подчелюстных лимфатических узлов. Эффективность мутанта gE против заражения EHV-1 дикого типа оценивали с использованием жеребят, предварительно вакцинированных дважды в / м 10 5 или 10 6 бляшкообразующих единиц (БОЕ) gE-мутанта с интервалом в 3 недели. . У этих жеребят не было признаков респираторного заболевания после иммунизации внутримышечно, и у них развился хороший вирус нейтрализующий ответ антител на EHV-1 после второй дозы.После заражения вирусом EHV-1 дикого типа у вакцинированных жеребят наблюдались более легкие клинические симптомы, чем у жеребят, вакцинированных плацебо, и выделение вируса контрольного заражения было значительно снижено [72].
Ген тимидинкиназы (TK) альфа-герпесвирусов является фактором вирулентности. Сравнение аминокислотных последовательностей белков ТК герпесвируса показало, что эти белки сильно расходятся, разделяя только короткие участки с несовершенной аминокислотной идентичностью. Nunberg et al. [73] впервые идентифицировали ген TK FeHV-1 с помощью ПЦР с сильно вырожденными олигонуклеотидными праймерами.Yokoyama et al. [74] вставили ген, кодирующий капсидный белок калицивируса кошек, в локус TK FHV-1 и обозначили рекомбинантный C730ldfTK-Cap. В пилотном исследовании 2 кошкам вводили интраназально и перорально C730ldfTK-Cap, а одной кошке тем же путем вводили C730ldfTK. Вирус-нейтрализующие (VN) антитела как против FeHV-1, так и против FCV индуцировали с помощью C730ldfTK-Cap, а против FeHV-1 — с помощью C730ldfTK.
Ген US3 FeHV-1 кодирует серин / треониновую протеинкиназу (PK), и его аминокислотная последовательность консервативна в подсемействе Alphaherpesvirinae [75–77].Возможные функции ПК включают блокирование апоптоза, индуцированного как вирусными, так и клеточными белками [78–81], регуляцию ядерного выхода нуклеокапсидов потомства [82, 83] и контроль морфологии инфицированных клеток [84, 85]. Kimman et al. [86] продемонстрировали, что PK-мутант вируса псевдобешенства (PRV) имеет сильно сниженную вирулентность, а у животных, инокулированных мутантом PK-gE-PRV и впоследствии зараженных вирусом дикого типа, снижается выделение вируса.
Гомологи гликопротеина C (gC) были тщательно изучены на нескольких альфа-герпесвирусах.Гомологи gC не являются необходимыми для репликации вируса герпеса in vitro , но они опосредуют несколько важных биологических функций. Прежде всего, gC участвует в начальной стадии прикрепления вируса, взаимодействуя с гепарансульфатом на поверхности клетки, как показано в HSV-1, PRV, BHV-1 и EHV-1 [87–90]. Мутанты с дефицитом gC прикрепляются к клеткам с меньшей эффективностью [90]. Во-вторых, gC HSV-1 и -2 могут связывать компонент комплемента C3b [91, 92]. Связывание этого фактора комплемента может защищать инфицированные вирусом герпеса клетки от лизиса, опосредованного комплементом [93].Вирусы, лишенные комплемент-связывающих доменов, менее вирулентны, чем вирус дикого типа [87, 91, 92]. Было показано, что gC FeHV-1 является доминирующим гепарин-связывающим гликопротеином, который опосредует начальную стадию вирусной адсорбции, как это наблюдается в других герпесвирусах [94]. Однако еще предстоит определить, защищает ли FeHV-1 gC инфицированные вирусом клетки от лизиса, опосредованного комплементом.
Willemse et al. [95] сначала определили частичную последовательность gC. Они также обнаружили, что соседний ген UL45 может котранскрибироваться с gC.Полная последовательность gC FeHV-1 была позже определена Maeda et al. [96]. Основываясь на аминокислотной последовательности, выведенной из нуклеотидной последовательности, они предсказали, что gC является мембранным гликопротеином, содержащим характерную N-концевую гидрофобную сигнальную последовательность, девять потенциальных сайтов N-связанного гликозилирования и C-концевые трансмембранные и цитоплазматические домены. Maeda et al. [97] далее продемонстрировали, что gC является основным гепарин-связывающим гликопротеином, участвующим в начальной стадии адсорбции вируса клетками, как это наблюдается в gC других герпесвирусов.Кроме того, они обнаружили, что gC может агглютинировать эритроциты мыши и что инфекция FeHV-1 ингибируется добавлением растворимого гепарина в культуры клеток.
Гликопротеин gG герпесвирусов взаимодействует с хемокинами, которые участвуют в регуляции движения и функции лейкоцитов, а также в регуляции воспаления и иммунного надзора. Гликопротеин gG альфа-герпесвирусов может существовать в трех различных формах: мембраносвязанный полной длины, мембраносвязанный усеченный или секретируемый.Полноразмерная форма, присутствующая в FeHV-1 и EHV-1, также может существовать в виде усеченной секретируемой формы. Секретируемая форма функционирует как вирусный хемокин-связывающий белок (vCKBP) и теперь классифицируется в подсемействе vCKBP-4 [98].
Van de Walle et al. [99] использовали EHV-1 в качестве модели для первого молекулярного определения остатков в gG EHV-1, участвующих в связывании хемокинов и взаимодействии с клетками-мишенями. В недавнем исследовании Thormann et al. [100] сконструировали рекомбинантные вирусы, чтобы показать, что способность gG EHV-1 взаимодействовать с хемокином не полностью опосредована его хемокин-связывающей областью.
gG FeHV-1 существует в мембраносвязанной и секретируемой формах будки. Секретируемая форма демонстрирует связывание in vitro и для связывания с рядом хемокинов. Связанная с мембраной мембрана проявляет истинные характеристики вирорецептора [101].
Были исследованы характеристики вирулентности gG нескольких альфа-герпесвирусов. Ранее было показано, что делеция gG в PRV не оказывает значительного влияния на вирулентность вируса [102]. Напротив, введение ILTV с удаленным gG птицам, естественным хозяевам этого вируса, показало, что делеция gG приводит к значительному снижению вирулентности.Важно отметить, что вирулентность может быть восстановлена с помощью ревертанта, и делеция gG не влияет на транскрипцию генов, прилегающих к делеции gG. Было показано, что иммунизация мутантом с делецией gG защищает экспериментальных птиц от заражения вирулентным вирусом [103–105].
Вирусы герпеса имеют несколько генов уклонения от иммунитета с различными механизмами уклонения.
UL49.5 — это ген, присутствующий в геноме нескольких представителей рода varicellovirus , таких как EHV-1, BoHV-1 и PRV.UL49.5 подавляет переносчик, связанный с процессингом антигена (TAP), и подавляет экспрессию на клеточной поверхности молекул класса I главного комплекса гистосовместимости (MHC) [106].
Было показано, что нуль-мутант BoHV-1 UL49.5 больше не обладает свойствами подавления TAP и подавления MHC-I, как у родительского вируса [107]. В последующем исследовании сравнивали патогенность и иммунные ответы у телят, инфицированных нулевым мутантом по UL49.5 BoHV-1, и родительским штаммом дикого типа. Оба штамма одинаково реплицировались в носовом эпителии, и обе группы имели одинаковые клинические показатели.Антиген-специфическая пролиферация CD8 + Т-клеток BoHV-1, а также цитотоксичность CD8 + Т-клеток у телят, инфицированных нулевым мутантом UL49.5 BoHV-1, достигла пика через 7 дней после заражения, на 1 неделю раньше, чем у телят, инфицированных диким типом напряжение. Кроме того, титры вирус-нейтрализующих антител (VN) и мононуклеарных клеток периферической крови (PBMC), продуцирующих IFN-γ, у телят, инфицированных мутантным вирусом UL49.5, также достигли пика на 7 и 14 дней соответственно. Это исследование показало, что в то время как иммунный ответ достигает пика раньше, исключая UL49.5 сам по себе недостаточно аттенуировал этот альфа-герпесвирус, чтобы сделать его кандидатом на вакцину [108].
10.2. Создание мутантов путем рекомбинации клонов ВАС
Клонирование и рекомбинирование ВАС — это два современных метода, облегчающих процесс мутагенеза. ВАС представляют собой однокопийные плазмидные векторы на основе F-фактора, которые могут стабильно удерживать 300 т.п.н. или более чужеродной ДНК [109]. Большая емкость и большая стабильность BAC по сравнению с другими векторами позволили клонировать весь геном герпесвируса в единую плазмиду.Эти свойства также сделали ВАС предпочтительным вектором для клонирования геномов герпесвирусов.
Рекомбинирование — это мощный метод быстрого и эффективного управления BAC. Это позволяет модифицировать ДНК, клонированную в E. coli , посредством гомологичной рекомбинации, опосредованной лямбда ( λ ), что устраняет необходимость в рестрикционных ферментах и ДНК-лигазах. Для этого сконструированы специфические бактериальные штаммы, например, E. coli SW105 [110–112].Дефектный профаг λ (mini- λ ) вставлен в геном E. coli и кодирует индуцируемые тепловым шоком гены, которые делают возможной рекомбинирование. Линейная ДНК (продукт ПЦР, олигонуклеотид и т. Д.) С достаточной гомологией на 5′- и 3′-концах с целевой молекулой ДНК, уже присутствующей в бактериях (плазмиде, ВАС или самом бактериальном геноме), может быть подвергнута электропорации в теплоноситель. шокирует и электрокомпетентные клетки бактерий и подвергается гомологичной рекомбинации с молекулой-мишенью.Используя методы рекомбинации, сайт-специфические мутации могут быть введены в любом месте вирусного генома. Все этапы мутагенеза можно строго контролировать и анализировать в E. coli , а управляемый вирусный геном можно стабильно поддерживать в E. coli .
Весь геном FeHV-1 был ранее клонирован как ВАС в нашей лаборатории, из которого была получена полная геномная последовательность FeHV-1 [14]. Клонированный ВАС вирус был охарактеризован in vitro и in vivo .Перед определением характеристик роста in vitro клонированного ВАС вируса кассету ВАС вырезали из генома клонированного вируса. Затем мы провели анализ размера бляшек и построили многоступенчатые кривые роста для FeHV-1ΔBAC и его родительского штамма C-27. Бляшки, продуцируемые штаммом C-27 и вирусом FeHV-1ΔBAC, были морфологически неотличимы друг от друга. Средний диаметр бляшки вируса FeHV-1ΔBAC составлял 101,05% от диаметра родительского штамма С-27 и существенно не отличался.Анализ многоступенчатой кривой роста показал, что они могут вырасти до аналогичного титра.
Для исследования возможного ослабления в результате самого клонирования ВАС был проведен предварительный эксперимент с заражением с использованием четырех кошек, свободных от специфических патогенов (SPF). Двум кошкам интраназально вводили вирус FeHV-1ΔBAC, а двум другим кошкам интраназально вводили либо штамм С-27, либо среду для культивирования клеток. Главный вывод из эксперимента in vivo заключался в том, что вирус, полученный из клона ВАС, ведет себя очень аналогично его родительскому штамму C-27 как in vitro , так и in vivo , что делает его отличной стартовой платформой для введения мутаций, направленных на удаление генов, вызывающих вирулентность, из генома FeHV-1 [14].
11. Вакцинация слизистых оболочек и вакцины на основе эпитопов
Основная цель стратегий иммунизации против альфа-герпесвирусных инфекций — предотвратить первичную инфекцию, которая, в свою очередь, предотвратит первичное заболевание и установит латентный период и последующую латентную реактивацию. Было показано, что латентная реактивация происходит часто, что приводит к выделению вируса, которое в большинстве случаев протекает бессимптомно. Естественная инфекция обеспечивает защиту от повторного заражения первичных участков репликации слизистой оболочки в течение определенного периода времени.Это дает основание для разработки стратегий иммунизации на уровне слизистой оболочки.
Врожденные иммунные ответы развиваются первыми после естественной инфекции. Распознавание компонентов альфа-герпеса толл-подобными рецепторами является важным механизмом индукции этих ответов. HSV и его компоненты связываются с TLR 2, 3, 7 и 9. Синтетические агонисты были разработаны для временной активации врожденного иммунного ответа [113].
В медицине человека большая часть усилий по разработке стратегий иммунизации против герпесвирусных инфекций была сосредоточена на профилактике генитального герпеса.Однако также хорошо известно, что глазная инфекция HSV-1 является ведущей мировой причиной герпетического кератита, который может привести к слепоте роговицы. Как и в случае с FeHV-1, наиболее тяжелые глазные инфекции HSV-1 являются результатом повторяющихся событий реактивации. Ясно, что доставка через слизистую оболочку является лучшим способом создания секреторного иммунитета и цитотоксических Т-клеточных ответов на участках слизистой оболочки.
Долгосрочные усилия по иммунизации против инфекций альфа-герпеса человека включали субъединичные вакцины, модифицированные живые вакцины, вакцины с дефектной репликацией, вирусные векторные вакцины и вакцины с голой ДНК.Несмотря на эти усилия, лицензированных вакцин нет.
Один из современных подходов к иммунизации слизистых оболочек направлен на разработку мультиэпитопной самоадъювантной липопептидной вакцины. Недавний обзор этого подхода, сделанный группой, первопроходящей его, подчеркивает его перспективы, но также и препятствия, которые еще предстоит преодолеть [114]. Они указывают, что, основываясь на недавних испытаниях, индукции нейтрализующих антител недостаточно для защиты. Из этих результатов следует, что индукция соответствующих и адекватных защитных Т-клеточных ответов является важной частью развития защитного иммунитета.Существенными компонентами защитного иммунного ответа могут быть предотвращение первичной инфекции или предотвращение или уменьшение событий реактивации. Из их работы и работы других ясно, что люди, латентно инфицированные ВПГ, часто имеют события реактивации, связанные с выделением вируса. Эта реактивация не связана с клиническими признаками у большинства людей, которых поэтому называют бессимптомными. Напротив, термин «пациенты с симптомами» используется для обозначения тех, у которых частая реактивация связана с клиническими признаками.Важным элементом стратегии является характеристика уникального репертуара Т-клеток у ВПГ-положительных людей, которые не страдают от частой симптоматической реактивации. Было установлено, что набор человеческих Т-клеточных эпитопов gB и gD ВПГ-1 строго распознается Т-клетками бессимптомных индивидуумов, но не Т-клетками симптоматических индивидуумов. Напротив, другой неперекрывающийся набор эпитопов gB и gD распознается лицами с симптомами. Результаты недавней иммунизации бессимптомных HLA-трансгенных кроликов показали, что иммунизация бессимптомными эпитопами CD8 + из gD HSV-1 индуцировала сильные иммунные ответы CD8 + и уменьшала выделение HSV-1, разрывы и поражения роговицы после введения вируса для заражения глаз.
Авторы неоднократно подчеркивают, что необходимо преодолеть следующие пять существующих препятствий: (1) причины неоптимального иммунитета, возникающие в результате естественной инфекции, (2) оптимальные эффекторные механизмы защитного иммунитета против острой и латентной фаз болезни, (3) ) знание иммуноэвазивных стратегий, (4) различие между защитными и патогенными антигенами и (5) разработка соответствующей системы доставки вакцины. Они признают, что вакцины-кандидаты необходимо тестировать на соответствующих животных моделях, если их нельзя напрямую оценить на естественном хозяине.Уже существующая модель кролика с трансгенной HLA человека и разработка аналогичной модели морской свинки являются ключевыми инструментами в этом отношении.
12. In vitro Подходы к молекулярному патогенезу
Инфекция глаз, вызванная FeHV-1, возникает в результате вирусного воздействия на ткань конъюнктивы и роговицы. Поскольку поражения роговицы являются важным проявлением заболевания как в острой фазе, так и в результате реактивации, поиск эффективных методов лечения глазных заболеваний имеет высокий приоритет.Sandmeyer et al. [115] сообщили о разработке первичной системы культивирования клеток роговицы, которая полезна для in vitro патогенеза глазных заболеваний, а также для тестирования потенциальных противовирусных препаратов [116]. Используя эту систему, они показали, что IFN- α не токсичен для глазных клеток и
Методы диагностики коронавируса кошек: обзор
Коронавирусы кошек (FCoV) обнаружены во всем мире. Инфекция FCoV может приводить к появлению разнообразных признаков — от клинически неявных инфекций до смертельного заболевания, называемого инфекционным перитонитом кошек (FIP).FIP — одно из самых серьезных вирусных заболеваний кошек. Несмотря на то, что не существует ни эффективной вакцины, ни лечебного средства от FIP, протокол диагностики FCoV значительно поможет в управлении и контроле над вирусом. Клинические данные при FIP неспецифичны и не помогают при дифференциальной диагностике. Гематологические и биохимические отклонения в случаях FIP также неспецифичны. Доступные в настоящее время серологические тесты имеют низкую специфичность и чувствительность для выявления активной инфекции и перекрестной реакции со штаммами FCoV низкой патогенности, кишечными коронавирусами кошек (FECV).Полимеразная цепная реакция с обратной транскриптазой (ОТ-ПЦР) была использована для обнаружения FCoV, она быстрая и чувствительная, но результаты необходимо интерпретировать в контексте клинических данных. В настоящее время окончательный диагноз FIP может быть установлен только при гистопатологическом исследовании биоптатов. В этой статье описываются и сравниваются методы диагностики FCoVs, а также кратко описаны биология, эпидемиология и патогенез вируса.1. Введение
Коронавирусы кошек (FCoV) представляют собой оболочечные вирусы с большим, закрытым геномом полиаденилированной РНК, состоящим примерно из 29 190 нуклеотидов.FCoV — это коронавирусы группы 1, недавно обозначенные как члены подгруппы 1a в семействе Coronaviridae . К другим членам этой подгруппы относятся вирус трансмиссивного гастроэнтерита (TGEV), коронавирус собак (CCV), коронавирус енотовидных собак (RDCoV) и коронавирус китайского хорька-барсука (CFBCoV) [1].
Порядок генов, кодирующих вирусную полимеразу (Pol) и четыре структурных белка (белки шипа, оболочки, мембраны и нуклеокапсида): 5′-Pol-S-E-M-N-3 ‘.Эти гены присутствуют во всех коронавирусах. Геном коронавируса кошек также включает дополнительные гены (3a, 3b, 3c, 7a и 7b), которые кодируют неструктурные белки. Функции этих генных продуктов до конца не изучены [2].
Известны два биологических типа FCoV: вирус инфекционного перитонита кошек (FIPV) и кишечный коронавирус кошек (FECV). Согласно широко принятой теории « in vivo мутация », FIPV возникает в результате мутации родительского FECV в желудочно-кишечном тракте инфицированной кошки, распространяется системно и вызывает FIP [3–5].Сайты мутаций до конца не изучены, но некоторые вспомогательные гены (3c и 7b) являются кандидатами на место критических мутаций, ответственных за FIP [6, 7]. Альтернативной гипотезой является теория «циркулирующего вирулентного / авирулентного», которая предполагает, что как вирулентные, так и авирулентные штаммы циркулируют в популяциях кошек, и что у восприимчивых индивидуумов, подвергшихся воздействию вирулентных штаммов, развивается болезнь. Эта гипотеза была предложена после анализа последовательности четырех генов (Pol, S, M и 7b) от инфицированных FCoV здоровых кошек и кошек с FIP.Филогенетический анализ показал, что последовательности генов M и 7b в вирусах, полученных от здоровых кошек, отличаются от последовательностей, полученных от больных кошек, и предполагают сосуществование обоих биотипов у кошек [8]. Однако, поскольку эти вирусы легко подвергаются мутации [7], а генетические различия в гене 7b не коррелировали с патогенностью в другом исследовании [9], эпидемиология FIPV еще предстоит выяснить.
Независимо от источника FIPV и неопределенности относительно значимости генетических различий, взаимосвязь между вирулентностью и тропизмом макрофагов / моноцитов была твердо установлена [7].Хотя и FIPV, и FECV могут вызывать виремию [10–12], только FIPV реплицируется в макрофагах и вызывает заболевание [5, 13]. Сложные иммунные реакции между вирусом, противовирусными антителами и комплементом вызывают диссеминированный васкулит, который является отличительной чертой FIP [14, 15].
На основании их антигенного родства с собачьим коронавирусом, анализа последовательности гена S и характеристик роста in vitro штаммы FCoV можно разделить на серотипы I и II. Штаммы FCoV серотипа I полностью относятся к кошачьим.Их сложно выращивать в культуре клеток, они вызывают медленно развивающийся цитопатический эффект. Штаммы FCoV серотипа II, по-видимому, возникли в результате рекомбинации между FCoV серотипа I и CCV. Они растут быстрее, чем вирусы серотипа I, и вызывают литический цитопатический эффект. Штаммы FIPV и FECV могут быть серотипом I или II [6, 16–18].
Инфекция FCoV чрезвычайно распространена в популяциях кошек. Антитела против FCoV обнаруживаются у 20–60% домашних кошек и до 100% кошек в питомниках или домах с несколькими кошками [14, 19–24].FCoV очень заразны и распространяются преимущественно фекально-оральным путем. Около 75–100% кошек в среде с несколькими кошками выделяют вирус [14, 25, 26].
2. Диагностика FCoV
Инфекции FECV обычно связаны в лучшем случае с легкой формой заболевания. Многие случаи остаются бессимптомными, и у маленьких котят обычно единственным признаком является легкая преходящая диарея продолжительностью несколько дней. Рвота возникает в меньшем количестве случаев и обычно не является заметным признаком. Инфекция FECV редко вызывает заболевание достаточной степени тяжести, требующей специфической диагностики основного этиологического агента.Вирус может быть обнаружен в фекалиях инфицированных котят с помощью электронно-микроскопического исследования или анализа полимеразной цепной реакции с обратной транскриптазой (ОТ-ПЦР). Однако многие здоровые кошки и котята также выделяют FCoV с фекалиями. Таким образом, кроме выявления носителей или демонстрации наличия FCoV-инфекции в колонии кошек, такие исследования имеют ограниченную ценность [15, 27].
Варианты FIPV FCoV вызывают летальный перитонит. У кошек со слабым клеточно-опосредованным иммунным ответом развивается эффузивная или «влажная» форма заболевания, которая представляет собой иммунный комплексный васкулит, вызывающий утечку богатой белком жидкости из кровеносных сосудов в брюшную полость, что приводит к вздутию живота.У кошек с частичным клеточным иммунитетом развивается неэфузивная или «сухая» форма с пиогранулематозными или гранулематозными поражениями во многих тканях. Сухой FIP может стать эффузивным на терминальных стадиях заболевания, когда иммунная система разрушается [28, 29].
Антагонистическая диагностика FIP сложна и утомительна. Трудности в окончательной диагностике FIP возникают из-за отсутствия специфических клинических признаков, отсутствия патогномоничных биохимических отклонений, а также низкой чувствительности и специфичности тестов, обычно используемых на практике.Диагностика FIP основана на анализе анамнеза, гематологии и других вспомогательных диагностических тестов, включая серологию и результаты визуализации, биопсии тканей и ПЦР [8, 15]. Типичный анамнез случаев FIP включает приобретение кошки из питомника и повышение и понижение температуры, не улучшающуюся при антимикробной терапии. Чаще всего заражаются котята в возрасте от 6 до 8 недель, когда ослабевают материнские антитела, в основном при контакте с фекалиями их матерей или других кошек, выделяющих FCoV [27].
ФИП — заболевание с чрезвычайно разнообразными клиническими проявлениями. При «влажной» форме наиболее характерным признаком является значительное количество внутриполостного выпота (рис. 1). Типичными поражениями эффузивного FIP являются пиогранулема и фибринозные бляшки на серозных поверхностях органов брюшной полости (рис. 2 и 3). Часто наблюдаются одышка, умеренная гипертермия и приглушенные тоны сердца . Поражение глаз при FIP может включать увеит, кератические осадки и изменения окраски радужной оболочки.При невыпухающей форме поражения обычно возникают в глазах и ЦНС, но гранулемы также могут быть обнаружены в брюшной полости, что приводит к более разнообразным и часто более расплывчатым клиническим признакам [15, 29] (Рисунок 4).
Рентгенограммы могут выявить плевральный, перикардиальный или перитонеальный выпот, а также гепатомегалию или реномегалию. У некоторых кошек брыжеечная лимфаденопатия может приводить к образованию опухолей в брюшной полости. Ультрасонография может использоваться для подтверждения наличия абдоминальной жидкости у кошек с минимальным объемом жидкости и для оценки поджелудочной железы, печени, лимфатических узлов и почек.Магнитно-резонансная томография (МРТ) может выявить усиление перивентрикулярного контраста, дилатацию желудочков и гидроцефалию у кошек с неврологическим FIP [30, 31].
3. Общие диагностические тесты
Существует ряд лабораторных исследований, которые часто встречаются у кошек с FIP, но ни одно из них не является патогномоничным. Хотя часто утверждается, что лимфопения и нейтрофилия типичны для FIP, это изменение можно интерпретировать как типичную «стресс-лейкограмму», которая встречается при многих тяжелых системных заболеваниях у кошек [32, 33].
Наиболее постоянным лабораторным обнаружением FIP является увеличение общей концентрации сывороточного белка. Это обнаруживается примерно у 50% кошек с эффузивной болезнью и у 70% кошек без эффузивной болезни. Увеличение общего белка вызвано повышением концентрации глобулинов, в основном-глобулинов. Для FIP характерна концентрация-глобулина более 32% [33–36]. Изменения профиля сывороточного протеина приводят к снижению соотношения альбумина и глобулина (A: G). Соотношение A: G меньше 0.5 сильно коррелирует с FIP [37].
Белки острой фазы (АРР) представляют собой большую и разнообразную группу гликопротеинов в сыворотке крови, концентрации которых увеличиваются (или уменьшаются) при определенных воспалительных заболеваниях. Концентрации АРР, таких как кошачий α 1-кислотный гликопротеин (fAGP) и сывороточный амилоид A (SAA), могут быть измерены и облегчить диагностику. Концентрации SAA и fAGP увеличиваются при FIP, но они не специфичны для этого заболевания. В то время как умеренно повышенные уровни белков острой фазы обнаруживаются при нескольких воспалительных состояниях, высокие уровни fAGP (> 1.5 г / л) и SAA в плазме или излияниях могут указывать на FIP и могут быть полезными вспомогательными тестами [38–41].
Взятие образцов из выпотов является важным диагностическим шагом для FIP, поскольку тесты на выпоты имеют гораздо более высокую диагностическую ценность, чем тесты, проводимые на образцах крови. Вытоки обычно прозрачно-желтого цвета и вязкие и могут образовывать нити фибрина. Однако наличие этого типа жидкости в полостях тела само по себе не является диагностическим. Вовлечение перитонеальной и множественной полостей было зарегистрировано в 58% и 11% случаев FIP соответственно [7, 15].
Выпот, наблюдаемый при FIP, классифицируется как модифицированный экссудат транссудата с очень высоким содержанием белка (> 3,5 г / дл) и умеренным содержанием клеток. Выпот FIP можно исследовать с помощью простого и дешевого метода, называемого тестом Ривальта. Добавление небольшой капли выпота в пробирку с дистиллированной водой и капли 8% уксусной кислоты может вызвать выпадение осадка из-за высокого содержания белка. Этот тест, по-видимому, полезен для дифференциации излияний, вызванных FIP, и излияниями, вызванными другими заболеваниями.Однако ложноотрицательные результаты могут быть получены у кошек с бактериальным перитонитом, а ложноположительные — у кошек с лимфомой [37, 38].
Цитологическая оценка выпота у кошек с FIP выявляет макрофаги и нейтрофилы на плотном белковом фоне. Нейтрофилы не являются дегенеративными или могут проявлять умеренные ядерные дегенеративные изменения. Лимфоциты и плазматические клетки также могут быть обнаружены в жидкости.
В исследовании Hartmann et al. [37] иммунофлуоресцентное окрашивание внутриклеточного антигена FCoV в макрофагах в выпотах имело положительную прогностическую ценность 100%, но отрицательную прогностическую ценность не было высоким (57%).Это может быть связано с небольшим количеством макрофагов в мазке или маскировкой антигена за счет конкурентного связывания антител против FCoV в выпоте [15].
Другие лабораторные параметры (например, ферменты печени, билирубин, мочевина и креатинин) могут быть увеличены в разной степени, в зависимости от степени и локализации поражения органа, но они не помогают при постановке этиологического диагноза [15, 27, 38] .
4. Серология
Измерения антител в сыворотке — полезные диагностические инструменты для выявления инфекции FCoV.Однако, поскольку у большого процента здоровых кошек есть антитела против FCoV, тестирование на антитела более полезно для лечения инфекции FCoV (например, создание питомника без FCoV) [15]. Чувствительность и специфичность коммерчески доступного практического тестового набора для обнаружения антител к FCoV (ImmunoComb FCoV Antibody Test Kit, Biogal, Израиль) составляли
, определение инкубационного периода и синонимы инкубационного периода (английский)
«Время задержки» перенаправляет Вот. Информацию о задержке связи см. В разделе «Задержка».Инкубационный период — это время, прошедшее между воздействием патогенного организма, химического вещества или радиации и момента появления первых симптомов и признаков. В случае варианта болезни Крейтцфельдта – Якоба период может составлять от нескольких минут до тридцати лет.
Хотя латентный или латентный период может быть синонимом, иногда проводится различие между инкубационным периодом , периодом между инфекцией и клиническим началом заболевания, и латентным периодом , временем от заражения до заразности.Что короче, зависит от заболевания.
Человек может быть носителем болезни, такой как Streptococcus в горле, без каких-либо симптомов. В зависимости от заболевания человек может быть или не быть заразным в инкубационный период.
Во время латентного клинического периода инфекция носит субклинический характер. Что касается вирусных инфекций, то в латентный период вирус активно реплицируется. [1] Это контрастирует с латентным периодом вируса, формой покоя, при которой вирус не реплицируется.
Клиническая латентность наступает через:
Внешний инкубационный период : В векторе это время между проникновением организма в вектор и временем, когда этот вектор может передавать инфекцию. Например: после попадания в организм комара малярийные паразиты должны развиться внутри комара, прежде чем они заразятся для человека. Время, необходимое для развития у комара (внешний инкубационный период), составляет от 10 до 21 дня, в зависимости от вида паразита и температуры.Если комар не проживет дольше внешнего инкубационного периода, он не сможет передавать малярийных паразитов.
Примеры инкубационных периодов
Инкубационные периоды сильно различаются и обычно выражаются в виде диапазона.


