остеосинтез – Ветеринарные клиники УшиХвост, полный спектр услуг для животных.
20 августа 2019 973
Остеосинтез — от греческого «osteon» — кость и «synthesis» — соединение: хирургическая операция при переломах, при которой фрагменты костей соединяются при помощи специальных металлических имплантов (спиц, пластин, штифтов).
Перелом — это не только повреждение кости, но и окружающих мягких тканей — разрывы, ушибы, контузии; ущемление/разрыв нервов, сосудов; в результате перелома нарушается функция конечности.
Сложный перелом у собаки до операции
Сложный перелом у собаки после операции
Сложный перелом у кошки до операции
Сложный перелом у кошки до операции
Сложный перелом у кошки после операции
Методы лечения переломов:
- Консервативные. Фрагменты кости фиксируются до их полного срастания наложением сверху конечности иммобилизирующих повязок из гипса, шин (от латин.

- Хирургические. При выборе метода лечения нужно принимать во внимание, что основная цель лечение перелома – это восстановление функции, т.е. работы конечности. Что касается заживления самой кости – в большинстве случаев она срастется без какого либо лечения.
Иммобилизация конечности при консервативном лечении:
- из-за длительно периода заживления может привести к неизлечимому повреждению мягких тканей и суставов (атрофия мышц, контрактуры и пр.), укорочению конечности, что приведет к частичной или полной потере функции конечности
- не обеспечивает полную неподвижность кости. Помимо этого вытянутое положение конечности и вес фиксирующего приспособления усиливают нестабильность в области перелома, что приводит к замедлению заживления
- требует существенного ограничение подвижности питомца
- проводится только при закрытых простых переломах, т.
 е. без нарушения целостности мышц и кожи
е. без нарушения целостности мышц и кожи - зачастую выбор в пользу консервативного лечения обусловлен финансовыми причинами и отсутствием опыта проведения операций по остеосинтезу у врача.
Из-за того, что консервативное лечение имеет множество недостатков, от него давно отказались. В ветклинике «УшиХвост-Алабино» применяются только современные методы оперативного лечения переломов. Это позволяет:
- восстановить форму и опорную функцию кости при помощи импланта. Использование максимально щадящей ткани техники операции для предотвращения травмирования мягких тканей во время операции также влияет на время выздоровления
- обеспечить стабильную фиксацию кости
- собаке/кошке двигаться или наступать на конечность, в то время как кость заживает. Собака/кошка начинает пользоваться конечностью в первые сутки после операции.
- проводится при любом типе и сложности переломов (открытый, закрытый; оскольчатый и пр.)
- стоимость операций доступна, часто она существенно ниже, чем затраты на лечение осложнений при консервативном лечении.
 Как правило, более 30% стоимости операции – это стоимость металлических имплантов, которые подбираются под конкретного пациента необходимой формы и размера.
Как правило, более 30% стоимости операции – это стоимость металлических имплантов, которые подбираются под конкретного пациента необходимой формы и размера.
Различают Остеосинтез:
- Интрамедулярный (внутрикостный): для лечения простых переломов длинных трубчатых костей, с установкой внутри кости штифта или спицы.
- Экстрамедулярный (внекостный): к кости с помощью специальных винтов крепиться пластина. Используется при стабилизации большинства переломов различной сложности и локализации.
- Внеочаговый: для лечения простых переломов и вывихов с помощью спиц, проведенных через кость ниже и выше перелома, и с их фиксацией снаружи полимером. Не используется у крупных и гигантских пород собак, т.к. не может обеспечить надежной стабилизации из-за веса собак.
- Комбинированный.
Противопоказания к остеосинтезу:
- Общее тяжелое состояние пациента.
В таком случае сначала проводится стабилизация пациента, затем операция.
- Патологический перелом вследствие онкологического или иного патологического процесса.
Послеоперационное лечение и реабилитация включают в себя:
- Назначение антибиотика
- Обработку швов
- Контрольные осмотры и рентгеновские снимки
- Реабилитация требуется только пациентам с несколькими травмами или пациентам с нарушением работы нервной системы.
Статью подготовил ветеринарный врач Петров Станислав Александрович
Ветклиника «УшиХвост-Алабино»
ПЕРЕЛОМЫ КОСТЕЙ (FRACTURAE OSSIUM)
ПЕРЕЛОМЫ КОСТЕЙ (FRACTURAE OSSIUM)
Переломом называют полное или частичное нарушение целости кости, возникающее под действием какой-либо внешней силы и сопровождающееся большим или меньшим повреждением окружающих мягких тканей (мускулов, сухожилий, фасций, сосудов и нервов).
Причины. Переломы возникают в результате различных механических воздействий, сила действия которых превосходит эластичность и прочность костей.
В практике наиболее частыми причинами переломов являются: удары копытом, палкой, падение больших тяжестей на животное, травмирование его движущимся транспортом (автомашинами, вагонами и др.), падение животного на твердый пол, огнестрельные ранения и т. п.
К предрасполагающим причинам относят заболевания, при которых понижается устойчивость костей к механическим воздействиям (остеомаляция, рахит, туберкулез, фиброзный остит, остеомиелит, опухоли костей и др.). Переломы костей при этих заболеваниях могут возникать при самой незначительной травме, которую иногда даже невозможно установить.
Классификация переломов. Существует несколько классификаций переломов.
1. По происхождению переломы делят на врожденные и приобретенные.
Врожденные, или внутриутробные, переломы возникают во время развития плода в матке или при извлечении его во время родов.
Приобретенные переломы разделяют на травматические, при которых происходит нарушение целости здоровой кости под воздействием сильной травмы, и патологические, возникающие при заболеваниях костей.
2. По характеру повреждения тканей различают переломы открытые и закрытые.
Открытые переломы сопровождаются нарушением целости кожи или слизистой оболочки; они обычно осложняются развитием инфекции.
Закрытие переломы не имеют повреждений со стороны наружного покрова, поэтому заживление их происходит в асептических условиях.
3. По анатомической локализации переломы делят на эпифиз а р н ы е (суставного конца кости), м е т а ф и з а р и ы е (околосуставные) п дна ф и з а р н ы е (в области тела кости — диафиза). Разъединение кости по линии эпифизарного хряща (у молодых животных и при рахите) называют эпифизиол и з о м.
В зависимости от числа переломов их делят на о д и н о ч н ы е и множественные. При множественных переломах повреждается несколько костей или одна кость в нескольких местах.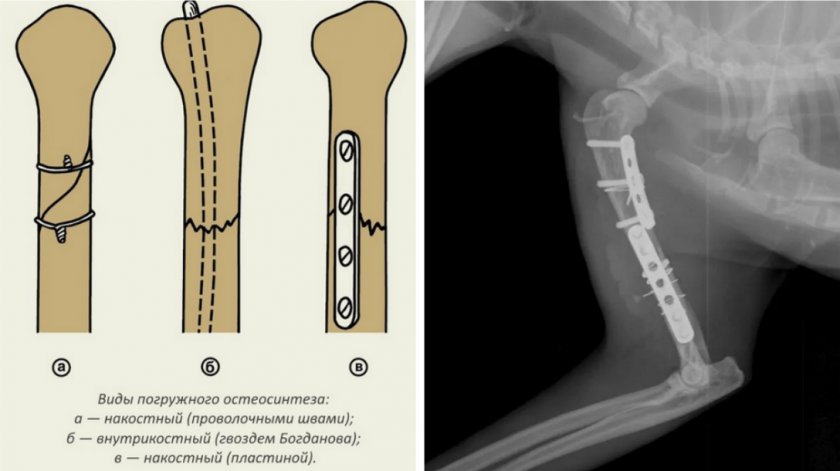
4. По степени и характеру повреждения кости переломы делят на неполные и полные.
Неполные переломы характеризуются частичным повреждением целости кости. К ним относят трещины, поднадкостничные переломы, краевые переломы (отломы), надломы и дырчатые переломы.
Рис. 132. Виды неполных переломов:
Под надкостничные переломы (рис. 132, 5) характеризуются тем, что линия перелома проходит через весь диаметр кости, за исключением надкостницы, которая остается неповрежденной.
Краевые переломы (рис. 132, 2), когда происходит отлом и отъединение участка кости, например края лопатки, остистого или поперечного отростка и т. п.
Надломы (рис. 132, 4) представляют собой нарушение целости кортикального слоя и надкостницы на выпуклой стороне изгиба кости.
Дырчатые переломы (рис. 132, 3) наблюдаются при огнестрельных ранениях лопатки, черепа, таза и реже в области эпифиза трубчатых костей. Дефект при этих переломах имеет вид отверстия, располагающегося в центральном участке кости.
Полные переломы характеризуются разъединением кости во всю ее толщину и более или менее выраженным смещением отломков.
В зависимости от направления плоскости перелома по отношению к оси кости различают следующие виды полных переломов.
Поперечные — линия перелома располагается перпендикулярно к длинной оси кости (рис. 133, /). Они встречаются на трубчатых и коротких костях.
Косые — плоскость перелома проходит под острым углом к длинной оси кости (рис. 133, 2).
Продольные — наблюдаются редко и характеризуются совпадением плоскости перелома с длинной осью кости (рис. 133, 3).
Рис. 133. Виды полных переломов:
Винтообразные, или спиральные, — характеризуются тем, что излом кости располагается по спирально изогнутой линии, напоминая виток нарезки винта (рис. 133, 4).
133, 4).
Оскольчатые — характеризуются наличием одного-двух промежуточных костных осколков на месте перелома (рис. 133, 5). Если имеется много промежуточных костных отломков, то такой перелом называют раздробленным (рис. 133, 6). При р а з -м о з ж е и н ы х переломах кость раздробляется на мелкие осколки и последние перемешиваются с размозженными мягкими тканями. Эти переломы чаще наблюдаются при огнестрельных ранениях и раздроблении костей тяжелыми грузами.
Заживление переломов. Весь процесс заживления переломов делят на три основных периода: 1) подготовительный; 2) образование костной мозоли; 3) окончательная перестройка костной мозоли.
Подготовительный пери-о д сопровождается кровоизлиянием, гибелью и рассасыванием травмированных тканей, развитием воспалительного процесса с резко выраженным отеком тканей. Одновременно с очищением зоны перелома от погибших клеток и тканей происходит размножение клеточных элементов (фнбробластов, остеобластов и др.), эмиграция лейкоцитов и формирование новых сосудистых капилляров.
Образование костной мозоли (рис. 134) происходит путем размножения клеток надкостницы, костного мозга, гаверсовых каналов и соединительной ткани, окружающей место перелома. Первоначально формируется первичная костная мозоль, состоящая из остеоидной ткани. В первичной мозоли различают четыре слоя: 1) наружный, или периостальный, разрастающийся со стороны надкостницы; 2) внутренний, или зндостальный, формирующийся из клеток эндоста и костного мозга; 3) промежуточный, или интермедиарный, продуцируемый клеточными элементами гаверсовых каналов; 4) околокостный, или параостальный, развивающийся из мягких тканей, окружающих место перелома.
Рис. 134. Схема образования костной мозоли
Первичная мозоль является мягкой и допускает ограниченную подвижность отломков. В дальнейшем в остеоидной ткани первичной мозоли начинают откладываться соли извести, т. е. происходит процесс окостенения или образования так называемой вторичной костной мозоли. Продолжительность образования костной мозоли различна и зависит от целого ряда условий (характера и локализации перелома, возраста животного, качества лечебной помощи, характера кормления и др.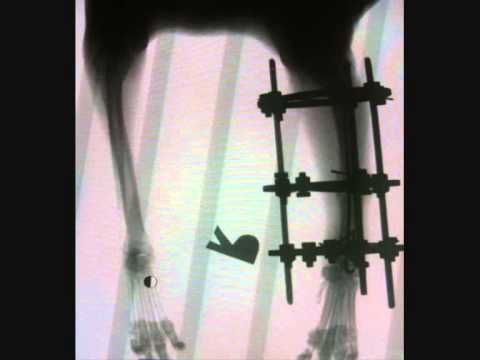 ). В среднем для развития костной мозоли при переломе трубчатых костей требуется от 4 до 6 нед у крупных животных — и от 3 до 4 нед у мелких.
). В среднем для развития костной мозоли при переломе трубчатых костей требуется от 4 до 6 нед у крупных животных — и от 3 до 4 нед у мелких.
Период окончательной перестройки костной мозоли состоит в том, что остеокласты рассасывают избыток костной мозоли и костные осколки. При этом восстанавливаются костный мозговой канал и костные балки, т. е. поврежденный участок кости принимает нормальное Строение. Эта архитектурная перестройка костной мозоли продолжается длительное время, иногда в течение нескольких месяцев и даже лет.
Клинические признаки. Основными признаками перелома являются: боль, нарушение функции поврежденного органа, деформация органа в участке перелома, подвижность кости на ее протяжении и костный хруст (крепитация).
Боль при переломах костей бывает кратковременной. Она возникает в момент перелома, отмечается при активных и пассивных движениях, сопровождающихся смещением отломков. Затем болевые ощущения быстро уменьшаются, а после предоставления животному покоя вовсе исчезают.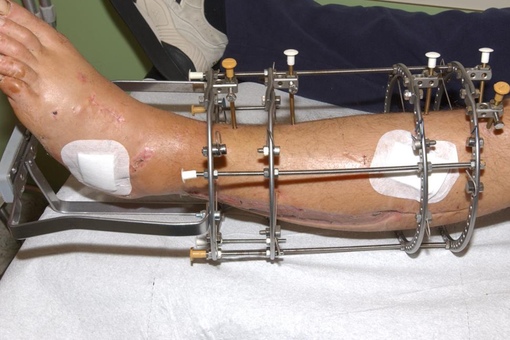
Нарушение функции органа наиболее ярко выражено при полных переломах костей конечностей (хромота) и челюстей (нарушение приема корма). Хромота при переломе костей конечностей обычно наступает внезапно и бывает сильной. Животное не может опираться на больную конечность как во время движения, так и при покое. При неполных переломах (трещинах, дырчатых’ переломах и др.) нарушение функции органа бывает слабым или совсем отсутствует. То же наблюдается иногда при полных переломах ребер и некоторых других костей.
Деформация органа в участке перелома клинически характеризуется изменением контуров, формы и размеров пораженного участка на месте перелома или всего органа в целом. Обычно отмечаются искривление, утолщение и изменение формы области перелома. При смещении отломков кости по длине наблюдают укорочение конечности. Следует иметь в виду, что деформация может быть вызвана не только смещением отломков, но также гематомами и воспалительными отеками.
Подвижность кости на ее протяжении является самым характерным и наиболее достоверным признаком при полных диафизарных переломах трубчатых костей..png) При неполных и вколоченных переломах, а также при переломах позвонков этот признак может отсутствовать. Его устанавливают ощупыванием и осторожными пассивными движениями органа в области предполагаемого перелома.
При неполных и вколоченных переломах, а также при переломах позвонков этот признак может отсутствовать. Его устанавливают ощупыванием и осторожными пассивными движениями органа в области предполагаемого перелома.
Костная крепитация появляется при смещении отломков, она возникает вследствие трения соприкасающихся поверхностей переломленной кости. При большом расхождении отломков и ущемлении между ними мягких тканей (мускулов, фасций и др.) крепитация может отсутствовать.
Диагностика переломов осуществляется клиническими методами и рентгеновским исследованием. Последнее является основным методом распознавания неполных переломов.
Особенности переломов отдельных костей. Переломы костей в области головы, шеи туловища и конечностей клинически проявляются различно.
В области головы. Здесь встречаются переломы носовых, верхнечелюстной, резцовой, лобных и нижнечелюстных костей.
Переломы носовых костей, если нарушается при этом целость слизистой оболочки носа, сопровождаются носовым кровотечением. При переломе верхнечелюстной и резцовой костей возможно кровотечение из ротовой полости, кроме того, появляется подвижность зубов, иногда они смещаются или же выпадают. При двустороннем переломе тела нижней челюсти наблюдаются ее отвисание и невозможность приема корма.
В области шеи. Клинические признаки при переломе шейных позвонков весьма разнообразны. При переломе атланта сгибание и разгибание шеи невозможны. При переломе эпистрофея нарушается подвижность головы вправо и влево. При переломах остальных шейных позвонков наблюдается ограничение подвижности шеи и сильная болевая реакция при поднимании головы или отведении ее в сторону. Голова животного опущена, шея искривлена. Переломы позвонков, сопровождающиеся их смещением и повреждением продолговатого или спинного мозга, заканчиваются общими параличами и смертью животных.
В области т у л о в ища. При полном переломе дужек или тела спинных и поясничных позвонков с повреждением спинного мозга наступает паралич тела, в результате чего животное не может встать, болевая чувствительность при уколах иглой отсутствует. При переломах поперечных и остистых отростков на месте их повреждения обнаруживают болезненную припухлость, при проводке животного отмечаются связанность движений и шаткость зада.
При переломах поперечных и остистых отростков на месте их повреждения обнаруживают болезненную припухлость, при проводке животного отмечаются связанность движений и шаткость зада.
Переломы костей таза могут быть разнообразными (рис. 135). Клинические признаки при этих переломах в каждом отдельном случае зависят от локализации и характера’ перелома. При переломе маклока отмечается асимметрия крупа, на месте перелома появляется болезненная припухлость и иногда прослушивается крепитация. При переломе тела подвздошной кости круп деформирован, маклок опущен, конечность укорочена, при движении наблюдается хромота смешанного типа, пассивные движения сопровождаются крепитацией. При переломах лонной кости наблюдаются хромота опирающейся конечности и ее абдукция, иногда появляется припухание в области паха и нижней стенки живота. При переломе седалищного бугра обнаруживают болезненное припухание на месте перелома, здесь же прослушивается крепитация, при движении животного наблюдается хромота висячей конечности, причем больную конечность животное выносит вперед волоком.
В области конечностей. При переломах длинных трубчатых костей конечности (плечевой, лучевой, бедренной, больше-берцовой, пястных и плюсневых) наблюдают все основные признаки перелома: сильную хромоту опирающейся конечности, деформацию органа в участке перелома, подвижность костных отломков и крепитацию.
Переломы костей пальца могут быть сагиттальными, латеро-медиальными (боковыми) и смешанными (рис. 136). При сагиттальных переломах плоскость перелома проходит в дорсоволярном (плантарном) направлении, при латеромедиальных переломах плоскость перелома проходит с латеральной поверхности на медиальную. При смешанных переломах их плоскость проходит и в сагиттальном и в латеромедиалыюм направлениях. Эти переломы в свою очередь разделяют на крупно- и мелкооскольчатые, или раздробленные.
Рис. 135. Схема переломов костей таза: / Рис. 136. Схемы переломов костей пальца (фаланг) у лошади (по А. Л. Хохлову):
Переломы костей пальца сопровождаются сильной хромотой опирающейся конечности. При переломах путовой и венечной костей пальпацией ощущают крепитацию.
Осложнения при заживлении переломов. При заживлении переломов, особенно открытых, возможно развитие различных осложнений. При переломах, кроме флегмон, гнойных артритов, остеомиелитов, контрактур и других осложнений, свойственных травмам, наблюдается ряд нарушений процесса срастания костей, К последним относятся: гипертрофическая мозоль, замедленное образование мозоли и ложный сустав.
Гипертрофическая мозоль характеризуется большими размерами и часто служит причиной ограниченной подвижности суставов. Такому развитию мозоли способствует продолжительное раздражение тканей инородными телами, нефиксированными отломками костей в участке перелома.
Замедленное образование мозоли может быть обусловлено: 1) обширным разрушением надкостницы и окружающих мягких тканей; 2)’ недостаточным кровоснабжением костных отломков; 3) нарушением трофики тканей при повреждении нервов; 4) плохой иммобилизацией поврежденного органа; 5) развитием инфекция в участке перелома; 6) истощением животного и ослаблением защитных сил его организма па почве интоксикации, инфекционных заболеваний, авитаминозов и т. д.
Ложный сустав образуется при отсутствии сращения отломков костей. Он характеризуется сохранением подвижности кости в месте ее перелома, закругленностью и гладкостью ее концов, закрытием костномозгового канала эндостальной мозолью и развитием на месте перелома соеднннтельнотканои капсулы. Наиболее частыми причинами образования ложного сустава служат залегание между концами отломков костей мускулов или фасций (интерпозиция) и отсутствие иммобилизации перелома.
Прогноз. Полные переломы больших трубчатых костей (бедренной, плечевой, лучевой, болынеберцовой) у крупных животных не излечимы. Животных с такими переломами направляют на бойню. При переломах пястных и плюсневых костей, а также костей пальца прогноз осторожный или неблагоприятный. При решении вопроса о целесообразности лечения переломов указанных костей принимают во внимание характер перелома, возраст животного и его хозяйственную ценность. Прогноз при неполных переломах благоприятный. У мелких животных успешно излечиваются почти все переломы.
Лечение. Основной целью лечения переломов является восстановление анатомического строения и физиологических функций переломленной кости. Это достигается: 1) вправлением отломков кости; 2) иммобилизацией (фиксацией) их до образования мозоли; 3) применением функциональной и стимулирующей терапии. При открытых переломах, кроме того, производят хирургическую’ обработку ран, при которой удаляют все отломки костей, лишенные надкостницы и свободно лежащие в ране, а также закругляют или откусывают щипцами острые края костей, выступающие в просвет раны. Животному назначают антибиотики.
Вправление (репозиция) костных отломков заключается в придании им такого положения, при котором кость могла бы приобрести первоначальную (до перелома) или приближенную к ней форму. Смотря по виду перелома и характеру смещения отломков кости производят вытяжение, сгибание, повороты вокруг оси и другие движения до тех пор, пока не будет установлено правильное положение отломков. В необходимых случаях правильность положения отломков кости проверяют рентгенологическим исследованием. Репозицию костных отломков обычно производят непосредственно перед наложением иммобилизирую-щей повязки. Для успешного вправления отломков кости необходимо расслабить мускулатуру поврежденной области применением наркоза или местного обезболивания.
Фиксация (иммобилизация) костных о с к о л к о в, установленных в правильное положение, осуществляется применением иммобилизирующих повязок или остеосинтеза. Шинные иммобилизирующие повязки используют при оказании первой помощи, при лечении же переломов костей конечности применяют бесподкладочные гипсовые повязки, как наиболее эффективные. У крупных животных повязку при переломах костей снимают через 5—6 нед, у мелких — через 3—4 нед. Преждевременное снятие повязки может повлечь за собой вторичное смещение костных отломков, чрезмерно длительная иммобилизация увеличивает опасность развития тугоподвижности суставов и атрофии мускулов.
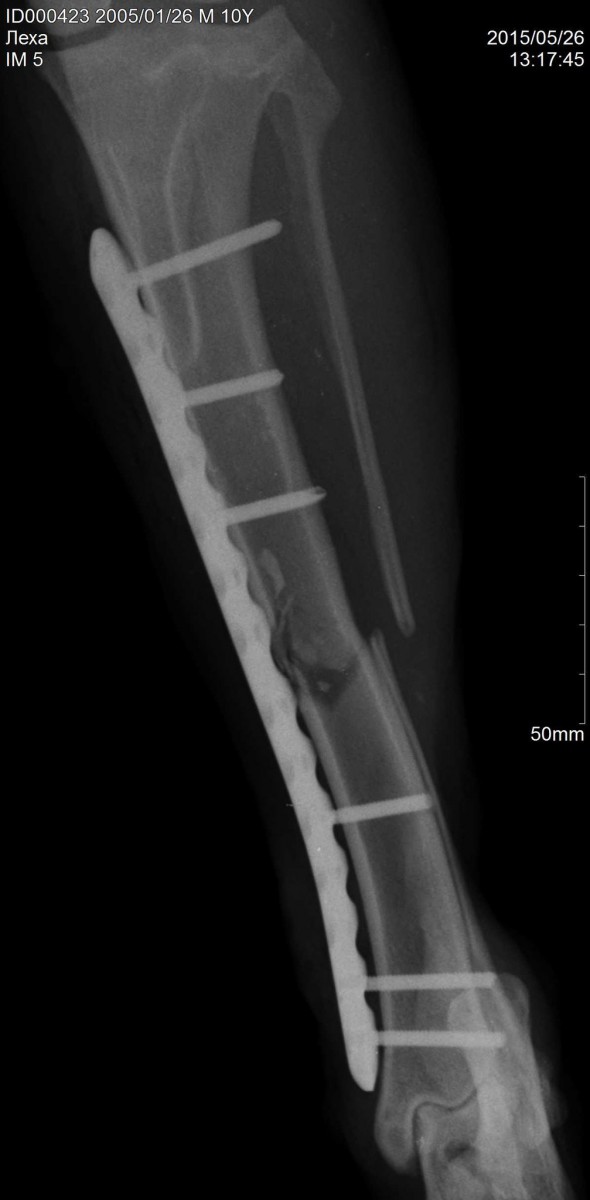
В последние годы для фиксации костных отломков у собак, овец и телят с успехом применяют остеосинтез, при котором в костномозговой канал вводят металлические или костные штифты (рис. 137). После сращения переломов металлические штифты удаляют оперативным путем. Костные штифты постепенно рассасываются, поэтому их не удаляют.
При переломах шейных позвонков стремятся обеспечить неподвижность шеи путем применения специальных фиксаторов, состоящих из ряда продольно расположенных деревянных планок.
При переломах костей таза и лопатки применение иммобилизирующих повязок весьма затруднительно. При лечении этих переломов больным животным предоставляют длительный покой. Имеются сообщения (П. П. Колушов) о сращении закрытых поперечных диафизарных переломов плечевой и бедренной костей у крупного рогатого скота в возрасте до 15 мес без применения иммобилизирующих повязок.
Рис. 137. Фиксация костных отломков (остеосинтез):
Функциональная терапия переломов заключается в проведении пассивных и активных движений конечности, массажа тканей и применении на участок поражения тепловых физиотерапевтических процедур. Пассивные движения конечности (сгибание и разгибание суставов) и массаж тканей выше места наложения гипсовой повязки начинают уже через 5—7 дней после перелома. Проводку назначают через 3—4 нед по 15—20 мин 2—3 раза в день. Активные движения конечности предупреждают атрофию мускулов, улучшают крово- и лимфообращение, ускоряют образование костной мозоли.
После снятия гипсовой повязки применяют парафинолечение, грязелечение, светолечение и электролечение, механотерапию. Эти методы назначают для рассасывания отеков и пролифератов, улучшения движения в суставах и уменьшения болей.
Для ускорения образования костной мозоли создают условия, улучшающие местное и общее кровообращение, нормализующие общий и витаминный обмен, устраняющие боли и повышающие общие защитные силы организма. С этой целью больному животному переливают небольшие дозы крови, вводят антиретикулярную сыворотку Богомольца, назначают ионофорез кальция и фосфора, дают травертин (пористые известняки) в виде подкормки, витаминизированный рыбий жир, в рацион включают корма, богатые белками, витаминами и солями кальция. За больными животными устанавливают постоянное наблюдение и организуют хороший уход за ними.
Профилактика. При организации мероприятий, предотвращающих переломы костей, основное внимание обращают на недопущение механических повреждений, что достигается созданием для животных хороших условий содержания и организацией надлежащего ухода за ними. Для профилактики патологических переломов первостепенное значение имеют своевременное обнаружение заболеваний, на почве которых могут возникнуть переломы (остеомаляция, рахит и т. п.), и назначение соответствующего лечения заболевшему животному.
Контрольные вопросы
1. Что такое периостит, каковы его признаки и лечение?
2. Что такое остит, каковы его причины, признаки и лечение?
3. Что такое остеомиелит, каковы его причины, признаки и лечение?
4. Какие различают виды переломов по их анатомической локализации и степени повреждения кости?
5. Какие различают периоды заживления переломов?
6. В чем состоят особенности переломов костей в области головы, туловища и конечностей?
7. Какие встречаются осложнения при заживлении переломов?
8. Какое рекомендуется лечение при переломах костей?
- Подробности
- 30 Январь 2016
- Раздел: Ветеринарная хирургия, офтальмология и ортопедия
- Просмотров: 6221
Остеосинтез — лечение переломов у животных
Это инновационная методика, которая является более действенной, чем применение лонгет или гипсовых повязок. Она представляет собой специализированный способ хирургического лечения, при котором используется система соединения костной ткани.
Основная цель процедуры заключается в том, чтобы обеспечивать целостность конечностей, ведь при серьезных переломах повреждаются, в том числе и мягкие ткани.
Как правильно понять, что у вашего питомца есть перелом конечности?
Лечение переломов у животных начинается, прежде всего, с определения проблемы. Единственный достоверный способ – это рентгенологическая диагностика. При подозрении на травму питомца необходимо доставить в ближайшую клинику. Там врачи осмотрят животное и назначат прохождение рентгеновской диагностики, на основании которой будет планироваться дальнейшее лечение. При помощи снимка можно определить тяжесть перелома, его тип (открытый, закрытый или осколочный).
Виды остеосинтеза
Медикаментозная процедура градируется в зависимости от физиологического состояния животного, особенностей травмы, наличия дополнительных патологий. В основном бывает погружной и поверхностный остеосинтез. При погружном остеосинтезе фиксаторы располагаются прямо в зоне переломанной конечности. При наружной методике используются ортопедические аппараты, напоминающие внешне аппарат Илизарова. Процедуры, которые применяются при погружном остеосинтезе:
- Накостная фиксация. При ней пластина крепится хирургическим путем на кости;
- Интрамедулярное фиксирование. Ветеринары используют спицы и штифты, которые располагаются прямо внутри кости, обеспечивая ее целостность;
- Внутрикостный или комбинированный метод. Такая комбинация позволяет использовать как пластины на внешней поверхности кости, так и штифты или спицы внутри нее.
Задача ветеринара заключается в том, чтобы обеспечить полную стабильность костной ткани при фиксации обломков кости. Недопустимы даже микродвижения, поэтому важно обеспечить полный покой и неподвижность домашнего питомца. Это позволит костям срастись как можно быстрее без образования мозолей и неровностей.
Уход за животными после проведения процедуры
Врач должен обеспечить полное анатомическое совпадение отломков, стабильную фиксацию костей и суставов, сохранение системы местного кровоснабжения. Основные осложнения – это поломки фиксаторов, остеомиелит, миграция фиксаторов или штифтов при недостаточном закреплении в мягкие ткани, рассасывание кости, артриты, гнойные поражения мягких тканей. Но этого можно избежать, если соблюдать все рекомендации врача и обязательно обращаться за профилактическими осмотрами во время процесса лечения и реабилитации.
Швы после операции следует обрабатывать специальными бактерицидными средствами. Хорошо для этих целей подойдет мазь Вишневского или левомиколь. После каждой обработки следует накладывать свежие марлевые повязки. Надо стараться не допускать вторичного инфицирования раневой поверхности. Обращайте внимание на состояние раны. Если она кровоточит, болезненная, горячая и красная на ощупь, то тогда следует как можно быстрее обратиться к ветеринару.
СОЕДИНЕНИЕ КОСТЕЙ (ОСТЕОСИНТЕЗ)
Остеосинтез — соединение отломков кости кровавым способом. Соединение и удержание костных обломков могут быть достигнуты разными способами с использованием шелка, кетгута, капрона, скрепок, металлических, пластмассовых, древесных и других штифтов, проволоки, пластин, шурупов, болтов, костных трансплантантов и т. д. Показаниями к остеосинтезу служат открытые и закрытые переломы плечевой, лучевой, бедренной и большеберцовой костей, локтевого и пяточного отростков, тела нижней челюсти, ложные суставы, которые трудно поддаются направлению и фиксации в правильном анатомическом положении при консервативном методе лечения. Остеосинтез выполняют при строжайшем соблюдении правил асептики.
При закрытых переломах остеосинтез следует делать не позднее чем через сутки после травмы, так как в более поздние сроки (5—10 дней) делать вытяжение и репозицию отломков труднее, при этом приходится дополнительно травмировать ткани. В случае открытых переломов операцию проводят как можно раньше, до развития клинических признаков инфекции (А. Д. Белов, 1990).
При остеосинтезе обнажают хирургическим путемместо перелома, проводят открытую репозицию отломков и фиксируют их одним из средств в зависимости от локализации и вида перелома. Доступ к костям при остеосинтезе осуществляется со стороны, свободной от крупных сосудов и нервов.
Проволочные лигатуры. Целесообразно накладывать при длинных косых и спиральных переломах. Мягкие ткани иссекают. Иглой Дешана вокруг места перелома проводят несколько лигатур из проволоки (никелевой, латунной и др.). Концы каждой лигатуры скручивают и выводят за пределы кожной раны, которую зашивают. На конечность накладывают гипсовую повязку, которую удаляют вместе с лигатурами после образования костной мозоли (через 6— 8 нед).
Проволочный бандаж. Отломки соединяют поверхностями излома и стягивают проволокой в виде кольца перпендикулярно оси кости (рис. 101).
Штифты из нержавеющей стали. Используют при поперечных и коротких косых переломах трубчатых костей. Металлические стержни вводят внутрь кости — интрамедуллярный остеосинтез или накладывают и фиксируют шурупами металлические пластинки снаружи — экстрамедуллярный остеосинтез (рис. 102).
Интрамедуллярный остеосинтез применяют довольно широко. В свежих случаях при отсутствии клинических признаков инфекции операцию делают через сутки после травмы. К этому времени в поврежденных сосудах устанавливается гемостаз. При повышенной температуре и угнетенном состоянии для подавления инфекции внутримышечно и в экстравазат вводят антибиотики, а после улучшения состояния приступают к операции. Операцию осуществляют как под сочетанным, так и под местным обезболиванием. В области эпифиза кости рассекают мягкие ткани, удаляют свободно лежащие между отломками костные осколки, сгустки крови, размозженные ткани, вводят спиртовой раствор новокаина в костномозговой канал обоих отломков, просверливают в кости канал по продольной оси. Через трепанационные отверстия легкими ударами молоточка в костномозговой канал вводят штифт. Его забивают до тех пор, пока конец его не выйдет за линию излома на 0,5—1 см. Затем концы отломков тщательно сопоставляют друг с другом и, направляя конец штифта в костномозговой канал соседнего отломка, придают последнему правильное положение. Убедившись в восстановлении правильной оси поврежденной кости, продвигают штифт в костномозговой канал периферического отломка (рис. 103, а). Операционные раны закрывают двухэтажным швом, а на конечность накладывают гипсовую повязку. Штифт извлекают под местным обезболиванием у крупного рогатого скота, опец, коз, свиней на 25-30-й день, у собак и кошек-на 35-45-й
Рис. 101. Соединение костей проволокой Рис. 102. Соединение костей при помощи пластин и шурупов Рис. 103. Соединение костей штифтами: а — при переломе бедренной кости; б, в — при переломе шейки головки бедренной кости
Винты. Ими соединяют переломы выступающих участков кости (бугры, отростки). Рассекают мягкие ткани, пробуравливают канал в сопоставляемых обломках, в который ввинчивают винт (рис. 103, б, в). На мягкие ткани накладывают швы. Винты извлекают через 8 нед.
При всех способах остеосинтеза назначают курс антибиотикотерапии.
Склеивание костей. Наряду с описанными способами, сопряженными со вторичным травмированием тканей в процессе наложения шва, существуют бескровные способы соединения тканей без применения шовного материала: соединение краев раны лейкопластырем, склеивание тканей, ультразвуковая сварка костей.
Склеивание мягких тканей. Применяют цианакрилатные клеевые композиции: циакрин, СО-4, СО-9, СО-100, МК-6 и др. В организме цианакрилатный клей подвергается биодеструкции и постепенно замещается соединительной тканью. Циакрин используют для склеивания тканей при гастро-, румено-, абомазо-, энтеро-, цисто-, гастеро-, уретротомии. Однако широкого распространения склеивание тканей не получило.
Противопоказания к применению цианакрилатных клеев — наличие в операционной ране большого количества жировой ткани, множественные нарушения целости крупных кровеносных сосудов, сильное натяжение тканей после операции.
Ультразвуковая сварка костей. Костные обломки склеивают циакрином, а затем подвергают воздействию ультразвука. Костную стружку, смешанную с циакрином, обрабатывают ультразвуком в процессе наплавки кости и заполнения крупных дефектов.
Оперативная хирургия с топографической анатомией животных/Под ред. К. А. Петракова
ЧРЕСКОСТНЫЙ ОСТЕОСИНТЕЗ КОСТЕЙ ПРЕДПЛЕЧЬЯ У МЕЛКИХ ДОМАШНИХ ЖИВОТНЫХ
А.А. ЕМАНОВ, А.Н. ДЬЯЧКОВ
РНЦ «ВТО» им. академика Илизарова, Курган
Частота переломов костей предплечья у мелких домашних животных варьирует от 15 до 25 % от общего количества повреждений длинных трубчатых костей [4, 7].
Для получения положительных анатомо-функциональных результатов при лечении животных методом чрескостного остеосинтеза важнейшим условием является определение безопасных точек введения фиксаторов, основанное на знании анатомо-топографических особенностей строения сегмента, а также подбор оптимальных компоновок аппарата. Однако до настоящего времени не получено объективной картины анатомического и топографического строения области предплечья животных, в частности, при внеочаговой аппаратной фиксации [1 — 3].
Широко применяемый в медицинской практике метод чрескостного остеосинтеза костей предплечья [6] в силу синтопии лучевой и локтевой костей человека, а также особенностей сосудисто-нервных образований и мягкотканных компонентов неприемлем для применения у мелких домашних животных. Предложенные ранее конструкции аппаратов наружной фиксации для других сегментов конечностей у животных не могут быть использованы при остеосинтезе предплечья [5].
Нами разработан и экспериментально апробирован способ проведения спиц и аппарат для чрескостного остеосинтеза костей предплечья у животных при их повреждении. Он включает проведение перекрещивающихся спиц на проксимальном уровне сегмента дистальнее 1,0- 1,5 см от головки лучевой кости: первой — через обе кости с латеральной поверхности под углом 25 — 30° к сагиттальной плоскости, второй — через локтевую кость под углом 5 — 10° к фронтальной плоскости. Концы каждой из них фиксируют на проксимальной фигурной опоре аппарата (рис 1, а). На дистальном уровне на 2 — 2,5 см проксимальнее шиловидного отростка локтевой кости проводят три взаимоперекрещивающиеся спицы: через лучевую кость под углом 10 -15° к фронтальной плоскости; через обе кости предплечья под углом 50 — 55° к первой и через локтевую кость в сагиттальной плоскости (рис. 1, б). Концы каждой из них фиксируют в дистальной кольцевой опоре. На расстоянии не более 2,5 см от линии излома через каждый отломок костей предплечья вводят по одной спице, при этом через лучевую кость — под углом 5 — 10° к фронтальной плоскости, а локтевую — под углом 25 — 30° к той же плоскости. Спицы фиксируются в соответствующих промежуточных опорах (рис. 1, в, г).
Данный способ осуществляют аппаратом для чрескостного остеосинтеза костей предплечья у животных (рис. 2). В качестве фиксаторов используют взаимоперекрещивающиеся спицы, концы которых закрепляют на опорах. Проксимальная из них выполнена в виде фигурной пластины, а три другие — в виде колец. При этом опоры соединены между собой резьбовыми стержнями с возможностью перемещения. Проксимальная опора (фигурная пластина), выполненная в виде 1/2 кольца, имеет ассиметричную форму с удлиненными концами (рис. 3). Наиболее удлиненный конец опоры служит для фиксации спицы, проходящей через обе кости в косо-сагиттальной плоскости (рис. 1, а). В свою очередь, фигурная пластина соединена с одной из промежуточных кольцевых опор тремя резьбовыми стерж-
| а | б | в | г |
Рис. 1. Схемы уровней проведения спиц на предплечье: а — проксимальные эпиметафизы; б — границы верхней и средней третей диафизов; в — греницы средней и нижней третей диафизов; г -дистальные зпиметафизы
Рис. 2. Аппарат для чрескост-ного остеосинтеза костей предплечья у животных
нями, два из которых сквозные и соединены со второй промежуточной кольцевой опорой, что позволяет удерживать спицы, проведенные на данном уровне с перекрестом. Для более жесткой фиксации в зоне перелома промежуточные кольца соединены двумя дополнительными стержнями. До начала операции в двух стандартных проекциях производят рентгенографию предплечья, включая смежные суставы, на основании которой монтируют аппарат. Операционное поле выбривают от пястных костей до середины плечевой кости. Остеосинтез проводят в стерильных условиях под общим наркозом. Животное укладывают на операционном столе на бок со стороны здоровой конечности. Операционное поле обрабатывают 5%-ным спиртовым раствором йода. Предварительно осуществляют ручную репозицию отломков, что позволяет устранить грубое смещение. После этого проводят по одной спице на проксимальном и дистальном уровнях перпендикулярно отломкам костей сегмента. На проксимальном уровне со стороны лучевой шероховатости лучевой кости спицу вводят при полном разгибании локтевого сустава. На дистальном уровне спицу проводят через лучевую кость в положении разгибания запястного сустава. Точка вкола с латеральной поверхности находится рядом с бороздкой лучевого разгибателя запястья. Концы этих спиц фиксируют на соответствующих опорах. Аппарат центрируют относительно оси предплечья и осуществляют дистракцию по стержням для устранения оставшегося смещения по длине. Для окончательной репозиции и усиления жесткости фиксации в зоне перелома вводят перекрещивающиеся спицы через диафизы лучевой и локтевой костей; через отломки лучевой кости — в плоскости, близкой к фронтальной; через отломки локтевой кости — под
Рис. 3. Проксимальная опора аппарата
углом 30 — 35° к первой, с точкой вкола с латеральной стороны, оставляя интактными мышечные образования сегмента. После этого на проксимальном и дистальном отделах проводят перекресты спиц. На проксимальном — через локтевую кость под углом 5 — 10° к фронтальной плоскости. На дистальном уровне вводят две спицы: первую — через обе кости со стороны локтевой под углом 50 — 55° к первой, вкол осуществляют, отступив 1 — 2 мм от сухожилия локтевого разгибателя запястья; вторую — через локтевую кость в сагиттальной плоскости. Затем производят контрольную рентгенографию сегмента, включая смежные суставы, в двух стандартных проекциях.
Данный способ и аппарат для чрескостного остеосинтеза применяли при лечении 20 мелких домашних животных с переломами обеих костей предплечья, а также 12 собак в возрасте 1 — 3 г. Он обеспечивал стабильную фиксацию костных фрагментов при минимальном повреждении мышц сегмента, что подтверждалось отсутствием ограничения функции смежных суставов в период остеосинтеза и полной консолидацией перелома. Ближайшие и отдаленные результаты лечения констатировали полное восстановление анатомо-функционального состояния оперированной конечности через 1 мес после демонтажа аппарата.
ЛИТЕРАТУРА
1. Анатомия домашних животных: практикум по препарированию / Под ред. ГА. Гиммельрейха. — Киев, 1980.
2. Анатомия домашних животных / Под ред. А.И. Акаевского. — М.: Колос, 1968.
3. Анатомия собаки / Под. ред. Б.М. Хромова. — Л.: Наука, 1972.
4. Ерофеев С.А., Перовская Н.В., Еманов А.А. // Материалы Х1 Московского международного ветеринарного конгресса. — М., 2003.
5. Свид. № 14122 РФ, МПК 7 А 61 D 1/00, А 61 В 17/60 Аппарат для лечения повреждений и заболеваний бедренной кости животных /ММ. Щудло, Н.А. Щудло (РФ). — № 99128010/20; Заявл.31.12.99; Опубл. 10.07.2000, Бюл.19.
6. Чрескостный остеосинтез диафизарных переломов костей предплечья /ГА. Илизаров, ГД. Кудзаев. // Метод, рекомендации. — Курган, 1990.
7. Ягников С.А. Использование внеочагового остеосинтеза и компрессионно-дистракционного метода Илизарова при лечении злокачественных опухолей костей у собак: Автореф. дис. … канд. биол. наук. -М., 1998.
журнал «Ветеринария» № 5 2008
Операция остеосинтеза при помощи наружного фиксатора (специальный состав)
Фиксация отломков кости аппаратом внеочаговой фиксации относится к биологическому виду остеосинтеза, который обеспечивает стабильную фиксацию отломков, атравматичность операции с сохранением кровоснабжения фрагментов кости и раннюю функциональную нагрузку.
В наших клиниках операции остеосинтеза проводят после предоперационного обследования животного, куда входит УЗИ, ЭКГ, Общий и Биохимический Анализ Крови, R-исследования, обязательно надо выдержать 8 часовую диету. Перед операцией врач с владельцем составляют документ, об информированном согласии на операцию, после того, как владельцу пояснят все риски от этих мероприятий.
Внеочаговый остеосинтез позволяет:
- Осуществить анатомическую репозицию фрагментов при простых диафизарных и внутрисуставных переломах
- Добиться стабильной фиксации
- Сохранить кровоснабжения костных отломков за счет атравматической техники
- Восстановить раннюю активность мышц и суставов, предупредить развитие болезни переломов
Показания к внеочаговому остеосинтезу. Огнестрельные переломы, оскольчатые клиновидные и сложные переломы, переломы с минимальной величиной отломков, инфицированные переломы, псевдоартроз, реоперации по поводу отсутствия сращения отломков после удаления интрамедуллярного или накостного фиксатора, артродез суставов, комбинированный остеосинтез (одномоментное использование фиксатора с пластинами, интрамедуллярными штифтами, стягивающими шурупами, проволочными серкляжами).
Внеочаговый остеосинтез стержневыми аппаратами. К основным элементам наружных фиксаторов относят:
- вращающиеся зажимы – основные шарниры, используемые для соединения винтов Шанца, спиц Штейнманна или спиц Киршнера со штангой (карбоновым стержнем или титановым стержнем). Зажимы позволяют ввести винты в любой плоскости.
- штанга — трубка из нержавеющей стали и /или карбоновый стержень диаметром от 4 до 11 мм и различной длины, быстро затвердевающие прочные пластмассы (турбокаст), костные цементы.
- Винты Шанца диаметром 2,5;4 мм;
- Спицы Штейнманна диаметром 4 мм;
- Спицы Киршнера 2; 2,5 мм.
1. Односторонняя одноплоскостная фиксация. Метод наиболее часто применяют при переломах плечевой и бедренной костей, вследствие анатомиечекой особенности строения тела у мелких животных, которая не позволяет располагать компоненты аппарата (спицы, винты, штанги) на медиальной поверхности этих костей. Односторонний, одноплоскостной фиксатор (ООФ), может применяться в комбинации с компрессирующими винтами, нейтрализующими или мостовидными пластинами и интрамедуллярными штифтами, с целью дополнительного нивелирования сил (ротационные, сгибающие, смещающие) действующих на фрагменты кости в зоне перелома.
Преимуществами обладает спицестержневой аппарат «гибрид» при фиксации переломов плечевой и большеберцовой костей. Возможна комбинация с проволочными серкляжами или интрамедуллярным остеосинтезом спицей Киршнера.
2. Двухсторонняя одноплоскостная внешняя фиксация. Показания к наложению данного фиксатора: фиксация переломов пястных и плюсневых костей, голени и предплечья, фрагментов после остеотомии и одномоментного исправления вальгусной деформации, артродезирования лучезапястного и скакательного суставов. В проксимальный и дистальный фрагменты кости вводят по 2-3 спицы Киршнера, просверливая кость насквозь, перфорируя мягкие ткани с обеих сторон. Концы спиц с обеих сторон загибают в сторону противоположного фрагмента, параллельно оси кости, на расстоянии 1,0-3,0 см от поверхности кожи. Концы спиц образуют штанги двухстороннего одноплоскостного фиксатора. Спицы, формирующие штангу, стягивают проволочными серкляжами на 3 — 4 уровнях и дополнительно фиксируют быстро затвердевающим пластиком (турбокаст), быстроотвердевающим клеем (Poxipol – холодная сварка) или костным цементом (Palacos, GMW, Osteobond), контролируя репозицию отломков (рисунок 3 г).
Возможна комбинация с проволочными серкляжами (гемисеркляжами), швами, компрессирующим винтом или интрамедуллярным остеосинтезом спицей Киршнера.
3. Внеочаговый остеосинтез аппаратом Г.А. Илизарова. Аппарат Г. А. Илизаров состоит из спиц проведенных перекрестно под углом 90º через кость, двух-четырех колец, к которым крепятся спицы и фиксируются на двух уровнях спицезажимами и стержней соединяющих кольца между собой.
Сроки сращения переломов. Сроки сращения (консолидации) простых и клиновидных переломов 57- 58 дней. Сращение сложных переломов происходило в среднем за 84 дня. Сроки сращения фрагментов кости зависят от степени смещения отломков, их фрагментации и стабильности фиксации перелома.
Среднее время оперативного вмешательства при использовании стержневого аппарата 21 минута, аппарата Илизарова – 72 минуты. Установка комбинированных систем фиксации может потребовать больше времени (интрамедулярный остеосинтез + наружная фиксация, серкляж + наружная фиксация).
Осложнения при использовании аппаратов внеочаговой фиксации
Наиболее типичные осложнения при внеочаговом остеосинтезе: перелом спицы, повреждение сосуда, боль и отсутствие опороспособности на оперированную конечность.
Осложнения не вызывают нарушения репаративного процесса. При переломе стержня или спиц необходимо прибегнуть к повторному оперативному вмешательству, с целью их замены и восстановления стабильной фиксации. Переломы стержней и спиц связаны с неконтролируемой нагрузкой на конечность во время движения животного (уважаемые владельцы животных – будьте внимательны к своим питомцам, не позволяйте им бурно проявлять свою активность – это чревато нарушением металлоконструкций и как следствие к еще одной операции).
При повреждении сосуда спицей и излиянии крови, спицу или стержень необходимо удалить, а кровотечение остановить салфеткой, сдавливая мягкие ткани в месте перфорации кожи в течении 3 –5 минут.
При отсутствии опороспособности на конечность, методом постукивания по проведенным спицам определяют болезненную спицу и удаляют её. Для сохранения стабильности отломков необходимо провести спицу на другом уровне.
Серозно-гнойные выделения на местах входа спиц в мягкие ткани и кость не должны интерпретироваться, как осложнение, а скорее как закономерность, так как движение мягких тканей и кожи вокруг неподвижной спицы неминуемо приведет к данному результату.
ВНИМАНИЕ!!! Аппараты наружной фиксации позволяют животному опираться на сломанную конечность, что ускоряет заживление перелома и качество жизни животного. Однако, они требуют кропотливого ухода. Необходимо защищать аппарат от разлизывания и ежедневно осуществлять обработку мест проведения спиц антисептиками (каф-спрей, чеми-спрей, алю-спрей и др.).
истории медицины | История и факты
Ранняя медицина и фольклор
Неписаную историю нелегко интерпретировать, и, хотя многое можно узнать из изучения рисунков, костных останков и хирургических инструментов первых людей, трудно восстановить их умственные способности. отношение к проблемам болезни и смерти. Кажется вероятным, что, как только они достигли стадии рассуждения, методом проб и ошибок они обнаружили, какие растения можно использовать в пищу, какие из них были ядовитыми, а какие имели некоторую лечебную ценность.Народная медицина или домашняя медицина, состоящая в основном из растительных продуктов или трав, возникла таким образом и существует до сих пор.
Но это еще не все. Сначала люди не считали смерть и болезнь естественными явлениями. Обычные болезни, такие как простуда или запор, считались частью существования, и их лечили с помощью доступных лечебных трав. Однако серьезные и инвалидизирующие заболевания были отнесены к совершенно другой категории. Они были сверхъестественного происхождения.Они могут быть результатом заклинания, наложенного на жертву каким-то врагом, посещения злобным демоном или работой оскорбленного бога, который либо спроецировал какой-то объект — дротик, камень, червя — в тело жертвы. жертва или что-то абстрагировала, обычно душа пациента. Затем применяемое лечение заключалось в том, чтобы заманить заблудшую душу обратно в ее надлежащую среду обитания в теле или извлечь злого вторгшегося, будь то дротик или демон, с помощью контрзаклинаний, заклинаний, зелий, всасывания или других средств.
Одним из любопытных методов избавления болезни от тела было проделывание отверстия в черепе жертвы диаметром от 2,5 до 5 см — практика трепанации или трепанации. Трепанированные черепа доисторических времен были найдены в Великобритании, Франции и других частях Европы и в Перу. Многие из них свидетельствуют об исцелении и, предположительно, о выживании пациента. Эта практика все еще существует среди некоторых племен в некоторых частях Алжира, в Меланезии и, возможно, в других местах, хотя она быстро вымирает.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасМагия и религия играли большую роль в медицине доисторического или раннего человеческого общества. Прием растительного лекарства или лекарства через рот сопровождался заклинаниями, танцами, гримасами и всеми уловками фокусника. Следовательно, первые врачи, или «знахари», были знахарями или колдунами. Использование оберегов и талисманов, все еще распространенных в наше время, имеет древнее происхождение.
Помимо лечения ран и переломов костей, фольклор медицины, вероятно, является самым древним аспектом искусства исцеления, поскольку первобытные врачи проявили свою мудрость, лечив человека целиком, как душу, так и тело. Лечение и лекарства, не оказывающие физического воздействия на организм, тем не менее могли улучшить самочувствие пациента, если и целитель, и пациент верили в их эффективность. Этот так называемый эффект плацебо применим даже в современной клинической медицине.
Древний Ближний Восток и Египет
Создание календаря и изобретение письменности ознаменовали начало письменной истории.Ключов к ранним знаниям немного, они состоят только из глиняных табличек с клинописными знаками и печатями, которые использовали врачи древней Месопотамии. В Лувре во Франции сохранилась каменная колонна, на которой начертан Кодекс Хаммурапи, который был вавилонским королем 18 века до нашей эры. Этот кодекс включает законы, относящиеся к медицинской практике, и штрафы за неисполнение были суровыми. Например: «Если врач, вскрывая абсцесс, убьет пациента, ему отрубают руки»; если же пациент был рабом, врач просто обязан был предоставить другого раба.
Греческий историк Геродот утверждал, что каждый вавилонянин был врачом-любителем, поскольку был обычай класть больных на улице, чтобы любой, проходящий мимо, мог дать совет. Гадание, основанное на исследовании печени принесенного в жертву животного, широко практиковалось для предсказания течения болезни. Мало что известно о вавилонской медицине, и ни одного врача не сохранилось.
Когда исследуется медицина Древнего Египта, картина становится яснее.Первым появившимся врачом стал Имхотеп, главный министр короля Джосера в 3-м тысячелетии до н. Асклепий. Более точные знания приходят из изучения египетских папирусов, особенно папируса Эберса и папируса Эдвина Смита, обнаруженных в XIX веке. Первый — это список лекарств с соответствующими заклинаниями или заклинаниями, а второй — хирургический трактат по лечению ран и других травм.
ImhotepИмхотеп читает свиток папируса, деталь скульптуры
Ägyptisches Museum, Staatliche Museen zu Berlin — Preussischer KulturbesitzВопреки тому, что можно было ожидать, широко распространенная практика бальзамирования мертвого тела не стимулировала изучение человеческого тела. анатомия. Однако при сохранении мумий были выявлены некоторые заболевания, перенесенные в то время, включая артрит, туберкулез костей, подагру, кариес, камни в мочевом пузыре и желчные камни; есть также данные о паразитарном шистосомозе, который до сих пор остается бедствием.Сифилиса и рахита вроде бы не было.
Папирус ЭберсаПапирус Эберса Рецепт для лечения астмы.
Национальная медицинская библиотека США / Национальные институты здравоохраненияПоиск информации по древней медицине естественным образом ведет от египетских папирусов к литературе на иврите. Хотя в Библии мало говорится о медицинской практике древнего Израиля, это кладезь информации о социальной и личной гигиене. Евреи действительно были пионерами в вопросах общественного здравоохранения.
Дуглас Джеймс Гатри Филип Роудсистории медицины | История и факты
Ранняя медицина и фольклор
Неписаную историю нелегко интерпретировать, и, хотя многое можно узнать из изучения рисунков, костных останков и хирургических инструментов первых людей, трудно восстановить их умственные способности. отношение к проблемам болезни и смерти. Кажется вероятным, что, как только они достигли стадии рассуждения, методом проб и ошибок они обнаружили, какие растения можно использовать в пищу, какие из них были ядовитыми, а какие имели некоторую лечебную ценность.Народная медицина или домашняя медицина, состоящая в основном из растительных продуктов или трав, возникла таким образом и существует до сих пор.
Но это еще не все. Сначала люди не считали смерть и болезнь естественными явлениями. Обычные болезни, такие как простуда или запор, считались частью существования, и их лечили с помощью доступных лечебных трав. Однако серьезные и инвалидизирующие заболевания были отнесены к совершенно другой категории. Они были сверхъестественного происхождения.Они могут быть результатом заклинания, наложенного на жертву каким-то врагом, посещения злобным демоном или работой оскорбленного бога, который либо спроецировал какой-то объект — дротик, камень, червя — в тело жертвы. жертва или что-то абстрагировала, обычно душа пациента. Затем применяемое лечение заключалось в том, чтобы заманить заблудшую душу обратно в ее надлежащую среду обитания в теле или извлечь злого вторгшегося, будь то дротик или демон, с помощью контрзаклинаний, заклинаний, зелий, всасывания или других средств.
Одним из любопытных методов избавления болезни от тела было проделывание отверстия в черепе жертвы диаметром от 2,5 до 5 см — практика трепанации или трепанации. Трепанированные черепа доисторических времен были найдены в Великобритании, Франции и других частях Европы и в Перу. Многие из них свидетельствуют об исцелении и, предположительно, о выживании пациента. Эта практика все еще существует среди некоторых племен в некоторых частях Алжира, в Меланезии и, возможно, в других местах, хотя она быстро вымирает.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасМагия и религия играли большую роль в медицине доисторического или раннего человеческого общества. Прием растительного лекарства или лекарства через рот сопровождался заклинаниями, танцами, гримасами и всеми уловками фокусника. Следовательно, первые врачи, или «знахари», были знахарями или колдунами. Использование оберегов и талисманов, все еще распространенных в наше время, имеет древнее происхождение.
Помимо лечения ран и переломов костей, фольклор медицины, вероятно, является самым древним аспектом искусства исцеления, поскольку первобытные врачи проявили свою мудрость, лечив человека целиком, как душу, так и тело. Лечение и лекарства, не оказывающие физического воздействия на организм, тем не менее могли улучшить самочувствие пациента, если и целитель, и пациент верили в их эффективность. Этот так называемый эффект плацебо применим даже в современной клинической медицине.
Древний Ближний Восток и Египет
Создание календаря и изобретение письменности ознаменовали начало письменной истории.Ключов к ранним знаниям немного, они состоят только из глиняных табличек с клинописными знаками и печатями, которые использовали врачи древней Месопотамии. В Лувре во Франции сохранилась каменная колонна, на которой начертан Кодекс Хаммурапи, который был вавилонским королем 18 века до нашей эры. Этот кодекс включает законы, относящиеся к медицинской практике, и штрафы за неисполнение были суровыми. Например: «Если врач, вскрывая абсцесс, убьет пациента, ему отрубают руки»; если же пациент был рабом, врач просто обязан был предоставить другого раба.
Греческий историк Геродот утверждал, что каждый вавилонянин был врачом-любителем, поскольку был обычай класть больных на улице, чтобы любой, проходящий мимо, мог дать совет. Гадание, основанное на исследовании печени принесенного в жертву животного, широко практиковалось для предсказания течения болезни. Мало что известно о вавилонской медицине, и ни одного врача не сохранилось.
Когда исследуется медицина Древнего Египта, картина становится яснее.Первым появившимся врачом стал Имхотеп, главный министр короля Джосера в 3-м тысячелетии до н. Асклепий. Более точные знания приходят из изучения египетских папирусов, особенно папируса Эберса и папируса Эдвина Смита, обнаруженных в XIX веке. Первый — это список лекарств с соответствующими заклинаниями или заклинаниями, а второй — хирургический трактат по лечению ран и других травм.
ImhotepИмхотеп читает свиток папируса, деталь скульптуры
Ägyptisches Museum, Staatliche Museen zu Berlin — Preussischer KulturbesitzВопреки тому, что можно было ожидать, широко распространенная практика бальзамирования мертвого тела не стимулировала изучение человеческого тела. анатомия. Однако при сохранении мумий были выявлены некоторые заболевания, перенесенные в то время, включая артрит, туберкулез костей, подагру, кариес, камни в мочевом пузыре и желчные камни; есть также данные о паразитарном шистосомозе, который до сих пор остается бедствием.Сифилиса и рахита вроде бы не было.
Папирус ЭберсаПапирус Эберса Рецепт для лечения астмы.
Национальная медицинская библиотека США / Национальные институты здравоохраненияПоиск информации по древней медицине естественным образом ведет от египетских папирусов к литературе на иврите. Хотя в Библии мало говорится о медицинской практике древнего Израиля, это кладезь информации о социальной и личной гигиене. Евреи действительно были пионерами в вопросах общественного здравоохранения.
Дуглас Джеймс Гатри Филип Родс7 ветеринаров в области охраны дикой природы и здоровья экосистем | Потребности в кадрах в ветеринарии
Управление здоровьем свободных популяций дикой природы
Ветеринары, чья работа связана со здоровьем свободно обитающих популяций диких животных, включают специалистов по эпидемиологии, патологии, инфекционным заболеваниям, токсикологии, репродуктивной биологии, фармакологии, переселению, анестезиологии, управлению исчезающими видами и их реинтродукции, общественному здравоохранению и клинической медицине.Они часто обладают опытом более чем в одной из вышеперечисленных специальностей и работают в команде со специалистами в других областях. Примеры видов деятельности, в которых они участвуют, включают сохранение дикой природы посредством диагностики причин гибели, меры управления для популяризации здоровых популяций диких животных, восстановление численности исчезающих видов и защиту популяций людей и домашних животных от угроз со стороны инфекционных агентов или токсичных веществ. химические вещества в дикой природе.
Ветеринары дикой природы на уровне штата и на федеральном уровне, а также в университетах обеспечивают руководство и опыт в решении проблемы передачи инфекционных заболеваний на стыке домашних животных и диких животных.Предотвращение распространения болезней между дикими животными и домашними видами может, например, включать вакцинацию диких животных (как в случае с енотовидным бешенством в Соединенных Штатах) или использование альтернативных стратегий, таких как вакцинация домашних животных и животных-компаньонов, размещение животноводческих производств. рационально и сокращая контакт между домашними и дикими животными.
В Соединенных Штатах существует ряд федеральных, государственных, университетских и совместных программ, направленных на борьбу с болезнями диких животных, но не все штаты в них участвуют.Некоторые программы сотрудничают с канадскими организациями (рис. 7-1). 1 , 2
Ветеринары ОВД
Ветеринарные службы, связанные со свободным выгулом диких животных, существуют в нескольких агентствах. На федеральных землях Министерство внутренних дел берет на себя определенную ответственность за охрану здоровья диких животных и контроль. Тем не менее, в 2008 году агентство сообщило, что у него всего 24 ветеринара, более половины из которых входят в Геологическую службу США (USGS), а в 2010 году их число увеличилось до 34 (TMAC, 2011).Только 4 ветеринара были идентифицированы в Службе рыболовства и дикой природы (FWS), и только 4 были наняты Службой национальных парков (NPS) (GAO, 2009).
_____________________________
1 Юго-восточное совместное исследование болезней дикой природы, Университет Джорджии, Афины, предоставляет услуги по диагностике и другим заболеваниям дикой природы агентствам по охране дикой природы в штатах: AL, AR, FL, GA, KS, KY, LA, MD, MS , MO, NC, OH, OK, PA, SC, TN, VA, WV среди его программных мероприятий.
2 Канадским биологам-биологам дикой природы помогает программа Канадского кооперативного центра здоровья диких животных (CCWHC), расположенная в Саскатуне, Саскачеван (Западная / Северная Канада), и действует с момента ее основания в 1992 году. Каждая из канадских провинциальных школ ветеринарной медицины поддерживает компонент программы.
Frontiers | Стволовые клетки в ветеринарии — современное состояние и варианты лечения
Типы стволовых клеток
По определению, стволовые клетки — это недифференцированные клетки, способные к самообновлению и трансформации в различные специализированные клетки (1).По своему источнику они классифицируются как (а) эмбриональные (ESC), (b) взрослые и (c) индуцированные плюрипотентные стволовые клетки (IPSC) (2, 3). Принимая во внимание их фазы развития и дифференцировки, они далее классифицируются как тотипотентные, плюрипотентные или мультипотентные клетки (4).
Тотипотентные стволовые клетки присутствуют только в очень раннем эмбрионе на стадии морулы перед началом гаструляции. Они способны развиваться во все эмбриональные и внеэмбриональные ткани. Последующие деления клеток во время раннего эмбрионального развития приводят к появлению бластоцисты с плюрипотентными ESC, присутствующими во внутренней клеточной массе.ЭСК могут давать начало всем тканевым клеткам в организме, за исключением внеэмбриональных тканей и половых клеток (2, 5). При дальнейшем развитии клеток плюрипотентные ЭСК постепенно теряют свою плюрипотентность и становятся мультипотентными. Мультипотентная стадия характеризуется способностью клеток дифференцироваться на ограниченные типы специфических клеток, часто в зависимости от происхождения их зародышевого листка (6).
О первом выделении человеческих ЭСК было сообщено в 1998 г. (7). Это вызвало многочисленные исследования экспрессии и функции генов во время эмбрионального развития и процессов дифференцировки клеток, а также попытки идентифицировать гены-мишени для новых лекарств, которые могут быть полезны в терапии регенерации тканей.Однако терапевтические возможности широкого спектра человеческих ESC столкнулись с этическими, моральными и культурными дилеммами, потому что их сбор связан с разрушением человеческих эмбрионов. Поэтому необходимо было изучить другие источники стволовых клеток, чтобы продолжить исследования методов лечения на основе стволовых клеток. Одна альтернатива была разработана в 2006 году Такахаши и Яманака, которые перепрограммировали фибробласты взрослых мышей в плюрипотентные стволовые клетки с помощью ретровирусной трансдукции четырех специфических генов: OCT4, c-Myc, SOX2 и KLF4.Эти клетки были названы IPSC и похожи на ESC по своей морфологии, свойствам роста и экспрессии маркерных генов ESC. Хотя открытие IPSC явилось значительным прогрессом в терапии стволовыми клетками, ретровирусные трансдукции могут создавать хромосомные изменения, которые увеличивают риск онкогенеза, поднимая вопросы о безопасности IPSC для регенеративной медицины (3).
Другой альтернативой ЭСК являются стволовые клетки, которые присутствуют во взрослом организме. Костный мозг и пуповинная кровь содержат гемопоэтические стволовые клетки (HSC) и негематопоэтические или мезенхимальные стволовые клетки (MSC), причем последние также находятся во многих других тканях.Эти клетки мультипотентны, потому что они могут дифференцироваться в определенные типы клеток тела. HSC могут дифференцироваться в различные клетки иммунной системы, эритроциты и тромбоциты, а MSC — в клетки костей, хрящей, связок, сухожилий, жира, кожи, мышц и соединительной ткани. МСК активируются эндогенно, когда необходимо заменить мертвые, поврежденные или больные клетки ткани (8). Первое упоминание о взрослых мультипотентных клетках / МСК относится к 1968 году, когда из костного мозга была выделена остеогенная популяция клеток с фибробластоподобной морфологией (9).Ранние исследования показали, что мультипотентные стволовые клетки способны дифференцироваться в остеобласты, хондробласты и адипоциты (10). Это приводит к убеждению, что МСК проявляют свой терапевтический потенциал через дифференцировку в тканевые клетки (11, 12). Однако многочисленные последующие исследования поставили это под сомнение, и сегодня считается, что основной механизм регенеративных способностей МСК проистекает из их иммуномодулирующих механизмов и механизмов восстановления тканей. Предполагается, что периваскулярная локализация МСК в различных тканях играет важную роль, позволяя этим клеткам обнаруживать локальное или отдаленное повреждение ткани и реагировать на него направленной миграцией к месту повреждения и участием в процессе заживления (13).Исходя из этого, Каплан предложил заменить термин «мезенхимальные стволовые клетки» на «лекарственные сигнальные клетки» (MSC) (14).
По сравнению с другими типами стволовых клеток, МСК признаны наиболее перспективным типом стволовых клеток для терапии стволовыми клетками из-за простых процедур, необходимых для их сбора, выделения, высокого выхода клеток после их сбора и отсутствия этических ограничений при использовании. . Чтобы избежать путаницы в области исследования стволовых клеток взрослых, Комитет по мезенхимальным и тканевым стволовым клеткам Международного общества клеточной терапии (ISCT) предложил набор стандартов для определения МСК человека как для лабораторных научных исследований, так и для доклинических исследований. исследования (15).По сути: (1) MSC должны быть прикреплены к пластику при поддержании в стандартных условиях культивирования с использованием колб для тканевых культур, (2) 95% популяции MSC должны экспрессировать CD105, CD73 и CD90 и не иметь экспрессии CD45, CD34, CD14. или CD11b, CD79a или CD19 и HLA класса II, и (3) МСК должны быть способны дифференцироваться в остеобласты, адипоциты и хондробласты в стандартных условиях дифференцировки in vitro .
Источники MSC
Тканевое происхождение MSC
На сегодняшний день МСК были успешно выделены из различных тканей, и в зависимости от источника они обладают разными свойствами, которые следует учитывать при выборе оптимального подхода к терапии стволовыми клетками, направленного на заживление тканей.У собак, лошадей и кошек, наиболее часто встречающихся в ветеринарии пациентов-компаньонов, МСК были выделены из костного мозга (16–23), жировой ткани (16, 17, 19–21, 23, 24), синовиальной оболочки (16), синовиальной жидкости. (17, 21, 25, 26), синовиальная оболочка (26), инфрапателлярная жировая подушечка (16), пуповина (27–29), пуповинная кровь (19, 30, 31), Wharton’s Jelly (19, 31), мышца и надкостница (20, 32), десна и периодонтальная связка (33), периферическая кровь (34–37), эндометрий (38) и плацента (31). У мышей МСК также выделяли из мозга, селезенки, печени, почек, легких, мышц, тимуса и поджелудочной железы (39).В настоящее время наиболее часто используемыми источниками МСК для лечения стволовыми клетками являются костный мозг и жировая ткань, поскольку они предлагают большее количество МСК, чем другие ткани. Среди этих двух жировая ткань является особенно привлекательным источником МСК из-за минимально инвазивной процедуры, необходимой для получения клеток. Хотя МСК, выделенные из костного мозга и жировой ткани, имеют сходное поверхностное иммунофенотипирование и трехлинейную дифференцировку (16, 17, 40), существуют важные различия с точки зрения способности к пролиферации и дифференцировке, а также их секреторных профилей.В некоторых исследованиях было показано, что MSC, полученные из жировой ткани собак (ADMSC), обладают более высоким пролиферативным потенциалом (17, 19, 40, 41), тогда как MSC, полученные из костного мозга (BMMSC), демонстрируют более высокую секреторную продукцию растворимых факторов и экзосом (19, 41). Сообщалось, что ADMSC у собак обладают превосходным хондрогенным (17) и остеогенным потенциалом (19) по сравнению с BMMSC, тогда как у лошадей хондрогенный и остеогенный потенциал, по-видимому, выше у BMMSC (42, 43). BMMSC лошадей также, по-видимому, обладают большей миграционной способностью (21), чем ADMSC.Другим потенциальным источником стволовых клеток с высоким хондрогенным потенциалом могут быть МСК синовиального происхождения, поскольку некоторые исследования показали, что они расширяются быстрее, чем ADMSC у лошадей (21), и обладают большим хондрогенным потенциалом, чем ADMSC и BMMSC у собак (16, 17 ). При выборе жировой ткани в качестве источника МСК также важно анатомическое место забора. Guercio et al. (44) сообщили, что подкожные ADMSC обладают лучшим потенциалом к пролиферации, чем ADMSC, полученные из депо висцерального жира, а Yaneselli et al.(45) сообщили, что подкожные ADMSC остаются мультипотенциальными в культуре клеток в течение более длительного времени и обладают более высоким остеогенным потенциалом. Bahamondes et al. (46) также сообщили, что висцеральная жировая ткань дает большее количество МСК по сравнению с подкожной жировой тканью.
Поскольку различия в свойствах стволовых клеток могут привести к различиям в успехе терапии стволовыми клетками, в будущем их необходимо будет изучить более тщательно. В настоящее время нет никаких доказательств, которые в целом предполагали бы предпочтительный тканевый источник МСК.Это, по крайней мере частично, связано с изменчивостью видов доноров, возраста доноров и состояния здоровья доноров в различных исследованиях. Более того, отсутствие стандартизации для выделения, культивирования и характеристики МСК животных значительно затрудняет сравнение результатов между исследованиями, а разнообразие источников тканей вызывает проблемы при установлении критериев для определения МСК. На сегодняшний день не существует минимально установленных критериев для идентификации МСК у животных, подобных критериям у человека (15).Хотя все МСК животных демонстрируют способность к прилипанию к пластику и дифференцировке, не все экспрессируют ту же самую панель поверхностных антигенов, которая была описана для МСК человека. Большинство нечеловеческих MSC экспрессируют CD29 и CD44. Однако экспрессия CD73, CD90 и CD105 варьируется в зависимости от вида и штамма (47).
Аутологичный и аллогенный MSC
В зависимости от взаимоотношений донор-реципиент стволовые клетки можно классифицировать как аутологичные, аллогенные или ксеногенные стволовые клетки. Аутологичные стволовые клетки собирают и вводят одному и тому же индивидууму, аллогенные стволовые клетки собирают у донора и используют у реципиента одного и того же вида, тогда как ксеногенные стволовые клетки пересаживают между видами (48).При выборе наиболее подходящего типа клеток для конкретной терапии стволовыми клетками выбор между аутологичными и аллогенными источниками может оказаться сложной задачей, и следует учитывать преимущества и недостатки одного варианта по сравнению с другим. Выделение и размножение аутологичных стволовых клеток отнимают много времени и связаны с дорогостоящей процедурой. Более того, на эффективность аутологичных МСК может влиять возраст пациента (44, 49–53) и существующее заболевание (54). Следовательно, возрастает потребность в готовых аллогенных продуктах стволовых клеток, полученных от молодых и здоровых доноров.
Основная проблема терапии аллогенными стволовыми клетками — это возможность того, что поверхностные молекулы MHC I на аллогенных МСК распознаются CD8 + Т-клетками реципиента, что приводит к прямой цитотоксичности чужеродных клеток. Кроме того, молекулы MHC II могут распознаваться CD4 + T-клетками реципиента, что приводит к цитотоксическому или гуморальному иммунному ответу. Молекулы MHC также могут подвергаться косвенному распознаванию антигенпрезентирующими клетками, что приводит к продукции аллоантител в B-клетках (55). Несмотря на многообещающие результаты относительно безопасности аллогенных МСК, в нескольких исследованиях было проведено in vitro, (56, 57) и in vivo, не только на грызунах (58, 59), но также на лошадях (60–62) и собаках (63). , показали иммуногенные ответы, вызванные аллогенными МСК.Это вызвало некоторую обеспокоенность по поводу их предполагаемых иммунопривилегированных характеристик. Joswig et al. (60), Bertoni et al. (64) и Cabon et al. (63) сообщили о местных побочных эффектах при повторном применении аллогенных клеток и предположили, что побочные реакции наиболее вероятны из-за иммунного распознавания клеток реципиентом после повторного воздействия. Однако, когда сравнивали эффекты однократного и многократного применения аллогенных клеток для лечения остеоартрита у лошадей, клинически значимых различий в результатах не наблюдалось (65).
В соответствии с противоречивыми клиническими результатами, касающимися иммуногенности MSC, также сообщалось о противоречивых результатах в отношении экспрессии MHC в зависимости от их состояния, происхождения ткани, пород, индивидуального донора и условий культивирования. Например, Menard et al. (66) показали, что ADMSC обладают повышенной способностью модулировать иммунные клетки и что их фенотипический и транскриптомный профиль согласуется с более низкой иммуногенностью по сравнению с BMMSC.
Несмотря на многие положительные результаты исследований, поощряющих использование аллогенных МСК, несколько исследований подтвердили, что иммуносупрессивные свойства МСК не исключают их иммуногенность.Следовательно, необходимы дальнейшие исследования для определения потенциальных механизмов регуляции экспрессии MHC на MSC и достижения согласия по вопросу иммуногенности MSC. Поэтому аутологичные стволовые клетки остаются наиболее часто используемым источником стволовых клеток в современной ветеринарии.
Терапевтический потенциал MSC
Хотя изначально предполагалось, что стволовые клетки являются источником клеток, которые будут дифференцироваться и заменять поврежденные или больные ткани, стало очевидно, что терапевтические свойства МСК достигаются в основном за счет их иммуномодулирующих функций, которые действуют во взаимодействии с иммунной системой. клетки.Комплексная иммуномодулирующая активность МСК включает их паракринное действие, секрецию внеклеточных везикул (ЭКВ), иммуномодуляцию, опосредованную апоптозом, и митохондриальный перенос мембранных везикул и органелл.
Паракринные эффекты
Все больше данных свидетельствует о том, что первичный механизм действия МСК основан на паракринной передаче сигналов, которая приводит к функциональным изменениям в иммунных клетках, таких как моноциты / макрофаги (67), дендритные клетки (68), Т-клетки (69), B- клетки (70) и естественные клетки-киллеры (71).Сообщалось, что несколько факторов способствуют иммуномодулирующим эффектам МСК. Среди них хорошо зарекомендовавшие себя эффекторы, такие как трансформирующий фактор роста-бета (TGF-β), индоламин-2,3-диоксигеназа (IDO), простагландин E2 (PGE2), интерлейкин 10 (IL-10) и фактор некроза опухоли. (TNF) стимулировал ген-6 (TSG-6).
TGF-β участвует во многих биологических процессах, таких как пролиферация и дифференцировка клеток, эмбриональное развитие, заживление ран и ангиогенез (72). Он влияет на миграцию и возвращение МСК (73, 74), а также на их пролиферацию и дифференцировку.Было показано, что TGF-β вызывает переключение с воспалительного (M1) на противовоспалительное / регуляторное (M2) состояние макрофагов и, таким образом, играет важную роль в индукции регуляторных Т-клеток (Tregs) (75–79). IDO, метаболический фермент, является еще одним растворимым фактором, который секретируется МСК в воспалительной среде (70). IDO катализирует реакции, приводящие к остановке цикла T- и B-клеток (80), ингибированию пролиферации T-клеток и индукции генерации Treg (81), ингибированию B-клеток (80) и NK-клеток (82), и коррелирует со случайной дифференцировкой макрофагов M2 (83).PGE2, основной простагландин, модулирует продукцию хемокинов, подавляет привлечение провоспалительных клеток и усиливает дифференцировку регуляторных клеток (84). Это важный медиатор в ингибировании NK-клеток (82) и играет роль в поляризации макрофагов в направлении фенотипа M2 (85). Кроме того, недавно была продемонстрирована его роль в удалении апоптотических клеток с помощью МСК (86). IL-10 представляет собой противовоспалительный цитокин, который ограничивает ответ Th2 и Th3 и вспомогательные функции макрофагов и дендритных клеток, подавляя при этом рост Т-клеток (87) и управляя производством Treg (88).Секреция IL-10 МСК стимулируется воспалительной средой и контактом с Т-клетками (68, 89). TSG-6 — это белок, связанный с воспалением, с противовоспалительными и защитными свойствами (90). МСК конститутивно экспрессируют TSG-6, что влияет на их морфологию, размер ECV, скорость пролиферации, потенциал дифференцировки, выживаемость и способность колониеобразующих единиц и, следовательно, имеет решающее значение для поддержания стволовости МСК (91). Было показано, что TSG-6 индуцирует переключение с фенотипа M1 на M2 и увеличивает количество Treg, что приводит к облегчению симптомов воспалительных состояний на экспериментальных моделях многих заболеваний (92–95).
Таким образом,МСК способны изменять течение и последствия определенного заболевания за счет паракринного воздействия на иммунный ответ человека.
Секреция внеклеточных везикул (ECV)
Паракринное действие МСК не ограничивается только секрецией растворимых факторов, поскольку МСК обладают способностью переносить различные молекулы через внеклеточные везикулы (ECV). ECVs представляют собой пузырьки, возникающие из плазматической мембраны путем отрастания наружу или внутрь (96).Они являются переносчиками миРНК, мРНК, белков и митохондрий, которые защищены мембраной. Это позволяет ECV перемещаться на большие расстояния внутри тела (97, 98). ECV включают экзосомы, которые представляют собой везикулы эндоцитотического происхождения, покрытые большой плазматической мембраной размером 30–150 нм, микровезикулы, которые представляют собой большие везикулы неэндоцитотического происхождения размером 100–1000 нм, и апоптотические тельца, большие везикулы размером 50–5 мкм, высвобождаемые во время мембран апоптотических клеток (99).
Было показано, чтоМСК секретируют экзосомы и по крайней мере три других типа ECV аналогичного размера (100).
Что касается механизмов действия ECVs, они кажутся сходными с механизмами действия самих MSC. Исследование Hyvarinen et al. (101) продемонстрировали, что ECV усиливают макрофаги M2 так же, как MSC, посредством активации PGE2. Кроме того, результаты недавнего исследования показывают, что ECV подавляют Т-клетки посредством TGF-β и передачи сигналов аденозина (102). Основная роль в увеличении Treg приписывалась TSG-6 из полученных от ADMSC ECV собак, используемых для терапии индуцированного колита у мышей (92). Было также показано, что ECV увеличивают выработку IL-10 при использовании для лечения мышиной модели сепсиса (103).На моделях свиней, мышей и крыс сообщалось, что ЭКВ, полученные из МСК, полезны при заболеваниях органов дыхания (104), почек (105) и печени (106), а также при лечении остеоартрита (107), позвоночника. повреждение спинного мозга (108), ишемия головного мозга (109) и инфаркт миокарда (110). ECV также использовались на собаках и лошадях. Kornicka-Garbowska et al. (111) сообщили об улучшении ангиогенеза и эластичности поврежденного сухожилия у жеребца после лечения микровезикулами, полученными из ADMSC. Сообщалось, что у собак ECV способствуют васкуляризации, синтезу коллагена и заживлению кожных ран с лучшими эффектами, чем их исходные клетки (112).
ECV представляют собой потенциал для использования эффектов MSC бесклеточным способом, при этом основным преимуществом является предотвращение возможных побочных эффектов MSC, таких как иммунный ответ и легочная эмболия, при внутривенном (IV) применении MSC (97, 98). Тем не менее, межклеточный контакт считается важным для некоторых иммуномодулирующих свойств МСК (68, 70, 113). Когда термоинактивированные МСК без секретома, но с неповрежденной целостностью мембраны вводили внутривенно, они действительно модулировали функцию моноцитов таким же образом, как и контрольные клетки, повышая уровни IL-10 и снижая уровни IFN-γ.Результаты этого исследования позволяют предположить, что иммунный ответ после введения МСК не зависит от их активной иммуномодулирующей активности (114), и одного контакта с МСК достаточно для некоторых иммуномодулирующих эффектов.
Однако отсутствие стандартизированных методов выделения и очистки ECV остается основным ограничением в исследованиях ECV. Наиболее часто используемые методы выделения экзосом — это ультрацентрифугирование, ультрафильтрация, фильтрация с тангенциальным потоком, осаждение и эксклюзионная хроматография, а также методы, основанные на иммуноаффинности.Например, ключевые маркеры экзосом связаны с эндоцитозом (115) и включают кавеолины, клатрины, рецепторы трансферрина, тетраспанины (CD81, CD63, CD9), Alix и TSG101 (116). Лиганды и груз различаются между типами ECV, что позволяет предположить, что каждый тип ECV выполняет разные функции. Отсутствие стандартизированных методов выделения экзосом приводит к неспособности отделить экзосомы от других ECV аналогичного размера. Более того, в настоящее время не существует стандартных измерений чистоты ECV.Поэтому несоответствия в описании ECV присутствуют в литературе (116, 117). Рекомендации Международного общества внеклеточных везикул призывают исследователей использовать общий термин «внеклеточные везикулы», а не обозначение определенного подтипа, который следует тщательно определять в случае использования. Кроме того, руководящие принципы предполагают, что процедура выделения и подготовки должна быть подробно описана для возможности репликации. Подтверждение функции ECV требует демонстрации того, что эффект ECV происходит без межклеточного контакта и не достигается с растворимыми, не связанными с ECV секретируемыми факторами (118).
Иммуномодуляция, опосредованная апоптозом
Апоптоз также может играть важную роль в иммуномодулирующем эффекте МСК. Фагоцитарный клиренс умирающих клеток (эффероцитоз) принимает участие не только в разрешении воспаления и восстановлении функции поврежденной ткани, но также в адаптивных и иммунных ответах в воспаленных тканях (119). В исследовании, проведенном Luk et al. (114), термоинактивированные МСК модулируют функцию моноцитов так же, как и контрольные клетки, что приводит к увеличению уровней IL-10 и снижению уровней IFN-γ.Результаты этого исследования предполагают, что иммунный ответ после введения МСК не зависит от их активной иммуномодулирующей активности, а происходит от других клеток и запускается присутствием МСК. Недавние данные также показывают, что клетки врожденной иммунной системы являются определяющими в опосредовании эффекта МСК. В частности, это было продемонстрировано Galleu et al. что МСК подвергаются апоптозу в присутствии цитотоксических клеток, а именно CD56 + NK-клеток и CD8 + Т-клеток, после внутривенной инфузии. Апоптоз МСК, индуцированный цитотоксическими клетками, не зависит от МНС и требует физического контакта между МСК и цитотоксическими клетками.Затем апоптотические МСК фагоцитируют макрофаги, которые в конечном итоге обеспечивают иммуносупрессивную активность, продуцируя IDO (120). Аналогичные результаты были получены Cheung et al. (121), где моноциты, поглощенные апоптотическими МСК, усиливали ингибирование пролиферации Т-клеток за счет продукции PGE2. Следовательно, механизм иммуносупрессии, вызванной апоптозом, может быть прогностическим при клинической терапии, когда пациенты с высокой цитотоксичностью будут более чувствительны к МСК (120, 121). де Витте и др. (122) также показали, что МСК быстро фагоцитируются в легких моноцитами и нейтрофилами после внутривенного введения мышам.Фагоцитоз МСК индуцирует экспрессию регуляторного фенотипа в моноцитах и индуцирует их поляризацию, которая, в свою очередь, модулирует адаптивную иммунную систему, индуцируя T-reg клетки.
Митохондриальный перенос
Митохондриальный перенос был предложен как еще один механизм действия МСК. В дополнение к переносу молекул через ECV, МСК, по-видимому, способны к межклеточному переносу органелл через туннелирующие нанотрубки. В 2006 г. наблюдался первый перенос митохондрий между МСК и соматическими клетками (123).Это исследование показало, что активный перенос митохондрий от взрослых стволовых клеток к соматическим может спасти аэробное дыхание в клетках млекопитающих с нефункциональными митохондриями. В модели пневмонии у мышей BMMSC человека мог передавать свои митохондрии через туннельные нанотрубки к альвеолярным макрофагам, что приводило к усиленному фагоцитозу макрофагов и антимикробному эффекту MSC (124). Перенос митохондрий также был продемонстрирован in vivo от системно вводимого BMMSC на модели мышей с диабетической нефропатией (125).Поскольку перенос митохондрий связан с различными физиологическими и патологическими действиями, перенос митохондрий может быть потенциально полезен для будущего лечения многих патологических состояний.
Самонаведение MSC
Помимо сложных механизмов иммуномодуляции, одним из ключевых преимуществ терапии на основе МСК является их способность удерживать поврежденные ткани дома. Направление МСК тесно связано с химическими факторами, такими как хемокины, цитокины и факторы роста.Одним из основных химических факторов, вовлеченных в миграцию МСК, является производный от стромальных клеток фактор 1 (SDF-1), хемокин, высвобождаемый из поврежденной ткани, посылающий хемо-привлекательные сигналы для клеток, экспрессирующих рецепторы CXCR4 на внешней мембране (126). Однако CXCR4 в неактивированных МСК присутствует только на низких уровнях на поверхности клетки, но на более высоких уровнях внутриклеточно. После активации МСК могут быстро перемещать молекулы CXCR4 на поверхность клетки, что позволяет им следовать за сигналами миграции (127).Помимо CXCR4, на мембранах МСК были идентифицированы другие хемокиновые рецепторы, которые участвуют в миграции МСК, такие как CCR6, CCR9, CXCR3 и CXCR6 (128). Другой химический агент, активизирующийся в поврежденных тканях и при воспалении, — это остеопонтин (OPN). Этот цитокин привлекает МСК к участкам повреждения посредством лигирования с интегрином β1, который экспрессируется на МСК при индукции OPN (129). Среди факторов роста фактор роста фибробластов (130), фактор роста эндотелия сосудов (131), фактор роста гепатоцитов (132), инсулиноподобный фактор роста-1 (133) и TGF-β1 (134), как было показано, влияют на МСК. самонаведение важно.Механические факторы, такие как механическая деформация, напряжение сдвига, жесткость матрицы и микрогравитация, также играют важную роль в самонаведении MSC (135). При лечении стволовыми клетками местная трансплантация MSC является желательным методом введения клеток. Однако в некоторых случаях интрапаренхимальная инъекция МСК может оказаться невозможной из-за потенциальной инвазивности (136). Поэтому предпочтительны системные приложения, из которых внутривенный путь является наименее инвазивным. Самонаведение MSC после применения IV сталкивается с различными препятствиями.Во-первых, системно трансплантированные МСК должны сначала выйти из кровотока, а затем мигрировать к месту повреждения (137). Во-вторых, МСК после внутривенной трансплантации часто секвестрируются, а затем выводятся из легких (122, 138–142). МСК — это относительно крупные клетки, средний размер которых в суспензии составляет 30 мкм. Для сравнения, легочные капилляры в среднем имеют диаметр всего 14 мкм, что приводит к механическому захвату МСК в легких (138). Помимо размера, молекулярные взаимодействия МСК с легочным эндотелием могут быть еще одной причиной их накопления в легких.Wang et al. (143) были первыми, кто показал, что критической причиной захвата МСК легочной тканью является чрезмерная экспрессия и активация интегринов. Их исследование продемонстрировало, что блокада интегринов приводит к значительному снижению захвата МСК в легких у мышей, увеличению уровней циркулирующих МСК в крови и усилению перемещения МСК к тканям-мишеням. Мониторинг МСК после системной инфузии также показал, что МСК недолговечны и часто исчезают через 24 часа после инфузии (122, 139).Таким образом, долгосрочные положительные эффекты МСК каким-то образом противоречат их короткому времени жизни (144). Интересно, что их терапевтический эффект может не коррелировать с жизнеспособностью клеток, как было показано de Witte et al. (122), что, несмотря на накопление клеток в легких и непродолжительную жизнеспособность после внутривенного введения, МСК проявляют долгосрочное действие через апоптоз и фагоцитоз иммунными клетками.
Чтобы избежать проблем с внутривенным введением, были протестированы другие пути введения, такие как внутриартериальное (IA) и внутрибрюшинное (IP) введение.Введение IA может снизить накопление МСК в фильтрующих органах и, таким образом, является многообещающим способом лечения ишемических повреждений стволовыми клетками (98). IA-инъекция МСК может способствовать лучшему распределению клеток. Централизованное введение МСК через ИА через бедренную артерию на модели интактной свиньи показало повышенное поглощение МСК в различных органах, особенно в печени (98). Обратной стороной внутривенного введения является то, что это технически более сложная процедура, чем внутривенная инъекция (145), и существует риск возможной внутрисосудистой окклюзии (145, 146).Sole et al. (145) наблюдали артериальный тромбоз у лошадей, когда внутриартериальное применение аллогенного BMMSC выполнялось через регионарную перфузию конечностей IA. Интересно, что осложнение тромбоза не было обнаружено при выполнении инъекции IA без использования жгута, что указывает на то, что тромбоз является следствием застоя крови, а не применения МСК (147). Точно так же было доказано, что IA инъекция MSC возможна с аллогенным конским BMMSC, вводимым в краниальную большеберцовую артерию у лошадей, также без жгута (148).Nishimura et al. (149) также доказали безопасность и эффективность применения МСК IA путем введения аутологичных BMMSC через печеночную артерию на модели фиброза печени у собак. IP-введение МСК применяется редко, но потенциально может достигать интраабдоминальных участков и относительно безопасно при применении у кошек (150). Было показано, что IP-введение МСК полезно также при лечении ухудшения детрузора мочевого пузыря у крыс (151) и при воспалительном заболевании кишечника у мышей (93).Более того, IP-подход использовался для инъекции нео-островков, агрегатов ADMSC и клеток островков поджелудочной железы в пилотном исследовании под руководством FDA при инсулинозависимом сахарном диабете у домашних собак. Нео-островки, по-видимому, приживаются, повторно дифференцируются, вырабатывают инсулин и не вызывают ауто- или аллоиммунного ответа (152).
Прекондиционирование МСК провоспалительными цитокинами
Поскольку многие пациенты, получающие МСК, страдают острыми или хроническими воспалительными заболеваниями, воспалительная среда, вероятно, будет присутствовать in vivo при введении МСК.Таким образом, праймирование МСК IFN-γ перед лечением имитирует среду, в которой МСК будут присутствовать в организме. Было высказано предположение, что воспалительные состояния усиливают взаимодействие между МСК и В-клетками. Luk et al. (70) показали, что МСК, культивированные в воспалительной среде, значительно снижают пролиферацию В-клеток и продукцию IgG В-клетками за счет индукции активности индоламин-2,3-диоксигеназы (IDO), тогда как МСК, культивируемые в невоспалительных условиях, увеличивают процентное содержание B -regs, но не повлияли на их распространение.Тканевое происхождение также следует учитывать при принятии решения о примировании МСК IFN-γ, поскольку, например, собачьи МСК из желе Wharton не подвержены влиянию IFN-γ (102). В корреляции с предварительным кондиционированием МСК для улучшения их терапевтического потенциала, предварительное кондиционирование ЭКВ также оказалось полезным для их терапевтической эффективности. Недавно сообщалось, что ECV из собачьих МСК, предварительно обработанных противовоспалительными цитокинами, усиливают поляризацию макрофагов и генерацию Treg при колите у мышей (92).Однако в некоторых исследованиях также сообщалось о побочных эффектах прекондиционирования МСК провоспалительными цитокинами. Предварительная обработка IFN-γ увеличивала иммуногенность МСК с усилением экспрессии MHC (71) и MHC II (153–155). Предварительная обработка IFN-γ также значительно усиливает экспрессию генов, участвующих в апоптозе, отражая негативное влияние на МСК (156). Также было показано, что лечение как IFN-γ, так и TNF-α индуцировало апоптоз в мышиных МСК. Апоптоз стимулировался экспрессией индуцибельной синтазы оксида азота (iNOS) и образованием оксида азота, необходимого для апоптоза (157).Чтобы избежать побочных эффектов прекондиционирования IFN-γ с одновременным усилением их иммуносупрессивных способностей, в качестве альтернативы была предложена предварительная обработка МСК IL-17A (156). Исследование Brandt et al. (158) продемонстрировали, что ADMSC лошадей скомпрометированы в воспалительной среде. Высокие концентрации провоспалительных цитокинов ФНО-альфа и IL-1 и присутствие лейкоцитов увеличился потенциал ADMSCs пролиферации и остеогенной дифференцировки, но отрицательно жизнеспособность пораженных клеток, приживление, хондрогенный и Adipogenic дифференциации потенциал, и экспрессию маркеров опорно-двигательного аппарата.Противоречивые результаты различных исследований по прекондиционированию МСК провоспалительными цитокинами, таким образом, предполагают, что, хотя существует потенциальный положительный эффект такой предварительной обработки, ее следует рассматривать очень внимательно, и потребуются дальнейшие исследования для выяснения потенциальных положительных эффектов такой предварительной обработки.
Клиническое применение MSC в ветеринарии
На сегодняшний день стволовые клетки используются, в основном экспериментально, для лечения различных заболеваний у разных видов животных.Первоначальное внимание регенеративной ветеринарии было направлено на ортопедические заболевания, но сейчас акцент быстро расширяется на другие области, такие как заболевания органов ротовой полости и пищеварительного тракта, печени, почек, сердца, дыхательных путей, нервно-мышечной, кожной, обонятельной и репродуктивной систем. . Лечение стволовыми клетками чаще всего применялось у собак и лошадей при различных заболеваниях различных систем органов, а у кошек — при почечных, респираторных и воспалительных заболеваниях.
костно-мышечной системы Болезни
связок и сухожилий Болезни
Травмы и стрессовые повреждения сухожилий и связок заживают естественным путем с образованием рубцовой ткани, функционально недостаточной по сравнению со здоровой тканью.В то время как первоначальное повреждение вызывает снижение структурной жесткости, фиброз стирает физиологическую архитектуру и функцию сухожилия или связки (159). Это приводит к скомпрометированной функции опорно-двигательного аппарата, склонной к повторной травме (160). Поэтому оптимальное лечение должно быть направлено на восстановление нормальной структуры и функции тканей. Традиционные методы лечения травм сухожилий у лошадей основаны на охлаждении (161), перевязке и реабилитационном периоде с контролируемыми упражнениями. Фармакологическое лечение включает использование системных и местных кортикостероидов или других противовоспалительных препаратов (162), но часто требуется хирургическое лечение (163, 164).Эти консервативные методы не позволяют полностью заживить ткани, часто возникают повторные травмы, и часто животные не могут вернуться к уровню работоспособности до травм (162). Поэтому идеальное лечение должно быть направлено на восстановление нормального матрикса сухожилия. Использование МСК было введено в качестве альтернативы традиционному подходу, поскольку он представляет собой потенциальный инструмент для лучшей регенерации тканей (165, 166). Регенеративная клеточная терапия направлена на заживление с правильным образованием коллагеновых волокон и успешным восстановлением нормальной активности сухожилий с меньшим риском рецидивов.Предполагается, что МСК, выделенные из той же ткани, которая нуждается в лечении, будут наиболее адекватным источником МСК для терапии стволовыми клетками. Таким образом, лучшим источником стволовых клеток при тендинопатиях будут стволовые клетки, полученные из сухожилий (167), но выделение стволовых клеток из ткани сухожилий является очень сложной задачей, и стандартного протокола индукции тендиногенеза не существует (168). Стволовые клетки из других источников, в основном из жировой ткани и костного мозга, поэтому использовались для регенерации сухожилий.Впервые об имплантации аутологичного BMMSC в сухожилие поверхностного сгибателя пальцев кисти лошади было сообщено в 2003 г. (165). Сообщалось о значительном клиническом выздоровлении после введения клеток 11 скаковым лошадям с поверхностными повреждениями сухожилий сгибателей пальцев рук (169). Аналогичным образом, в когортном исследовании, включающем 141 скаковую лошадь с естественным повреждением сухожилия поверхностного сгибателя пальца, внутриочаговая инъекция аутологичного BMMSC привела к <28% повторных травм у всех лошадей за 2 года наблюдения (170). Результаты показали значительное снижение частоты повторных травм по сравнению с результатами аналогичного исследования того же типа травмы и последующего наблюдения, когда лошадям вводили внутриочаговые инъекции гиалуронана, бета-аминопропионитрилфумарата или полисульфатированных гликозаминогликанов (160).Это было продемонстрировано Smith et al. (171), что лечение естественных тендинопатий аутологичным BMMSC вызывает образование ткани, напоминающей нормальный матрикс сухожилия, а не фиброзную ткань, которая образуется в процессе естественного заживления. В дополнение к аутологичной терапии МСК, многообещающие результаты были получены при аллогенной терапии МСК при заболеваниях сухожилий и связок, таких как тендинит сухожилий поверхностных и глубоких сгибателей пальцев и десмит поддерживающих и нижних контрольных связок (172).Однако при хирургически индуцированных поражениях сухожилий поверхностных сгибателей пальцев рук у лошадей аутологичная терапия BM- или ADMSC не дала никакого или очень небольшого улучшения по сравнению с другими методами лечения, такими как обогащенная тромбоцитами плазма (PRP) (173, 174).
Как и лошади, собак также подвергали экспериментальному лечению МСК. Распространенной травмой у собак является разрыв решающей черепной связки коленного сустава (175). Его разрыв связан с остеоартритом коленных суставов и является наиболее частой причиной хромоты у взрослых собак (176).В настоящее время рекомендованной терапией является хирургическая коррекция (177).
Положительные результаты нескольких исследований подчеркнули важность использования МСК при этом состоянии. Было продемонстрировано, что уровень послеоперационной хромоты и боли после однократной внутрисуставной инъекции аллогенного BMMSC может быть ценной альтернативой 1-месячному курсу перорального приема нестероидных противовоспалительных препаратов (НПВП) у собак, которым требуется тибиальное плато. выравнивающая остеотомия (TPLO) (178). Было показано, что введенные внутрисуставно аутологичные BMMSC приживаются к месту травмы критической связки черепа (179) и обладают противовоспалительным действием.Послеоперационная внутрисуставная или внутривенная инъекция аутологичных МСК собакам с таким же состоянием привела к снижению уровня CD8 + Т-клеток, снижению сывороточного и синовиального СРБ и снижению уровней синовиального IFN-γ, которые сохранялись в течение 8 недель после инъекции BMMSC (180 ). В случаях частичных разрывов без дестабилизации коленного сустава, когда операция не является оптимальным решением, многообещающие результаты были получены в ретроспективном исследовании, в котором лечение аутологичным BMMSC в сочетании с PRP предотвращало прогрессирование дальнейших дегенеративных изменений в суставе и контралатеральной связке. разрыв у собак (181).
Болезни суставов
Из-за относительной гипоцеллюлярности и аваскуляризации хрящевая ткань имеет ограниченную способность к самовосстановлению. У лошадей на него также влияют огромные силы нагрузки и механическое напряжение, которые оказываются на суставные поверхности во время выступления (182). Одной из наиболее частых причин прекращения спортивной карьеры лошадей и хронической хромоты являются заболевания суставов, из которых наиболее распространен остеоартрит (183). Традиционное лечение опорно-двигательного аппарата травмы, включая повреждение суставного хряща, связок и менисков часто ассоциируется с плохим прогнозом для спортивной работы лошадей (184, 185).Сообщалось об эффективности in vivo внутрисуставного лечения МСК заболеваний костей, мениска и хрящей у лошадей. Наиболее изучены и описаны локомотивом расстройства системы у лошадей является костный шпат, дегенеративное заболевание суставов, в которых традиционное лечение основано на применении противовоспалительных кортикостероидов для уменьшения боли и воспаления. Результаты, полученные в ходе исследования, в котором 16 лошадей с костным спавином получали внутрисуставное лечение аутологичным ADMSC, свидетельствуют о положительном и долгосрочном эффекте терапии МСК.Никаких признаков хромоты не наблюдалось через 180 дней после лечения у обработанных лошадей по сравнению с необработанной контрольной группой. Это было подтверждено сцинтиграфическим исследованием, которое не выявило признаков воспалительного процесса в суставах предплюсны обработанных лошадей по сравнению с контрольной группой, где воспаление все еще присутствовало (186). Лечение МСК также очень перспективно для лошадей с повреждением мениска. Лошади, получавшие внутрисуставное введение аутологичного BMMSC, вернулись к работе в большем проценте, чем те, которые лечились только артроскопией (187).В одном исследовании 80 лошадей с остеоартритом лечили аллогенным ADMSC, и в течение 90-дневного периода наблюдения наблюдалось значительное уменьшение хромоты, что указывает на положительный эффект аллогенных клеток (188). Аналогичным образом, МСК, полученные из аллогенного пуповины, для лечения остеоартрита пястно-фалангового / плюснефалангового суставов у лошадей привели к значительному уменьшению хромоты в течение 6 месяцев, но клинических различий при однократной или повторной инъекции МСК не наблюдалось (65).Однако в некоторых исследованиях сообщалось о неблагоприятных клинических ответах после повторных внутрисуставных инъекций аллогенных МСК лошадям с остеоартритом (60). Сообщалось, что даже однократные инъекции аллогенных МСК вызывают легкие или умеренные местные воспалительные симптомы (64). Несколько исследований на собаках продемонстрировали, что введение МСК в суставы, страдающие артритом, уменьшают дискомфорт пациентов и повышают их функциональные возможности. Значительное уменьшение хромоты было подтверждено у собак с остеоартритом коленных суставов (189), продемонстрированное значительно замедленным прогрессированием остеоартрита в суставах, обработанных аутологичным ADMSC, по сравнению с суставами, получавшими плацебо.Аналогичные результаты были получены Black et al. (190) и Vilar et al. (191) у собак с остеоартрозом тазобедренного сустава. Эффект от внутрисуставной инъекции аутологичных ADMSC при лечении остеоартрита различных суставов собак, по-видимому, является длительным, как показано в исследовании с последующим наблюдением до 4 лет (192). Значительное улучшение терапии МСК для лечения остеоартрита также было показано при использовании аллогенных ADMSC. У 74 собак, получавших аллогенные ADMSC в проспективном, рандомизированном, замаскированном и плацебо-контролируемом исследовании, не сообщалось о побочных эффектах, и была показана эффективность в снижении клинических признаков по сравнению с группой плацебо (193).В другом обширном исследовании, проведенном на 203 собаках с тяжелым остеоартритом, вызывающим сильную хроническую боль и хромоту, результаты показали отличное улучшение у 90% молодых собак и хорошее улучшение у 60% собак старшего возраста через 10 недель после лечения (194). На модели остеоартрита собаки, получавшей МСК из аллогенного пуповины, восстановление хряща было продемонстрировано в виде новообразования хряща, снижения содержания суставной жидкости, уменьшения воспалительной реакции и улучшения заживления окружающих тканей по сравнению с контрольной необработанной группой (27 ).В отличие от исследований на лошадях, повторная аллогенная терапия МСК показала себя безопасной при наличии только легких и самоограничивающихся воспалительных реакций без побочных эффектов даже через 2 года после внутрисуставной инъекции МСК (63). МСК-терапия остеоартрита собак, аутологичного или аллогенного, также была протестирована и доказала свою эффективность в сочетании с PRP или гиалуроновой кислотой (191, 195, 196). По сравнению с лечением ADMSC и PRP при остеоартрите собак, терапия MSC имела более сильные и более благоприятные эффекты (197).
MSC терапии при лечении расстройств опорно-двигательного аппарата, оказалось весьма эффективной, особенно у лошадей с сухожильных травмами, костный шпат и мениска повреждений, и у собак с остеоартритом условиях. Такие положительные результаты лечения МСК, таким образом, снижают потребность в длительном местном или системном применении противовоспалительных препаратов с их известными токсическими побочными эффектами. Однако необходимы дополнительные исследования, чтобы расширить наши знания о механизмах действия МСК, и особенно аллогенных МСК, поскольку не все исследования дали положительные результаты в отношении их безопасности при использовании в терапии.ECV, происходящие из MSC, могут представлять собой многообещающую альтернативу аллогенной терапии MSC, поскольку они имитируют несколько биологических действий MSC. Терапия ECV уже была протестирована для лечения повреждений поддерживающей связки у жеребца и дала положительные результаты, показавшие увеличение заполнения очага поражения, улучшение ангиогенеза и эластичности поврежденного сухожилия (111).
Заболевания полости рта
Боль в ротовой полости и проблемы с жеванием могут иметь большое влияние на качество жизни животного. Многие заболевания полости рта также могут приводить к системным проблемам (198).Заболевания полости рта, такие как кариес, пародонтоз, необратимая потеря зубов, поражения слизистой оболочки полости рта, рак ротоглотки и травмы зубов, также являются одной из основных проблем общественного здравоохранения во всем мире (199). С развитием регенеративной клеточной терапии, стволовые клетки привлекли интерес к лечению тканей ротовой полости. Исследования сосредоточены на иммуномодулирующих эффектах МСК, способствующих регенерации тканей зубов и пародонта, и на потенциале дифференцировки МСК для повышения прочности имплантата и восстановления костной ткани в альвеолярных дефектах.Помимо обычных источников стволовых клеток, таких как костный мозг и жировая ткань, изучаются клетки, полученные из местных тканей, таких как стволовые клетки пульпы зуба (DPSC) (200–202) или стволовые клетки периодонтальной связки (PDLSC) (203, 204). как терапевтический вариант при заболеваниях ротовой полости. В экспериментальных моделях собак аутологичные BMMSC или ксеногенные МСК периодонтальной связки оказались полезными при реконструкции периодонтальной связки в сочетании с факторами роста (205), фибриновым клеем, PRP (206), эфрином B2 — мембранным белком, регулирующим гомеостаз кости (204) или с конструкцией из пористого двухфазного фосфата кальция (203).Сами по себе аллогенные ADMSC также способны вызывать регенерацию тканей пародонта на модели дефекта пародонта мини-свиньи (207). Для регенерации пульпы зуба аутологичные (200) и аллогенные (201) стволовые клетки из пульпы зуба или аутологичные BMMSC (208) были эффективны при регенерации пульпы зуба на моделях собак. Хотя эти исследования показывают многообещающие перспективы регенерации тканей ротовой полости, другие не сообщают об отсутствии положительного влияния стволовых клеток на стоматологические состояния, такие как дефекты, связанные с зубными имплантатами (209).
Исследования, проведенные на животных моделях, действительно представляют собой основу и справочные материалы для использования стволовых клеток и тканевой инженерии для стимуляции регенерации тканей ротовой полости. Тем не менее, необходимы обширные исследования, чтобы доказать эффективность и полезность лечения стволовыми клетками при проблемах ротовой полости у реальных пациентов с естественными заболеваниями.
Тем не менее, очень обнадеживающие результаты получены при лечении MSC хронического гингивостоматита у кошек (FCGS), болезненного и изнурительного состояния полости рта у кошек, характеризующегося хроническим воспалением десны, распространяющимся на слизистую оболочку ротовой полости и каудального отдела.Кошки, страдающие FCGS, страдают анорексией, болью в полости рта, потерей веса, птичьим синдромом, неприятным запахом изо рта и отсутствием ухода (210). Текущие варианты лечения включают лекарства, такие как кортикостероиды (211), циклоспорин (212) и хирургическое удаление зубов (213), и имеют переменную частоту ответа и несколько возможных побочных эффектов (214). Arzi et al. (215) показали, что внутривенное введение аутологичного ADMSC привело к полному клиническому и гистологическому разрешению или снижению тяжести клинического заболевания у большинства кошек.Иммуномодуляция МСК была продемонстрирована нормализацией субпопуляций иммунных клеток, уровней сывороточного белка и цитокинов. Результаты исследования также свидетельствуют об отсутствии клеток CD810 в качестве биомаркера для прогнозирования ответа на терапию МСК (215). Интересно, что аллогенные ADMSC, по-видимому, имеют более низкую клиническую эффективность по сравнению с аутологичными МСК при лечении FCGS (216). Клинический, гистологический и системный ответ был продемонстрирован у 70% кошек с FCGS, получавших внутривенное введение аллогенного ADMSC (217).
Болезни пищеварительного тракта
Воспалительное заболевание кишечника (ВЗК) — это аутоиммунное заболевание с хронической реакцией гиперчувствительности слизистой оболочки кишечника неизвестной этиологии (218). Некоторые собаки невосприимчивы к традиционному пожизненному лечению циклоспорином или стероидами (219). Однократная внутривенная инфузия аллогенных ADMSC привела к клинической ремиссии у 9 из 11 собак с тяжелой ВЗК через 6 недель после лечения вместе со значительным повышением уровней альбумина, кобаламина и фолиевой кислоты в
.