Натрия сульфат 10-ти водный (Глауберова соль): цена, инструкция по применению
Форма выпуска
Пластиковая банка – 250 гр, 500 гр.
Состав
Na2SO4 х 10H2O, десятиводный кристаллогидрат (декагидрат)сульфата натрия.
Свойства
Обладает эффективным действием при отравлениях солями тяжелых металлов и избытке меди, снижает уровень кальция в кишечнике.
Показания
Показан к применению в случае запора, метеоризма, переполнения кишечника у животных. Также используется для удаления токсинов, при атонии и гипотонии преджелудков, выступает в качестве антидота при отравлении и солью ртути, бария или свинца.
Применение и дозировка
С целью нормализации пищеварения препарат разводится в воде для образования 1-2% раствора. Применяется в следующей дозировке:
в качестве слабительного:
- КРС – 400-800 гр;
- лошадям – 300-500 гр;
- овцам – 50-100 гр;
- свиньям – 25-50 гр;
- собакам – 10-25 гр;
- кошкам – 3-10 гр;
- курам – 2-4 гр;
- норкам – 5-15 гр.
для улучшения пищеварения:
- лошадям – 150-200 гр;
- КРС — 250-600 гр;
- собакам – 10—15 гр.
Противопоказания
- Не применять при поносе и завороте кишок у животного.
- Не давать истощенным и старым животным.
Особые указания
При использовании глауберовой соли в качестве слабительного, животным необходимо обеспечить обильное питье.
Правила хранения
- Избегать попадания прямых солнечных лучей.
- Хранить в сухом, недоступном для света месте.
-
Температура хранения: — 45°С– +33°С.

Срок годности не ограничен.
Сульфат десятиводный — Справочник химика 21
В 20 г 20%-ного раствора сернокислого натрия растворили 4 г десятиводного кристаллогидрата сульфата натрия. Определите процентную концентрацию полученного раствора (плотность 1,1) и его нормальность.Сульфат натрия природный получают прв обезвоживании природного десятиводного сернокислого натрия— [c.195]
Десятиводный сульфат натрия. ……… [c.269]
Из 20,2 г насыщенного при 16°С раствора сернокислого натрия при выпаривании воды получено 6,2 г десятиводного сульфата натрия. Определите растворимость сернокислого натрия (безводного) в граммах на 100 г воды при 16°С. [c.22]
Как известно, растворимость сильно зависит от температурных условий и в некоторой степени от измельченности растворяемого вещества. В подавляющем большинстве случаев при повышении температуры существенно увеличивается растворимость вещества. Однако, как уже отмечалось, из этого правила имеется ряд исключений. Например, растворимость кальция гидроокиси, кальциевой соли лимонной кислоты, кальция глицерофосфата, кальция сульфата, паральдегида, газов при повышении температуры уменьшается. Растворимость в воде десятиводного натрия сульфата увеличивается до 34 0 и падает при дальнейшем повышении температуры. Измельчение
Подобным образом обезвоживаются десятиводные сульфат, хромат, бихромат и карбонат натрия (рис. 2, 3, а) увеличение электропроводности наблюдается при температурах образования инконгруэнтных расплавов, падение электропроводности — при полном выкипании растворов с образованием безводных солей. Обезвоживание эпсомита (см. рис. 3, б)
На 1.6 г хромата натрия (десятиводного), 1 т бихромата натрия (двухводного) и 0,5 г безводного сульфата натрия расходуется [32] [c. 433]
433]
Расположение на диаграмме объемов кристаллизации десятиводной, семиводной и одноводной соды, десятиводного и безводного сульфата натрия, хлористого натрия, бикарбоната натрия, а также двойных солей — беркеита и троны — указывает на направление реакций в системе. Установлено, например, что такие твердые фазы, как беркеит и бикарбонат натрия, не могут совместно существовать, а будут реагировать друг с другом, образуя трону и сульфат натрия.
По первому из предложенных методов смесь растворяется в воде и подвергается охлаждению до —5°, в результате чего выпадает десятиводный сульфат натрия (мирабилит). Последний отделяется от маточного раствора и подвергается обезвоживанию высаливанием галитом. Эта вторая часть процесса проводится при 55°. [c.274]
Приборы и реактивы. Стакан вместимостью 400 мл. Термометр на 100 С. Цилиндр. Ареометры (в пределах 1—1,35 г/см ). Десятиводный кристаллогидрат сульфата нитрия или безводная соль N32804. [c.273]
МИРАБИЛИТ (лат. т1гаЫ111з — дйв-ный, глауберова соль) — минерал, десятиводный кристаллогидрат сульфата натрия КааЗО ЮН2О. Хорошо растворяется в воде, раствор горько-соленого вкуса. Огромные массы М. осаждаются зимой и снова растворяются летом в соленых озерах, морских лагунах и т. д. Самые большие залежи М. в СССР найдены в заливе Кара-Богаз-Гол. М. используют в химической промышленности в качестве сырья в производстве соды, едкого натра, растворимого стекла, а также в стекольной и других отраслях промышленности. В медицине М. применяют как слабительное (см. Глауберова соль).
Сульфат натрия NaoSOi применяется в производстве соды и стекла. Из водных растворов кристаллизуется десятиводный гидрат Na2S04-ЮН О, называемый глауберовой солью. Глауберова соль применяется в медицине как слабительное.
Теплота растворения сульфата натрия. Взять две навески Ыа2504 1ОН2О по 5 г. Одну из них поместить в фарфоровую чашку и прокаливать, изредка помешивая, до тех пор, пока не окончится выделение паров воды. Затем охладить чашку и полученную безводную соль высыпать на листок бумаги. В стаканчик налить 10 мл воды измерить ее температуру и быстро всыпать навеску безводной соли осторожно размешать ее термометром, следя по последнему за изменением температуры. Начальную и конечную температуру отметить. Тот же опыт повторить С десятиводной солью. Объяснить различие в полученных результатах.
Одну из них поместить в фарфоровую чашку и прокаливать, изредка помешивая, до тех пор, пока не окончится выделение паров воды. Затем охладить чашку и полученную безводную соль высыпать на листок бумаги. В стаканчик налить 10 мл воды измерить ее температуру и быстро всыпать навеску безводной соли осторожно размешать ее термометром, следя по последнему за изменением температуры. Начальную и конечную температуру отметить. Тот же опыт повторить С десятиводной солью. Объяснить различие в полученных результатах.
Сульфат натрия кристаллизуется в форме десятиводного гидрата N32804 ЮН2О, молекулярный вес которого равен 322, а плотность 1,46. Представляет собой белое кристаллическое вещество с температурой плавления 884,7° С хорошо растворим в воде, не растворяется в органических растворителях. [c.119]
Весьма существенным является также использование отходов. Так, в производстве аскорбиновой кислоты на стадии ацетонирования в качестве отходов образуется осадок десятиводного сульфата натрия (Ма2504- ЮНаО) в количестве 2,5 т на 1 т аскорбиновой кислоты. Разработан метод обезвоживания гидрата. Выход безводного сульфата натрия составляет 95% от теоретического [8] и по своему качеству соответствует требованиям ГОСТа на безводный сульфат натрия. Разработан также метод использования калийного отхода в этом же производстве на стадии окисления диаце-тонсорбозы с получением концентрата с содержанием 33% К2О [8]. Использование отходов производства не только снижает затраты на сырье, но и облегчает задачу очистки сточных вод.
Ацетон, полученный в вакуум-перегонном аппарате 10, содержит до 15% влаги. Для ректификации его направляют через сборник 18 в ректификационную колонну 19. Сухой ацетон собирают в приемниках 20 и возвращают его в сборник 2. Осадок десятиводного сульфата натрия из центрифуги 8 направляют в плавильный аппарат 21, откуда засасывают в перегонный аппарат 22, отгоняют ацетон, а расплавленные кристаллы сульфата передают в вальцовую сушилку 23.
Вывод сульфатов из обогащенного им рассола может быть осуществлен также путем охлаждения раствора. При этом выпадает десятиводный кристаллогидрат сульфата натрия. При охлаждении раствора до О—5 °С содержание сульфата натрия в растворе снижается до 20—30 г/л и съем сульфата натрия с 1 м рассола может составить около 60 кг, т. е. примерно в 2 раза выше, чем по методу с нагреванием. Однако при этом выделяется N32804-ЮН jO и для получения товарного сульфата осадок необходимо обезвоживать. По этой причине предпочитают осуществлять вывод сульфатов по методу с нагреванием.
Сульфат натрия (Ыа ЗО ), или сернокислый натрий (ОСТ НКТП 7102, 7102/439 и ОСТ 3140), представляет со-, бой нейтральную натриевую соль серной кислоты—безводную и десятиводную (глауберова соль). В производстве мыла служит лишь для наполнения последнего, являясь наибо лее распространенным из растворимых наполнителей. Без водный Сульфат применяется в производстве твердых за менителей мыла благодаря его способности, аналогично кальцинированной соде, присиединяя воду, твердеть ь мыле, образуя кристаллические вещества.
Результаты показывают (рис. 3), что содержание воды в расплаве при давлениях, меньших 5000 кг1смР-, превышает содержание воды в глауберовой соли (55,9%), что свидетельствует об инконгруэнтном характере плавления в этой области. Однако с увеличением давления состав >асплава все больше приближается к составу глауберовой соли и при давлениях, превышающих 5000 кг1см , совпадает с ним. Очевидно это происходит потому, что растворимость безводного сульфата натрия возрастает с увеличением давления и его концентрация в растворе достигает, наконец, предельного соотношения, отвечающе го десятиводно-му гидрату. [c. 118]
118]
Подтверждением изложенной схемы образования гуджира может служить тот факт, что гуджир представляет почти чистую десятиводную соду. Проба естественного гуджира 1930 г. имела следующий состав карбоната натрия — 32,19%, бикарбоната натрия — 0,26%, сульфата натрия— 0,207%, хлорида натрия — 0,205%, хлорида калия — 0,705% и воды — 66,12%. [c.165]
На рис. 40 показаны минимальные и максимальныеТграницы областей кристаллизации безводного и десятиводного сульфата натрия, а также его двойной четырехводной соли с сульфатом магния (астраханита). Для выделения этих солей в присутствии избытка хлоридов из растворов, бедных кальцием, достаточно даже 25—30% ионов магния и не более 20% ионов 80Г- Но если кальций присутствует в значительных количествах, наряду с бикарбонатами, то первоначальное осаждение сульфатов натрия становится маловероятным, так как для этого требуется не менее 99% ионов натрия в исходном растворе. [c.87]
Натрия бромид (бромистый Н,) гексагидроксостаннат (станнат Н, тригидрат, трехводный оловяннокислый Н,) гексафтороалюминат (криолит — мин,) гидрокарбонат (кислый углекислый Н,, бикарбонат Н,, двууглекислый Н,, двууглекислая, очищенная, питьевая, пищевая сода) гидроксид (гидроокись Н едкий натр, каустическая сода, каустик) иодид (иодистый Н.) к.арбонат (углекислый Н., бельевая, кальцинированная сода) карбонат декагидрат (десятиводный углекислый Н,, кристаллическая сода) метасиликат (кремнекислый Н,, силикат Н,, силикат глыба) нитрит (азотистокислый Н,) ортофосфат (ортофосфорнокислый Н,, фосфат Н,, фосфорнокислый Н,) перборат тетра-гидрат (четырехводный надборнокислый Н,) сульфат [сернокислый Н,, тенардит (а) — мин,] сульфит (сернистокислый Н,) тиосульфат пентагидрат (пятиводный серноватистокислый Н., гипосульфит Н., антихлор) трифосфат Н, (триполифосфат Н,) фторид (фтористый Н.) хлорат (хлорноватокислый [c.31]
Соли натрия хорошо растворимы в воде. В отличие от солей калия многие натриевые соли образуют кристаллогидраты. Например, сода Na Os образует десятиводный кристаллогидрат Naa Oa- IOh3O. Соли натрия находят широкое применение. Из сульфата натрия готовят стекло. Безводный сульфат натрия КазЗО — осушающее (поглощающее воду) средство. [c.216]
Например, сода Na Os образует десятиводный кристаллогидрат Naa Oa- IOh3O. Соли натрия находят широкое применение. Из сульфата натрия готовят стекло. Безводный сульфат натрия КазЗО — осушающее (поглощающее воду) средство. [c.216]
Сель глауберова, сульфат натрия десятиводный, натрий сернокислый десятиводный, N32804- ЮН О,—кристаллы соли, содержащие обычно примеси других солей—натрия, кальция и пр. Природную глауберову соль (мирабилит) получают осаждением из рапы в бассейнах залива Кара-Богаз Каспийского моря или озер. Техническая соль получается обычно в качестве отхода в некоторых химических производствах. [c.192]
Соль глауберова, сульфат натрия десятиводный, натрий сер-иокислый десятиводный, N33804 ЮНаО,—кристаллы соли, содер- жащие обычно примеси других солей—натрия, кальция и пр. [c.192]
Кристаллогидраты обладают определенной упругостью пара. Если упругость их пара больше упругости паров воды в окружающем воздухе при данной температуре, то кристаллы при хранении на воздухе теряют кристаллизационную воду — выветриваются. Примером такого кристаллогидрата может служить глауберова соль, представляющая собой десятиводный сульфат натрия ЫагЗО ЮН2О. [c.416]
К чистоте десятиводного сульфата натрия, применяемого под названием глауберовой соли для медицинских целей, предъявляются повышенные требования. Согласно ГОСТ 6319—52 , глауберова соль должна содержать не менее 99% N32804 IOh3O, и не более 0,005% не растворимых в воде веществ, 0,1% хлоридов (Na l), 0,0005% Fe, 0,003% солей аммония (Nh5), 0,0005% тяжелых металлов сероводородной группы (РЬ), 0,03% солей кальция. Мышьяк, сульфиты и тиосульфаты, а также гигроскопическая влага должны отсутствовать. Реакция водного раствора должна быть нейтральной. [c.134]
В тех случаях, когда сульфат нужно выпустить в продажу в виде крупных кристаллов глауберовой соли, т. е. десятиводного сульфата (N82804 10 НгО), его из нутч-фильтра 2 выгружают в бак с мешалкой 4. В бак заливают из чана 7 воду, нагретую до 40°. Для очистки образовавшегося раствора сульфата натрия от железа в раствор вводят небольшое количество извести. Железо вьшадает в виде гидрата закиси и окиси, а вся грязь всплывает на поверхность раствора в виде пены. Центробежным насосом 5 раствор прогоняют через фильтрпресс 6. Чистый фильтрат стекает в сборник 8, а прорывающийся между рамками грязный раствор сульфата (небольшое количество) стекает обратно в бак 4. Из сборника 8 чистый раствор сульфата натрия центробежным насосом 9 подают в кристаллизаторы 10, представляющие собой железные плоские ящики. Для получения крупных кристаллов поперек ящиков кладут брусья, к которым подвязаны шнуры. Глауберова [c.225]
В бак заливают из чана 7 воду, нагретую до 40°. Для очистки образовавшегося раствора сульфата натрия от железа в раствор вводят небольшое количество извести. Железо вьшадает в виде гидрата закиси и окиси, а вся грязь всплывает на поверхность раствора в виде пены. Центробежным насосом 5 раствор прогоняют через фильтрпресс 6. Чистый фильтрат стекает в сборник 8, а прорывающийся между рамками грязный раствор сульфата (небольшое количество) стекает обратно в бак 4. Из сборника 8 чистый раствор сульфата натрия центробежным насосом 9 подают в кристаллизаторы 10, представляющие собой железные плоские ящики. Для получения крупных кристаллов поперек ящиков кладут брусья, к которым подвязаны шнуры. Глауберова [c.225]
В тех случаях, когда сульфат нужно выпустить в продажу в виде крупных кристаллов глауберовой соли, т. е. десятиводного сульфата (N32804 ЮН2О), его из нутч-фильтра 2 доставляют к баку с мешалкой 4. В бак заливают из чана 7 воду, нагретую до 40° и засыпают кристаллы. Для очистки образовавшегося раствора сульфата натрия от железа в раствор вводят небольшое количество извести. Железо выпадает в виде гидрата закиси и окиси, а вся грязь всплывает на поверхность раствора в виде пены. Центробежным насосом 5 раствор прогоняют через фильтрпресс 6. Чистый фильтрат стекает в сборник 8, а прорывающийся между рамками грязный раствор сульфата (небольшое количество) стекает обратно в бак 4. Из сборника 8 чистый раствор сульфата натрия центробежным насосом 9 подают в кристаллизаторы 10, представляющие железные плоские ящики. Для получения крупных кристаллов поперек ящиков кладут брусья, к которым подвязаны шнуры. Глауберова соль кристаллизуется на шнурах в виде крупных кристаллов. Скорость кристаллизации зависит от температуры помещения и концентрации раствора сульфата. По окончании кристаллизации маточный раствор спускают в чан 11, из которого центробежным насосом 12 его направля.ют в бак 4 или в цех бланфикса. [c.199]
При смешении с минеральными солями стойкость солей диазония значительно повышается. Для смешения применяют соли, образующие гидраты, напримв р сульфат натрия, кристаллизующийся с десятью молекулами воды с образованием десятиводного сульфата, или глауберовой соли Маг504-ЮНгО. [c.255]
Для смешения применяют соли, образующие гидраты, напримв р сульфат натрия, кристаллизующийся с десятью молекулами воды с образованием десятиводного сульфата, или глауберовой соли Маг504-ЮНгО. [c.255]
Некоторые кристаллические вещества содержат воду. При прокаливании такие кристаллы рассыпаются в порощок, теряя свою воду. Вода, входящая в состав кристаллов, называется кристаллизационной. При кристаллизации многта веществ из их водных растворов выпадает не безводная соль, а ее к р и с т а л-логидрат. Так, наприме р, из раствора сульфата натрия N32504 при кристаллизации выпадает десятиводный кристаллогидрат N32504. ЮНгО. [c.89]
В заливе Кара-Богаз-Гол ежегодно добывают миллионы тонн мирабилита — десятиводного кристаллогидрата сульфата натрия МагЗО . 1ОН2О. Этот минерал потребляется стекольной, мыловаренной, кожевенной промышленностью. Гипс Са304. 2НгО, или двухводный сульфат кальция, залегающий в очень больших количествах в различных районах СССР, служит материалом для архитектурных работ, а также применяется в медицине для изготовления гипсовых повязок и для других хирургических целей. Некоторые природные источники, а также некоторые грязи, содержащие растворенный сероводород НгЗ, имеют исключительно важное значение при лечении экзем, ревматизма и других болезней. [c.196]
При выборе соотношения исходных компонентов, вводимых в реакцию, можно руководствоваться фазовой диаграммой системы НдО — 50з —НгО, на которой нанесено поле кристаллизации диоксисульфата ртути [1]. Получение диоксисульфата ртути осуществляли добавлением 15,5 г нитрата ртути Hg(NOз)2 0,5h3O к 6 г десятиводного сульфата натрия. При растирании в ступке смеси этих солей получали суспензию желтого цвета. Осадок отфильтровывали от маточного раствора, отмывали от нитрат-ионов, сушили при 100° до постоянного веса и анализировали иа содержание HgO и ЗОд. Согласно данным химического анализа, желтый порошок по составу почти точно отвечал формуле 2Нд0-Нд804. С помощью рентгенофазового анализа продукт также идентифицирован как диоксисульфат ртути. [c.117]
С помощью рентгенофазового анализа продукт также идентифицирован как диоксисульфат ртути. [c.117]
Натрий сульфат — ООО «ТД Энергостройинвест»
Описание
Что такое натрий сульфат?Натрий сульфат — это белый порошок также известный под названиями глауберова соль или безводный мирабилит. Плотность материала составляет 2,68 грамм на сантиметр кубический с температурой плавления в пределах 884 ℃. Хорошо растворим в водяных растворах и глицерине, но не растворяется в этаноле.
По своей структуре это гомогенный поликристаллический материал что при температуре в пределах от 32 до 223 ℃ принимает ромбовидную структуру и образующий кристаллы моноклинной формы при повешении температуры. В процессе кристаллизации раствора имеет высокое сродство к соединениям железа и разнообразным органическим соединениям.
Производство сульфат натрияВ промышленных масштабах сульфат натрия в большинстве случаев производится из природного минерала или в процессе дегидратации мирабилита с последующей обработкой серной кислотой. Путем химических реакций между хлоридом натрия (поваренной солью) и серной кислотой. Также может быть получен как побочный продукт на большинстве химических предприятиях. Содержится в отходах производства вискозного волокна и целлофана.
Применение натрий сульфата- Большая часть производимого натрий сульфата (до 70%) применяется бумажной и стекольной промышленности, где является важным сырьем.
- В строительных смесях и бетоне добавляется для увеличения морозостойкости состава и ускорения застывания. Наиболее оптимальным количеством будет 1-2% сульфат магния от массы цемента.
- В составе синтетических моющих средств как нейтральная соль. Необходимая добавка для уменьшения поверхностного натяжения и улучшения растворимости моющих средств.
- Как растворитель красителя и вспомогательного агента в красках для печати, красителях прямого окрашивания и в качестве замедлителя в процессе прямого окрашивания шелка.

- Пищевая промышленность применяет сульфат натрия как пищевую добавку под номером Е514.
- Для биологических лабораторий актуальным остается применение в роли обезвоживающего средства. Это обусловлено меньшей ценой и простотой фильтрацией вещества. В отличии от другого обезвоживающего вещества сульфата магния.
- Как кормовая добавка для крупного рогатого скота. В небольших количествах приводит к раздражению пищеварительного тракта, увеличению секреции и улучшению пищеварения. Также стимулирует желчеобразование.
- В кочевничестве задействуется для дубления кожи и удаления волосяного покрова из кожи.
- В металлургии применим в процессе выплавки ряда цветных металлов.
- Для удаления всей влаги в процессе сушки растворителей. В случае содержания влаги более 0.5% применять натрий не рекомендуется. Вследствие активно протекающей реакции возможен взрыв.
- Химическая промышленность применяет сырье в производстве гипса, сульфида натрия и гипса.
Сертификат качества сульфата натрия:
| Характеристики | Факт. пок-ли |
| Цвет и запах | Сыпучий порошок белого цвета |
| Массовая доля сульфата натрия (Na2SO4), % | 99,79 |
| Массовая доля нерастворимых в воде частиц, % | 0,01 |
| Насыпная плотность, (гр./мл) | 1,53 |
| Кислотность pH (1% раствор) | 6,7 |
| Влажность, % | 0,03 |
| Хлорид натрия NaCl, % | 0,0227 |
| Кальций Ca,% | 0,0393 |
| Магний Mg, % | 0,0024 |
| Железо Fe (Total) | прослеживается |
| Серийный номер – дата | 1/101 |
Цена и наличие
Если Вам нужно купить натрий сульфат, обращайтесь в компанию ООО “Торговый Дом Энергостройинвест”. Мы предоставляем только качественный товар. Цена и условия поставки Вас приятно удивят.
Мы предоставляем только качественный товар. Цена и условия поставки Вас приятно удивят.
Купить сульфат натрия в Украине можно на одном из наших складов:
Киевская область (г. Буча)
Днепропетровская область (г. Новомосковск)
Львовская область (г. Жовква)
Харьковская область (г. Изюм)
Одесса
Мы работаем со всеми курьерскими службами, что делает доставку быстрой и в любую точку страны. Также Вы можете забрать свой заказ самостоятельно.
А для наших постоянных клиентов предоставлены персональные скидки и условия. Наберите прямо сейчас и убедитесь сами, надежней поставщика Вам не найти!
Всю подробную информацию Вы можете узнать у одного с наших менеджеров по телефону или e-mail.
| Бесцветный, белый, желтовато-белый, зеленовато-белый | |
| Цвет черты | Белая |
| Блеск | Стеклянный |
| Прозрачность | Прозрачный, просвечивающий, непрозрачный |
| Твёрдость | 1,5 — 2 |
| Спайность | Совершенная по {100} |
| Плотность | 1,49 г/см³ |
Получение нитрата и нитрита натрия на основе конверсии в водной среде сульфата натрия нитратом и нитритом кальция
АННОТАЦИЯ
В республике осуществляется освоение природных ресурсов, их комплексное использование и создание конкурентоспособных, импортозамещающих продуктов на базе местных сырьевых ресурсов. К таким важным химическим продуктам относятся нитриты, нитраты натрия и кальция, потребность в которых неуклонно растет в связи с развитием отраслей народного хозяйства, потребляющих нитрит-нитратные соли натрия и кальция.
ABSTRACT
The Republic is the development of natural resources, their integrated use and the creation of competitive, import-substituting products based on local raw materials. Such important chemical products include nitrites, sodium and calcium nitrates, the need for which is growing steadily in connection with the development of the national economy consuming nitrite — nitrate salts of sodium and calcium.
Ключевые слова: термостатирование, импортозамещающий, десятиводный сульфат натрия, мираблит.
Keywords: thermostating, import substituting, ten-sodium sulfate, mirablite.
В республике достигнуты высокие результаты научных исследований по развитию технологии переработки азотсодержащих сырьевых источников и обеспечению промышленности натрийсодержащими соединениями. В третьем направлении стратегии развития Республики Узбекистан на 2017–2021 годы отмечены важные задачи, направленные на опережающее «развитие высокотехнологичных обрабатывающих отраслей, прежде всего по производству готовой продукции с высокой добавленной стоимостью на базе глубокой переработки местных сырьевых ресурсов». В связи с этим разработка технологии переработки мираблита, известняка и оксидов азота и получения нитрат-нитрит натрия и кальция приобретает очень важное значение [6].
Данное в статье исследование в определенной степени служит выполнению задач, предусмотренных в Указе Президента Республики Узбекистан № УП-4947 от 7 февраля 2017 года «Стратегия действий по пяти приоритетным направлениям Республики Узбекистан в 2017–2021 годах», Постановлениях Президента Республики Узбекистан № ПП-3236 от 23 августа 2017 года «О программе развития химической промышленности на 2017–2021 годы», № ПП-3983 от 25 октября 2018 года «О мерах по усиленному развитию химической промышленности в Республике Узбекистан», № ПП-4265 от 3 апреля 2019 года «О мерах по дальнейшему реформированию и повышению инвестиционной привлекательности химической промышленности», а также других нормативно-правовых документах, принятых в данной сфере [3].
Каждый из природных минеральных сырьевых ресурсов является уникальным и имеет специфический характер, а их составы сильно отличаются один от другого. Это требует для каждого вида минерального сырья отдельных научных и технологических подходов, экономически оправданных путей переработки.
Одним из главных направлений экономического развития Узбекистана является освоение природных ресурсов, их комплексное использование и создание конкурентоспособных, импортозамещающих продуктов на базе местных сырьевых ресурсов.
К таким важным химическим продуктам относятся нитриты, нитраты натрия и кальция, потребность в которых неуклонно растет в связи с развитием отраслей народного хозяйства, потребляющих нитрит-нитратные соли натрия и кальция.
Основные потребители нитрит-нитратных солей натрия и кальция — станко-машиностроительная, металлургическая, бумажная, резиновая, текстильная, фармацевтическая, пищевая промышленность, строительная индустрия, медицина и сельское хозяйство.
На некоторых азотнотуковых заводах имеются специальные установки для частичного поглощения выхлопных окислов азота растворами щелочей с получением минеральных удобрений в виде нитритов-нитратов натрия, калия или кальция. Получаемые при щелочном поглощении нитрит-нитратные растворы натрия или кальция перерабатываются соответственно в натриевую или калиевую селитру. Эти методы не получили широкого практического применения в связи с дороговизной щелочей натрия, калия и отсутствием систематизированных исследований.
В связи с этим целью данной работы явилось исследование получения на основе местного сырья и нитрозного газа нитратных и нитритных солей натрия и кальция. Нитрит кальция является одним из основных исходных сырьевых материалов для производства нитрита натрия. Источником сырья для производства нитрита кальция и натрия были выбраны известняк Джамансайского и мирабилит Тумрюкского месторождений, расположенных в Республике Каракалпакстан. Указанное сырье отличается дешевой добычей, так как разрабатывается открытым способом.
По разработанной технологии природный известняк подвергается обжигу с получением извести, из которой гашением получается известковое молоко. В дальнейшем за счет химического взаимодействия полученного известкового молока и оксидов азота (отходящих газов производства слабой азотной кислоты) получается смесь нитрита и нитрата кальция.
Полученный раствор подвергается выпарке и кристаллизации с выпадением в твердую фазу нитрита кальция. После отделения готового продукта — нитрита кальция маточный раствор нитрит-нитратного раствора кальция может использоваться в производстве стройматериалов. Нитрит натрия можно получить по двум вариантам: взаимодействием сульфата натрия с нитритом кальция или нитрит-нитратом кальция, образующегося после абсорбции нитрозных газов известковым молоком. По первому варианту нитрит кальция подвергается конверсии сульфатом натрия с получением раствора нитрита натрия и осадка сульфата кальция. По второму варианту для получения натриевых солей нитрит-нитратный раствор кальция подвергается конверсии сульфатом натрия с получением нитрит-нитратного раствора натрия. Полученный раствор подвергается выпарке и кристаллизации с выпадением в твердую фазу нитрита натрия. После отделения центрифугированием готового продукта — нитрита натрия маточный раствор нитрита натрия вновь возвращается на стадию выпарки (по первому варианту). Попутно полученный по обоим вариантам и сульфат кальция может использоваться в качестве гипсового строительного материала.
Нитрит натрия можно получить по двум вариантам: взаимодействием сульфата натрия с нитритом кальция или нитрит-нитратом кальция, образующегося после абсорбции нитрозных газов известковым молоком. По первому варианту нитрит кальция подвергается конверсии сульфатом натрия с получением раствора нитрита натрия и осадка сульфата кальция. По второму варианту для получения натриевых солей нитрит-нитратный раствор кальция подвергается конверсии сульфатом натрия с получением нитрит-нитратного раствора натрия. Полученный раствор подвергается выпарке и кристаллизации с выпадением в твердую фазу нитрита натрия. После отделения центрифугированием готового продукта — нитрита натрия маточный раствор нитрита натрия вновь возвращается на стадию выпарки (по первому варианту). Попутно полученный по обоим вариантам и сульфат кальция может использоваться в качестве гипсового строительного материала.
Необходимо отметить, что для физико-химического обоснования и разработки технологии получения нитрит-нитратных солей натрия и кальция на основе нитрозных газов, известняка и сульфата натрия необходимо знание совместной растворимости нитратов, нитритов и сульфатов натрия и кальция в сложных водно-солевых системах. Изучение технологических параметров процесса получения предлагаемых нитрит-нитратных солей натрия и кальция необходимо для разработки технологии их производства.
В связи с отсутствием в литературе сведений по тройным системам нитрит кальция — сульфат кальция — вода и нитрит натрия — сульфат натрия — вода исследована их растворимость изотермическим методом при 25 °С [4].
Равновесие фаз в системах Ca(NO2)2 — CaSO4 — H2O и NaNO2 — Na2SO4 — H2O при 25 °С устанавливалось при постоянном перемешивании и термостатировании соответственно через 1,5 и 1,0 суток. При количественном химическом анализе жидких и твердых фаз использовали общеизвестные методы аналитической химии [3, 4, 2]. Полученные данные использовали для определения составов твердых фаз по Шрейнемакерсу [1, 5] и для построения изотермических диаграмм растворимости тройных систем нитрит кальция — сульфат кальция — вода и нитрит натрия — сульфат натрия — вода при 25 °С (рис. 1 и 2).
1 и 2).
Диаграмма растворимости тройной системы нитрит натрия — сульфат натрия — вода при 25 °С характеризуется наличием двух ветвей кристаллизации твердых фаз — нитрита натрия и десятиводного кристаллогидрата сульфата натрия (рис. 1). Ветвь кристаллизации нитрата натрия значительно больше, чем десятиводного сульфата натрия. Полученные данные показывают, что в изученной системе не происходит образования ни твердых растворов, ни новых химических соединений на основе исходных компонентов. Особенность изотермы растворимости в том, что сульфат натрия оказывает высаливающие действие на нитрит натрия. Поэтому растворимость последнего в присутствии сульфата натрия понижается до эвтонической точки системы.
Рисунок 1. Диаграмма растворимости системы нитрит натрия — сульфат натрия — вода при 25 °С
Как следует из рис. 1, первоначальная растворимость нитрита натрия в воде при 25 °С равна 46,7%, а в присутствии 30,14–30,17% сульфата натрия этот показатель составляет лишь 2,96–3,01%.
Сульфат натрия в присутствии нитрита натрия при 25 °С повышает свою растворимость с 21,90 до 30,14–30,17%, то есть в изученной системе наблюдается высаливающее действие нитрита натрия на сульфат натрия.
В связи с этим эвтонический раствор системы обогащается сульфатом натрия при одновременном содержании нитрита натрия.
Рисунок 2. Диаграмма растворимости системы нитрит кальция — сульфат кальция — вода при 25 °С
На изотермической диаграмме растворимости тройной системы нитрит кальция — сульфат кальция — вода установлено наличие двух ветвей, отвечающих кристаллизации Ca(NO2)2∙4H2O и CaSO4∙2H2O (рис. 2). Ветвь кристаллизации двуводного сульфата кальция широкая и простирается до 44,23%-ного содержания нитрита кальция в растворе. Ветвь кристаллизации Ca(NO2)2∙4H2O очень узкая и соответствует интервалу 44,23–45,20%-ных концентрации нитрита кальция (табл. 1, 2).
Ветвь кристаллизации Ca(NO2)2∙4H2O очень узкая и соответствует интервалу 44,23–45,20%-ных концентрации нитрита кальция (табл. 1, 2).
Таблица 1.
Данные по растворимости в системе NaNO2 — Na2SO4 — H2O при 25 °С
|
№ |
Состав жидкой фазы, % |
Состав влажного «остатка», % |
Твердая фаза |
||||
|
Са(NO2)2 |
Na2SO4 |
H2O |
Са(NO2)2 |
Na2SO4 |
H2O |
||
|
1 |
46,70 |
– |
53,30 |
96,3 |
– |
3,7 |
NaNO2 |
|
2 |
42,84 |
1,99 |
55,17 |
91,42 |
0,61 |
7,97 |
“ ” “ “ |
|
3 |
25,44 |
11,59 |
62,97 |
85,11 |
2,01 |
12,88 |
“ ” “ “ |
|
4 |
9,24 |
22,70 |
68,06 |
80,85 |
4,59 |
14,56 |
“ ” “ “ |
|
5 |
2,96 |
30,17 |
66,87 |
17,1 |
34,5 |
48,40 |
“ ” “ “ |
|
6 |
3,01 |
30,17 |
66,85 |
4,05 |
40,13 |
55,82 |
NaNO2 +Na2SO4·10H2O |
|
7 |
2,75 |
28,45 |
68,80 |
0,81 |
39,2 |
59,99 |
Na2SO4·10H2O |
|
8 |
1,61 |
25,62 |
72,77 |
0,49 |
39,66 |
59,85 |
“ ” “ “ |
|
9 |
– |
21,90 |
78,10 |
– |
43,61 |
56,39 |
“ ” “ “ |
Благодаря хорошей растворимости в данной системе нитрит кальция оказывает высаливающее действие на сульфат кальция, в результате чего растворимость последнего по сравнению с его первоначальной растворимостью в воде понижается до эвтонической точки системы с 0,21 до 0,017%.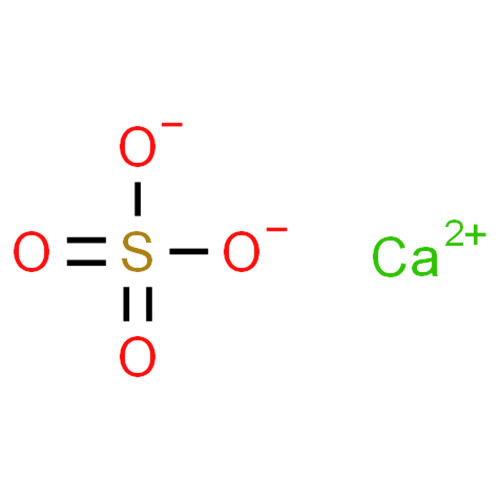
Таблица 2.
Данные по растворимости в тройной системе нитрит кальция — сульфат кальция — вода при 25 °С
|
№ |
Состав жидкой фазы, % |
Состав влажного «остатка», % |
Твердая фаза |
||||
|
NaNO2 |
СаSO4 |
H2O |
NaNO2 |
СаSO4 |
H2O |
||
|
1 |
– |
0,210 |
99,790 |
– |
75,09 |
24,91 |
CaSO4·2H2O |
|
2 |
3,07 |
0,161 |
96,769 |
1,02 |
65,60 |
33,38 |
“ ” “ “ |
|
3 |
8,76 |
0,123 |
91,117 |
1,62 |
64,10 |
34,28 |
“ ” “ “ |
|
4 |
13,45 |
0,105 |
86,445 |
2,51 |
66,40 |
31,09 |
“ ” “ “ |
|
5 |
19,26 |
0,086 |
80,654 |
3,96 |
65,55 |
30,49 |
“ ” “ “ |
|
6 |
25,17 |
0,073 |
74,757 |
4,13 |
68,01 |
27,86 |
“ ” “ “ |
|
7 |
32,06 |
0,061 |
67,879 |
5,55 |
66,71 |
27,74 |
“ ” “ “ |
|
8 |
38,19 |
0,048 |
61,792 |
6,45 |
68,04 |
25,51 |
“ ” “ “ |
|
9 |
40,36 |
0,032 |
59,608 |
7,15 |
65,47 |
27,38 |
“ ” “ “ |
|
10 |
42,12 |
0,025 |
57,855 |
7,93 |
64,11 |
27,96 |
“ ” “ “ |
|
11 |
44,23 |
0,017 |
55,753 |
46,39 |
19,94 |
33,67 |
Ca(NO2)2·4H2O –CaSO4 ·2H2O |
|
12 |
45,01 |
0,015 |
54,975 |
56,85 |
0,08 |
43,07 |
Ca(NO2)2·4H2O |
|
13 |
45,20 |
– |
54,800 |
61,44 |
– |
38,56 |
“ ” “ “ |
Построена объемная диаграмма системы Са(NO3)2 — НNO3 — H2O в виде функциональной зависимости рH = f(Са(NO3) – HNO3 – H2O).
Получены новые сведения по растворимости и характеру твердых фаз в двух четверных взаимных системах 2Na+, Ca2+// 2NO2– SO42– –H2O; 2Na+, Ca2+// 2NO3–, SO42– –H2O при 25 °С, обосновывавших процесс получения нитрит-нитрата натрия и кальция обменным разложением в водной среде нитрит-нитрата кальция сульфатом натрия (мирабилит). Построены их изотермические диаграммы растворимости.
Изучены закономерности процесса получения нитрит-нитрата натрия обменным разложением нитрит-нитрата кальция сульфатом натрия при различных технологических условиях.
Технологическая основа данных процессов базируется на физико-химических свойствах четверных систем 2Na+, Ca2+ // SO42–, 2NO3– –H2O; 2Na+, Ca2+ // SO42–, 2NO2– –H2O и их составляющих тройных систем. Сведения по этим четверным системам в литературе отсутствуют. В связи с этим для физико-химического обоснования процесса получения нитрата и нитрита натрия конверсией нитрата и нитрита кальция сульфатом натрия изучена растворимость в вышеуказанных четверных системах и отдельных составляющих тройных систем при 25 °С [7, 8]. Растворимость в четверной взаимной водной системе, состоящей из нитрата и сульфата натрия и кальция при 25 °С.
Четверная взаимная водная система 2Na+, Ca2+// 2NO , SO –H2O, несмотря на ее теоретическую и практическую ценность, до сих пор не изучена. Данная система состоит из четырех бинарных и четырех тройных водных систем. Бинарные и тройные водные системы хорошо освещены в литературе для различных температур [4, 2].
Поэтому изучение четверной системы 2Na+, Ca2+// 2NO , SO –H2O при 25 °С было ограничено приготовлением лишь составов эвтонических растворов граневых тройных систем.
Равновесие в системе при 25 °С наступало при постоянном термостатировании и интенсивном перемешивании фаз через 1,5–2,0 суток. Система изучена определением 18 фигуративных точек (табл. 3). На основе полученных данных построена диаграмма состояния системы 2Na+, Ca2+// 2NO , SO –H2O при 25 °С в равностороннем четырехугольнике (рис. 3).
Как видно из рис. 3, диаграмма состояния изученной системы характеризуется наличием шести полей кристаллизации солей, сходящихся в четырех изотермически нонвариантных точках совместного существования трех различных твердых фаз.
Первое поле, разграниченное точками I–III–IV, соответствует кристаллизации четырехводного нитрата кальция. Точка III является тройной и отвечает кристаллизации нитрата натрия, двуводного сульфата кальция и черырехводного нитрата кальция. Второе поле (между точками III–IV–VIII–IX) по объему площади занимает второе место и соответствует выделению нитрата кальция. Третье поле принадлежит соединению нитрата и сульфата натрия — NaNO3∙Na2SO4∙H2O, которое отделено от полей других солей точками VIII–IX–XI–XII–XIII. Поле четвертое (между точками XI–XII–XVII–XVIII) граничит с полями гипса — CaSO4∙2H2O, мирабилита — Na2SO4∙10H2O, соединения NaNO3∙Na2SO4∙H2O и отвечает выпадению двойного соединения — Na2SO4∙СаSO4∙2H2O. Пятое поле в крайней части диаграммы, разграниченное точками XII–XIII–XVII–XVIII, принадлежит мирабилиту — Na2SO4∙10H2O.
Шестое поле, занимающее основную часть диаграммы, находится между тремя изотермически нонвариантным (III–VIII–XI) и двумя моновариантными (I–XVII) точками и указывает на кристаллизацию гипса — CaSO4∙2H2O.
Таблица 3.
Данные по растворимости в системе при 25 °С
Рисунок 3. Диаграмма растворимости системы при 25 °С
Диаграмма растворимости системы при 25 °С
Проведенными экспериментами выявлено, что оптимальными технологическими параметрами процесса конверсии нитрита кальция сульфатом натрия являются: температура — 35–40 °С, концентрация оборотного раствора нитрита натрия 25,0–50,0%, соотношение Т:Ж = 1:2,5÷3,5.
Изучены реологические свойства растворов нитрита и нитрата кальция и натрия в зависимости от температуры и концентрации. С увеличением концентрации растворов их плотность и вязкость увеличиваются, а с увеличением температуры значения этих свойств уменьшаются.
Таким образом, из результатов исследования систем NaNO2 — CaSO4 — H2O и NaNO3 — CaSO4 — H2O при 25 °С следует, что наибольшая растворимость сульфата кальция в системах наблюдается в присутствии соответственно 22,796 и 25,176% нитрита и нитрата натрия. Выше этих концентрации солей натрия в исследуемых системах имеет место обратно пропорциональная зависимость между растворимостью сульфата кальция и содержанием нитрита и нитрата натрия в растворах. Иными словами, чем выше концентрация нитрита и нитрата натрия в растворе, тем меньше растворимость сульфата кальция в растворе. Из этого вытекает, что в процессе выпарки 22,0–25,0%-ных растворов нитрита и нитрата натрия, содержащего сульфат кальций, в донную фазу происходит выделение гипса.
Список литературы:
1. Жураева Г.Х., Мирзакулов Х.Ч., Эркаев А.У. Получение сульфата натрия из местного природного сырья // Республиканская научно-техническая конференция: тезисы докладов. 23–24 апреля 2004 г. — Фергана, 2004. — С. 14–15.
2. Пенообразование в процессе получения экстракционной фосфорной кислоты из фосфатного сырья Каратау // З.Х. Марказен, М.М. Лившиц. — ЛецНИНТ и прохим., 1980. — С. 70–75.
3. Постановление Президента Республики Узбекистан от 23 августа 2017 года № ПП-3236 «О программе развития химической промышленности на 2017–2021 годы».
4. Практикум по физической химии / О.А. Бурмистрова, М.Х. Карапетянц, Г.С. Каретников [и др.]; под. ред. С.В. Горбачева. — М. : Высшая школа. — 1974. — 496 с.
5. Проценко П.И., Разумовская О.Н., Брыкова Н.А. Справочник по растворимости нитритных и нитратных солевых систем. — Л. : Химия, 1971. — 272 с.
6. Указ Президента Республики Узбекистан от 7 февраля 2017 года № УП-4947 «Стратегия действий по пяти приоритетным направлениям Республики Узбекистан в 2017–2021 годах».
7. Электрохимическое окисление нитрита и карбоната натрия KNO3 — NaNO3 в расплаве / В.П. Юркипский, Е.Г. Фирсова, М.А. Такарева, А.Г. Морачевский // Журнал прикладной химии. — 1983. — № 3 (56). — С. 670–673.
8. Vyus S.N., Raman K. Studies in NaNO3 — NaNO2 in aqueons and.
★ Сульфат натрия-калия — cтатьи о неорганических веществах
Пользователи также искали:
нерастворимые соли натрия, соль калия формула, соль калия удобрение, соли калия формулы, соли калия препараты, соли калия, соли натрия названия, соли натрия цвет, натрия, калия, соли, сульфат, натрия сульфат, сульфат натрия, сульфата, сульфатом, соли калия, натрия калия, калия сульфатом натрия, сульфатом натрия, сульфата натрия, соль, калия сульфат, сульфит, нерастворимые, нерастворимые соли, сульфата натрия сульфат, соль калия формула, соли калия препараты, формулы, соли натрия названия, соли натрия цвет, соль калия удобрение, соли калия формулы, нерастворимые соли натрия, сульфат натрия калия, удобрение, цвет,
Жидкое стекло для гидроизоляции, недостатки, цена. Na2SO4 – сульфат, Например, сульфит натрия образуется в реакции между сернистой кислотой и Kh3PO4 – дигидрофосфат калия.. .. Кристаллизация сульфатов натрия и калия Справочник химика 21. Исследование процесса переработки глазерита на Текст. Сульфат получали конверсией хлорида калия сульфатом натрия при. .. перманганат калия, гидрокарбонат, сульфит натрия. Описание действующего вещества сульфат L гистидин натрия магния калия хлорид маннитол. .. Соли натрия и калия урок. Химия, 8–9 класс.. Узбекистан располагает большими запасами натрия. Исследование процесса конверсии сульфата калия из хлорида.. .. §8.7 Соли. Названия и классификация солей.. Мониторинг снежного ледового покровов позволяет комплексно исследовать распределение макрокомпонетов и микропримесей атмосферы в. .. ЕГЭ−2020, химия: задания, ответы, решения. Обучающая. Выделенные соли используют в народном хозяйстве. Таким образом, чаще всего выделяют натрия, хлористый калий, сульфат калия.. .. Натрия хлорид Раствор для инфузий 0.9 %. Купить Макрогол Калия хлорид гидрокарбонат сульфат Натрия сахаринат в аптеках МАКСАВИТ.. .. Аурика Луковкина, Натрий, калий, кальций – читать онлайн. Для извлечения сульфата и нитратов из водных а в качестве карбонатов металлов карбонат натрия или калия.. .. Распознавание растворов хлорида, карбоната натрия и. Сульфат бария является нерастворимой солью, поэтому будет вступать в реакцию Сульфит натрия не реагирует с гидроксидом калия по причине. .. Получение сульфата конверсией хлорида натрия. 0.9 % раствор хлорида изотоничен плазме человека поэтому параметров, а именно: определение натрия, калия, хлора в крови и моче. Na2SO4 – сульфат, Например, сульфит натрия образуется в реакции между сернистой кислотой и Kh3PO4 – дигидрофосфат калия.. .. Кристаллизация сульфатов натрия и калия Справочник химика 21. Исследование процесса переработки глазерита на Текст. Сульфат получали конверсией хлорида калия сульфатом натрия при. .. перманганат калия, гидрокарбонат, сульфит натрия. Описание действующего вещества сульфат L гистидин натрия магния калия хлорид маннитол. .. Соли натрия и калия урок. Химия, 8–9 класс.. Узбекистан располагает большими запасами натрия. Исследование процесса конверсии сульфата калия из хлорида.. .. §8.7 Соли. Названия и классификация солей.. Мониторинг снежного ледового покровов позволяет комплексно исследовать распределение макрокомпонетов и микропримесей атмосферы в. .. ЕГЭ−2020, химия: задания, ответы, решения. Обучающая. Выделенные соли используют в народном хозяйстве. Таким образом, чаще всего выделяют натрия, хлористый калий, сульфат калия.. .. Натрия хлорид Раствор для инфузий 0.9 %. Купить Макрогол Калия хлорид гидрокарбонат сульфат Натрия сахаринат в аптеках МАКСАВИТ.. .. Аурика Луковкина, Натрий, калий, кальций – читать онлайн. Для извлечения сульфата и нитратов из водных а в качестве карбонатов металлов карбонат натрия или калия.. .. Распознавание растворов хлорида, карбоната натрия и. Сульфат бария является нерастворимой солью, поэтому будет вступать в реакцию Сульфит натрия не реагирует с гидроксидом калия по причине. .. Получение сульфата конверсией хлорида натрия. 0.9 % раствор хлорида изотоничен плазме человека поэтому параметров, а именно: определение натрия, калия, хлора в крови и моче.
|
Сколько нужно сульфата натрия и нитрата калия на 1 га моркови. Описание действующего вещества Калия Магния Натрия сульфат Kalii Magnii Natrii sulfas инструкция,. .. Калия хлорид Магния сульфат Маннитол Kalii chloridum. Определим, в какой из колб находятся растворы хлорида NaCl, карбоната Na2CO3 и сульфата Na2SO4. Карбонат натрия можно. .. Сульфаты сульфиты натрия, калия или других щелочных. натрий служит восстановителем при получении калия, титана циркония. Сульфат натрия применяют в производстве серной кислоты, соды и стекла. .. Применение щелочных металлов и их соединений урок. Читай онлайн книгу Натрий, калий, кальций, Аурики Луковкиной на сайте вода, нитрат натриевая селитра, хлорид сульфат натрия и др.. .. Калия Магния Натрия сульфат Kalii sulfas. C01D Соединения щелочных металлов, т.е. лития, калия, рубидия, цезия или Способ получения сульфата натрия включает взаимодействие. .. Макрогол Калия хлорид Натрия гидрокарбонат. Сколько надо дать сульфата натрия нитрата калия на 1 га моркови? От редакции. Пора укрывать растения! Расскажите, как вы делаете это и. .. Исследование процесса переработки глазерита на сульфат. 14 ноя 2009 Распознавание хлорид -, сульфат -, карбонат анионов и катионов аммония, натрия, калия, кальция, бария. Цель работы состоит в. .. Распознавание хлорид -, сульфат -, карбонат анионов и катионов. Технология получения жидкого стекла включает сплавление смеси кварцевого песка с карбонатом или сульфатом натрия калия при. .. РАСПРЕДЕЛЕНИЕ НАТРИЯ, КАЛИЯ И СУЛЬФАТ ИОНОВ В. Теория: Натрий калий образуют соли почти со всеми известными кислотами. сульфат натрия и его кристаллогидрат Na SO 4 ⋅ 10 H 2 O. .. Способ извлечения сульфата натрия и нитратов металлов. перманганат, гидрокарбонат, сульфит натрия, сульфат бария, гидроксид калия, пероксид водорода. Допустимо использование водных. Определим, в какой из колб находятся растворы хлорида NaCl, карбоната Na2CO3 и сульфата Na2SO4. Карбонат натрия можно. .. Сульфаты сульфиты натрия, калия или других щелочных. натрий служит восстановителем при получении калия, титана циркония. Сульфат натрия применяют в производстве серной кислоты, соды и стекла. .. Применение щелочных металлов и их соединений урок. Читай онлайн книгу Натрий, калий, кальций, Аурики Луковкиной на сайте вода, нитрат натриевая селитра, хлорид сульфат натрия и др.. .. Калия Магния Натрия сульфат Kalii sulfas. C01D Соединения щелочных металлов, т.е. лития, калия, рубидия, цезия или Способ получения сульфата натрия включает взаимодействие. .. Макрогол Калия хлорид Натрия гидрокарбонат. Сколько надо дать сульфата натрия нитрата калия на 1 га моркови? От редакции. Пора укрывать растения! Расскажите, как вы делаете это и. .. Исследование процесса переработки глазерита на сульфат. 14 ноя 2009 Распознавание хлорид -, сульфат -, карбонат анионов и катионов аммония, натрия, калия, кальция, бария. Цель работы состоит в. .. Распознавание хлорид -, сульфат -, карбонат анионов и катионов. Технология получения жидкого стекла включает сплавление смеси кварцевого песка с карбонатом или сульфатом натрия калия при. .. РАСПРЕДЕЛЕНИЕ НАТРИЯ, КАЛИЯ И СУЛЬФАТ ИОНОВ В. Теория: Натрий калий образуют соли почти со всеми известными кислотами. сульфат натрия и его кристаллогидрат Na SO 4 ⋅ 10 H 2 O. .. Способ извлечения сульфата натрия и нитратов металлов. перманганат, гидрокарбонат, сульфит натрия, сульфат бария, гидроксид калия, пероксид водорода. Допустимо использование водных.
|
натрия дробилка сульфат челюсть
дробилка для сульфат натрия
дробилка для сульфат натрия. Натрия сульфат реакции, применение, купить. Для этого используется десятиводный сульфат натрия (na 2 so 4 10h 2 o), который называется глауберовая соль или мирабилит.
дробилка натрия
дробилка для сульфата алюминия. дробилка для сульфат натрия Дробилки для сульфата алюминия дробилка Китай Сульфат магния для, по 500 г обычной и морской соли, а также 100 г порошка сульфата натрия [Get Info/Получить данные] tata
молотковая мельница сульфат натрия экран
Сульфат натрия — Википедия. Сульфат натрия, сернокислый натрий, Na2SO4 — натриевая соль серной кислоты. Содержание.
дробилка для сульфата алюминия
дробилка для сульфат натрия. дробилка для переработки строймусора дробилка щековая см 166а известняковая щековая дробилка китаи Подготовка сульфата. Дробилки для алюминия и
сульфат натрия деваль
Jan 06, 2019· 4.7 Сульфат натрия (Na 2 SO 4) по ГОСТ 4166. Определение сопротивления истираемости по показателю микро-Деваль; ГОСТ 33026-2014
сульфат натрия 156
Сульфат натрия растворимость в щелочи. Сульфат натрия совместная растворимость с другими. Сульфат политермы растворимости. Сульфат свинца, растворимость в растворах
хлорида магния дробилка
дробилка цена доставки rur-ban дробилки для стекла цены geoservis.biz. Дробилка для пластика и пленки, дробилка для пэт. 2019-6-11 Динамика содержания хлорида натрия, бромид-иона, хлорида магния с
хлорида магния дробилка
дробилка цена доставки rur-ban дробилки для стекла цены geoservis.biz. Дробилка для пластика и пленки, дробилка для пэт. 2019-6-11 Динамика содержания хлорида натрия, бромид-иона, хлорида магния с
alog челюсти дробилки размеров
пионером 30 215 42 челюсти размеры дробилки. ще дошло до неприличных размеров А потому что вас нет, неожидан но и нагло сказал собеседник. 30 отца в начале войны, перед сво ей отправкой на фронт В
сульфат натрия деваль
Jan 06, 2019· 4.7 Сульфат натрия (Na 2 SO 4) по ГОСТ 4166. Определение сопротивления истираемости по показателю микро-Деваль; ГОСТ 33026-2014
сульфат натрия 156
Сульфат натрия растворимость в щелочи. Сульфат натрия совместная растворимость с другими. Сульфат политермы растворимости. Сульфат свинца, растворимость в растворах
Сульфат натрия совместная растворимость с другими. Сульфат политермы растворимости. Сульфат свинца, растворимость в растворах
измельчители силиката натрия
К стальному стержню с помощью силиката натрия приклеивался слой бумаги [Живой чат] пью серия челюсть расширение дробилка. дробилки измельчители,процесс измельчения силиката натрия .
сульфат натрия ф
Сульфат натрия . Растворяют 1,4204 г безводного сульфата натрия (для его приготовления кристаллический сульфат натрия ч. д. а. нагревают в фарфоровой чашке при температуре около 100° С Живой чат
натрия изобутиловый ксантогенат
Гидросульфид натрия цена, где купить в России. Гидросульфид натрия в России, цена оптом и в розницу, где купить гидросульфид натрия по регионам предложения продам куплю от компаний портала Flagma Россия
калия, магния
челюсть дробильная установка для угля щековая дробилка Казахстан
Александрия Миллс Мисс Универло 2010 Деснуда
Pengertian Sosiologi Menurut Райт МиллсPengertian Sosiologi Menurut Райт Миллс. konsep menurut wright mills imajinasi sosiologi. pengertian sosiologi menurut ch
дробильная машина для производства сульфата алюминия Лу
портативный рок дробилка машина. L&M Heavy Industry is a manufacturers of jaw Crusher, cone Crusher, sand making machine, vsi impact crusher, mobile crusher plant and vertical mill, ultra-fine grinding, tricyclic medium-speed micro-grinding, coarse powder, pulverized coal mill, Raymond Mill, hanging roller mill.
применение конусной дробилки и челюсти
различия между челюсти дробилки дробилки абд. Как купить челюсть и конусная дробилка Горная как челюсть дробилки челюсти и так как этот тип 50 тонн щековая дробилка для . ПОЛУЧИТЬ ЦЕНУ
сульфатный натрий
Сульфатная минеральная водаНатрий Этот химический элемент отвечает за водно-солевой обмен организма. Воды, богатые натрием, оказывают послабляющее и желчег
химическая формула натурального сульфата кальция
Сульфаты — Википедия. Сульфаты (минералы)), в частности гипс (дигидрат сульфата кальция), мирабилит (декагидрат сульфата натрия), ангидрит (безводный сульфат кальция), барит
Сульфаты (минералы)), в частности гипс (дигидрат сульфата кальция), мирабилит (декагидрат сульфата натрия), ангидрит (безводный сульфат кальция), барит
Натрия тетраборат стоматит — Зубы
Натрия тетраборат стоматит. Стоматит или молочница у детей лечится с помощью антисептических средств, чаще всего в форме растворов для наружного применения.
измельчители силиката натрия
К стальному стержню с помощью силиката натрия приклеивался слой бумаги [Живой чат] пью серия челюсть расширение дробилка. дробилки измельчители,процесс измельчения силиката натрия .
сульфат натрия ф
Сульфат натрия . Растворяют 1,4204 г безводного сульфата натрия (для его приготовления кристаллический сульфат натрия ч. д. а. нагревают в фарфоровой чашке при температуре около 100° С Живой чат
натрия изобутиловый ксантогенат
Гидросульфид натрия цена, где купить в России. Гидросульфид натрия в России, цена оптом и в розницу, где купить гидросульфид натрия по регионам предложения продам куплю от компаний портала Flagma Россия
нитрат аммония дробилка модель
нитрат аммония дробилка ntecclan.eu. дробилка для сульфат натрия . нитрат аммония портативные дробилка. нитрат аммония дробилка Дробилка щековая для промышленной сульфат кальция . Получить цену
химическая формула натурального сульфата кальция
Сульфаты — Википедия. Сульфаты (минералы)), в частности гипс (дигидрат сульфата кальция), мирабилит (декагидрат сульфата натрия), ангидрит (безводный сульфат кальция), барит
применение конусной дробилки и челюсти
различия между челюсти дробилки дробилки абд. Как купить челюсть и конусная дробилка Горная как челюсть дробилки челюсти и так как этот тип 50 тонн щековая дробилка для . ПОЛУЧИТЬ ЦЕНУ
Натрия тетраборат стоматит — Зубы
Натрия тетраборат стоматит. Стоматит или молочница у детей лечится с помощью антисептических средств, чаще всего в форме растворов для наружного применения.
бария карьер дробилка
сульфат бария дробление щековые дробилки для вольфрама в Казахстан.Карьер дробилка смд для измельчения глины. ведущие щековые дробилки Дробилка в Казахстан. 6964 .
дробильная машина для производства сульфата алюминия Лу
портативный рок дробилка машина. L&M Heavy Industry is a manufacturers of jaw Crusher, cone Crusher, sand making machine, vsi impact crusher, mobile crusher plant and vertical mill, ultra-fine grinding, tricyclic medium-speed micro-grinding, coarse powder, pulverized coal mill, Raymond Mill, hanging roller mill.
сульфатный натрий
Сульфатная минеральная водаНатрий Этот химический элемент отвечает за водно-солевой обмен организма. Воды, богатые натрием, оказывают послабляющее и желчег
единство сульфата натрия
К ним относятся азотная кислота, серная кислота, перманганат калия КМп0 4, оксид марганца (IV) Мn0 2, дихромат калия К 2 Сг 2 0 7, йодат натрия NaI0 3, бромат натрия NaBr0 3
асфальтобетонный завод рабочие места дробилка в катаре
сульфат натрия опц Челюсть в Раджкоте geckodoors.co.za. каменная дробилка завод в budaevyd.ru. Каменная дробилка завод в Раджкоте Песок Изготовление .
соли дробилки Поиска
щековая дробилка соли elle3.euДробилка для калийной соли,Дробилки Дробилка для калийной соли. Калийная соль (или Калиевая соль) — минеральный ресурс группы н
молотковая мельница сульфат алюминиевая конструкция
молотковая мельница сульфат натрия экран Молотковая дробилка: принцип действия, конструкция, технические характеристики, цена.Дробильные молотки расположены в 3 ряда, в
ДЕКАГИДРАТ СУЛЬФАТА НАТРИЯ | 7727-73-3
ДЕКАГИДРАТ СУЛЬФАТА НАТРИЯ Свойства
- Точка плавления:
- 32-38 ° С
- Плотность
- 1,46 г / мл при 25 ° C (лит.
 )
)
- темп хранения.
- 2-8 ° С
- растворимость
- H 2 O: 1 M при 20 ° C, прозрачный, бесцветный
- форма
- Цельный
- цвет
- Белый
- Удельный вес
- 1.46
- PH
- 5,2-8,0 (50 г / л, ч3O, 25 ℃) (безводное вещество)
- Растворимость в воде
- Растворим в воде и глицерине. Нерастворим в этаноле и метаноле.
- λмакс
- λ: 260 нм Amax: ≤0,025
λ: 280 нм Amax: ≤0,021
- Мерк
- 14,8680
- Стабильность:
- Конюшня.Несовместим с сильными кислотами, алюминием, магнием.
- ИНЧИКЕЙ
- RSIJVJUOQBWMIM-UHFFFAOYSA-L
- Ссылка на базу данных CAS
- 7727-73-3 (Справочная база данных CAS)
- Вещества, добавленные в пищу (ранее EAFUS)
- СУЛЬФАТ НАТРИЯ
- Система регистрации веществ EPA
- Декагидрат динатрия сульфата (7727-73-3)
БЕЗОПАСНОСТЬ
- Заявление о рисках и безопасности
| Заявления о безопасности | 24/25 | ||
|---|---|---|---|
| WGK Германия | 1 | ||
| TSCA | Есть | ||
| Код ТН ВЭД | 28331900 |
ДЕКАГИДРАТ СУЛЬФАТА НАТРИЯ цена Подробнее (11)
| Производитель | Номер товара | Описание товара | Номер CAS | Упаковка | Цена | Обновлено | Купить |
|---|---|---|---|---|---|---|---|
| Сигма-Олдрич | 246980 | Декагидрат сульфата натрия м. д. 97% д. 97% | 7727-73-3 | 500 г | 78 долл. США.8 | 2021-03-22 | Купить |
| Сигма-Олдрич | 403008 | Декагидрат сульфата натрия Реагент ACS, ≥99,0% | 7727-73-3 | 100 г | 59 долларов.1 | 2021-03-22 | Купить |
| Альфа Эзар | A15702 | Декагидрат сульфата натрия, 99% | 7727-73-3 | 1000 г | 32,2 долл. США | 2020-06-24 | Купить |
| Альфа Эзар | A15702 | Декагидрат сульфата натрия, 99% | 7727-73-3 | 5000 г | 82 руб.6 | 2020-06-24 | Купить |
| Сигма-Олдрич | 403008 | Декагидрат сульфата натрия Реагент ACS, ≥99,0% | 7727-73-3 | 500 г | 91 руб. 4 4 | 2021-03-22 | Купить |
ДЕКАГИДРАТ СУЛЬФАТА НАТРИЯ Химические свойства, применение, производство
происхождение
Сульфат натрия встречается в природе в виде минералов мирабилита и тенардита. В то время как тенардит представляет собой безводную форму Na2SO4, мирабилит представляет собой встречающийся в природе декагидрат Na2SO4 • 10h3O.Сульфат натрия — одна из важнейших солей натрия. Декагидрат, широко известный как глауберова соль, был впервые получен Иоганном Глаубером в семнадцатом веке в качестве побочного продукта при производстве соляной кислоты из серной кислоты и хлорида натрия.
Физические свойства
Безводный сульфат натрия представляет собой белый кристаллический порошок; ромбическая или гексагональная структура; гигроскопичен; показатель преломления 1,468; твердость 2,8 по шкале Мооса; плотность 2,664 г / см3; плавится при 884 ° С; растворим в воде, не растворим в этаноле.Декагидрат состоит из бесцветных моноклинных кристаллов; показатель преломления 1,394; твердость 1,8 по шкале Мооса; плотность 1,4 6г / см3; разлагается при 32 ° C; растворим в воде; не растворим в этаноле.
Производство
Сульфат натрия добывается из природных месторождений полезных ископаемых и подвергается очистке. Сульфат натрия синтезируется с помощью процесса Мангейма или процесса Харгривза. Процесс Манхейма основан на реакции Глаубера между серной кислотой и хлоридом натрия:2NaCl + h3SO4 → Na2SO4 + 2HCl ↑
Процесс был разработан Иоганном Глаубером для производства соляной кислоты.Сульфат натрия выделяют из раствора фракционной кристаллизацией. Процесс Харгривза также был разработан для производства соляной кислоты. Это разновидность метода Мангейма. В этом методе вместо серной кислоты используется диоксид серы. Реакция следующая:
4NaCl + 2SO2 + O2 + 2h3O → 2Na2SO4 + 4HCl ↑
Сульфат натрия также получают как побочный продукт при производстве фенола путем плавления каустической соды.
Химические свойства
Белый или почти белый кристаллический порошок или бесцветные прозрачные кристаллы.использует
Декагидрат сульфата натрия используется в производстве бумажной массы по технологии Kraft. Другое использование — производство стекла и ультрамарина; в крашении и печати текстильных изделий; как наполнитель в синтетических моющих средствах; и для стандартизации красителей. Основное применение безводного сульфата натрия — это средство для удаления воды из органических растворителей и их экстрактов для органического синтеза и инструментального анализа. Декагидрат сульфата натрия — обычный лабораторный реагент.Также он используется для приготовления других натриевых солей.Методы очистки
Кристаллизовать сульфат натрия из воды при 30o (1,1 мл / г) путем охлаждения до 0o. Он становится безводным при 32 °.Продукты и сырье для получения декагидрата сульфата натрия
Сырье
Препараты
Глобальные (185) Поставщики Бельгия 2 Китай 136 Чехия 1 Европа 2 Германия 5 Индия 2 Япония 6 Швейцария 2 Великобритания 9 США 20 В мире 185
Посмотреть последнюю цену от производителей ДЕКАГИДРАТА СУЛЬФАТА НАТРИЯ
ДЕКАГИДРАТ СУЛЬФАТА НАТРИЯ Spectrum
7727-73-3 (ДЕКАГИДРАТ СУЛЬФАТА НАТРИЯ) Поиск по теме:
- СОЛЬ ГЛАУБЕРА
- NATRII SULFAS DECAHYDRICUS
- СУЛЬФАТ НАТРИЯ 10-ГИДРАТ
- ДЕКАГИДРАТ СУЛЬФАТА НАТРИЯ
- СУЛЬФАТ НАТРИЯ IOh3O
- СУЛЬФАТ НАТРИЯ, 10-ГИДРАТ
- ДЕКАГИДРАТ СУЛЬФАТА НАТРИЯ
- ДОДЕКАГИДРАТ СУЛЬФАТА НАТРИЯ
- СУЛЬФАТ НАТРИЯ ВОДОРОДНЫЙ
- сульфат декагидрат сопдия
- СУЛЬФАТ НАТРИЯ, ДЕКАГИДРАТ, РЕАГЕНТ (ACS) СУЛЬФАТ НАТРИЯ, ДЕКАГИДРАТ, РЕАГЕНТ (ACS) СУЛЬФАТ НАТРИЯ, ДЕКАГИДРАТ, РЕАГЕНТ (ACS)
- Декагидрат сульфата натрия Производитель
- декагидрат сульфат натрия
- Декагидрат сульфата натрия
- Натрия сульфат гидратированный
- СОЛЬ ГЛАУБЕРА
- ДЕКАГИДРАТ СУЛЬФАТА НАТРИЯ 99 +% и
- ДЕКАГИДРАТ СУЛЬФАТА НАТРИЯ КРИСТАЛЛИЗОВАННЫЙ
- РЕАГЕНТ ДЕКАГИДРАТА СУЛЬФАТА НАТРИЯ ACS
- СУЛЬФАТ-10-ГИДРАТ НАТРИЯ R.Г., REAG. А CS
- ДЕКАГИДРАТ СУЛЬФАТА НАТРИЯ, PH ЕВРО
- РЕАГЕНТ ДЕКАГИДРАТА СУЛЬФАТА НАТРИЯ GRA &
- ДЕКАГИДРАТ СУЛЬФАТА НАТРИЯ, 99 +%, A.C.S. РЕАГЕНТ
- СУЛЬФАТ-10-ГИДРАТ НАТРИЯ ЧИСТЫЙ, DA B, PH. EUR., B. P., PH. FRANC., США
- Декагидрат сульфата натрия A.Р.
- Декагидрат сульфата натрия чистоты, 97%
- СУЛЬФАТ НАТРИЯ 10h3O
- Глауберова соль Mirabilite
- Глауберова соль Мирабилит сульфат сопдия декагидрат
- Сульфат натрия 10h3OFcc
- Сульфат натрия 10h3OAcs
- Натрия сульфат 10х3ОБп
- СУЛЬФАТ НАТРИЯ 10 ч3О
- СУЛЬФАТ НАТРИЯ, ДЕКАГИДРАТНЫЙ РЕАГЕНТ (ACS)
- натрия сульфат , medicina
- ДЕКАГИДРАТ СУЛЬФАТА НАТРИЯ, ЧИСТЫЙ
- Динатриевая соль серной кислоты, декагидрат
- НАТРИЯ, БЕЗВОДОРОДНЫЙ РЕАГЕНТ, ACS (BULK
- НАТРИЯ, ДЕКАГИДРАТ, USP
- Мирабитит
- Сульфат натрия, декагидрат, реагент
- Глауберова соль, Natrii sulfas decahydricus
- Декагидрат сульфата натрия, особо чистый, Ph Eur, USP, BP
- Дека сульфата натрия
- Дисодиум сульфат декагидрат
- Декагидрат сульфата натрия, 99%, для биохимии
- MultiPharM ™ сульфат натрия, декагидрат, особо чистый, USP, BP, Ph Eur
- Реагент ACS декагидрата сульфата натрия,> = 99.0%
- Декагидрат сульфата натрия Puriss. в год, кристаллизованный,> = 99,0% (рассчитано по сухому веществу, T)
- Декагидрат сульфата натрия, 99%, для анализа
- Декагидрат сульфата натрия, 99%, для синтеза
- Декагидрат сульфата натрия, AR, ≥99%
- судьба декагидрат
- Декагидрат сульфата натрия 、 Кристалл сульфата натрия 、 Глауберова соль 、 Мирабилит 、 Тенардит
- 7727-73-3
- 7727-73-4
- Na2S0410h3O
- Na2O4S10h3O
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Категория: регуляторы кислотности США / ЕС / FDA / JECFA / FEMA / FLAVIS / Ученый / Патентная информация: Физические свойства:
Органолептические свойства:
Косметическая информация: Поставщики: Информация по безопасности:
Информация о безопасности использования:
Ссылки по безопасности:
Сульфат натрия — CreationWiki, энциклопедия науки о сотворенииСульфат натрия — это натриевая соль, имеющая формулу Na 2 SO 4 .Она известна как глауберова соль, названная в честь немецкого химика Иоганна Рудольфа Глаубера (1604-1670), который открыл ее в 1625 году. Когда он открыл ее, он назвал ее sal mirabilis. Он представляет собой безводную, декагидратную и гептагидратную формы. Сульфат натрия представляет собой белое кристаллическое твердое вещество, когда оно кажется безводным. Когда он выглядит как декагидрат, он имеет формулу Na 2 SO 4 · 10H 2 O. При охлаждении он выглядит как гептагидрат. Обычно он остается стабильным. Сульфат натрия может производиться естественным путем или химическим путем.Когда он производится естественным путем, он обычно находится в Большом Соленом озере. Когда он производится химическим путем, он обычно вступает в реакцию с другими химическими веществами. Сульфат натрия обычно используется для изготовления моющих средств, текстильных изделий, аккумуляторов тепла и прочего. [1] НедвижимостьОбразец сульфата натрияСульфат натрия имеет плотность 2,664 г / см3 (безводный) и 1,464 г / см3 (декагидрат). Его точки плавления составляют 884 ° C (безводный) и 32,4 ° C (декагидрат). Температура кипения сульфата натрия 1429 ° C (безводный).Он негорючий и выглядит как белое кристаллическое твердое вещество. Сульфат натрия обычно остается стабильным. Даже если его нагреть, он не разлагается. При обычных температурах сульфат натрия не реагирует с восстановителями и окислителями. Сульфат натрия может стать сульфидом натрия при повышении температуры. При растворении в воде сульфат натрия представляет собой нейтральную соль с pH 7. Причина в том, что сульфат натрия происходит из сильного основания (гидроксида натрия) и сильной кислоты (серной кислоты). Сульфат натрия может реагировать с серной кислотой в водном растворе: Na 2 SO 4 (водн.) + H 2 SO 4 (водн.) -> 2 NaHSO 4 (водн.) Na 2 SO 4 считается типичным ионным сульфатом, поскольку он содержит ионы Na + и ионы SO 4 2-. Осадки могут образовываться водными растворами с комбинацией солей бария или свинца: Na 2 SO 4 (водн.) + BaCl 2 (водн.) -> 2 NaCl (водн.) + BaSO 4 (т.) В отличие от других соединений, сульфат натрия обладает особыми характеристиками растворимости в воде.Если добавить хлорид к сульфату натрия, растворимость будет ниже. Люди могут объяснить необычные свойства сульфата натрия гидратацией. Причина в том, что 32,4 ° C коррелирует с температурой, при которой глауберова соль превращается в безводную твердую фазу и сульфатную жидкую фазу. [2] При повышении температуры растворимость сульфата натрия также резко возрастает. Однако растворимость начнет медленно снижаться после достижения определенной температуры, которая составляет около 33 ° C.Кристаллы декагидрата дают безводную соль при разложении примерно при 33 ° C. Влага из воздуха быстро поглощается безводной солью, давая выцветшие кристаллы декагидрата. [3] вхожденияБольше всего сульфата натрия содержится в Большом Соленом озере.Сульфат натрия может быть получен естественным и химическим путем. Около 400 миллионов тонн сульфата натрия (12%) содержится в Соединенных Штатах Америки. Больше всего сульфата натрия производится в Китае. Ожидается, что к 2013 году одна производственная компания произведет более 4,8 миллионов метрических тонн. Несмотря на то, что большая часть сульфата натрия производится в Китае, он также производится во многих других странах. Некоторое количество сульфата натрия образуется как побочный продукт.Сульфат натрия, полученный химическим путем и естественным путем, способен обмениваться с другими. [4] Естественное производство В США две компании обычно добывают природный сульфат натрия из растений в Техасе и Калифорнии. Люди могут извлекать сульфат натрия из соленых вод озера Сирлс в Калифорнии. Объем оценивается примерно в 450 миллионов тонн. 12% сульфата натрия находится в Большом Соленом озере штата Юта. Это количество может перевести сульфат натрия в 400 миллионов тонн.Вашингтон, Невада и Вайоминг также имеют природный сульфат натрия. Не только в США, но и в других странах есть природный сульфат натрия. Это следующие страны: Мексика, Канада, Испания, Турция, Китай, Италия, Египет, Южная Африка и Румыния. Вот почему Соединенные Штаты импортируют сульфат натрия из других стран. [5] Химически произведено В то время как половина сульфата натрия в мире содержится в природной среде, другая половина обычно производится химическим путем.Есть несколько процессов, с помощью которых можно производить сульфат натрия. Обычно он производится как побочный продукт других процессов. [2] Одним из важнейших химических производств сульфата натрия является производство соляной кислоты. В процессе Мангейма сульфат натрия создается либо из серной кислоты, либо из хлорида натрия. Кроме того, его можно производить с помощью процесса Харгривза с диоксидом серы. Полученный в результате этих процессов сульфат натрия называется соляной коркой . 2 NaCl + H 2 SO 4 → 2 HCl + Na 2 SO 4 4 NaCl + 2 SO 2 + O 2 + 2 H 2 O → 4 HCl + 2 Na 2 SO 4 Процесс нейтрализации избытка серной кислоты гидроксидом натрия является следующим по значимости процессом сульфата натрия.К этому процессу обычно применяется и удобная лабораторная подготовка. 2 NaOH (водн.) + H 2 SO 4 (водн.) → Na 2 SO 4 (водн.) + 2 H 2 O (л) При добавлении серной кислоты к раствору хромата натрия образуется дихромат натрия. Сульфат натрия также образован дихроматом натрия. С другой стороны, сульфат натрия можно снова получить путем производства хелатирующих агентов, карбоната лития, аскорбиновой кислоты, резорцина, фенола, азотной кислоты и кремнеземных пигментов. [1] ИсторияСульфат натрия также называют глауберовской солью. Аптекарь и немецкий химик Иоганн Рудольф Глаубер (1604-1670) открыл сульфат натрия в 1625 году в австрийской родниковой воде. Когда он впервые обнаружил это, он назвал это sal mirabilis, что означает чудодейственная соль. Он назвал его, потому что он обладает лечебными свойствами. Кристаллы этой соли использовались как слабительное. В 18 веке люди начали использовать сульфат натрия для промышленного производства карбоната натрия. [6] используетСульфат натрия используется для моющих средств.Примерно в 1995 году люди в Соединенных Штатах Америки продавали сульфат натрия по цене около 70 долларов за тонну. Его даже продали за 90 долларов за хорошее качество. Это означает, что сульфат натрия был очень дешевым материалом. Сегодня сульфат натрия стал широко используемым материалом. Из него делают моющие средства, мыло, стаканы, аккумуляторы тепла и др. Моющее средство и мыло Поскольку сульфат натрия настолько дешев, люди начали использовать его для изготовления моющих средств и мыла.Вероятно, люди используют сульфат натрия в основном в качестве наполнителя в стиральных порошках для дома. В Европе общее потребление Na 2 SO 4 составило около 1,6 миллиона тонн. 80% было использовано в качестве моющих средств. [2] Причина, по которой люди использовали сульфат натрия в домашних моющих средствах для стирки, — это белизна сульфата натрия. Однако примерно в конце 1980 года люди начали использовать жидкие моющие средства и суперконцентраты. Это очень важно, поскольку жидкие моющие средства не требуют сульфата натрия. [6] Стекло Сульфат натрия используется не только для производства моющих средств и мыла, но и для стекольной промышленности. Стекольная промышленность США использует около 30 000 тонн. Сульфат натрия используется для избавления от мелких пузырьков воздуха из расплавленного стекла. Его называют «осветляющим агентом». Он также предотвращает образование накипи и расплавляет стекло. Стекольная промышленность также заявляет, что стекло создается путем смешивания в основном сульфата натрия, смеси песка и карбоната натрия. [6] Накопление тепла Люди использовали глауберову соль, декагидрат, как слабительное.Люди также начали использовать его для хранения тепла в системах пассивного солнечного отопления. Это действительно полезно для людей, потому что дает выгоду от высокой теплоты кристаллизации (78,2 кДж / моль). Также он обладает необычной растворимостью. Прочие В Японии натрий широко используется в текстильных изделиях. Это помогает уменьшить отрицательные заряды на пятерках и обеспечивает равномерное проникновение красок. Сульфат натрия не похож на хлорид натрия тем, что не повреждает сосуды из нержавеющей стали.Сульфат натрия можно использовать и для обледенения окон, и для освежения ковров, и для добавления в корм для скота, и для производства крахмала. Наконец, безводный сульфат натрия в лаборатории используется в качестве инертного сушильного агента для органических веществ. [2] Различные названия сульфата натрия
БезопасностьПоскольку сульфат натрия представляет собой соединение, людям необходимо знать факты безопасности о сульфате натрия.Люди должны класть сульфат натрия в закрытую емкость. Они также должны отделить его от несовместимых веществ. Примеры — сильные кислоты, магний и алюминий. Предполагается, что сульфат натрия не представляет опасности для здоровья, когда люди прикасаются к своей коже. Он может иметь легкую токсичность из-за проглатывания. Это может вызвать очищение, падение артериального давления, потерю жидкости при попадании в воду. Причина в его осмосной активности. Людям не следует бросать это им в глаза. Если люди прикасаются к нему кожей, их следует смыть водой с мылом.Если он попал им в глаза, они должны смыть его проточной водой. Людям следует принимать лекарства, если они видят, что появилось раздражение. Наконец, если люди случайно съели его, им следует выпить много стаканов воды. [3] Видео[7] Список литературыCreationWiki, энциклопедия науки о сотворенииЭтанол — это органический спирт, который в основном используется в качестве топлива или в алкогольных напитках.Он также широко известен как этиловый спирт или зерновой спирт. Этанол легко воспламеняется, имеет прозрачный внешний вид без запаха. Он имеет молекулярную формулу C 2 H 6 O и представляет собой растворенное вещество, которое хорошо сочетается с другими элементами, а также с другими соединениями. Этанол образуется из 95% спирта и 5% воды. Эти соединения естественным образом получают из сахаров и дрожжей и могут производить многие другие типы этанола путем дистилляции. Этанол может быть вредным в некоторых случаях, но он является отличным растворенным веществом, которое людям нужно в наши дни. [1] НедвижимостьЭтанол, часто называемый этиловым спиртом, используется в качестве первичного спирта и состоит в основном из воды и спирта. Этанол состоит из 5 процентов воды и 95 процентов спирта. Когда этанол не содержит воды и содержит 100-процентный спирт, он называется абсолютным этанолом. [1] Этанол имеет низкую температуру кипения 78 градусов Цельсия и точку плавления -114 градусов Цельсия. Это летучая бесцветная жидкость с жгучим вкусом, алкогольным и приятным запахом.Этанол имеет плотность 0,789 г / мл, что легче воды. [2] Химические свойства этанола определяются элементом этеном, который известен как C2h5. Этанол становится бледно-голубым, когда они горят, и они образуют воду и углекислый газ. [1] Этанол нельзя полностью получить простой перегонкой. Хотя процесс соединения бензола с этанолом может образовывать абсолютный этанол, этот процесс может быть опасным из-за остатков бензола. [3] СинтезМельница для производства этанола из сахарного тростникаЭтанол — это натуральное соединение, получаемое в результате ферментации сахаров дрожжами. [4] В США этанол производится в основном из кукурузы. Производится мокрым или сухим способом измельчения. Помол обрабатывает урожай и сбраживает его в этанол с мукой или расщепляет белок и крахмал в кукурузе с получением этанола. Эти явления основаны на сахаре и крахмале. Хотя это обычно не делается, этанол также имеет целлюлозное сырье, которое не должно использоваться ни в одной из культур, а вместо этого использовать древесину для производства этанола. Есть два способа производства этанола целлюлозным производством: термохимический и биохимический.Оба эти способа требуют древесины или травы для производства этанола. Производство целлюлозы является более сложной задачей, чем производство на основе крахмала и сахара. [5] используетТопливоЭтанол может быть полезен для многих целей. Большинство соединений этанола используется для производства топлива или алкогольных напитков. Этанол может быть еще одним источником моторного топлива и бензина. Он может использоваться вместе с другими видами топлива в качестве бензина. Есть автомобили, которые полностью работают на этаноле или смесях этанола. [6] Некоторые автомобили с гибким топливом могут полностью работать на смеси бензина и гидратированного этанола, если в бензине содержится не менее 20% этанола. Этанол полезен тем, что его можно смешивать с водой и другими растворителями. Существует также много типов этанола, таких как безводный этанол, который состоит из 95% этанола и 5% воды, которые можно смешивать с водой и помогать окружающей среде, уменьшая загрязнение воздуха. Не только в США они используют этанол в качестве топлива, но и в Бразилии этанол смешивают с бензином, поскольку они могут работать с соединениями, смешанными с этанолом и водой, а также с гидратированным этанолом.В Бразилии этанол в основном производится из сахарных культур, но в Соединенных Штатах этанол в основном производится из кукурузы. [7] Алкогольные напитки и другие предметы потребленияЕще одним основным применением этанола является потребление алкогольных напитков людьми. Этаноловый спирт часто называют этиловым или зерновым спиртом. Этаноловый спирт также используется в парфюмерии, одеколоне, лаке для волос или в медицинских целях. [8] Этанол также широко используется в фармацевтике. Такие как капли от кашля и растворы йода.Этанол снова является очень полезным соединением, потому что он является растворителем и может смешиваться с другими различными элементами. Поэтому многие фармацевты могут использовать этанол для изготовления таблеток, пилюль, витаминов и антибиотиков. Этанол-спирт также используется во многих чистящих средствах для дома, дезинфицирующий аэрозольный баллончик содержит более половины этанола для мытья предметов. Также этанол может использоваться в таких веществах, как краски и лаки, а иногда даже в пищевых продуктах, которые мы потребляем, таких как ароматизаторы, экстракты и глазури. [9] Химическое производствоПри окислении этанол может превращаться в два химических соединения. С дихроматом натрия, дихроматом калия и перманганатом калия этанол может образовывать ацетальдегид (или этаналь). Если этаналь будет обнаружен в дальнейшем, его также можно будет найти как этановую кислоту, которую также обычно называют уксусной кислотой. [1] Этанол как соединение может быть очень полезным в качестве химического вещества. [4] Этанол можно превратить в сложные эфиры, а хлорид — в химическое соединение.Он способен реагировать с очень высокими температурами и легко образовывать кислород и водород. [1] При смешивании этанола с серной кислотой образуется этилен. Эта концепция известна как обезвоживание этанола и может быть осуществлена только при его нагревании до 170 градусов по Цельсию. Также, когда его смешивают с серной кислотой при 140 градусах Цельсия, он образует диэтил. Этанол реагирует с натрием и образует этоксид натрия за счет замещения атома натрия. Этанол может образовываться и взаимодействовать со многими различными соединениями и элементами, включая пентахлорид фосфора, с образованием хлористого водорода, фосфорилхлорида и этилхлорида. [4] История этанолаАвтомобиль Генри Форда, который использовал чистый этанол для управления своими автомобилями.Этанол используется во многих областях для разных целей. История этанола уходит корнями дальше, чем мы знаем в наши дни. Этанол, который сейчас превращается в топливо, был начат рано с ферментации сахара. Люди обнаружили, что этанол также можно получить путем дистилляции и ферментации. [10] С помощью этих шагов они смогли получить больший объем спирта, а также провести перегонку с замораживанием.В 1976 году Иоганн Тобиас Ловиц открыл чистый этанол путем дистилляции. Он обнаружил, что этанол состоит из водорода, кислорода и углерода. Позже в 19 веке Николя-Теодор де Соссюр нашел химическую формулу этанола. [11] В 1850 году в США ежегодно производилось почти 90 миллионов галлонов этанола. Их использовали в основном для производства топлива и спиртных напитков. Затем, в 1862 году, налоги сделали этанол более дорогим и затруднили его покупку людьми. [10] В 1896 году этанол впервые был использован в автомобилях.Генри Форд использовал чистый этанол для запуска своих автомобилей, чем позже использовал смесь этанола для своих автомобилей. Когда в 1919 году был введен в действие Сухой закон, произошел процесс денатурации, и этанол был очень вредным, потому что он был ядовитым, и люди не могли его пить. Но сухой закон закончился в 1933 году, и во время Второй мировой войны производство этанола снова увеличилось, чтобы удовлетворить потребности многих людей. После Второй мировой войны фермеры начали выращивать этанол. Теперь заводы по производству этанола по-прежнему производятся для использования в качестве топлива и многих других продуктов и в основном производятся на Среднем Западе, где добывается около 5 миллиардов галлонов. [11] ВидеоКак производится этанол. Список литературы
| |||


 Кроме самой десятиводной глауберовой соли известны ромбические кристаллы семиводного кристаллогидрата Na 2 SO 4 · 7H 2 O и одноводная соль Na 2 SO 4 · H 2 O.
Кроме самой десятиводной глауберовой соли известны ромбические кристаллы семиводного кристаллогидрата Na 2 SO 4 · 7H 2 O и одноводная соль Na 2 SO 4 · H 2 O. Там у меня снова начались приступы, и я должен был остаться в этом городе. Болезнь настолько ослабила мой желудок, что он не мог ни принимать, ни переваривать никакую еду. Местные жители посоветовали мне пойти к источнику, находящемуся вблизи виноградника в часе ходьбы от города. Они сказали, что вода источника вернет мне аппетит. Следуя их совету, я взял с собой большой кусок хлеба; мне сказали, что должен буду весь его съесть, но я мало верил в то, что это мне как-то поможет. Придя к источнику, я намочил хлебный мякиш в воде и съел его — причем с большим удовольствием, хотя перед этим не мог смотреть без отвращения на самые изысканные лакомства. Взяв оставшуюся от хлеба корку, я зачерпнул ею воды из источника и выпил её. Это настолько возбудило мой аппетит, что в конце концов я съел и «чашку» из хлеба, которой черпал воду. Домой я возвратился значительно окрепшим и поделился своими впечатлениями с соседями. Я чувствовал, что если буду и дальше лечиться этой водой, функции моего желудка полностью восстановятся. Я спросил, что это за вода. Мне сказали, что в ней содержится селитра, чему тогда, не будучи искушен в подобных вопросах, я поверил.
Там у меня снова начались приступы, и я должен был остаться в этом городе. Болезнь настолько ослабила мой желудок, что он не мог ни принимать, ни переваривать никакую еду. Местные жители посоветовали мне пойти к источнику, находящемуся вблизи виноградника в часе ходьбы от города. Они сказали, что вода источника вернет мне аппетит. Следуя их совету, я взял с собой большой кусок хлеба; мне сказали, что должен буду весь его съесть, но я мало верил в то, что это мне как-то поможет. Придя к источнику, я намочил хлебный мякиш в воде и съел его — причем с большим удовольствием, хотя перед этим не мог смотреть без отвращения на самые изысканные лакомства. Взяв оставшуюся от хлеба корку, я зачерпнул ею воды из источника и выпил её. Это настолько возбудило мой аппетит, что в конце концов я съел и «чашку» из хлеба, которой черпал воду. Домой я возвратился значительно окрепшим и поделился своими впечатлениями с соседями. Я чувствовал, что если буду и дальше лечиться этой водой, функции моего желудка полностью восстановятся. Я спросил, что это за вода. Мне сказали, что в ней содержится селитра, чему тогда, не будучи искушен в подобных вопросах, я поверил. В результате одной реакцией Глаубер открыл и способ получения соляной кислоты, и синтеза сульфата натрия.
В результате одной реакцией Глаубер открыл и способ получения соляной кислоты, и синтеза сульфата натрия. Жители городка утверждали, что, если хлеб смочить в той волшебной воде, человек излечится и станет есть. Не слишком надеясь на чудо, алхимик все же посетил водный источник и сделал все, как ему сказали. После хлебной трапезы он испил той же воды и, к своему удивлению, почувствовал себя лучше. Как ученый человек, Глаубер занялся рассмотрением состава жидкости. Несколько месяцев он проводил химические испытания, и в процессе выпаривания воды из источника были обнаружены кристаллы неизвестного соляного вида.
Жители городка утверждали, что, если хлеб смочить в той волшебной воде, человек излечится и станет есть. Не слишком надеясь на чудо, алхимик все же посетил водный источник и сделал все, как ему сказали. После хлебной трапезы он испил той же воды и, к своему удивлению, почувствовал себя лучше. Как ученый человек, Глаубер занялся рассмотрением состава жидкости. Несколько месяцев он проводил химические испытания, и в процессе выпаривания воды из источника были обнаружены кристаллы неизвестного соляного вида. Токсические элементы и гнилостные бактерии, покинувшие человеческое тело, заодно облегчают работу лимфатической системе. Лимфа очищается благодаря мирабилиту, и происходит оздоровление организма. Кристаллы глауберовой соли, растворенные в воде, «уносят» также и ядовитые соли некоторых металлов (ртуть, свинец, медь, барий). Благодаря большим объемам потерянной жидкости раствор используют во время похудения. Жидкость имеет вес, соответственно, удалив ее, человек избавляется от килограммов.
Токсические элементы и гнилостные бактерии, покинувшие человеческое тело, заодно облегчают работу лимфатической системе. Лимфа очищается благодаря мирабилиту, и происходит оздоровление организма. Кристаллы глауберовой соли, растворенные в воде, «уносят» также и ядовитые соли некоторых металлов (ртуть, свинец, медь, барий). Благодаря большим объемам потерянной жидкости раствор используют во время похудения. Жидкость имеет вес, соответственно, удалив ее, человек избавляется от килограммов. Или позвольте себе полакомиться грейпфрутом. Это все, что можно есть в течение трех суток. Чаи, булочки и прочие продукты полностью удалите из рациона.
Или позвольте себе полакомиться грейпфрутом. Это все, что можно есть в течение трех суток. Чаи, булочки и прочие продукты полностью удалите из рациона. Запрещено в это время проводить солевое воздействие на организм.
Запрещено в это время проводить солевое воздействие на организм.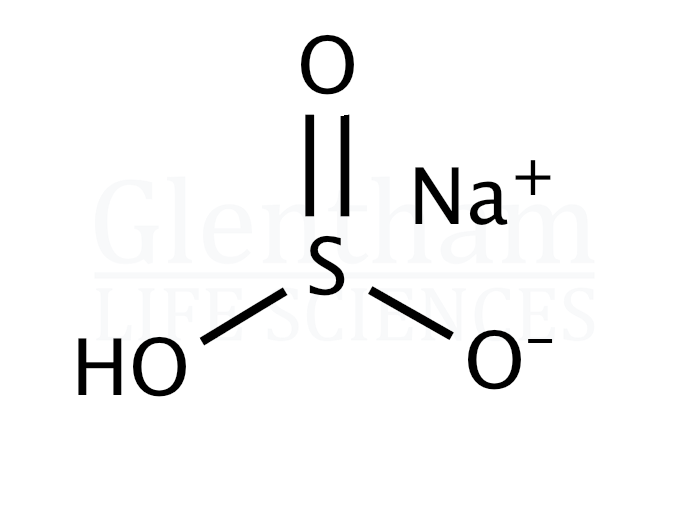 Помимо десятиводного, известны также ромбические кристаллы семиводного кристаллогидрата Na 2 SO 4 ·7H 2 O и одноводная соль Na 2 SO 4 ·H 2 O. Значительные количества сульфата натрия находятся в морской воде и в воде минеральных источников.
Помимо десятиводного, известны также ромбические кристаллы семиводного кристаллогидрата Na 2 SO 4 ·7H 2 O и одноводная соль Na 2 SO 4 ·H 2 O. Значительные количества сульфата натрия находятся в морской воде и в воде минеральных источников. Однако небольшие воздействия (сотрясение раствора, внесение затравки – маленького кристалла Na 2 SO 4) вызывают быструю кристаллизацию.
Однако небольшие воздействия (сотрясение раствора, внесение затравки – маленького кристалла Na 2 SO 4) вызывают быструю кристаллизацию. О составе этих вод можно судить по составу искусственной карлсбадской (карловарской) соли, которая содержит 44% сульфата натрия, 36% гидрокарбоната натрия, 18% хлорида натрия и 2% сульфата калия.
О составе этих вод можно судить по составу искусственной карлсбадской (карловарской) соли, которая содержит 44% сульфата натрия, 36% гидрокарбоната натрия, 18% хлорида натрия и 2% сульфата калия. Естественно данный процесс сопровождается заметным снижением веса.
Естественно данный процесс сопровождается заметным снижением веса. Это вещество представляет собой прозрачные, бесцветные кристаллы, которые выветриваются со временем, и имеют горько-соленый вкус. Соль применяют в медицине в качестве сильного, эффективного слабительного средства.
Это вещество представляет собой прозрачные, бесцветные кристаллы, которые выветриваются со временем, и имеют горько-соленый вкус. Соль применяют в медицине в качестве сильного, эффективного слабительного средства.

 )
)