Белки + продукты богатые белками
Белок является важным строительным материалом нашего организма. Из него состоит каждая клетка организма, он входит в состав всех тканей и органов. Кроме того, особая разновидность белков исполняет роль ферментов и гормонов в живом организме.
Помимо строительной функции, белок также может являться источником энергии. А в случае избытка белка, печень «предусмотрительно» преобразует белок в жиры, которые откладываются про запас в организме (как избавиться от такого жира?).
В теле человека содержится 22 аминокислоты: 13 аминокислот организм может синтезировать самостоятельно из имеющегося строительного материала, а 9 из них он может получить только с пищей.
В процессе усвоения организмом белки распадаются на аминокислоты,
которые в свою очередь поставляются в разные части организма, для
выполнения своих основных функций.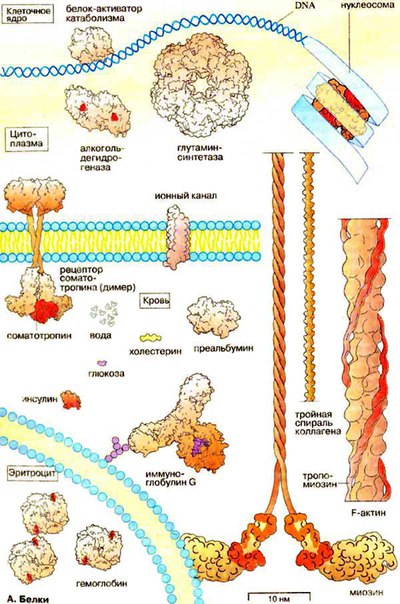
Продукты богатые белками:
Указано ориентировочное количество в 100 г продукта
Молоко сухое28,5 г «Сервелат»24 г Сыр «Российский»
23,2 г
| Индейка | 21,6 | Палтус | 18,9 | Брынза | 17,9 | Вареная колбаса | 12,1 | |||
| Куриный окорочок | 21,3 | Телятина | 19,7 | Сельдь | 17,7 | Пшено | 12,0 | |||
| Мясо кролика | 21,2 | Говядина | Говяжья печень | 17,4 | Овсянка | 11,9 | ||||
| Горбуша | 21 | Свиная печень | 18,8 | Свиные почки | 16,4 | Свинина жирная | 11,4 | |||
| Креветки | 20,9 | Баранья печень | 18,7 | Фундук | Хлеб пшеничный | 7,7 | ||||
| Куры | 20,8 | Цыплята | 18,7 | Минтай | 15,9 | Сдобная выпечка | 7,6 | |||
| Семга | 20,8 | Миндаль | 18,6 | Сердце | 15 | Рисовая каша | 7 | |||
| Семя подсолнечника | 20,7 | Кальмар | 18 | Грецкий орех | 13,8 | Хлеб ржаной | 4,7 | |||
| Сайра мелкая | 20,4 | Скумбрия | 18 | Докторская варенка | 13,7 | Кефир нежирный | 3 | |||
| Баранина | 20 | Творог нежирный | Гречневая ядрица | 12,6 | Молоко | 2,8 |
Суточная потребность в белках
Рекомендуемая потребность в белках для взрослого человека 0,8 г на 1кг веса. Этот показатель можно найти в таблицах расчета идеальной массы тела.
Фактический вес человека в данном случае не учитывается, вследствие того, что аминокислоты предназначены для клеточной массы тела, а не для жировых отложений.
Этот показатель можно найти в таблицах расчета идеальной массы тела.
Фактический вес человека в данном случае не учитывается, вследствие того, что аминокислоты предназначены для клеточной массы тела, а не для жировых отложений.
Согласно правилам диетологии, белковая пища должна составлять около 15% от общей калорийности ежедневного рациона. Хотя этот показатель может варьироваться в зависимости от рода деятельности человека, а также состояния его здоровья.
Потребность в белках возрастает:
- Во время болезни, особенно после операции, а также в период выздоровления.
- Во время работ, требующих сильного физического напряжения.
- В холодное время года, когда организм затрачивает больше сил на обогрев.
- Во время интенсивного роста и развития организма.
- Во время спортивных соревнований, а также подготовки к ним.
Потребность в белках снижается:
- В теплое время года.

- С возрастом. В преклонном возрасте обновление организма происходит медленнее, поэтому белков требуется меньше.
- При заболеваниях, связанных с усваиваемостью белков. Одной из таких болезней является подагра.
Усваиваемость белков
Когда человек
употребляет углеводы, процесс их переваривания начинается еще во время
пребывания их во рту. С белками же всё по-другому. Их переваривание
начинается только в желудке, при помощи соляной кислоты. Однако, поскольку
молекулы белка являются очень крупными, перевариваются белки достаточно
трудно. Для улучшения усвоения белков, необходимо употреблять продукты,
содержащие белок в наиболее усваиваемой и легкой его форме. К таковым
относится белок яиц,
а также белок, содержащийся в кисломолочных продуктах, таких как кефир,
ряженка, брынза и т.
Согласно теории раздельного питания, белковая пища хорошо сочетается с различной зеленью и листовыми овощами. Современные диетологи утверждают, что белок лучше усваивается в присутствии жиров и углеводов, которые являются основными источниками энергии для организма.
Поскольку белковая пища в организме задерживается значительно дольше углеводистой, то чувство сытости после употребления белков сохраняется значительно дольше.
Полезные свойства белка и его влияние на организм
В зависимости от своей специализации белки
выполняют в организме различные функции. Транспортные белки,
например, занимаются доставкой витаминов, жира и минералов ко всем
клеткам организма. Белки-катализаторы ускоряют различные химические
процессы, происходящие в организме. Также существуют белки, которые
борются с различными инфекциями, являясь антителами к различным
заболеваниям.
Взаимодействие с эсенциальными элементами
Все в природе взаимосвязано, и также все взаимодействует в нашем организме. Белки, как часть всеобщей экосистемы, взаимодействуют с другими элементами нашего организма – витаминами, жирами и углеводами. Мало того, помимо простого взаимодействия, белки участвуют также в трансформации одного вещества в другое.
Что касается витаминов, то на каждый грамм потребленного белка, необходимо употребить 1 мг витамина С. При недостатке витамина С, будет усвоено только то количество белка, на которое хватит содержащегося в организме витамина.
Опасные свойства белков и предостережения
Признаки нехватки белка в организме
- Слабость, нехватка энергии.
 Потеря работоспособности.
Потеря работоспособности. - Снижение либидо. При медицинских исследованиях может обнаружиться нехватка некоторых половых гормонов.
- Низкая сопротивляемость различным инфекциям.
- Нарушение функций печени, нервной и кровеносной системы, функционирования кишечника, поджелудочной железы, обменных процессов.
- Развивается атрофия мышц, замедляется рост и развитие организма у детей.
Признаки избытка белка в организме
- Хрупкость костной системы, возникающая в результате закисления организма, которая приводит к вымыванию кальция из костей.
- Нарушение водного баланса в организме, что также может привести к отекам, и неусваиваемости витаминов.
- Развитие подагры, которую в старину называли «болезнью богатых людей», также является прямым следствием избытка белка в организме.
- Избыточный вес также может стать следствием неумеренного потребления белков.
 Это связано с деятельностью печени, которая лишний для организма белок преобразовывает в жировую ткань.
Это связано с деятельностью печени, которая лишний для организма белок преобразовывает в жировую ткань. - Рак кишечника, по утверждению некоторых научных источников, может стать следствием повышенного содержания пуринов в пище.
Факторы, влияющие на содержание белка в организме
Состав и количество пищи. Так как незаменимые аминокислоты организм не может синтезировать самостоятельно.
Возраст. Известно, что в детском возрасте количество белка, необходимого для роста и развития организма, более чем в 2 раза превышает потребность в белке человека средних лет! В пожилом возрасте все обменные процессы протекают гораздо медленнее, а, следовательно, потребность организма в белках существенно сокращается.
Физический труд и профессиональный спорт. Для поддержания
тонуса и работоспособности спортсменам и людям, занимающимся интенсивным
физическим трудом, требуется увеличенная в 2 раза норма потребления
белка, так как в их организме очень интенсивно проходят все обменные
процессы.
Белковая пища для здоровья
Как мы уже говорили, существуют 2 большие группы белков: белки, являющиеся источниками заменимых и незаменимых аминокислот. Незаменимых аминокислот всего 9: треонин, метионин, триптофан, лизин, лейцин, изолейцин, фенилаланин, валин. Именно в этих аминокислотах особо нуждается наш организм, так как усваиваются они только из пищи.
В современной диетологии существует такое понятие, как полный и неполный белок. Белковая пища, содержащая все незаменимые аминокислоты, называется полным белком, неполным белком считается пища, содержащая лишь некоторые из незаменимых аминокислот.
К продуктам, содержащим полноценный высококачественный белок, относятся
мясные, молочные продукты, морепродукты и соя. Пальма первенства в
списке таких продуктов принадлежит яйцам, которые по медицинским критериям
считаются золотым стандартом полноценного белка.
Неполноценный белок чаще всего содержится в орехах, различных семенах, хлебных злаках, овощах, бобовых, некоторых фруктах.
Сочетая в одном приеме пищи продукты, содержащие неполноценный белок с полноценным, можно добиться максимального усвоения неполноценного белка. Для этого достаточно включить в свой рацион лишь небольшое количество продуктов животного происхождения, и польза для организма будет существенной.
Белок и вегетарианство
Некоторые люди по своим морально-этическим убеждениям, полностью исключили мясные продукты из своего рациона. Наиболее известные из них – Ричард Гир, звезда «Голубой лагуны» Брук Шилдс, великолепная Памела Андерсон, а также непревзойденный российский юморист Михаил Задорнов.
Однако, для того, чтобы организм не чувствовал себя обделенным, необходима
полноценная замена рыбе и мясу. Тем, кто употребляет молоко, творог,
яйца, конечно же, легче. Тем же, кто полностью отказался от животных
белков, приходится проявлять большую изобретательность, чтобы организм
не страдал от недостатка белка. Особенно это касается детского быстрорастущего
организма, который при недостатке аминокислот способен притормозить
рост и нормальное развитие.
Тем, кто употребляет молоко, творог,
яйца, конечно же, легче. Тем же, кто полностью отказался от животных
белков, приходится проявлять большую изобретательность, чтобы организм
не страдал от недостатка белка. Особенно это касается детского быстрорастущего
организма, который при недостатке аминокислот способен притормозить
рост и нормальное развитие.
Благодаря определенным исследованиям, связанным с изучением усвоения растительного белка организмом, стало известно, что определенные сочетания такого белка могут обеспечить организм полным набором незаменимых аминокислот. Вот эти сочетания: грибы–злаки; грибы–орехи; бобовые–злаки; бобовые–орехи, а также разные виды бобовых, сочетающиеся в одном приеме пищи.
Но это всего лишь только теория и пройдет время, прежде чем она будет полностью подтверждена либо опровергнута.
Среди растительных белковых продуктов, звание «чемпиона» по содержанию
белка достается сое. В 100 граммах сои содержится более 30% полноценного
белка. Японский суп «мисо», соевое мясо и соевый соус – это далеко
не все деликатесы, которые готовят из этого удивительного продукта.
Грибы, чечевица, фасоль и горох содержат в 100 граммах от 28 до 25%
неполноценного белка.
В 100 граммах сои содержится более 30% полноценного
белка. Японский суп «мисо», соевое мясо и соевый соус – это далеко
не все деликатесы, которые готовят из этого удивительного продукта.
Грибы, чечевица, фасоль и горох содержат в 100 граммах от 28 до 25%
неполноценного белка.
Авокадо сравнимо по содержанию белка со свежим коровьем молоком (в нем содержится около 14% белкового вещества). Кроме того, фрукт содержит полиненасыщенные жирные кислоты Омега-6 и пищевые волокна. Орехи, гречка, брюссельская и цветная капуста, а также шпинат и спаржа завершают наш далеко не полный список продуктов, богатых растительным белком.
Белки в борьбе за стройность и красоту
Для желающих оставаться всегда подтянутыми и красивыми, диетологи рекомендуют придерживаться определенной схемы питания до и после тренировок:
- 1 Для того, чтобы нарастить мышечную массу
и приобрести спортивную фигуру рекомендуется есть белковую пищу
за час до тренировки.
 Например, половину тарелки творога
или другой кисломолочный продукт, куриную грудку или индюшку с рисом,
рыбу с салатом, омлет с овсянкой.
Например, половину тарелки творога
или другой кисломолочный продукт, куриную грудку или индюшку с рисом,
рыбу с салатом, омлет с овсянкой. - 2 Для обретения спортивной фигуры, есть разрешается уже через 20 минут после тренировки. Притом, употреблять следует белковую и углеводистую пищу, но никак не жиры.
- 3 Если цель тренировки – обрести стройность и изящество, без наращивания мышечной массы, тогда белковую пищу следует употреблять не ранее, чем через 2 часа после окончания занятий. Перед тренировкой не есть белки в течение 5 часов вообще. Последний прием пищи (углеводы) за 2 часа до занятий.
- 4 А теперь насчет поддержания правильного
метаболизма в организме. По утверждению диетологов, белки
рекомендуется употреблять во второй половине дня. Они сохраняют
длительное время чувство сытости, а это является отличной профилактикой
обильных ночных трапез.

- 5 Красивая кожа, пышные и блестящие волосы, крепкие ногти – результат деятельности достаточного количества незаменимых аминокислот в рационе питания, действующих совместно с витаминами и микроэлементами.
Мы собрали самые важные моменты о белках в этой иллюстрации и будем благодарны, если вы поделитесь картинкой в социальной сети или блоге, с ссылкой на эту страницу:
Рейтинг:8.4/10
Голосов: 12
Другие популярные нутриенты:
Какие продукты богаты животными и растительными белками?
Составляя рацион питания, нужно соблюдать баланс по БЖУ. Все питательные элементы выполняют индивидуальную функцию. Углеводы – основной источник энергии. Жиры – депо, в котором хранятся запасы на «голодные времена». Белки – основной строительный материал. Рекомендуемое соотношение БЖУ в рационе – 30%, 30%, 40%.
Все питательные элементы выполняют индивидуальную функцию. Углеводы – основной источник энергии. Жиры – депо, в котором хранятся запасы на «голодные времена». Белки – основной строительный материал. Рекомендуемое соотношение БЖУ в рационе – 30%, 30%, 40%.
Чтобы составить по-настоящему полезное меню на день, нужно знать не только, в каких продуктах содержатся белки, но и из каких аминокислот они состоят, как усваиваются организмом и сочетаются с другими питательными веществами.
Функции белка
Основу белков составляют аминокислоты. Их основные функции:
- Транспортная – доставка витаминов, минералов, жиров к клеткам.
- Защитная – некоторые белки являются антителами.
- Каталитическая – белки являются главными участниками биохимических реакций.
- Строительная – главный материал для формирования новых клеток и восстановления старых.
Внимание! Белок хорошо усваивается в сочетании с витамином С.Учитывайте это при составлении рациона.
Виды белков
В организме человека белки распадаются на аминокислоты, всего существует 20 их разновидностей. Сам организм способен синтезировать 12 аминокислот, которые называют заменимыми. Остальные 8 являются незаменимыми. То есть организм человека не способен вырабатывать их самостоятельно, но не может без них полноценно функционировать. А значит, они должны поступать с пищей. При хроническом дефиците таких белковых соединений разрушается цепочка обмена веществ, и организм постепенно погибает.
В полноценной белковой пище присутствуют все незаменимые аминокислоты. К ней относят все продукты животного происхождения. Растительные белки, которыми богаты бобовые, злаки и орехи, являются неполноценными. То есть в них нет всех важных для здоровья аминокислот.
Внимание! Лучшее соотношение животных и растительных белков в рационе – 55% на 45%.
Суточная норма потребления белка
В день необходимо употреблять около 90 г белков. Точная суточная норма аминокислот зависит от пола, возраста, уровня физической активности и составляет:
- Для женщин – 60–90 г.
- Для мужчин – 80–150 г.
- Для дошкольников – 3 г на кг веса.
- Для школьников – 2,5 г на кг веса.
Топ-10 продуктов с высоким содержанием белка
В список продуктов с наибольшим количеством белков в 100 г входят:
- Орехи – до 30 г.
- Твердый сыр – до 27 г.
- Бобовые – до 25 г.
- Птица – до 22 г.
- Рыба – до 21 г.
- Мясо – до 20 г.
- Морепродукты – до 18 г.
- Творог – до 18 г.
- Яйца – до 12 г.
- Крупы – до 12 г.

Количество белков в продуктах
Мясо птицы и крупного рогатого скота рекомендуется варить в воде и на пару, тушить, запекать. Нежелательно его жарить.
Внимание! Свинину стоит есть в ограниченных количествах или очистив от прослоек сала, тогда она станет менее жирной.
Среди рыбных пород самыми богатыми протеином являются лосось, тунец, сельдь, форель, камбала. Наибольшее количество аминокислот содержится в икре.
Молочные продукты обязательно должны присутствовать в рационе, поскольку, помимо легкоусвояемых молочных белков, содержат большое количество кальция, который необходим для их усвоения и сохранения здоровья костей.
Среди круп первое место по пользе для здоровья занимает гречка. Рис уступает ей по этому показателю в 3 раза.
Количество белков в продуктах животного и растительного происхождения указано в таблице:
|
Продукт |
Содержание белка в 100 г, г |
|
Индейка |
20–22 |
|
Курица |
19–21 |
|
Говядина |
19 |
|
Баранина |
16 |
|
Свинина |
12–15 |
|
Горбуша |
21 |
|
Семга |
20,9 |
|
Кальмары, креветки |
18 |
|
Сельдь |
16–18 |
|
Минтай |
16 |
|
Мойва |
13 |
|
Сыр |
22–27 |
|
Творог |
15–18 |
|
Йогурт |
5 |
|
Сметана, кефир |
2,6–3 |
|
Молоко |
2,7–3 |
|
Пшенная крупа |
12 |
|
Овсяная крупа |
11 |
|
Гречневая крупа |
11 |
|
Перловая крупа |
9,5 |
|
Рис |
7 |
Усвояемость белков
В таблице указано максимальное количество белков в продуктах. Кроме того, усваиваются они в организме не полностью. К примеру, белки молока усваиваются на 100%, красного мяса, рыба и сои – на 92%, птицы – на 70%, круп – примерно на 50%, орехов – на 40%. Учитывайте это при составлении своего ежедневного рациона или белкового меню для похудения.
Кроме того, усваиваются они в организме не полностью. К примеру, белки молока усваиваются на 100%, красного мяса, рыба и сои – на 92%, птицы – на 70%, круп – примерно на 50%, орехов – на 40%. Учитывайте это при составлении своего ежедневного рациона или белкового меню для похудения.Строение и функции белков — конспект
Вернуться к теме «Строение и функции белков»
Белки – полимеры, мономерами которых являются аминокислоты.
Среди органических веществ белки занимают первое место по количеству и по значению. В организме человека встречаются 5 млн разнообразных белковых молекул, отличающихся не только друг от друга, но и от белков других организмов. Несмотря на такое разнообразие и сложность строения они построены всего из 20 различных аминокислот.
Строение аминокислоты:
В левой части молекулы расположены группа h3N–, которая обладает свойствами основания; справа — группа –COOH — кислотная, характерная для всех органических кислот. Следовательно, аминокислоты – амфотерные соединения, совмещающие свойства и кислоты и основания. Этим обусловлена их способность взаимодействовать друг с другом. Соединяясь, молекулы аминокислот образуют связи между углеродом кислотной и азотом основной групп. Такие связи называются ковалентными, а в данном случае – пептидными связями:
Следовательно, аминокислоты – амфотерные соединения, совмещающие свойства и кислоты и основания. Этим обусловлена их способность взаимодействовать друг с другом. Соединяясь, молекулы аминокислот образуют связи между углеродом кислотной и азотом основной групп. Такие связи называются ковалентными, а в данном случае – пептидными связями:
Соединение двух аминокислот в одну молекулу называется дипептидом, трех аминокислот – трипептидом и т. д., а соединение, состоящее из 20 и более аминокислотных остатков, – полипептидом.
Последовательность аминокислот в полипептидной цепи принято называть первичной структурой белка.
Однако молекула белка в виде цепи аминокислотных остатков, последовательно соединенных между собой пептидными связями, еще не способна выполнять специфические функции. Для этого необходима более высокая структурная организация. Путем образования водородных связей между остатками карбоксильных и аминогрупп разных аминокислот белковая молекула принимает вид спирали (α-структура) или складчатого слоя – «гармошки» (β-структура). Это вторичная структура белка. Но и ее часто недостаточно для приобретения характерной биологической активности.
Это вторичная структура белка. Но и ее часто недостаточно для приобретения характерной биологической активности.
Часто только молекула, обладающая третичной структурой, может выполнять роль катализатора или любую другую. Третичная структура образуется благодаря взаимодействию радикалов, в частности радикалов аминокислоты цистеина, которые содержат серу. Атомы серы двух аминокислот, находящихся на некотором расстоянии друг от друга в полипептидной цепи, соединяются, образуя так называемые дисульфидные, или S–S, связи. Благодаря этим взаимодействиям, а также другим, менее сильным связям, белковая спираль сворачивается и приобретает форму шарика, или глобулы. Способ укладки полипептидных спиралей в глобуле называют третичной структурой белка. Многие белки, обладающие третичной структурой, могут выполнять свою биологическую роль в клетке. Однако для осуществления некоторых функций организма требуется участие белков с еще более высоким уровнем организации.
Такую организацию называют четвертичной структурой. Присутствует не у всех белков. Она представляет собой функциональное объединение нескольких (двух, трех и более) молекул белка, обладающих третичной структурной организацией. Пример такого сложного белка – гемоглобин. Его молекула состоит из четырех связанных между собой молекул. Другим примером может служить гормон поджелудочной железы – инсулин, включающий два компонента. В состав четвертичной структуры некоторых белков включаются помимо белковых субъединиц и разнообразные небелковые компоненты. Тот же гемоглобин содержит сложное гетероциклическое соединение, в состав которого входит железо.
Строение белковой молекулы: А – первичная; Б – вторичная; В – третичная; Г – четвертичная структура
Строение молекулы гемоглобина
Гемоглобин – белок четвертичной структуры. В молекуле гемоглобина белковый компонент представлен белком глобином, небелковый компонент – гем. Глобин состоит из 4 субъединиц. Внутри каждой субъединицы имеется гидрофобный «карман», в котором располагается гем. Содержащийся в геме атом железа связывает кислород.
Глобин состоит из 4 субъединиц. Внутри каждой субъединицы имеется гидрофобный «карман», в котором располагается гем. Содержащийся в геме атом железа связывает кислород.
Свойства белка
Белки, как и другие неорганические и органические соединения, обладают рядом физико-химических свойств:
- Белки – преимущественно водорастворимые молекулы и, следовательно, могут проявлять свою функциональную активность только в водных растворах.
- Белковые молекулы несут большой поверхностный заряд. Это определяет целый ряд электрохимических эффектов, например изменение проницаемости мембран каталитической активности и других функций.
- Белки термолабильны, то есть проявляют свою активность в узких температурных рамках.
Денатурация и ренатурация белков
Денатурация – это утрата белковой молекулой своей структурной организации: четвертичной, третичной, вторичной, а при более жестких условиях – и первичной структуры. В результате денатурации белок теряет способность выполнять свою функцию. Причинами денатурации могут быть высокая температура, ультрафиолетовое излучение, действие сильных кислот и щелочей, тяжелых металлов и органических растворителей. Если изменение условий среды не приводит к разрушению первичной структуры молекулы, то при восстановлении нормальных условий среды полностью воссоздается структура белка и его функциональная активность. Такой процесс носит название ренатурации.
В результате денатурации белок теряет способность выполнять свою функцию. Причинами денатурации могут быть высокая температура, ультрафиолетовое излучение, действие сильных кислот и щелочей, тяжелых металлов и органических растворителей. Если изменение условий среды не приводит к разрушению первичной структуры молекулы, то при восстановлении нормальных условий среды полностью воссоздается структура белка и его функциональная активность. Такой процесс носит название ренатурации.
Функции белков
1. Каталитическая (ферментативная) функция:
Многие белки являются ферментами. Ферменты — это биологические катализаторы, т. е. вещества, ускоряющие протекание химических реакций в живых организмах. Ферменты участвуют в процессах синтеза и расщепления различных веществ. Они обеспечивают фиксацию углерода в процессе фотосинтеза, расщепление питательных веществ в пищеварительном тракте и т. д.
д.
2. Транспортная функция
Многие белки способны присоединять и переносить различные вещества. Гемоглобин связывает и переносит кислород и углекислый газ. Альбумины крови транспортируют жирные кислоты, глобулины — ионы металлов и гормоны. Многие белки, входящие в состав цитоплазматической мембраны, участвуют в транспорте веществ в клетку и из нее.
3. Защитная функция
Белки предохраняют организм от вторжения чужеродных организмов и от повреждений. Так, в ответ на проникновение чужеродных объектов (антигенов) определенные лейкоциты вырабатывают специфические белки — иммуноглобулины (антитела), участвующие в иммунном ответе организма. Белок плазмы крови фибриноген, участвуя в свертывании крови и тем самым уменьшая кровопотери.
4. Двигательная (сократительная) функция
Сократительные белки обеспечивают способность клеток, тканей, органов и целых организмов изменять форму, двигаться. Так, актин и миозин обеспечивают работу мышц и немышечные внутриклеточные сокращения.
5. Структурная (строительная, пластическая) функция
Белки входят в состав всех клеток и тканей живых организмов. Белки являются обязательным компонентом всех клеточных мембран и органоидов клетки. Из белков построены элементы цитоскелета, сократительные элементы мышечных волокон. Преимущественно из белков состоят хрящи и сухожилия. В их состав входит белок коллаген. Важнейшим структурным компонентом перьев, волос, ногтей, когтей, рогов, копыт у животных является белок кератин. В состав связок, стенок артерий и лёгких входит структурный белок эластин.
6. Сигнальная (рецепторная) функция
Некоторые белки клеточных мембран способны изменять свою структуру в ответ на действие внешних факторов. С помощью этих белков происходит прием сигналов из внешней среды и передача информации в клетку.
7. Регуляторная функция
Некоторые белки являются гормонами. Они влияют на различные физиологические процессы. Например, инсулин и глюкагон регулируют содержание глюкозы в крови, а соматотропин (гормон роста) — процессы роста и физического развития.
8. Запасающая (питательная) функция
В семенах растений запасаются резервные белки, которые используются при прорастании зародышем.
9. Энергетическая функция
При полном окислении 1 г белка выделяется 17,6 кДж энергии. Однако белки расходуются на энергетические нужды лишь в крайних случаях, когда исчерпаны запасы углеводов и жиров.
Белок — важная составляющая каждой клетки нашего организма.Человек нуждается в наборе конкретных пищевых веществ – белков, жиров, углеводов, витаминов, минеральных веществ. Белки – это органические вещества животного и растительного происхождения, которые обеспечивают поддержку клеток человеческого организма. Их основным элементом являются многочисленные аминокислоты. Белки называют пищей роста. Они представляют собой как бы каркас, который обеспечивает структурными элементами каждую клетку тела. Белки ответственны за рост, восстановление и замену тканей. Белки – единственный питательный элемент, который может сам себя дублировать. Ткани растут за счёт нагромождения друг на друга миллионов белковых молекул, пока каждый орган не достигнет своего полного развития, после чего, они заменяются новыми. Белок можно сравнить с длинным жемчужным ожерельем, где каждая жемчужинка – это аминокислота, маленькая частичка белка. Весьма популярна такая неправильная концепция питания: если питательное вещество полезно, то его должно быть много! Это заблуждение. Организму необходимо определённое количество каждого жизненно важного питательного вещества; если его мало – организм не может функционировать нормально, если слишком много – это дополнительная нагрузка для него. То же относится и к белкам. При избыточном поступлении белка организм начинает работать с нагрузкой, стараясь распределить калории. Человек расплачивается за это неправильным обменом веществ. Белок также способствует более медленному подъему и падению уровня сахара и инсулина в крови, поэтому Вы можете избежать «скачков сахара» после того, как поели сладостей без соответствующего количества белка. При недостаточном количестве белка в пище снижается работоспособность человека и сопротивляемость его организма к инфекционным заболеваниям. Наиболее выразительные признаки дефицита белка в организме — это потеря памяти и ослабле¬ние умственных возможностей, потеря сопротивляемости организма, образование целлюлита, исчезновение женского физиологического цикла или нарушение его нормального протекания. Организму требуется 22 вида аминокислот, из них только 13 видов он может синтезировать сам. Остальные же 9 аминокислот, называемых незаменимыми, он должен получать с продуктами питания. Белки, содержащие все 9 незаменимых аминокислот, называются полноценными. Мясо, рыба, куры, яйца, молочные продукты, – вот главные источники полноценных белков. Овощи, крупы, злаковые и особенно бобовые (сухой горох, соя, чечевица, бобы) – отличные источники белков, называемых неполноценными, поскольку в них содержатся многие, но не все аминокислоты, в разных соотношениях. Сбалансированное питание – это получение организмом всего набора незаменимых аминокислот вследствие сочетания овощей, злаковых, молочных и мясных продуктов. Вот перечень продуктов – источников белка, в убывающей последовательности:
Список литературы
Версия для печати |
Неорганические и органические вещества клетки, подготовка к ЕГЭ по биологии
Задумайтесь! Мы с вами состоит из миллиардов атомов. Все атомы находятся в круговороте, и все атомы, которыми мы обладаем, в ком-то и где-то находились те 4,5 млрд. лет, которые существует Земля. Они были частями животных, растений, грибов и бактерий — а сейчас принадлежат нам на короткое время.
С химической точки зрения ответ на вопрос «Жив ли изучаемый объект?» — не представляется возможным. Понятию «жизнь» дано колоссальное количество определений. Жизнь — это самовоспроизведение с изменением, способ существования белковых тел, постоянный обмен веществ с внешней средой.
Мы приступаем к изучению неорганических и органических веществ клетки. Начнем с неотъемлемого компонента клетки, благодаря которому жизнь на Земле в принципе стала возможна — вода.
Вода
Составляет 60-80% массы клетки. Молекула воды обладает уникальным свойством — полярностью, которое возникает из-за разницы в электроотрицательности (ЭО) между атомами кислорода и водорода (у кислорода ЭО больше).
Поскольку молекула воды полярна, ее называют диполь. Между молекулами воды возникают непрочные водородные связи: водородная связь начинается от отрицательно заряженного атома кислорода (2δ—) одной молекулы воды и тянется до положительно заряженного атома водорода другой молекулы воды (δ+)
По отношению к воде все вещества можно подразделить на два типа:
- Гидрофильные (греч. hydro — вода и philéo — люблю) — вещества, которые хорошо растворяются в воде. Гидрофильными веществами являются сахара, соли, альдегиды, спирты, аминокислоты.
- Гидрофобные (греч. hydro — вода и phobos — страх) — вещества, которые не растворяются в воде. Гидрофобными веществами являются жиры.
Роль воды в клетке трудно переоценить. Ее функции и свойства крайне важны:
- Вода — универсальный растворитель
- Вода — терморегулятор
- Вода — реагент
- Транспортная функция
- Структурная функция
Большинство реакций, которые протекают в клетке, идут в растворе (водной среде). Полярность молекулы воды позволяет ей быть отличным растворителем для других гидрофильных (полярных) веществ.
Вода может поглощать теплоту при минимальном изменении температуры. Это настоящее «спасение» для клеток: чуть только температура меняется, вода начинает поглощать избыток тепла, защищая клетку от перегревания. Выделяясь на поверхность кожи с потом, вода испаряется, поверхность кожи при этом охлаждается.
Она не только создает среду для реакций в клетке, но и сама активно участвует во многих из них. Расщепление питательных веществ, попавших в клетку, происходит за счет реакции гидролиза (греч. hydro — вода и lysis — расщепление).
Питательные вещества, газы перемещаются по организму с током крови. Вода составляет 90-92% плазмы крови, является ее основным компонентом. С помощью воды происходит не только доставка веществ к клеткам, но и удаление из организма побочных продуктов обмена веществ.
Вода придает тканям тургор (лат. turgor — наполнение) — внутреннее осмотическое давление в живой клетке, создающее напряжение оболочек клеток. Вода составляет от 60 до 95% цитоплазмы, придает клеткам форму. Изменение тургора клеток растений приводит к перемещениям их частей, раскрытию устьиц, цветков.
Осмотическое давление — избыточное гидростатическое давление на раствор, отделенный от чистого растворителя с помощью полупроницаемой мембраны.
Главное — понимать суть: если мы поместим живую клетку в гипертонический раствор, то вода (растворитель) устремится из клетки в раствор (в сторону большей концентрации соли) — это приведет к сморщиванию клеток.
Если же клетка окажется в гипотоническом растворе, то вода извне устремится внутрь клетки (опять-таки в сторону большей концентрации солей), приводя при этом к разбуханию (и возможному разрыву) клетки.
Элементы
Живая клетка — кладезь элементов таблицы Менделеева. Процент содержания различных элементов отличается, в связи с чем все они делятся на 3 группы:
- Биогенные (основные) — C, H, O, N. Входят в состав органических соединений, составляют основную часть клетки
- Макроэлементы (греч. makrós — большой) — составляют десятые и сотые доли в клетке: K, Na, Ca, Mg, Cl, P, S, Fe
- Микроэлементы (греч. mikrós — маленький) — составляют тысячные доли в клетке: Zn, Cu, I, Co, Mn
Процентное содержание элемента не коррелирует с его важностью и биологической значимостью. Так, к примеру, микроэлемент I играет важную роль в синтезе гормонов щитовидной железы: тироксина, трийодтиронина. За нормальные рост и развитие организмов отвечают Zn, Mn, Cu.
Благоприятно влияют на сперматозоиды Zn, Ca, Mg, защищая их от оксидативного стресса (окисления). Невозможным становится нормальное образование эритроцитов без должного уровня Fe и Cu.
Соли
В водной среде клетки соли диссоциируют (распадаются) на положительно заряженные ионы — катионы (Na+, K+, Ca2+, Mg2+) и отрицательно заряженные — анионы (Cl—, SO42-, HPO42-, H2PO4—).
Для процессов возбуждения клетки (нейрона, миоцита — мышечной клетки) внутри клетки должна поддерживаться низкая концентрация ионов Na+ и высокая концентрация ионов K+. В окружающей клетку среде все наоборот: много Na и мало K. В мембране существует специальный натрий-калиевый насос, который поддерживает необходимое равновесие. Если это соотношение нарушится, то нейрон не сможет сгенерировать нервный импульс, а клетка мышцы — сократиться.
Соли в клетке и организме выполняют ряд важных функций:
- Участвуют в активации ферментов
- Создают буферные системы (бикарбонтаную, фосфатную, белковую)
- Поддерживают кислотно-щелочное состояние (КЩС)
- Создают осмотическое давление клетки
- Создают мембранный потенциал клеток (натрий-калиевый насос)
- Являются основным минеральным составляющим скелета внутреннего и наружного (у моллюсков)
Мы переходим к органическим компонентам клетки, к которым относятся: жиры, углеводы, белки и нуклеиновые кислоты.
Белки, или пептиды (греч. πεπτος — питательный)
Белки — полимеры, мономерами которых являются аминокислоты. Белки представляют линейную структуру, образованную из длинной цепи аминокислот, между которыми возникают пептидные связи. Пептидная связь образуется между карбоксильной группой (COOH) одной аминокислоты и аминогруппой другой аминокислоты (NH2).
Между понятиями пептиды и белки существует определенная разница. Белки состоят из сотен тысяч аминокислот. Пептидами называют небольшие белки, содержащие до 10 аминокислот. Ими являются некоторые гормоны: окситоцин, вазопрессин, тиреолиберин — эти пептиды выполняют регуляторную функцию.
Выделяется несколько уровней пространственной организации белка:
- Первичная — полипептидная цепь, в которой аминокислоты расположены линейно
- Вторичная — полипептидная цепь закручивается в спираль, формируется α или β структура
- Третичная — спирали скручиваются в глобулу (лат. globulus — шарик)
- Четвертичная — образуется у сложных белков путем соединения нескольких глобул
При резком изменении оптимальных для белка условий он подвергается денатурации: при этом происходит переход от высших структур организации к низшим, или «раскручивание белка». Важно заметить, что аминокислотная последовательность (первичная структура белка) при этом не меняется, однако свойства белка меняются кардинально (теряется его гидрофильность).
Осмелюсь сделать заявление: вы часто начинаете свой день с денатурации белка. Простейший способ провести такой эксперимент — пожарить яичницу. Заметьте, что изначально яичный белок прозрачный и текучий, но по итогу жарки эти свойства утрачиваются: он становится непрозрачным и вязким.
Завершаем тему о белках изучением их функций:
- Каталитическая (греч. katalysis — разрушение)
- Строительная
- Регуляторная
- Защитная
- Энергетическая
- Транспортная
- Сократительная
- Рецепторная
Белки — природные катализаторы, ускоряющие реакции в организме в десятки и сотни тысяч раз. Эту роль главным образом выполняют белки-ферменты (энзимы).
Иногда в состав белков входят так называемые ко-факторы — небелковые соединения, которые необходимы ферменту для его биологической активности (в роли ко-факторов могут выступать Zn2+, Mg2+).
Белки входят в состав клеточных мембран. Сложные белки: коллаген, эластин — входят в состав соединительных тканей организма, придавая им некоторую прочность и эластичность.
Некоторые гормоны, регулирующие обменные процессы в организме, имеют белковое происхождение: инсулин, глюкагон, адренокортикотропный гормон (АКТГ).
Говоря об этой функции, прежде всего, стоит вспомнить об антителах — иммуноглобулинах, которые синтезируют B-лимфоциты. Антитела нейтрализуют чужеродные организму антигены (разрушают бактерии).
Помимо антител, защитную функцию выполняют также белки свертывающей системы крови (тромбин и фибриноген): они предохраняют организм от кровопотери.
При недостаточном питании в организме начинают окисляться молекулы белков. При расщеплении 1 г белков выделяется 17,6 кДж энергии.
Некоторые белки крови способны присоединять к себе и переносить различные молекулы. Альбумины участвуют в транспорте жирных кислот, глобулины — гормонов и некоторых ионов (Fe, Cu). Основной белок эритроцитов — гемоглобин — способен переносить кислород, углекислый и угарный газы (угарный конечно нежелательно ему переносить, будет отравление)
Двигательные белки, актин и миозин, на уровне саркомера обеспечивают сокращение мышц. При возбуждении мышечной ткани тонкие нити актина начинают тереться о толстые нити миозина, приводя к сокращению.
На поверхности мембраны белки образуют многочисленные рецепторы, которые, соединяясь с гормонами, приводят к изменению обмена веществ в клетке. Таким образом, гормоны реализуют воздействие на клетки органов-мишеней.
Жиры, или липиды (греч. lipos — жир)
С химической точки зрения жиры являются сложными эфирами, образованными трехатомным спиртом глицерином и высшими карбоновыми кислотами (жирными кислотами). Среди их свойств надо выделить то, что они практически нерастворимы в воде. Вспомните, как тяжело смыть жир с рук водой.
Почему именно мыло смывает жир с рук? Дело в том, что молекула мыла повторяет свойства жира: одна часть ее гидрофобна, а другая гидрофильна. Мыло соединяется с молекулой жира гидрофобной частью, и вместе они легко смываются водой.
Приступим к изучению функций жиров:
- Энергетическая
- Запасающая
- Структурная
- Терморегуляция
- Гормональная
- Участие в обмене веществ (метаболизме)
При окислении жиров выделяется много энергии: 1 г — 38,9 кДж. Это вдвое больше выделяющейся энергии при расщеплении 1г углеводов.
Жиры имеют способность накапливаться в клетках, расположенных в подкожно-жировой клетчатке, внутренних органах. Эти запасы являются резервом организма на случай голодания или при недостаточном питании.
В жирах также запасается вода: в 100 г жира содержится 107 мл воды. Многим пустынным животным (верблюдам) жировые запасы помогают длительное время обходиться без воды.
Жиры входят в состав биологических мембран клеток человека вместе с белками. Из фосфолипидов построены мембраны всех клеток органов и тканей!
Так, к примеру, холестерин — обязательный компонент мембраны, придает ей определенную жесткость и совершенно необходим для нормальной жизнедеятельности (заболевания возникают только при нарушении липидного обмена).
Жиры обладают плохой теплопроводностью. Располагаясь в подкожно-жировой клетчатке, они образуют термоизолирующий слой. Особенно хорошо он развит у ластоногих (моржи и тюлени), китов, защищает их от переохлаждения.
Некоторые гормоны по строению относятся к жирам: половые (андрогены — мужские и эстрогены — женские), гормон беременности (прогестерон), кортикостероиды.
Производное жира — витамин D — принимает важное участие в обмене кальция и фосфора в организме. Он образуется в коже под действием ультрафиолетового излучения (солнечного света). При недостатке витамина D возникает заболевание - рахит.
Углеводы
Представляют собой органические соединения, состоящие из одной или нескольких молекул простых сахаров. Выделяется три основных класса углеводов:
- Моносахариды (греч. monos — единственный)
- Олигосахариды (греч. ὀλίγος — немногий)
- Полисахариды
Простые сахара, легко растворяющиеся в воде и имеющие сладкий вкус. Моносахариды подразделяются на гексозы (имеют 6 атомов углерода) — глюкоза, фруктоза, и пентозы (имеют 5 атомов углерода) — рибоза и дезоксирибоза, входящие в состав нуклеиновых кислот.
При гидролизе олигосахариды распадаются на моносахариды. В состав олигосахаридов может входить от 2 до 10 моносахаридных остатков. Если в состав олигосахарида входят 2 остатка моносахарида, то его называют дисахарид. К дисахаридам относятся сахароза, лактоза, мальтоза. При гидролизе сахароза распадается на глюкозу и фруктозу.
Это биополимеры, в состав которых входят сотни тысяч моносахаридов. Они обладают высокой молекулярной массой, нерастворимы в воде, на вкус несладкие.
Крахмал, целлюлоза, гликоген, хитин и муреин — все это биополимеры. Давайте вспомним, где они находятся.
Клеточная стенка образована: у растений — целлюлозой, у грибов — хитином, у бактерий — муреином. Запасным питательным веществом растений является крахмал, животных — гликоген.
Перечислим функции, которые выполняют углеводы:
- Энергетическая
- Запасающая
- Структурная (опорная)
В результате расщепления 1 г углеводов высвобождается 17,6 кДж энергии.
Запасным питательным веществом растений и животных соответственно являются крахмал и гликоген. Расщепление гликогена позволяет нам оставаться в сознании и быть активными между приемами пищи.
Гликоген представляет собой разветвленную молекулу, состоящую из остатков глюкозы. За счет больших размеров такая молекула хорошо удерживается в клетке, а ее разветвленность позволяет ферментам быстро отщеплять множество молекул глюкозы одновременно.
Существуют заболевания, при которых распад гликогена нарушается: в результате нейроны не получают глюкозы (источника энергии, соответственно не синтезируются и молекулы АТФ). Из-за этого становятся возможны частые потери сознания.
Целлюлоза входит в состав клеточных стенок растений, придавая им необходимую твердость. Хитин образует клеточную стенку грибов и наружный скелет членистоногих.
Нуклеиновые кислоты (от лат. nucleus — ядро)
Высокомолекулярные органические соединения, представленные двумя видами: ДНК (дезоксирибонуклеиновые кислоты) и РНК (рибонуклеиновые кислоты). ДНК и РНК — биополимеры, мономером которых является нуклеотид. Запомните, что нуклеотид состоит из 3 компонентов:
- Азотистое основание
- Остаток сахара
- Остаток фосфорной кислоты — фосфат
Для ДНК характерны следующие азотистые основания: аденин — тимин, гуанин — цитозин; для РНК: аденин — урацил, гуанин — цитозин. Исходя из принципа комплементарности, данные основания соответствуют друг другу, в результате чего между ними образуются связи.
Между аденином и тимином образуется 2 водородные связи, а между гуанином и цитозином — 3.
Именно по этой причине количество аденина в молекуле ДНК всегда совпадает с количеством тимина. К примеру, если в ДНК 20% аденина, то с уверенностью можно сказать, что в ней 20% тимина. Выходит на оставшиеся основания — цитозин и гуанин — остается 60%, значит, цитозин и гуанин составляют в ДНК 30% каждый. Таким нехитрым образом, зная процент содержания одного основания, можно подсчитать все остальные.
В ДНК остаток сахара — дезоксирибоза, в РНК — рибоза.
Мы подробно изучили структуру ДНК (дезоксирибонуклеиновой кислоты) — двойной правозакрученной спиральной молекулы. Теперь настало время детально поговорить об РНК (рибонуклеиновой кислоте). Все виды РНК синтезируются на матрице — ДНК, различают три вида РНК:
- Рибосомальная РНК (рРНК)
- Информационная РНК (иРНК, син. — матричная РНК, мРНК)
- Транспортная РНК (тРНК)
Синтезируется в ядрышке. рРНК входит в состав малых и больших субъединиц рибосом. В процентном отношении рРНК составляет 80-90% всей РНК клетки.
Синтезируется в ядре в ходе процесса транскрипции (лат. transcriptio — переписывание). Фермент РНК-полимераза строит цепь иРНК по принципу комплементарности с ДНК. Исходя из данного принципа, гуанин (Г) в молекуле ДНК соединяется с цитозином (Ц) в РНК. Далее соответственно: цитозин (Ц) — гуанин (Г), аденин (А) — урацил (У), тимин (Т) — аденин (А).
Обеспечивает транспорт аминокислоты к рибосоме во время синтеза белка. Благодаря этому становится возможным соединение аминокислот друг с другом, образуется белок. тРНК имеет характерную форму клеверного листа.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Виды белков, их функции и структура
По теории Опарина-Холдейна жизнь на нашей планете зародилась из коацерватной капельки. Она же представляла собой молекулу белка. То есть следует вывод, что именно эти химические соединения — основа всего живого, что существует сегодня. Но что же собой представляют белковые структуры? Какую роль сегодня они играют в организме и жизни людей? Какие виды белков существуют? Попробуем разобраться.
Белки: общее понятие
С точки зрения химического строения, молекула рассматриваемого вещества представляет собой последовательность аминокислот, соединенных между собой пептидными связями.
Каждая аминокислота имеет две функциональные группы:
- карбоксильную -СООН;
- амино-группу -NH2.
Именно между ними и происходит формирование связи в разных молекулах. Таким образом, пептидная связь имеет вид -СО-NH. Молекула белка может содержать сотни и тысячи таких группировок, это будет зависеть от конкретного вещества. Виды белков очень разнообразны. Среди них есть и те, которые содержат незаменимые для организма аминокислоты, а значит должны поступать в организм с пищевыми продуктами. Существуют такие разновидности, которые выполняют важные функции в мембране клетки и ее цитоплазме. Также выделяют катализаторы биологической природы — ферменты, которые тоже являются белковыми молекулами. Они широко используются и в быту человека, а не только участвуют в биохимических процессах живых существ.
Молекулярная масса рассматриваемых соединений может колебаться от нескольких десятков до миллионов. Ведь количество мономерных звеньев в большой полипептидной цепи неограниченно и зависит от типа конкретного вещества. Белок в чистом виде, в его нативной конформации, можно увидеть при рассмотрении куриного яйца в сыром виде. Светло-желтая, прозрачная густая коллоидная масса, внутри которой располагается желток — это и есть искомое вещество. То же самое сказать об обезжиренном твороге, Данный продукт также является практически чистым белком в его натуральном виде.
Однако не все рассматриваемые соединения имеют одинаковое пространственное строение. Всего выделяют четыре организации молекулы. Виды структур белка определяют его свойства и говорят о сложности строения. Также известно, что более пространственно запутанные молекулы подвергаются тщательной переработке в организме человека и животных.
Виды структур белка
Всего их выделяют четыре. Рассмотрим, что собой представляет каждая из них.
- Первичная. Представляет собой обычную линейную последовательность аминокислот, соединенных пептидными связями. Никаких пространственных закручиваний, спирализации нет. Количество входящих в полипептид звеньев может доходить до нескольких тысяч. Виды белков с подобной структурой — глицилаланин, инсулин, гистоны, эластин и другие.
- Вторичная. Представляет собой две полипептидные цепи, которые скручиваются в виде спирали и ориентируются по направлению друг к другу образованными витками. При этом между ними возникают водородные связи, удерживающие их вместе. Так формируется единая белковая молекула. Виды белков такого типа следующие: лизоцим, пепсин и другие.
- Третичная конформация. Представляет собой плотно упакованную и компактно собранную в клубок вторичную структуру. Здесь появляются другие типы взаимодействия, помимо водородных связей — это и ван-дер-ваальсово взаимодействие и силы электростатического притяжения, гидрофильно-гидрофобный контакт. Примеры структур — альбумин, фиброин, белок шелка и прочие.
- Четвертичная. Самая сложная структура, представляющая собой несколько полипептидных цепей, скрученных в спираль, свернутых в клубок и объединенных все вместе в глобулу. Такие примеры, как инсулин, ферритин, гемоглобин, коллаген, иллюстрируют собой как раз такую конформацию белков.
Если рассматривать все приведенные структуры молекул детально с химической точки зрения, то анализ займет много времени. Ведь на самом деле чем выше конфигурация, тем сложнее и запутаннее ее строение, тем больше типов взаимодействий наблюдается в молекуле.
Денатурация белковых молекул
Одним из самых важных химических свойств полипептидов является их способность разрушаться под влиянием определенных условий или химических агентов. Так, например, широко распространены разные виды денатурации белков. Что это за процесс? Он заключается в разрушении нативной структуры белка. То есть если изначально молекула имела третичную структуру, то после действия специальными агентами она разрушится. Однако при этом последовательность аминокислотных остатков остается в молекуле неизменной. Денатурированные белки быстро теряют свои физические и химические свойства.
Какие реагенты способны привести к процессу разрушения конформации? Таких несколько.
- Температура. При нагревании происходит постепенное разрушение четвертичной, третичной, вторичной структуры молекулы. Зрительно это можно наблюдать, например, при жарке обычного куриного яйца. Образующийся «белок» — это первичная структура полипептида альбумина, который был в сыром продукте.
- Радиация.
- Действие сильными химическими агентами: кислотами, щелочами, солями тяжелых металлов, растворителями (например, спиртами, эфирами, бензолом и прочими).
Данный процесс иногда еще называют плавлением молекулы. Виды денатурации белков зависят от агента, при действии которого она наступила. При этом в некоторых случаях имеет место процесс, обратный рассмотренному. Это ренатурация. Не все белки способны восстанавливать обратно свою структуру, однако значительная их часть может это делать. Так, химики из Австралии и Америки осуществили ренатурацию вареного куриного яйца при помощи некоторых реагентов и способа центрифугирования.
Этот процесс имеет значение для живых организмов при синтезе полипептидных цепочек рибосомами и рРНК в клетках.
Гидролиз белковой молекулы
Наравне с денатурацией, для белков характерно еще одно химическое свойство — гидролиз. Это также разрушение нативной конформации, но не до первичной структуры, а полностью до отдельных аминокислот. Важная часть пищеварения — гидролиз белка. Виды гидролиза полипептидов следующие.
- Химический. Основан на действии кислот или щелочей.
- Биологический или ферментативный.
Однако суть процесса остается неизменной и не зависит от того, какие виды гидролиза белков имеют место быть. В результате образуются аминокислоты, которые транспортируются по всем клеткам, органам и тканям. Дальнейшее их преобразование заключается в участии синтеза новых полипептидов, уже тех, что необходимы конкретному организму.
В промышленности процесс гидролиза белковых молекул используют как раз для получения нужных аминокислот.
Функции белков в организме
Различные виды белков, углеводов, жиров являются жизненно необходимыми компонентами для нормальной жизнедеятельности любой клетки. А значит и всего организма в целом. Поэтому во многом их роль объясняется высокой степенью значимости и повсеместной распространенности внутри живых существ. Можно выделить несколько основных функций полипептидных молекул.
- Каталитическая. Ее осуществляют ферменты, которые имеют белковую природу строения. О них скажем позже.
- Структурная. Виды белков и их функции в организме прежде всего влияют на структуру самой клетки, ее форму. Кроме того, полипептиды, выполняющие эту роль, образуют волосы, ногти, раковины моллюсков, перья птиц. Они же являются определенной арматурой в теле клетки. Хрящи состоят также из этих видов белков. Примеры: тубулин, кератин, актин и другие.
- Регуляторная. Данная функция проявляется в участии полипептидов в таких процессах, как: транскрипция, трансляция, клеточный цикл, сплайсинг, считывание мРНК и прочих. Во всех них они играют важную роль регулировщика.
- Сигнальная. Данную функцию выполняют белки, находящиеся на мембране клеток. Они передают различные сигналы от одной единицы к другой, и это приводит к сообщению тканей между собой. Примеры: цитокины, инсулин, факторы роста и прочие.
- Транспортная. Некоторые виды белков и их функции, которые они выполняют, являются просто жизненно необходимыми. Так происходит, например, с белком гемоглобином. Он осуществляет транспорт кислорода от клетки к клетке в составе крови. Для человека он незаменим.
- Запасная или резервная. Такие полипептиды накапливаются в растениях и яйцеклетках животных как источник дополнительного питания и энергии. Пример — глобулины.
- Двигательная. Очень важная функция, особенно для простейших организмов и бактерий. Ведь они способны передвигаться только при помощи жгутиков или ресничек. А эти органоиды по своей природе не что иное, как белки. Примеры таких полипептидов следующие: миозин, актин, кинезин и прочие.
Очевидно, что функции белков в организме человека и других живых существ очень многочисленны и немаловажны. Это еще раз подтверждает, что без рассматриваемых нами соединений невозможна жизнь на нашей планете.
Защитная функция белков
Полипептиды могут защищать от разных воздействий: химических, физических, биологических. Например, если организму угрожает опасность в виде вируса или бактерии, имеющих чужеродную природу, то иммуноглобулины (антитела) вступают с ними «в бой», выполняя защитную роль.
Если говорить о физических воздействиях, то здесь большую роль играют, например, фибрин и фибриноген, которые участвуют в свертывании крови.
Белки пищевые
Виды пищевого белка следующие:
- полноценные — те, что содержат все необходимые для организма аминокислоты;
- неполноценные — те, в которых находится неполный аминокислотный состав.
Однако для организма человека важны и те и другие. Особенно первая группа. Каждый человек, особенно в периоды интенсивного развития (детский и юношеский возраст) и полового созревания должен поддерживать постоянный уровень протеинов в себе. Ведь мы уже рассмотрели функции, которые выполняют эти удивительные молекулы, и знаем, что практически ни один процесс, ни одна биохимическая реакция внутри нас не обходится без участия полипептидов.
Именно поэтому необходимо каждый день потреблять суточную норму протеинов, которые содержатся в следующих продуктах:
- яйцо;
- молоко;
- творог;
- мясо и рыба;
- бобы;
- соя;
- фасоль;
- арахис;
- пшеница;
- овес;
- чечевица и прочие.
Если потреблять в день 0,6 г полипептида на один кг веса, то у человека никогда не будет недостатка в этих соединениях. Если же длительное время организм недополучает необходимых белков, то наступает заболевание, имеющее название аминокислотного голодания. Это приводит к сильному нарушению обмена веществ и, как следствие, многим другим недугам.
Белки в клетке
Внутри самой маленькой структурной единицы всего живого — клетки — также находятся белки. Причем выполняют они там практически все вышеперечисленные свои функции. В первую очередь формируют цитоскелет клетки, состоящий из микротрубочек, микрофиламентов. Он служит для поддержания формы, а также для транспорта внутри между органоидами. По белковым молекулам, как по каналам или рельсам, движутся различные ионы, соединения.
Немаловажна роль белков, погруженных в мембрану и находящихся на ее поверхности. Здесь они и рецепторные, и сигнальные функции выполняют, принимают участие в строительстве самой мембраны. Стоят на страже, а значит играют защитную роль. Какие виды белков в клетке можно отнести к этой группе? Примеров множество, приведем несколько.
- Актин и миозин.
- Эластин.
- Кератин.
- Коллаген.
- Тубулин.
- Гемоглобин.
- Инсулин.
- Транскобаламин.
- Трансферрин.
- Альбумин.
Всего насчитывается несколько сотен различных видов протеинов, которые постоянно передвигаются внутри каждой клетки.
Виды белков в организме
Их, конечно же, огромное разнообразие. Если же попытаться как-то разделить все существующие протеины на группы, то может получиться примерно такая классификация.
- Глобулярные белки. Это такие, которые представлены третичной структурой, то есть плотно упакованной глобулой. Примеры таких структур следующие: иммуноглобулины, значительная часть ферментов, многие гормоны.
- Фибриллярные белки. Представляют собой строго упорядоченные нити, имеющие правильную пространственную симметрию. К данной группе относятся протеины с первичной и вторичной структурой. Например, кератин, коллаген, тропомиозин, фибриноген.
Вообще, можно взять за основу множество признаков для классификации белков, находящихся в организме. Единой пока не существует.
Ферменты
Биологические катализаторы белковой природы, которые значительно ускоряют все происходящие биохимические процессы. Нормальный обмен веществ просто невозможен без этих соединений. Все процессы синтеза и распада, сборка молекул и их репликация, трансляция и транскрипция и прочие осуществляются под воздействием специфического вида фермента. Примерами этих молекул могут служить:
- оксидоредуктазы;
- трансферазы;
- каталазы;
- гидролазы;
- изомеразы;
- лиазы и прочие.
Сегодня ферменты используются и в быту. Так, при производстве стиральных порошков часто используют так называемые энзимы — это и есть биологические катализаторы. Они улучшают качество стирки при соблюдении указанного температурного режима. Легко связываются с частицами грязи и выводят их с поверхности тканей.
Однако из-за белковой природы энзимы не переносят слишком горячую воду или соседство с щелочными или кислотными препаратами. Ведь в этом случае произойдет процесс денатурации.
Всего протеина| eClinpath
Общий белок — это сумма концентраций всех индивидуальных белков сыворотки (г / дл). В сыворотке есть сотни различных видов белков, включая прямые полипептиды, а также гликозилированные и липид-ассоциированные формы. Измерение общего белка в клинических целях обычно выполняется следующими методами.
Методы, используемые для измерения общего белка
Рефрактометрия
Этот метод используется для оценки белка плазмы (включая фибриноген) в плазме с ЭДТА, и его результаты отображаются на обычных гемограммах в Корнельском университете.Он измеряет показатель преломления образца относительно показателя преломления воды. Показание фактически является измерением общего содержания твердых веществ и является лишь оценкой концентрации белка, поскольку изменение в других компонентах сыворотки, «твердых веществах» (натрий, хлорид, фосфат, глюкоза, холестерин, мочевина и т. Д.), Также может влиять на показатель преломления, поскольку могут коллоиды, такие как гетакрахмал и желатин (Yam et al 2018). Липемия ложно увеличивает результаты, а гемолиз от умеренного до тяжелого может размыть линию рефрактометра, что затрудняет чтение, но билирубин не влияет на результаты (Gupta and Stockham 2014).Подробнее об оценке общего белка с помощью рефрактометрии см. В разделе, посвященном основам гемограммы. Существуют также различные рефрактометры, которые могут не давать эквивалентных результатов, в зависимости от того, используют ли они формулу коррекции или нет.
Биуретовый метод
Колориметрический метод, используемый в автоматизированном химическом анализаторе. Он обнаруживает все белки и имеет точность в диапазоне 1-10 г / дл. Он недостаточно чувствителен к низким концентрациям, обнаруживаемым в некоторых жидкостях организма, таких как спинномозговая жидкость, моча и многие выделения из полостей тела.
Обратите внимание, что общий белок (измеренный рефрактометром), полученный с помощью гемограммы, обычно выше, чем полученный с помощью химического анализатора, особенно у собак и кошек по сравнению с крупными видами животных (по нашему опыту). Эта разница связана с:
- Вклад твердых тел в показатель преломления.
- Вклад фибриногена в общее содержание белка в плазме по сравнению с сывороткой. Обратите внимание, что если химическая панель проводится на гепаринизированной плазме, разница между двумя измерениями намного меньше, поскольку фибриноген присутствует как в образцах ЭДТА, так и в образцах гепаринизированной плазмы.
Однако следует отметить, что есть некоторые сообщения, в которых по неясным причинам общий белок по биурету выше (0,5-0,7 г / дл в среднем), чем по рефрактометрии у жвачных животных (Katsoulos et al 2017).
Турбидометрические методы
Количественное определение белка в спинномозговой жидкости, моче и других жидкостях с низким содержанием белка требует более чувствительных методов, чем метод биурета или рефрактометра. Белок в этих жидкостях можно более точно измерить с помощью методов осаждения или связывания красителя.Способы осаждения включают трихлоруксусную кислоту и сульфосалициловую кислоту, тогда как для связывания красителя используются такие красители, как кумасси синий и пирогаллоловый красный-молибдат. Процедура измерения белка в жидкостях с низким содержанием белка на Hitachi 911 в Корнельском университете представляет собой турбидометрический метод, основанный на осаждении белка хлоридом бензетония. Он чувствителен к содержанию всего 6 мг / дл белка.
Обратите внимание, что индикаторные полоски мочи можно использовать для оценки белка в пробах спинномозговой жидкости, однако они не так точны, как турбидометрические методы.
Физиология
Белки плазмы представляют собой очень разнородную группу, состоящую из более чем тысячи отдельных белков, с множеством функций, включая поддержание онкотического давления, транспортировку веществ, коагуляцию и т. Д. Общий белок часто делится на две категории: альбумин и глобулины. Альбумин — это единственный белок, на который приходится около половины общей концентрации белка в плазме. Остальные белки вместе называют глобулинами.
Методология
Тип реакции
Конечная точка (двухцветная)
Процедура
- Колориметрический анализ (биурет): В щелочной среде двухвалентная медь реагирует с белково-пептидными связями, образуя комплекс биурета фиолетового цвета, который измеряется фотометрически.Интенсивность окраски, создаваемая этим комплексом, прямо пропорциональна общей концентрации белка.
Реакция показана ниже:
Белок + Cu 2+ щелочной раствор > Cu-протеиновый комплекс
Единицы измерения
Общая концентрация белка измеряется в г / дл (условные единицы) и г / л (единицы СИ). Формула преобразования приведена ниже:
г / дл x 10 = г / л
Пример рассмотрения
Тип образца
Сыворотка и плазма.Сыворотку и плазму следует отделить от сгустка в течение 4 часов после сбора.
Антикоагулянт
Гепарин или ЭДТА
Стабильность
Стабильность общего белка в образцах сыворотки и плазмы человека следующая: 3 дня при 2-8 ° C или 6 месяцев при (-15) до (-25) ° C.
Помехи
- Липемия: Тяжелая липемия (индекс липемии> 1000) улучшит результаты.
- Гемолиз: Увеличивается при тяжелом гемолизе (индекс гемолиза> 650), поскольку гемоглобин будет реагировать как белок в анализе
- Иктеричность: Сильная желтуха может снизить концентрацию (желтушный индекс> 21 для модульного анализатора Roche P).Общий белок биурета был ложно снижен у собаки с тяжелой желтухой, вторичной по отношению к иммуноопосредованной гемолитической анемии, тогда как измерение общего белка рефрактометром не изменилось (Garner et al 2014). Последующее исследование с модулем Roche 6000 C501 показало, что концентрация общего белка ложно снижалась с увеличением концентрации неконъюгированного билирубина (образцы сыворотки крови с повышенным содержанием билирубина). В одном наборе образцов с добавками была затронута концентрация общего белка (уменьшилась на 0.2 г / дл) при билирубине 10,7 мг / дл (желтушный индекс 16) и линейно снизился с 5,2 г / дл до 4,1 г / дл при билирубине 43 мг / дл. Во втором наборе образцов с добавками снижение общего белка началось при 20,8 мг / дл билирубина (следующая самая низкая из исследованных концентраций билирубина составляла 10 мг / дл) с аналогичной степенью снижения общего белка (1,0 г / дл) на самом высоком уровне. концентрация билирубина (36 мг / дл). Что касается клинического случая, концентрации белка, измеренные рефрактометром, не изменились (Gupta and Stockham, 2014).
- Лекарства : 4% сукцинилированный желатин приведет к ложному увеличению результатов (Yam et al 2018).
Интерпретация теста
Поскольку общий белок состоит из смеси альбумина и глобулинов, результат не интерпретируется изолированно, а скорее интерпретируется в контексте изменений в альбумине и глобулинах (независимо и по отношению друг к другу). Альбумин обычно составляет около половины общей концентрации белка в плазме.
Калькулятор белка
Калькулятор протеина рассчитывает дневное количество белка, необходимое взрослым для поддержания здоровья.Детям, людям с высокой физической активностью, беременным и кормящим женщинам обычно требуется больше белка. Калькулятор также полезен для контроля потребления белка людьми с заболеваниями почек, печени, диабетом или другими состояниями, в которых потребление белка является фактором.
- Упражнение: 15-30 минут повышенной активности пульса.
- Интенсивные упражнения: 45–120 минут повышенной активности пульса.
- Очень интенсивные упражнения: 2+ часа повышенной активности пульса.
Калькулятор связанных калорий | Калькулятор углеводов | Калькулятор потребления жиров
Что такое белки?
Белки являются одним из трех основных макроэлементов, которые обеспечивают организм энергией, наряду с жирами и углеводами. Белки также несут ответственность за большую часть работы, выполняемой клетками; они необходимы для правильного строения и функционирования тканей и органов, а также регулируют их. Они состоят из ряда аминокислот, которые необходимы для правильного функционирования организма и служат строительными блоками тканей тела.
Всего существует 20 различных аминокислот, и последовательность аминокислот определяет структуру и функцию белка. Хотя некоторые аминокислоты могут синтезироваться в организме, есть 9 аминокислот, которые люди могут получить только из пищевых источников (недостаточное количество которых иногда может привести к смерти), называемых незаменимыми аминокислотами. Пища, содержащая все незаменимые аминокислоты, называется полноценными источниками белка и включает как животные (мясо, молочные продукты, яйца, рыба), так и растительные источники (соя, киноа, гречка).
Белки можно разделить на категории в зависимости от функции, которую они выполняют в организме. Ниже приведен список некоторых типов белков 1 :
- Антитела — белки, которые защищают организм от инородных частиц, таких как вирусы и бактерии, связываясь с ними.
- Фермент — белки, которые помогают формировать новые молекулы, а также выполнять множество химических реакций, происходящих в организме.
- Messenger — белки, передающие сигналы по всему телу для поддержания процессов в организме.
- Структурный компонент — белки, которые действуют как строительные блоки для клеток, которые в конечном итоге позволяют телу двигаться.
- Транспорт / хранение — белки, которые перемещают молекулы по всему телу
Как можно видеть, белки играют много важных ролей в организме, и поэтому важно обеспечить организм достаточным питанием для поддержания здорового уровня белка.
Сколько белка мне нужно?
Количество белка, которое ежедневно требуется человеческому организму, зависит от многих условий, включая общее потребление энергии, рост человека и уровень физической активности. Его часто оценивают на основе массы тела, в процентах от общего количества потребляемых калорий (10-35%) или на основании только возраста. 0,8 г / кг массы тела — это обычно цитируемая рекомендуемая диетическая доза (RDA). Это минимальное рекомендуемое значение для поддержания основных пищевых потребностей, но потребление большего количества белка до определенного момента может быть полезным, в зависимости от источников белка.
Рекомендуемый диапазон потребления белка составляет от 0,8 г / кг до 1,8 г / кг массы тела, в зависимости от многих факторов, перечисленных выше. Люди, которые очень активны или хотят нарастить больше мышц, обычно должны потреблять больше белка. Некоторые источники 2 предлагают потреблять от 1,8 до 2 г / кг для тех, кто очень активен. Количество белка, которое человек должен потреблять, на сегодняшний день не является точной наукой, и каждый человек должен проконсультироваться со специалистом, будь то диетолог, врач или личный тренер, чтобы определить свои индивидуальные потребности.
Рекомендуемая суточная доза белка, исходя из возраста
| Требуемый белок (граммы / день) | ||||||
| Возраст 1-3 | 13 | |||||
| Возраст 4-8 | 19 | |||||
| Возраст 9-13 | 34 | 14-18 (Девочки) | 46 | |||
| Возраст 14-18 (Мальчики) | 52 | |||||
| Возраст 19-70+ (Женщины) | 46 | |||||
| Возраст 19-70+ (Мужчины) | 56 |
Дополнительные потребности в белке при беременности и кормлении грудью
| Безопасное потребление (грамм / день) | Дополнительная энергия Требование (кДж / день) | Соотношение белок: энергия | |
| Триместр беременности 1 | 1 | 04 | |
| 2-й триместр беременности | 10 | 1,200 | 0,11 |
| 3-й триместр беременности | 31 | 1,950 | 0,23 | 2 месяца L |
| Лактация Через 6 месяцев | 13 | 1,925 | 0,11 |
Продукты с высоким содержанием белка
Есть много различных комбинаций продуктов, которые человек может съесть, чтобы удовлетворить свои потребности в белке.Многие люди получают большую часть белка из мяса и молочных продуктов, хотя можно получить достаточное количество белка, соблюдая определенные диетические ограничения. Как правило, легче удовлетворить суточную норму потребления белка, потребляя мясо и молочные продукты, но избыток любого из них может иметь негативные последствия для здоровья. Существует множество вариантов растительного белка, но обычно они содержат меньше белка в одной порции. В идеале человек должен потреблять смесь мясных, молочных и растительных продуктов, чтобы соответствовать своей суточной норме потребления, и иметь сбалансированную диету, богатую питательными веществами.
По возможности рекомендуется употребление разнообразных полноценных белков. Полноценный белок — это белок, который содержит хорошее количество каждой из девяти незаменимых аминокислот, необходимых в рационе человека. Примеры полноценных белковых продуктов или блюд включают:
Примеры мяса / молочных продуктов
- Яйца
- Куриная грудка
- Творог
- Греческий йогурт
- Молоко
- Постная говядина
- Тунец
- Грудка индейки
- Рыба
- Креветки
Примеры веганского / растительного происхождения
- Гречка
- Хумус и лаваш
- Соевые продукты (тофу, темпе, бобы эдамаме)
- Арахисовое масло на тостах или другом хлебе
- Фасоль и рис
- Киноа
- Семена конопли и чиа
- Спирулина
Обычно полноценными источниками белка являются мясо, птица, рыба, яйца и молочные продукты.Орехи и семена, бобовые, зерновые и овощи, помимо прочего, обычно не являются полноценными белками. Однако нет ничего плохого в неполном количестве белков, и есть много здоровых продуктов с высоким содержанием белка, которые не являются полноценными белками. Пока вы потребляете достаточное количество неполных белков, чтобы получить все необходимые аминокислоты, нет необходимости специально есть полноценные белковые продукты. На самом деле, некоторые виды красного мяса с высоким содержанием жира, которые, например, являются обычным источником полноценных белков, могут быть нездоровыми.Ниже приведены некоторые примеры продуктов с высоким содержанием белка, которые не являются полноценными белками:
- Миндаль
- Овес
- Брокколи
- Чечевица
- Хлеб Иезекииля
- Семена чиа
- Семена тыквы
- Арахис
- Брюссельская капуста
- Грейпфрут
- Горошек зеленый
- Авокадо
- Грибы
Как видно, есть много разных продуктов, которые человек может потреблять, чтобы удовлетворить свою дневную норму потребления белка.Приведенные выше примеры не являются исчерпывающим списком продуктов с высоким содержанием белка или полноценных белков. Как и во всем остальном, важен баланс, и приведенные выше примеры представляют собой попытку предоставить список более здоровых вариантов белка (при умеренном потреблении).
Количество белка в обычных продуктах питания
| Количество белка | ||
| Молоко (1 чашка / 8 унций) | 8 г | |
| Яйцо (1 большое / 50 г) | 6 г | |
| Мясо (2 унции) ) | 14 г | |
| Морепродукты (2 унции) | 16 г | |
| Хлеб (1 ломтик / 64 г) | 8 г | |
| Кукуруза (1 чашка / 166 г) | 16 г | |
| Рис (1 чашка / 195 г) | 5 г | |
| Сухие бобы (1 чашка / 92 г) | 16 г | |
| Орехи (1 чашка / 92 г) | 20 г | |
| Фрукты и овощи (1 чашка) | 0-1 г | |
| Пицца (1 ломтик / 107 г) | 12 г | |
| Гамбургер (McDonald Medium) | 20 г |
| Синтетическое мясо, полученное из грибов, Fusarium venenatum | |
| Пищевая добавка, полученная из водорослей |
1. SCP-объект должен быть безопасным для употребления в пищу.
2. Пищевая ценность в зависимости от аминокислотного состава должна быть высокой.
3. Это должно быть приемлемо для широкой публики.
4. Он должен иметь функциональные возможности, т.е. характеристики, присущие обычным основным продуктам питания.
5. Экономическая жизнеспособность процесса SCP
Микроб | Белок (%) | Нуклеиновая кислота (%) |
002 Бактерии83 | 905,8 10-16||
Дрожжи | 45.55 | 5-12 |
Нитчатые грибы | 30,55 | 3-10 |
Водоросли 9183 | 02 Водоросли
В таблице показано содержание незаменимых аминокислот в клеточном белке в сравнении с несколькими референсными белками (граммы аминокислот на 100 граммов белка)
Ссылки
Israelidis, C.(нет данных). ПИТАНИЕ — ЕДИНСТВЕННЫЙ КЛЕТОЧНЫЙ БЕЛК, ДВАДЦАТЬ ЛЕТ СПУСТЯ. Получено 7 марта 2011 г. с сайта http://www.biopolitics.gr/HTML/PUBS/VOL1/isreali.htm.
Шривастава, M.L., (2008), Fermentation Technology, Alpha Science International, Oxford,
Trehan, K., (1990), Biotechnology, New Age International, New Delhi
Клеточная стенка Candida albicans: взгляд на протеомику
1. Введение
Грибковые инфекции представляют собой серьезную проблему для здоровья во всем мире.Было подсчитано, что более 13% всего населения имеет грибковую инфекцию на коже, 300 миллионов человек страдают тяжелой грибковой инфекцией, а 25 миллионов находятся в большой опасности умереть или ослепнуть в результате заражения грибами. [1]. Инфекции, вызванные грибками, вызывают более 1,5 миллиона заболеваний во всем мире, в основном у людей, инфицированных ВИЧ или страдающих двумя или более патологическими состояниями [2]. Несмотря на то, что существует более 150 видов Candida , известно, что только около 20 видов вызывают инфекции человека, из них C.albicans — наиболее частый возбудитель кандидоза и ведущая грибковая инфекция [3]. C. albicans является частью нормальной микрофлоры человека и может быть обнаружен в нормальных слизистых оболочках или кожной микрофлоре здоровых людей [2]. При определенных условиях, например, когда пациенты проходят лечение антибиотиками, иммунодепрессантами или химиотерапевтическими агентами или находятся в хирургических отделениях интенсивной терапии в течение длительного времени, комменсальные дрожжевые клетки C. albicans превращаются в патогенные клетки, участвующие в опасных для жизни инвазивных заболеваниях. кандидоз [3].Более того, появляется все больше сообщений о штаммах C. albicans , проявляющих фенотип множественной лекарственной устойчивости к противогрибковым препаратам. Таким образом, инфекция Candida представляет собой клиническую проблему во всем мире из-за сложности лечения системного кандидоза.
2. Клеточная стенка Candida albicans
C. albicans разработала несколько молекулярных инструментов для обнаружения и уклонения от иммунной системы хозяина, которые включают факторы вирулентности грибов, участвующие в прикреплении, повреждении клеток и инвазии [4] .Многие из этих факторов локализованы в клеточной стенке грибов, которые составляют основную структуру, контактирующую с клетками-хозяевами, и необходимы для целостности клеток грибов. Клеточная стенка представляет собой замечательную структуру из-за ее ключевой роли в защите от стрессовых условий окружающей среды, включая осмотические изменения, обезвоживание, тепло, холод, реакцию иммунной системы или атаки других микроорганизмов [5, 6, 7], а также отвечает за форму клеток и адгезию к клеткам-хозяевам через адгезины.
Клеточная стенка в основном состоит из белков, гликанов и хитина [5, 6, 7]. Белки клеточной стенки сильно маннозилированы посредством O — и N -химических связей и действуют как структурные элементы, адгезины, сшивающие ферменты, молекулярные сенсоры изменений окружающей среды, а также для защиты от изменений окружающей среды [5, 6, 7, 8]. Существует два класса ковалентно связанных белков клеточной стенки грибов (CWP), гликозилфосфатидилинозитол (GPI) -зависимые CWP и Pir-CWP [5, 6, 7], которые могут быть выделены из клеточных стенок обработкой слабой щелочью (щелочью). чувствительная связь, ASL).В случае Saccharomyces cerevisiae , Cwp2 представляет собой белок клеточной стенки GPI, несущий повтор Pir, участвующий в связывании Cwp2 с β-1,3-гликаном для повышения целостности клеточной стенки [6, 8]. Белки, не обладающие гомологией с белками Pir, были обозначены как щелочно-чувствительные белки клеточной стенки (ASL-CWP), и они ковалентно связаны с клеточными стенками C. albicans и S. cerevisiae посредством слабочувствительных химических связей [ 5, 6, 8]. Другие белки связаны с CWP через дисульфидные связи [9].
Большинство компонентов клеточной стенки имеют ковалентные связи, установленные для повышения стабильности клеточной стенки и, следовательно, защиты от изменений окружающей среды. Один тип белков, описанный как основные сшивающие линкеры компонентов клеточной стенки, — это члены семейства газов, которое содержит только членов царства грибов. C. albicans обладает пятью генами, кодирующими представителей этого семейства: гены PHR1 , PHR2 , PHR3 , PGA4 и PGA5 [10].Эти белки представляют собой β-1,3-глюканазы, которые также проявляют трансглюкозидазную активность и необходимы для перекрестного связывания β-1,3-глюкана и β-1,6-глюкана. PHR1 и PHR2 гены являются единственными членами семейства, которые реагируют на изменения pH [10]. Ген PHR1 может дополнять нулевой мутант S. cerevisiae GAS1 / GGP1 , который имеет в качестве основных фенотипических характеристик сферическую форму и влияние на нормальный паттерн почкования в стационарной фазе кривой роста, что указывает на то, что PHR1 ген является ортологом GAS1 / GGP1 в C.albicans [11]. PHR2 Ген кодирует белок, который показывает 55,15 и 34,48% идентичности с Phr1 и Phr3, соответственно, в то время как Phr1 имеет 32,03% идентичности с Phr3, и что интересно, Phr3 не имеет GPI-заякоренного сайта. PGA4 и PGA5 гены, другие члены семейства Gas, кодируют белки, которые на 25–35% идентичны Phr1 и Phr2 и не чувствительны к pH.
Другими белками, участвующими в образовании ковалентных связей, являются трансглутаминазы (ТГазы), группа ферментов, широко распространенных в микроорганизмах, растениях и животных.Они участвуют в ряде биологических процессов, таких как дифференциация, регуляция роста, клеточная адгезия и целостность ткани. Эти белки являются ферментами с несколькими функциями, включая посттрансляционные модификации, сшивание белков, включение аминогрупп и дезаминирование. Наиболее изученной функцией TGase является сшивание, которое включает реакцию трансаминирования между боковыми цепями остатков глутамина и лизина в целевых белках с образованием амидных связей N-ε- (γ-глутамил) лизина, что приводит к увеличению механической прочности и устойчивости к протеолитическая деградация [12].Большинство трансглутаминаз полностью зависят от ионов Ca 2+ по своей активности. Однако существуют трансглутаминазы из микроорганизмов, которым для своей функции не требуется Ca 2+ . Точно так же ТГазы из слизистой оболочки кишечника грызунов также не зависят от Ca 2+ по своей ферментативной активности [12, 13]. Одной из наиболее изученных трансглутаминаз является человеческая TGase 2, которая играет ключевую роль в стабилизации внеклеточного матрикса и модуляции взаимодействия между фибронектином и интегрином [14].Кроме того, он был вовлечен в ряд заболеваний человека, оказывающих огромное влияние на здоровье во всем мире, таких как болезни Альцгеймера, Хантингтона и Крона, а также при фиброзе, раке и других заболеваниях [15]. В случае Chlamydomonas reinhardtii , TGase играет ключевую роль в сборке клеточной стенки посредством сшивания компонентов клеточной стенки [16]. Об активности ТГазы также сообщалось в C. albicans и S. cerevisiae , где она была обнаружена локализованной во фракции клеточных стенок дрожжевых клеток и показала способность устанавливать ковалентные поперечные связи между белками.Активность ТГазы этих микроорганизмов подавлялась специфическим ингибитором цистамином, который уменьшал включение нескольких полипептидов в клеточную стенку, влиял на регенерацию протопластов и ингибировал переход дрожжей в мицелий, показывая роль в установлении ковалентного скрещивания. связи между белками клеточной стенки и структурными полимерами хитина и / или глюкана [17, 18]. В недавней работе ингибирование активности ТГазы с помощью цистамина подавляло рост дрожжевых клеток и индуцировало аутофагию.Это также повлияло на характер деления дрожжей и структуру клеточной стенки. Интересно, что белок, ответственный за активность TGase в клеточной стенке, был идентифицирован как енолаза с помощью масс-спектрометрии [19].
3. Глюкан
Глюкан является основным компонентом клеточной стенки дрожжей, и вместе с хитином они собраны в трехмерную и динамическую сеть, отвечающую за форму клетки, которая обеспечивает защиту от вредного воздействия окружающей среды. У диморфных дрожжей C. albicans содержание хитина составляет примерно 1-2% от сухой массы клеточной стенки и он расположен рядом с клеточной мембраной.β-1,3 и β-1,6-глюкан составляют 40% и 20% от сухой массы клеточной стенки, соответственно, и располагаются сразу после хитина. Внешний слой клеточной стенки в основном состоит из маннопротеидов, определяющих свойства поверхности клетки [5, 20].
C. albicans глюкан — сильно разветвленный полимер. Он состоит из линейных молекул глюкозы, связанных через β-1,3- и β-1,6-гликозидные связи. β-1,3-глюкан образует спиральную основу в виде одного остатка или цепи, состоящей из трех нитей, соединенных водородными связями.β-1,6-глюкан отвечает за разветвление из-за перекрестного связывания с хитином и маннопротеинами через GPI-якорь, связанный с невосстанавливающим концом β-1,3-глюкана. Аналогичным образом, хитин и белки Pir прикрепляются к невосстанавливающему концу молекулы β-1,3-глюкана [21]. Было показано, что во время образования биопленки глюкан C. albicans повышает устойчивость к нескольким противогрибковым препаратам, таким как амфотерицин B, флуконазол [22] и анидулафунгин (эхинокандин) из-за механизма секвестрации лекарств [23] .Образ жизни с использованием биопленки на медицинских устройствах — серьезная проблема для медицины из-за сложности лечения пациентов с загрязненными протезными материалами.
Синтез β-1,3-глюкана включает несколько стадий и ферментов, и основным и наиболее хорошо охарактеризованным является комплекс плазматической мембраны, называемый глюкансинтазой, который использует UDP-глюкозу в качестве универсального донора и стимулируется GTP; из-за реакции трансгликозилирования возникающая линейная цепь экструдируется в клеточную стенку, где она может подвергаться дальнейшей обработке несколькими ферментами.Комплекс содержит каталитическую субъединицу Fks / Gsc и регуляторную субъединицу Rho1 [24]. Было идентифицировано три гена, кодирующих глюкансинтазу: FKS / GSC , GSC1 , GSL1 и GSL2 . Основная активность исходит от гена GSC1 , и невозможность получить нуль-мутант подчеркивает важность этого гена [25]. Ингибирование синтеза глюкана путем блокирования активности Fks1 / Gsc1 по повреждению клеточной стенки является основной мишенью противогрибковых препаратов.Эхинокандины — самые важные из этих препаратов. Большинство клинических изолятов C. albicans чувствительны к этим препаратам; однако мутации в генах FKS приводят к устойчивости к эхинокандину [26], увеличению количества хитина [27] и снижению экспрессии генов FKS2 и FKS3 [28]. FKS2 и FKS3 нулевые мутанты содержат повышенное количество глюкана в стенке и более толерантны к препаратам эхинокандина, что указывает на то, что оба гена негативно регулируют FKS1 [29].
β-1,3-глюкан претерпевает некоторые модификации после своего синтеза, такие как гидролиз на невосстанавливающем конце или внутри молекулы глюкана, перенос и связывание с другой цепью или сшивание с β-1,6-глюканом. Xog1 / Exg1 является основной активностью β-экзоглюканазы, которая секретируется в клеточную стенку, а затем в среду, и обладает двойной активностью, так как она также может действовать как гликозилтрансфераза [30, 31]. Нулевой мутант Xog1 / Exg1 не имеет существенных изменений жизнеспособности, патогенеза или морфогенеза по сравнению с родительским штаммом [32].Bgl2 (Gh27) представляет собой эндо-β-глюканазу и 1,3-β-глюканозилтрансферазу в C. albicans . Нулевой мутант этого фермента обладает большей чувствительностью к ингибиторам хитина и пониженной вирулентностью, но активность глюканозилтрансферазы остается у этих нулевых мутантов, что позволяет предположить наличие других трансфераз [33]. BGL2 активируется во время регенерации клеточной стенки и при заражении клеток флуконазолом [34]. Интересно, что отсутствие экзоглюканаз и гликозилтрансфераз увеличивает чувствительность к противогрибковым препаратам во время образования биопленок [22].Другой хорошо охарактеризованной глюканазой является Eng1, член эндоглюканазы семейства GH81; нулевые мутанты образуют клеточные цепи, потому что материнские и дочерние клетки не осуществляют цитокинез, указывая на то, что Eng1 играет ключевую роль в делении клеток [34].
Синтез β-1,6-глюкана остается малоизученным. Он требует Kre9, гликозилированного белка клеточной поверхности O , принадлежащего к семейству Gh26. В нуль-мутанте KRE9 количество β-1,6-глюкана не определяется, и белки GPI-стенки высвобождаются во внеклеточную среду, а его вирулентность ослабляется [35].Тем не менее идентифицировано больше генов, участвующих в синтезе β-1,6-глюкана [5].
4. Хитин
Хитин представляет собой линейный полимер N-ацетилглюкозамина, который составляет 1-2% от сухой массы клеточной стенки дрожжей и достигает 10% в гифах [36]. Хитин также может быть деацетилирован с образованием хитозана ферментативным действием хитиндеацетилаз Cda1 и Cda2 [37], о котором сообщалось при образовании спор у S. cerevisiae в условиях азотного голодания и отсутствия ферментируемых источников углерода [38]. ].Синтез хитина происходит как реакция трансгликозилирования, при которой N-ацетилглюкозаминильные остатки передаются от UDP-N-ацетилглюкозамина (UDP-GlcNAc) к растущим полисахаридным цепям через β- (1–4) химические связи [39]. Хитин C. albicans синтезируется хитинсинтазами, организованными в семейство из четырех изоферментов, которые подразделяются на три класса хитинсинтаз: класс I (Chs2 и Chs8), класс II (Chs1) и класс IV (Chs3) [ 39]. Эти ферменты синтезируют хитин, который откладывается на кончиках во время поляризованного роста почек и гиф, а также в перегородке.Белок Chs1 необходим для жизнеспособности, формы клеток и образования перегородки. В условиях репрессии условные мутанты Δchs1 могут расти, но дочерние почки не отделяются от материнских клеток, образуя дрожжевые цепочки [40]. Хитинсинтазы класса I участвуют в целостности клеток во время поляризованного роста дрожжей и гиф и вносят вклад в защиту растущей клеточной стенки во время поляризованного роста, а также в целостность клеток при стрессе, влияющем на клеточную стенку [41].Мутант chs8 дрожжевых клеток показал отсутствие длинных хитиновых микрофибрилл в перегородках дрожжей и гиф, тогда как мутант chs3 показал отсутствие коротких микрофибрилл [42].
Сообщалось, что обработка C. albicans уровнями каспофунгинов ниже минимальной ингибирующей концентрации (МПК) вызывает компенсаторное увеличение содержания хитина [43]. Walker et al. [44] показали увеличение содержания хитина в ответ на использование эхинокандинов у нескольких видов Candida .Было показано, что сигнальные пути протеинкиназы C (PKC) и кальциневрина активируются в изолятах C. albicans , C. krusei , C. parapsilosis, и C. guilliermondii , вызывая увеличение хитина и пониженная восприимчивость к каспофунгину. Таким образом, это механизм толерантности к каспофунгину у видов Candida [44].
5. Маннопротеины
Маннопротеины C. albicans соответствуют примерно 40% содержимого клеточной стенки и локализованы во внешнем слое клеточной стенки, и, следовательно, они взаимодействуют с белками-хозяевами и являются первыми. линия защиты от реакции хозяина [45].Одним из основных сахарных остатков в маннопротеинах является манноза, которая связана с белками во время процессов гликозилирования N -, O — и C — в C. albicans . Механизмы, приводящие к этим модификациям белков в C. albicans , весьма сходны с механизмами, присутствующими в S. cerevisiae . Есть прекрасные отзывы по этому поводу у обоих микроорганизмов. В этом разделе мы кратко опишем два основных процесса гликозилирования.
Большинство гликопротеинов клеточной поверхности сильно гликозилировано и несут как N -связанные, так и O -связанные олигосахариды. Гликозилирование белков N начинается с присоединения Glc 3 Man 9 -GlcNAc 2 корового олигосахарида комплексом долихил-дифосфулигосахарид-белковая гликозилтрансфераза (OST), где Ost1 является важным для каталитической активности [46]. Это ядро присоединено к остатку аспарагина в секвонах Asn-X-Ser / Thr белков в просвете эндоплазматического ретикулума, где X представляет собой любую аминокислоту, кроме пролина.Природа аминокислоты X играет ключевую роль в степени маннозилирования внешней цепи. Гипергликозилирование ингибируется отрицательно заряженными аминокислотами, тогда как оно усиливается положительно заряженными остатками [47].
Синтез ядра Glc 3 Man 9 -GlcNAc 2 начинается с синтеза долихол-фосфат-маннозы (Dol-P-Man) долихил-фосфат-β-маннозилтрансферазой или долихилфосфатом -манноза-синтаза (DPMS) с использованием изопреноидного липида, долихолфосфата (Dol-P) и GDP-маннозы в качестве субстратов, в то время как долихол-фосфат-глюкоза (Dol-P-Glc) синтезируется долихил-фосфат-β-глюкозилтрансферазой. или долихилфосфат-глюкозосинтаза (DPGS или Alg5p) с использованием Dol-P и UDP-глюкозы в качестве субстратов [46].И Dol-P-Man, и Dol-P-Glc перемещаются с цитозольной поверхности в просвет эндоплазматического ретикулума еще не описанными флиппазами, где они будут использоваться во время синтеза Glc 3 Man 9 — GlcNAc 2 сердцевинный олигосахарид. Синтез липидно-связанного олигосахарида Glc 3 Man 9 -GlcNAc 2 -PP-долихол начинается с переноса N-ацетилглюкозамин-фосфатной (GlcNAc-P) группы в долихолфосфат (Dol-P) из UDP-GlcNAc с помощью UDP-N-ацетилглюкозамин, долихил-фосфат N-ацетилглюкозаминфосфотрансферазы (Alg7) с образованием долихилпирофосфат-GlcNAc (Dol-PP-GlcNAc), химической реакции, ингибируемой туникамицином.Второй остаток N-ацетилглюкозамина добавляется белковым комплексом Alg7, Alg13 и Alg14 из UDP-GlcNAc с образованием Dol-PP-GlcNAc 2 . Затем первый остаток маннозы добавляется к Dol-PP-GlcNAc 2 с помощью хитобиозилдифосфодолихол β- (1,4) -маннозилтрансферазы (Alg1) с использованием GDP-Man с последующим последовательным добавлением двух остатков маннозы α-1 , 3 / 1,6-маннозилтрансфераза (Alg2p) для образования Dol-PP-GlcNAc 2 Man 3 , первая манноза, связанная через химическую связь α-1,3, а вторая через α-1,6 связь.Эти два фермента также собраны в белковый комплекс. Затем два остатка маннозы связываются с α-1,3-маннозой Dol-PP-GlcNAc 2 Man 3 посредством GDP-Man: Man 3 GlcNAc 2 -PP-Dol α-1 , 2-маннозилтрансфераза (Alg11) для сборки в Dol-PP-GlcNAc 2 Man 5 . Последующие реакции происходят в просвете эндоплазматического ретикулума после транслокации Dol-PP-GlcNAc 2 Man 5 белком транслокации олигосахаридов (Rft1).Первый остаток маннозы, добавленный в просвет, связан посредством α-1,3-химической связи с α-1,6-маннозой Dol-PP-GlcNAc 2 Man 5 посредством Dol-P-Man: Man 5 GlcNAc 2 -PP-Dol α-1,3-маннозилтрансфераза (Alg3). Затем остаток маннозы α-1,2 связан с α-1,3-маннозой Dol-PP-GlcNAc 2 Man 6 с образованием Dol-PP-GlcNAc 2 Man 7 посредством Dol-P-Man: Man 5 GlcNAc 2 -PP-Dol α-1,3-маннозилтрансфераза (Alg9).Следующий остаток маннозы связан с α-1,6-маннозой Dol-PP-GlcNAc 2 Man 7 посредством Dol-P-Man: Man 7 GlcNAc 2 -PP-Dol α- 1,6-маннозилтрансфераза (Alg12), которая показывает 37% идентичности и 56% сходства с S. cerevisiae Alg12. Последняя манноза связана с α-1,6-маннозой Dol-PP-GlcNAc 2 Man 8 через Dol-P-Man: Man 8 GlcNAc 2 -PP-Dol α-1 , 2-маннозилтрансфераза (Alg9p) для получения Dol-PP-GlcNAc 2 Man 9 .Заключительными этапами синтеза основного олигосахарида являются последовательные добавления трех остатков глюкозы с помощью Dol-P-Glc: Man 9 GlcNAc 2 -PP-Dol α-1,3-глюкозилтрансфераза (Alg6), Dol -P-Glc: Glc 1 Man 9 GlcNAc 2 -PP-Dol α-1,3-глюкозилтрансфераза (Alg8p) и Dol-P-Glc: Glc 2 Man 9 GlcNAc 2 -PP-Dol α-1,2-глюкозилтрансфераза (Alg10) [46].
Основной олигосахарид, присоединенный к белкам, дополнительно модифицируется тремя α-гликозидазами Cwh51, Rot2 и Mns1 в эндоплазматическом ретикулуме перед транспортировкой белков в аппарат Гольджи.Маннозил-олигосахарид глюкозидаза Cwh51 расщепляет внешний остаток глюкозы, связанный через химическую связь α-1,2. Rot2 (субъединица 2 глюкан-α-1,3-глюкозидазы) удаляет два остатка глюкозы, связанные через α-1,3-связи. Наконец, Mns1 или маннозил-олигосахарид α-1,2-маннозидаза удаляет остаток маннозы, связанный через α-1,2 связь, делая конечный зрелый олигосахарид Dol-PP-GlcNAc 2 Man 8 , присоединенный к белкам, готовым для дальнейшей модификации аппарата Гольджи [46].
Синтез внешней цепи маннана в аппарате Гольджи инициируется специфичной для инициации α-1,6-маннозилтрансферазой или Och2, которая добавляет остаток маннозы через химическую связь α-1,6 к внутреннему α-1 , 3-манноза GlcNAc 2 Man 8 сердцевина, связанная с остатком аспарагина в белках. Удлинение внешней цепи сначала осуществляется комплексом маннан-полимеразы I (M Pol I), который добавляет до 10 остатков маннозы через α-1,6-связи. M Pol I имеет несколько субъединиц, включая субъединицу Van1 комплекса маннан-полимеразы I и субъединицу Mnn9 комплекса маннан-полимеразы.Добавление дополнительных остатков маннозы (до 50 в дрожжах) осуществляется за счет α-1,6-маннозилтрансферазной активности комплекса маннан-полимеразы II (M Pol II), который содержит Mnn9, Anp1, Mnn10, Mnn11 и Hoc1 [ 48, 49].
После воздействия этих ферментов полимер маннозы α-1,6, составляющий основу внешней цепи маннана, готов к образованию разветвлений, в основном состоящих из остатков маннозы, связанных химическими связями α-1,2, как α-1,2 / α-1,3-маннозные единицы, так и α-1,2 / β-1,2-остатки маннозы.Добавление первой α-1,2-маннозы осуществляется α-1,2-маннозилтрансферазой Mnn2, а последующие остатки α-1,2-маннозы осуществляются Mnn5 в дрожжах. C. albicans имеет ортолог белка Mnn2, который проявляет активность α-1,2-маннозилтрансферазы и добавляет четвертый и пятый остатки маннозы во время O -гликозилирования [50]; однако роль маннозилирования во время гликозилирования N была приписана Mnt4 и Mnt5 / Ktr2 [50, 51]. Добавление единиц α-1,3 маннозы осуществляется Mnn1 в дрожжах, но соответствующая ферментативная активность еще не была идентифицирована у C.Альбиканс . Добавление остатков β-1,2 маннозы осуществляется Bmt1 и Bmt3 в C. albicans . Другой модификацией олигосахаридных ответвлений является фосфоманнозилирование, которое происходит в α-1,2-маннозе и катализируется Mnn6 в дрожжах, тогда как в C. albicans осуществляется Mnt3 и Mnt5 / Ktr2. Этот фосфоманнан также может быть дополнительно модифицирован добавлением звеньев β-1,2 маннозы за счет каталитической активности Bmt2, Bmt3 и Btm4 [50, 51].
Первым этапом процесса гликозилирования O , также известного как O -маннозилирование, является присоединение единицы маннозы α-1,2 к остаткам серина или треонина на белках в эндоплазматическом ретикулуме с помощью Pmt1, Pmt2. , Ферменты Pmt4, Pmt5 и Pmt6 с использованием в качестве субстрата Dol-P-Man.Удлинение олигосахарида O (до шести единиц маннозы в длину) проводят в аппарате Гольджи. Вторая и третья единицы α-1,2 маннозы добавляются ферментами Mnt1 / Kre2 и Mnt2. Этот олигосахарид O -Man 3 также может быть модифицирован путем добавления остатков β-1,2 маннозы белками Bmt1 и Bmt3. Добавление дополнительных единиц α-1,2 маннозы осуществляется Mnt1 [50, 52].
6. Протеомика клеточной стенки Candida albicans
C.Albicans секвенирование генома выявило 6218 открытых рамок считывания (ORF). Однако на данный момент охарактеризовано только 1686 ORF (~ 27%), а функция 4380 предполагаемых OFR неизвестна [53]. Чтобы определить, какие гены экспрессируются в белках, необходимо определить протеом с помощью масс-спектрометрии, которая стала рабочей лошадкой в разработке протеомов. Клеточная стенка — это первая структура, которая контактирует с хозяином, и, следовательно, было проведено несколько исследований для идентификации белков, содержащихся в клеточной стенке, и тех, которые участвуют во взаимодействии с клетками человека-хозяина.Одна из первых работ по выяснению высокой сложности клеточной стенки C. albicans была проведена Pitarch et al. [54], которые проанализировали серию фракций из изолированных клеточных стенок бластоспор или гиф с помощью двумерного электрофореза в полиакриламидном геле (2D-PAGE) и времяпролетной масс-спектрометрии с лазерной десорбцией / ионизацией (MALDI-TOF- РС). Необычные и обычные белки были идентифицированы и сгруппированы по классическим CWP, тепловому шоку и шаперону, фолдингу, факторам элонгации, гликозилированию, ферментам ферментации и прочему с неизвестными функциями.Белки с высокой степенью гликозилирования идентифицировать не удалось; тем не менее идентификация была возможна при использовании PNGase F. Сходным образом, чтобы минимизировать возможное загрязнение белками из различных клеточных компартментов, биотинилирование было использовано для очистки CWPs от дрожжей и гиф перед фракционированием клеток [55]. Белки очищали аффинной хроматографией, осаждали, разделяли с помощью SDS-PAGE и далее идентифицировали с помощью (MALDI-TOF-MS). Интересно, что некоторые внутриклеточные белки локализовались в клеточной стенке во время образования бластоспор.Например, тиол-специфический антиоксидантоподобный белок 1 (Tsa1) был обнаружен в ядре бластоспор, тогда как во время образования гиф он локализовался на поверхности клетки.
De Groot et al. [56] провели серию экстракций с использованием изолированных клеточных стенок, и белки в каждой фракции подвергали анионообменной хроматографии. Затем белки во фракциях разделяли с помощью SDS-PAGE и пептиды после расщепления протеиназой идентифицировали с помощью системы Quadrupole-TOF (Q-TOF) MS.Ковалентно связанные CWP были идентифицированы и классифицированы по нескольким классам белков, включая углеводно-активные ферменты, адгезию, защиту хозяина и белки с неизвестной функцией. В общей сложности 12 белков были идентифицированы как GPI-связанные белки, а два были классифицированы как чувствительные к слабощелочной экстракции. Аналогичным образом, пептиды из белков, полученных в результате нескольких химических экстракций клеточных стенок из бластоспор и мицелия, разделенных через колонку с обращенной фазой C18 и идентифицированных с помощью ESI-квадрупольной системы MS, позволили увеличить количество идентифицированных белков, как ковалентно, так и нековалентно связанных. к клеточной стенке.В первом случае большинство белков было идентифицировано как GPI-заякоренные белки. В последнем они были разделены на две группы, одна из которых получила название bona fide поверхностных белков, таких как белки агглютинин-подобной последовательности (Als), глюканазы, хитиназы, среди прочего, и группа, названная атипичными белками клеточной стенки, участвующими в клеточном цикле. , метаболизм и энергия, синтез белка, стрессовая реакция, удлинение трансляции, транспорт и другие, а также функции с неизвестными функциями, о которых никогда не сообщалось как о части клеточной стенки.Кроме того, MS-анализ экстрактов SDS, полученных из клеточных стенок, позволил идентифицировать большинство этих атипичных белков клеточной стенки и некоторые другие, предполагая, что возможно идентифицировать белки непосредственно из экстрактов клеточной стенки [57]. Белки клеточной поверхности, которые не были связаны с глюкановой сетью, были идентифицированы из биопленок, бластоспор и гиф C. albicans с использованием разницы в 2D-флуоресценции в гель-электрофорезе (2D-DIGE) и MALDI-TOF / TOF-MS, обнаружив 108 дифференциально экспрессируемых белки.Всего в биопленке было обнаружено 25 белков, которые были классифицированы по различным классам, включая метаболические процессы, судьбу и синтез белков, защитную защиту клеточной поверхности и вирулентность, биогенез клеточных компонентов, метаболизм белков и не охарактеризованные [58].

 Потеря работоспособности.
Потеря работоспособности. Это связано с деятельностью печени, которая лишний для организма белок преобразовывает в жировую ткань.
Это связано с деятельностью печени, которая лишний для организма белок преобразовывает в жировую ткань. Например, половину тарелки творога
или другой кисломолочный продукт, куриную грудку или индюшку с рисом,
рыбу с салатом, омлет с овсянкой.
Например, половину тарелки творога
или другой кисломолочный продукт, куриную грудку или индюшку с рисом,
рыбу с салатом, омлет с овсянкой.
 Учитывайте это при составлении рациона.
Учитывайте это при составлении рациона.
