Основные функции белков в организме, их свойства и роль
Поможем понять и полюбить химию
Начать учиться
Генетическая информация о структуре и функциях всех белков в организме передается нам от родителей с помощью специальных белков. К тому же эти вещества определяют структуру и форму клетки, обеспечивают узнавание и связывание различных молекул, а также катализ и регуляцию химических реакций, протекающих в наших телах. И это все еще неполный список функций белков в организме человека!
Что такое белки
Белки — это высокомолекулярные органические соединения, которые состоят из аминокислотных остатков, соединенных между собой пептидной связью.
Этот класс органических веществ можно рассматривать с точки зрения двух наук: биологии и химии. Начнем с биологической роли белков.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Запишитесь и участвуйте в розыгрыше 8 уроков
Биологические функции белков
Строительная, или пластическая
Белки являются основой структурного материала всех клеточных мембран, так как образуют основу протоплазмы любой живой клетки. Наверняка вам известны такие белки, как коллаген, кератин и эластин. Именно они составляют основу соединительной ткани организма и обеспечивают ее прочность.
Транспортная
Эта функция заключается в присоединении химических элементов или биологически активных веществ, то есть гормонов, и в перемещении их к различным тканям и органам тела. Например, гемоглобин является переносчиком кислорода в крови, а также принимает участие в транспорте углекислого газа. Перенос насыщенных жирных кислот в крови по организму происходит при участии альбумина. Трансферрин переносит ионы железа, а особые белки участвуют в переносе ионов натрия и калия через мембрану клетки.
Регуляторная
Белки играют роль в регуляции и согласовании обмена веществ в различных клетках организма. Например, инсулин регулирует уровень глюкозы в крови, а также увеличивает образование жиров из углеводов.
Например, инсулин регулирует уровень глюкозы в крови, а также увеличивает образование жиров из углеводов.
Защитная
При попадании в организм чужеродного белка или микроорганизма образуются особые белки — антитела. Защитой организма от чрезмерной кровопотери является превращение белка фибриногена. Конечно, в этом процессе участвуют и другие белки, например тромбин, а также множество других факторов свертывания. Защиту нашего желудка от воздействия сильнокислой среды обеспечивает белок муцин, основу кожи составляет коллаген, а кератин является белком защитного волосяного покрова.
Двигательная
Двигательную функцию обеспечивают специальные сократительные белки, например актин и миозин, которые участвуют в сокращении скелетных мышц.
Сигнальная
В поверхность мембраны клетки встроены рецепторы (молекулы белков), которые в ответ на воздействие внешней среды способны изменять свою структуру, передавая команды в клетку.
Запасающая
Белки способны образовывать запасные отложения — правда, в организме животных белки, как правило, не запасаются. Но на каждое правило всегда найдется исключение — это альбумин, который содержится в яйцах, и казеин молока. Благодаря белкам в организме могут откладываться, например, ионы железа, которые впоследствии образуют комплекс с белком ферритином.
Энергетическая
Белки могут распадаться в клетке до составляющих, то есть до аминокислот. Часть этих аминокислот подвергается расщеплению, в ходе которого высвобождается энергия. При расщеплении 1 грамма белка выделяется 17,6 кДж, или 4,2 ккал, энергии. Но в этой роли белки используются крайне редко.
Каталитическая
Белки, которые называются ферментами, способны ускорять биохимические реакции, происходящие в клетке, — в этом заключается каталитическая функция белков.
Питательная, или резервная
Эту функцию выполняют резервные белки, которые являются источником питания для плода. Такими белками могут быть казеин — белок молока, овальбумины — белки яйца, проламины и глютелины — белки растений.
Такими белками могут быть казеин — белок молока, овальбумины — белки яйца, проламины и глютелины — белки растений.
Функция антифриза
Антифризные белки способны понижать температуру замерзания раствора в клетках, чтобы предупредить замерзание в условиях низких температур.
Белки как класс органических соединений
А теперь рассмотрим белки с точки зрения химии. В состав белков живых организмов входит только 20 типов аминокислот. Все они являются альфа-аминокислотами, а состав белка и порядок соединения аминокислот друг с другом определяется индивидуальным генетическим кодом.
Перед нами пример альфа-аминокислоты, которая называется альфа-аминопропановой. В строении аминокислоты можно выделить две функциональные группы: карбоксильную (—СООН), которая отвечает за кислотные свойства, и аминогруппу (—NH2), которая, в свою очередь, отвечает за основные свойства.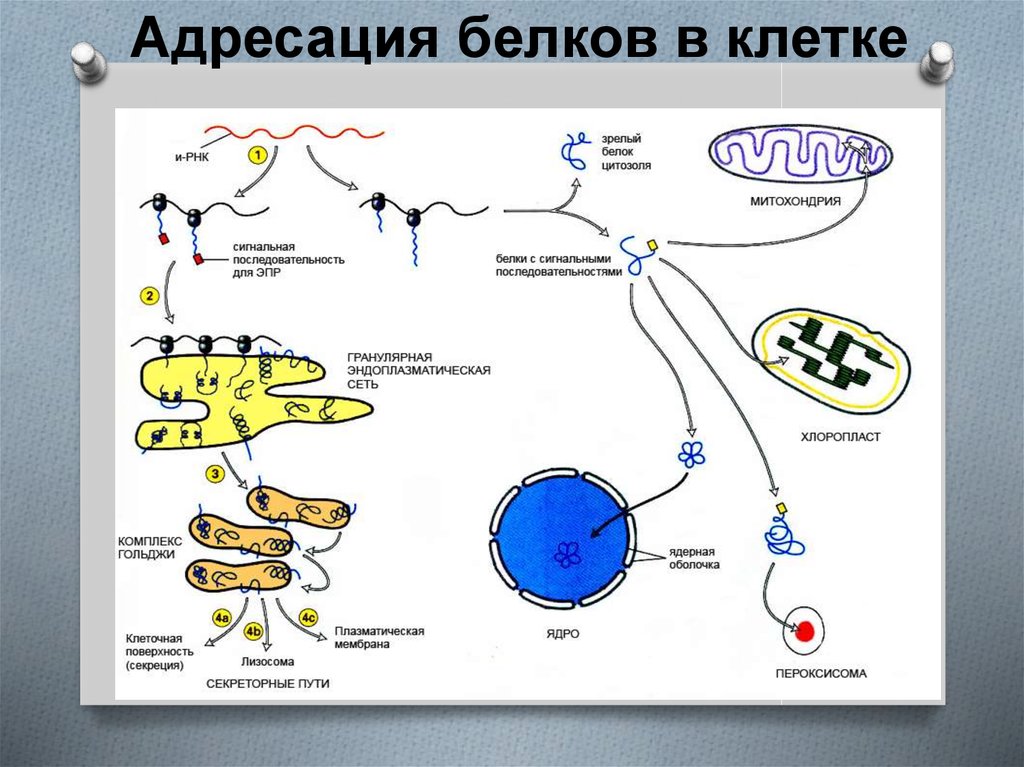
Отсюда можно сделать вывод, что все аминокислоты являются амфотерными соединениями и способны реагировать друг с другом по разным функциональным группам с образованием пептидной связи:
Химические свойства белков очень ограниченны. Давайте их рассмотрим.
Гидролиз
Все белки способны вступать в реакцию гидролиза. В общем виде данная реакция выглядит следующим образом:
Белок + nH2O = смесь из α-аминокислот.
Денатурация
Денатурация — это разрушение вторичной, третичной и четвертичной структур белка без разрушения его первичной структуры.
Напомним виды структур белка:
The image is a derivative of «Protein structure vector illustration» by VectorMine on Shutterstock.
Денатурация может быть обратимой, а может быть необратимой:
обратимая денатурация:
необратимая денатурация:
Как видно из условий, обратимость зависит от условий протекания реакций. Чем они жестче, тем меньше вероятность обратимости реакции.
Чем они жестче, тем меньше вероятность обратимости реакции.
Биуретовая реакция (качественная реакция на белок)
Раствор белка + NaOH(10%-й р-р) + CuSO4 = фиолетовое окрашивание.
Ксантопротеиновая реакция (качественная реакция на белок)
Растворы белка при кипячении с концентрированной азотной кислотой окрашиваются в желтый цвет:
Раствор белка + HNO3 (конц) = желтое окрашивание.
Реакция Фоля (цистеиновая проба)
Эта реакция является качественной для аминокислот, содержащих серу:
Белок + (CH3COO)2Pb + NaOH = PbS + черное окрашивание.
Вопросы для самопроверки
Какая из структур белка является самой прочной?
Первичная
Вторичная
Третичная
Четвертичная
Какую из перечисленных функций способен выполнять белок?
Результативную
Регулятивную
Растворную
За счет какой связи образуется первичная структура белка?
Ионной
Водородной
Пептидной
Ковалентной неполярной
 ..
..Аминокислоты, образующие этот белок
Углекислый газ
Аминокислота и вода
Белок гидролизу не подвергается
Какая реакция с белком дает фиолетовое окрашивание?
Ксантопротеиновая
Цистеиновая
Биуретовая
Денатурация
Еще больше наглядных примеров функций белков в клетках живых организмов — на онлайн-курсах химии в Skysmart. Мы поможем полюбить предмет, разобраться в непонятных темах, улучшить оценки в школе и подготовиться к государственным экзаменам. Выберите подходящий курс и начните учиться с удовольствием!
Мы поможем полюбить предмет, разобраться в непонятных темах, улучшить оценки в школе и подготовиться к государственным экзаменам. Выберите подходящий курс и начните учиться с удовольствием!
Ответы на вопросы
a
b
c
a
c
Ксения Боброва
К предыдущей статье
Алканы
К следующей статье
Реакции обмена и химические уравнения для них
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Белки — химический состав, структура, общая формула
Поможем понять и полюбить химию
Начать учиться
Белки — основной строительный материал клеток, они составляют 15–20% общей массы человека. Так что разобраться в значении белков для организма человека важно не только ради экзамена по химии, но и для того, чтобы лучше понимать, как мы устроены, правильно питаться и быть здоровым.
Так что разобраться в значении белков для организма человека важно не только ради экзамена по химии, но и для того, чтобы лучше понимать, как мы устроены, правильно питаться и быть здоровым.
Что такое белок. Химический состав и образование белков
Белки — это высокомолекулярные органические соединения, которые состоят из аминокислотных остатков, соединенных между собой пептидной связью. Важно уточнить, что в состав белков входит только 20 альфа-аминокислот, тогда как всего ученым известно около 500 аминокислот. Общая формула белков выглядит следующим образом:
Греческая приставка «альфа-» в названиях альфа-аминокислот взялась из систематической номенклатуры. По ее правилам, следующий после карбоксильной группы углерод получает название первой буквы греческого алфавита — альфа, затем идет буква бета и так далее. В названии аминокислоты указывается греческая буква того углерода, у которого есть заместитель, в данном случае — аминогруппа.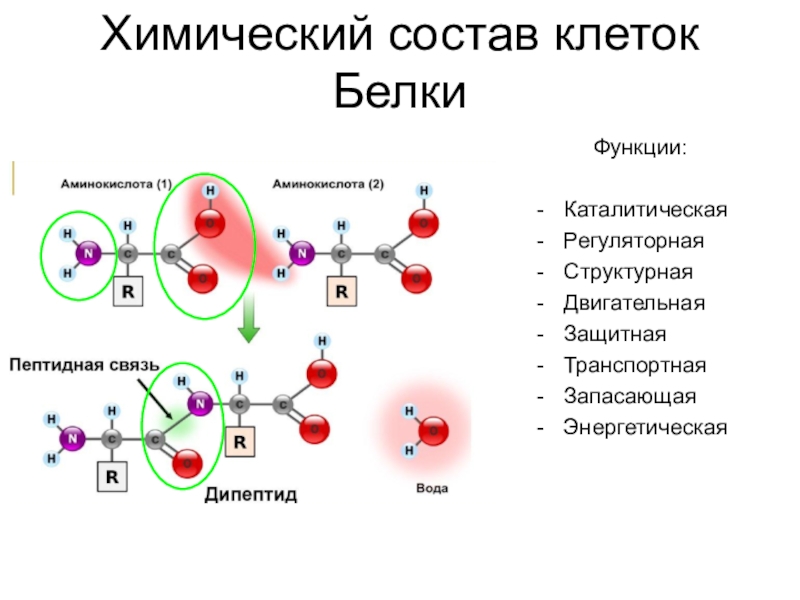
Рассмотрим пример образования молекулы белка. Для этого познакомимся сначала с представителем альфа-аминокислот — альфа-аминопропановой кислотой.
Рассматривая строение молекулы, можно увидеть две конкурирующие по свойствам группы: карбоксильную, которая отвечает за кислотные свойства, и аминогруппу, которая отвечает за оснóвные свойства. Две молекулы аминокислот и более могут вступать в реакцию между собой, реагируя по разным функциональным группам. Именно таким образом получается пептид:
Соединение, которое образуется в результате взаимодействия двух аминокислот, называется дипептидом. Благодаря наличию двух свободных функциональных групп (карбоксильной и аминогруппы) дипептид может взаимодействовать с другими аминокислотами, увеличивая свое строение и превращаясь в полипептид.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Запишитесь и участвуйте в розыгрыше 8 уроков
Аминокислоты и их значение для человеческого организма
Говоря об аминокислотах, важно рассмотреть понятие незаменимости. Основной критерий определения биологической ценности аминокислоты — это способность поддерживать рост человека, что, в свою очередь, связано с синтезом белка в живом организме.
Незаменимые аминокислоты — это такие кислоты, которые либо не синтезируются в организме, либо синтезируются со скоростью, недостаточной для обмена веществ и образования новых клеток и тканей.
Если исключить из рациона хотя бы одну из незаменимых аминокислот, это повлечет за собой задержку роста и снижение массы тела растущего организма.
К незаменимым аминокислотам относятся валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин.
 К ним относятся:
К ним относятся:| аланин | глицин | серин |
| аргинин | глютамин | таурин |
| аспарагин | инозитол | тирозин |
| аспартат | цистеин | |
| гистидин | пролин | цитруллин |
Давайте рассмотрим основные функции некоторых аминокислот в организме человека, чтобы лучше понять их значение:
аспартат используется для процессов регенерации;
гистидин необходим маленьким детям, у которых недостаточен эндогенный синтез;
глютамин нужен для регенерационных процессов, важный энергетический субстрат в критических состояниях;
таурин нужен новорожденным, у которых недостаточен эндогенный синтез, а также больным в критических состояниях.
 Дефицит таурина возникает при недостатке метионина и цистеина;
Дефицит таурина возникает при недостатке метионина и цистеина;тирозин необходим маленьким детям, у которых недостаточен эндогенный синтез. При нарушении функции почек снижено образование тирозина из фенилаланина;
цистеин необходим маленьким детям, у которых недостаточен эндогенный синтез. Дефицит цистеина возникает при недостаточном содержании метионина в питании. Необходим при нарушениях функции печени, а также больным в критических состояниях.
Пептиды
Вернемся к продукту синтеза двух аминокислот — пептиду — и дадим ему определение.
Пептид — это продукт конденсации двух аминокислот или более, соединенных пептидной связью.
Пептид и белок — это одно и то же? Между ними действительно есть сходство, но есть и различия:
- Основные различия — это структура и размер.
 Белки значительно больше пептидов. Пептиды состоят из 2–50 аминокислот, а белки — из более чем 50 аминокислот.
Белки значительно больше пептидов. Пептиды состоят из 2–50 аминокислот, а белки — из более чем 50 аминокислот. Пептиды менее строго определены в структуре, в то время как белки могут принимать сложные конформации.
Пептиды делятся на олигопептиды и полипептиды, а белок состоит из нескольких полипептидов.
Какие бывают белки
По строению
По строению белки делятся на простые (протеины) и сложные (протеиды):
составными частями простых белков являются в большинстве 20 различных остатков α–аминокислот;
сложные белки могут содержать ионы металлов или образовывать комплексные соединения с углеводами, липидами и др.
По форме молекулы
По форме молекулы белки подразделяются на глобулярные и фибриллярные:
форма молекулы глобулярных белков — глобула (сфера или эллипс).
 Например, альбумин (яичный белок), казеин (молочный белок). Такие белки растворимы в воде;
Например, альбумин (яичный белок), казеин (молочный белок). Такие белки растворимы в воде;форма молекулы фибриллярных белков — фибрилла (нити или волокна). Например, кератин (волосы, ногти, перья), коллаген (мускулы, сухожилия). Эти белки в воде не растворяются.
По аминокислотному составу
Как мы уже знаем, существуют незаменимые аминокислоты. Так вот, исходя из их наличия, белки бывают либо полноценные, либо неполноценные:
к полноценным относятся белки животного происхождения, также полноценные белки содержат некоторые растения: картофель, бобовые и другие;
к неполноценным относятся желатин и белки преимущественно растительного происхождения.
По растворимости
Растворимость белков зависит от их структуры, величины рН, солевого состава раствора, температуры и определяется природой тех групп, которые находятся на поверхности белковой молекулы.
Так, существуют белки (глобулины), которые растворяются только в растворах солей и не растворяются в чистой воде, а противоположные им альбумины хорошо растворимы в чистой воде.
К нерастворимым белкам относятся кератин (волосы, ногти, перья), коллаген (сухожилия), фиброин (шелк, паутина).
Чтобы запомнить классификацию белков было проще, показали ее на картинке:
Структура белков
После того как мы рассмотрели все производные белков, пора переходить к структуре белков.
Как видно из рисунка, белки имеют 4 структуры: первичную, вторичную, третичную и четвертичную. Рассмотрим каждую чуть более подробно.
Первичная структура белка — это простейший вид белковой структуры. Представляет собой последовательность аминокислот в полипептидной цепи. Последовательность аминокислот в белке определяется ДНК, а именно геном, кодирующим этот белок.
 Изменение всего лишь одной аминокислоты влечет за собой последствия: например, если вместо глутаминовой кислоты в молекуле гемоглобина находится валин, то у человека образуется серповидноклеточная анемия. При замене глутаминовой кислоты на валин клетки гемоглобина вытягиваются и принимают форму месяца или серпа.
Изменение всего лишь одной аминокислоты влечет за собой последствия: например, если вместо глутаминовой кислоты в молекуле гемоглобина находится валин, то у человека образуется серповидноклеточная анемия. При замене глутаминовой кислоты на валин клетки гемоглобина вытягиваются и принимают форму месяца или серпа.Вторичная структура — пространственная структура, которая образуется в результате взаимодействия функциональных групп пептидного остова (полипептидная цепь без атомов R-групп). Самые распространенные формы вторичной структуры — это α-спираль и β-лист. Обе структуры удерживают форму благодаря водородным связям между кислородом карбонильной группы одной аминокислоты и водородом аминогруппы другой аминокислоты.
Третичная структура — это пространственное строение всей молекулы белка, состоящей из единственной цепи.
 Эта структура обусловлена взаимодействиями между R-группами аминокислот, которые входят в состав белка. Среди взаимодействий между R-группами, формирующими третичную структуру, встречаются водородные, ионные и диполь-дипольные связи, а также дисперсионные силы.
Эта структура обусловлена взаимодействиями между R-группами аминокислот, которые входят в состав белка. Среди взаимодействий между R-группами, формирующими третичную структуру, встречаются водородные, ионные и диполь-дипольные связи, а также дисперсионные силы.Четвертичная структура — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.
Подробнее об основных функциях белков и их химических свойствах можно узнать из другой нашей статьи. А чтобы убедиться, что вы запомнили характеристику белков, их строение, структуру и функции, приходите на онлайн-курсы химии в школу Skysmart. Здесь вас ждут интересные факты из мира химии, интерактивные задания и опытные преподаватели, которые всегда помогут и поддержат.
Ксения Боброва
К предыдущей статье
Тепловой эффект
К следующей статье
Моносахариды
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Что такое белки клетки-хозяина?
Рекомбинантные белки, особенно моноклональные антитела открывают новые методы лечения ранее трудноизлечимых заболеваний. Поэтому их значение на фармацевтическом рынке быстро растет. Хозяева экспрессии, используемые для получения рекомбинантных белков для терапии, включают клетки насекомых, дрожжи и бактерии. Чтобы имитировать условия экспрессии человеческого белка, фокус смещается с классических хозяев, таких как .E. coli к клеткам млекопитающих, особенно к клеточным линиям яичника китайского хомячка (CHO) . 1 Основными преимуществами являются аналогичная или идентичная посттрансляционная обработка (например, паттернов гликозилирования ) и смещение кодонов по сравнению с человеческими. 2
Поэтому их значение на фармацевтическом рынке быстро растет. Хозяева экспрессии, используемые для получения рекомбинантных белков для терапии, включают клетки насекомых, дрожжи и бактерии. Чтобы имитировать условия экспрессии человеческого белка, фокус смещается с классических хозяев, таких как .E. coli к клеткам млекопитающих, особенно к клеточным линиям яичника китайского хомячка (CHO) . 1 Основными преимуществами являются аналогичная или идентичная посттрансляционная обработка (например, паттернов гликозилирования ) и смещение кодонов по сравнению с человеческими. 2
Узнайте больше о клеточных линиях CHO.
Что такое HCP
Белки клетки-хозяина (HCP) представляют собой белки, продуцируемые или кодируемые организмами-хозяевами используется для получения рекомбинантных терапевтических белков. Рекомбинантные терапевтические белки обычно продуцируют генетически модифицированные прокариотические или эукариотические клетки-хозяева с использованием технологии культивирования/ферментации клеток. 3,4
3,4
Биофармацевтические препараты должны быть свободны от технологических примесей для соответствия клиническому применению . 5 Клеточный протеом представляет собой набор белков, обнаруживаемых в клетках определенного типа при определенных условиях окружающей среды. Что касается производства белка все белки, присутствующие в системе экспрессии или субстрате , помимо интересующего белка , рассматриваются как примеси, обычно обозначаемые термином белки клетки-хозяина (HCP ) . 6
Удаление HCP является одной из самых больших проблем для производства биофармацевтических препаратов. Из-за присущей биологическим системам изменчивости количество и состав остаточных HCP уникальны к их соответствующему хозяину и производственному процессу, используемому для производства биологических препаратов.
Выбор хозяина оказывает наибольшее влияние на количество нежелательных белков. Например, E. coli имеет ~ 4300 генов , тогда как клетки CHO имеют ~ 30000 генов . 3 Хотя не каждый ген-хозяин будет транскрибирован и транслирован в белок, сложность генома-хозяина и посттрансляционная модификация, присутствующая в клетках млекопитающих, делают его почти невозможно понять полный состав HCP в данном производственном процессе.
HCP в готовом лекарственном средстве
HCP, как преобладающий класс связанных с технологическим процессом примесей, нежелательны в очищенном белковом продукте, поскольку предполагается, что они влияют на безопасность пациента . БКХ могут быть биологически активными в организме человека или, в случае БКХ с протеазной активностью, влиять на стабильность продукта путем деградации либо самого терапевтического белка, либо добавок, стабилизирующих продукт. В крайних случаях остаточные HCP могут спровоцировать неблагоприятные события, такие как иммунный ответ или образование антилекарственных антител . 6 Следовательно, нормативные требования требуют установки спецификаций HCP.
В крайних случаях остаточные HCP могут спровоцировать неблагоприятные события, такие как иммунный ответ или образование антилекарственных антител . 6 Следовательно, нормативные требования требуют установки спецификаций HCP.
Обнаружение и количественная оценка белка клетки-хозяина
Разработка методов обнаружения HCP является важным шагом для проверки наличия остаточного загрязнения во время биотехнологии и конечного биофармацевтического продукта. Несколько подходов были установлены с течением времени, в основном различающиеся по чувствительность и общее покрытие . Промышленность внимательно следит за развитием и комбинирует различные методы для оценки всех потенциальных HCP, которые загрязняют конечный продукт в процессе производства.
Для обнаружения таких малых суммарных количеств БКХ на фоне огромного избытка белкового продукта требуется высокочувствительный и специфичный аналитический метод с широким динамическим диапазоном. Иммуноферментные анализы (ELISA) просты в использовании в рутинных анализах и могут количественно определять низкие уровни HCP. 7 Требуется предварительная разработка индивидуальных реагентов поликлональных антител с максимальным охватом и чувствительностью к нативным экстрактам БКХ.
Иммуноферментные анализы (ELISA) просты в использовании в рутинных анализах и могут количественно определять низкие уровни HCP. 7 Требуется предварительная разработка индивидуальных реагентов поликлональных антител с максимальным охватом и чувствительностью к нативным экстрактам БКХ.
Специфические антитела к HCP
Поликлональные антитела против нативных экстрактов HCP являются наиболее часто используемым инструментом для обнаружения и оценки HCP, поскольку они могут использоваться для идентификации, обнаружения, и количественного определения . Разработка, оценка и валидация анти-HCP-антител являются важным шагом в эффективном мониторинге остаточного белка клетки-хозяина. В случае иммуноанализа поликлональное антитело, используемое в тесте, генерируется иммунизация препаратом клетки-продуцента за вычетом гена , кодирующего продукт , партнеров по слиянию или других подходящих клеточных линий 7 . Важно точно имитировать рабочий процесс более позднего производственного процесса; как упоминалось выше, производственный процесс влияет на состав HCP.
Важно точно имитировать рабочий процесс более позднего производственного процесса; как упоминалось выше, производственный процесс влияет на состав HCP.
Антитела для обнаружения HCP
В ходе продолжающихся исследований ученые обнаружили, что белки в зависимости от их свойств различаются способностью к разделению. Белки, которые трудно разделить, обобщаются под термином «белки-«плохие актеры». Существуют различные причины для включения белка, например ферментативная активность, большое количество мембранных частей или вездесущность самого белка. Оптимизация сред и процессов помогает уменьшить или даже устранить зарождающиеся критические HCP и повысить эффективность разделения. 9
Анализы с несколькими аналитами примеси обычно используются для количественного определения и следить за медицинскими работниками. Они сочетают чувствительность с высокой пропускной способностью — необходимое требование для промышленного масштабирования.
Тем не менее, универсальные наборы для ИФА HCP не обеспечивают полного охвата всех HCP, специфичных для процессов, и специфичный для процесса ELISA может быть непригодным для оценки содержимого HCP после изменения процесса. 8,9 ИФА HCP , а не , как ожидается, обеспечит 100% покрытие , однако в настоящее время они по-прежнему незаменимы для высокой пропускной способности процесса мониторинга согласованности и они обеспечивают подходящие средства для рутинного контроля качества лаборатория.
8,9 ИФА HCP , а не , как ожидается, обеспечит 100% покрытие , однако в настоящее время они по-прежнему незаменимы для высокой пропускной способности процесса мониторинга согласованности и они обеспечивают подходящие средства для рутинного контроля качества лаборатория.
Дополнительная информация о наборах HCP ELISA
Ортогональные методы обнаружения HCP
Неспецифические методы, ортогональные методы, такие как 2D-DIGE и 2D-HPLC в сочетании с MS , являются более сложными; тем не менее, они обеспечивают целостное представление профиля HCP и качественную информацию о составе HCP в образце. Несмотря на более высокие затраты и временные затраты, ортогональные методы незаменимы, поскольку они обеспечивают чистоту продукта на этапе клинической разработки . 9
Ортогональные подходы для обнаружения HCP
Ссылки
- Флориан М.
 Вурм ( 2004 ). «Производство рекомбинантных белковых терапевтических средств в культивируемых клетках млекопитающих. в Природа Биотехнология . 22 : 1393–1398. ПабМед
Вурм ( 2004 ). «Производство рекомбинантных белковых терапевтических средств в культивируемых клетках млекопитающих. в Природа Биотехнология . 22 : 1393–1398. ПабМед - Саймон Фишер, Рене Хэндрик, Керстин Отте ( 2015 ). Искусство инженерии клеток CHO: всесторонний ретроспективный взгляд и перспективы на будущее в достижениях биотехнологии, том 33 , выпуск 8, декабрь 2015 г., страницы 1878–1896
- Ф. Ван, Д. Ричардсон и М. Шамим, ( 2015 ) « Измерение и контроль белков-хозяев» BioPharm International, 28 (6). ПабМед
- М. Джин и др., ( 2010 ) . «Профилирование белков клетки-хозяина с помощью двумерного разностного гель-электрофореза (2D-DIGE): значение для дальнейшего развития процесса». в Биотехнолог. Биоэнг . 105 (2), стр. 306-16,
- FDA, ( 2018 ). «Установление критериев приемлемости примесей в рамках спецификаций для NDA,
ANDA и BLA на основе клинической значимости» в РУКОВОДСТВО ПО ПОЛИТИКАМ И ПРОЦЕДУРАМ, Ссылка - Стефани Вольраб ( 2018 г.
 ) « Отслеживание белков клеток-хозяев во время биофармацевтического производства: передовые методологии для обеспечения высокого качества продукции » в APR
) « Отслеживание белков клеток-хозяев во время биофармацевтического производства: передовые методологии для обеспечения высокого качества продукции » в APR - Martin Kornecki, ( 2017 ) «Белки клеток-хозяев в производстве биологических препаратов:
хорошие, плохие и уродливые» в Antibodies , 6 (3), 13, DOI - Кеш Пракаш, ( 2015 ). «Аналитические методы измерения белков клеток-хозяев и других примесей, связанных с процессом» в ACS Symposium Series , Chapter 9 , pp 387-404 DOI
- Д. Г. Брейсуэлл ( 2015 ). «Будущее идентификации белков клеток-хозяев (HCP) во время разработки процессов и производства связано с управлением рисками для их контроля». в Biotechnol Bioeng 112 (9):1727-37 PubMed
Proteins — Physiopedia
Исходный редактор — Люсинда Хэмптон
Ведущие участники — Люсинда Хэмптон и Ким Джексон
Содержание
- 1 Введение
- 2 Классификация
- 3 типа белков
- 4 Диета
- 5 Сопутствующие медицинские состояния
- 6 Каталожные номера
Изображение белка
Белки представляют собой биополимерные структуры, состоящие из аминокислот, 20 из которых широко распространены в биологической химии [1] и участвуют почти во всех клеточных процессах.:max_bytes(150000):strip_icc()/lipoproteins-and-pcsk9-bound-to-receptors-677090959-59df78c068e1a20010240da8.jpg)
- Белки синтезируются в цитоплазме в процессе, называемом трансляцией.
- Типичный белок состоит из одного набора аминокислот. Каждый белок специально оборудован для своей функции.
- Любой белок в организме человека может быть создан путем перестановки всего 20 аминокислот.
- Существует семь типов белков: антитела, сократительные белки, ферменты, гормональные белки, структурные белки, запасные белки и транспортные белки. [2]
Продукты, богатые белком
Белок является жизненно важной частью рациона человека.
Содержание белка, например. Мышцы содержат около 30 процентов белка, печень — от 20 до 30 процентов, а эритроциты — 30 процентов. Более высокий процент белка содержится в волосах, костях и других органах и тканях с низким содержанием воды [3] .
Хотя в природе существуют сотни аминокислот, человек использует только 20 из них. Один из способов их дальнейшей классификации — определение того, какие из них могут и не могут производиться здоровыми организмами.
Три класса белков: заменимые; условно существенный; Незаменимые аминокислоты
- Заменимые: существует пять аминокислот, которые называются заменимыми, поскольку они могут быть получены из продуктов питания, а также вырабатываться в организме. Заменимые аминокислоты: аланин; аспарагин; Аспарагиновая кислота; Глютаминовая кислота; серин
- Условно незаменимые аминокислоты: существует шесть аминокислот, называемых условно незаменимыми, поскольку здоровые организмы могут вырабатывать их в нормальных физиологических условиях. Они становятся необходимыми при определенных условиях, таких как голодание или врожденные нарушения метаболизма. Условно незаменимые аминокислоты: аргинин; цистеин; глютамин; Глицин; пролин; Тирозин
- Незаменимые аминокислоты: существует девять аминокислот, называемых незаменимыми, поскольку они не могут вырабатываться в организме. Таким образом, пищевой белок содержит эти аминокислоты, необходимые для производства определенных гормонов и других важных молекул.
 Незаменимыми аминокислотами являются: гистидин; изолейцин; лейцин; лизин; метионин; фенилаланин; треонин; триптофан; Валин [1] .
Незаменимыми аминокислотами являются: гистидин; изолейцин; лейцин; лизин; метионин; фенилаланин; треонин; триптофан; Валин [1] .
Всего существует семь различных типов белков, к которым относятся все белки. К ним относятся антитела, сократительные белки, ферменты, гормональные белки, структурные белки, запасные белки и транспортные белки.
Антитела: Антитела представляют собой специализированные белки, которые защищают организм от антигенов или чужеродных захватчиков. Их способность перемещаться по кровотоку позволяет иммунной системе использовать их для идентификации и защиты от бактерий, вирусов и других чужеродных вторжений в крови. Одним из способов, которым антитела противодействуют антигенам, является их иммобилизация, чтобы они могли быть уничтожены лейкоцитами.
Сократительные белки: Сократительные белки отвечают за сокращение и движение мышц (см. Молекулярные двигатели).
- Цитоплазма клеток представляет собой коллоидную сеть сократительных белков.
 Актиновые филаменты являются основными компонентами этой сети [4] . См. Мышечные клетки (миоциты)
Актиновые филаменты являются основными компонентами этой сети [4] . См. Мышечные клетки (миоциты) - Эукариоты, как правило, обладают обильным количеством актина, который контролирует сокращение мышц, а также клеточное движение и процессы деления. Миозин поддерживает задачи, выполняемые актином, снабжая его энергией.
Энергия активации фермента
Ферменты: Все идентифицированные ферменты являются белками.
- Ферменты, являющиеся катализаторами всех метаболических реакций, позволяют организму создавать необходимые для жизни химические вещества — белки, нуклеиновые кислоты, углеводы и липиды, превращать их в другие вещества и разлагать их.
- Жизнь без ферментов невозможна [3] .
Гормональные белки: Гормональные белки являются информационными белками, которые помогают координировать определенные функции организма, например:
- Факторы роста представляют собой высокоспецифичные белки, подразделение цитокинов.
 Факторы роста стимулируют деление и дифференцировку определенного типа клеток. При гипертрофии скелетных мышц факторы роста включают инсулиноподобный фактор роста (IGF). IGF секретируется скелетными мышцами. Он регулирует метаболизм инсулина и стимулирует синтез белка. [5] .
Факторы роста стимулируют деление и дифференцировку определенного типа клеток. При гипертрофии скелетных мышц факторы роста включают инсулиноподобный фактор роста (IGF). IGF секретируется скелетными мышцами. Он регулирует метаболизм инсулина и стимулирует синтез белка. [5] . - Тестостерон является андрогеном или мужским половым гормоном. Основная физиологическая роль андрогенов заключается в содействии росту и развитию мужских органов и характеристик. Тестостерон влияет на нервную систему, скелетные мышцы, костный мозг, кожу, волосы и половые органы.
- Кортизол представляет собой стероидный гормон (гормоны со стероидным ядром, способным проходить через клеточную мембрану без рецептора), который вырабатывается в коре надпочечников почек. Это гормон стресса.
Структурные белки: Большая группа структурных белков поддерживает и защищает структуру тела животного [3] .
- Наиболее распространенным примером структурного белка является коллаген, который содержится в костях, клетках и коже.

- Структурные белки также обнаружены в клетках. Они используются для обеспечения внутренней структуры клетки (цитоскелета) и иногда участвуют в движении клеток. Структурные белки особенно важны в крупных клетках.
Запасные белки: Запасные белки запасают аминокислоты для организма до тех пор, пока они не будут готовы к использованию. Примеры запасных белков включают
- Ферритин запасной белок, в котором хранится железо.
Мембранные белки
Транспортные белки: Транспортные белки — это белки-переносчики, которые перемещают молекулы из одного места в другое в организме.
- Дыхательный белок гемоглобин действует как переносчик кислорода в крови, транспортируя кислород от легких к органам и тканям тела [3] .
- Цитохромы, другой тип транспортных белков, действуют в цепи переноса электронов как белки-переносчики электронов. [2] См. Аденозинтрифосфат (АТФ)
Белок является жизненно важной частью рациона человека и присутствует в различных продуктах, например яйцах, мясе, молочных продуктах, морепродуктах, бобовых, орехах и семенах. Независимо от источника потребляемого белка, он расщепляется и превращается в новые белки в нашем организме.
Независимо от источника потребляемого белка, он расщепляется и превращается в новые белки в нашем организме.
Большинство животных белков называют полными белками, так как они содержат все девять незаменимых аминокислот, тогда как большинство растительных белков считаются неполными, поскольку в них отсутствует по крайней мере одна из незаменимых аминокислот 9.0013 [6] . Соевые продукты, лебеда и семена листовой зелени под названием амарант — это лишь некоторые из белков растительного происхождения, которые содержат все девять незаменимых аминокислот. [6]
Протеиновый порошок
Люди по большей части не способны запасать белок. Человеческое тело может разрушать свою мышечную ткань, чтобы получить определенные аминокислоты или строительные блоки белка, но у него нет специализированных клеток для эффективного хранения белка, как это происходит с жирами и углеводами. По этой причине регулярное употребление белка имеет первостепенное значение.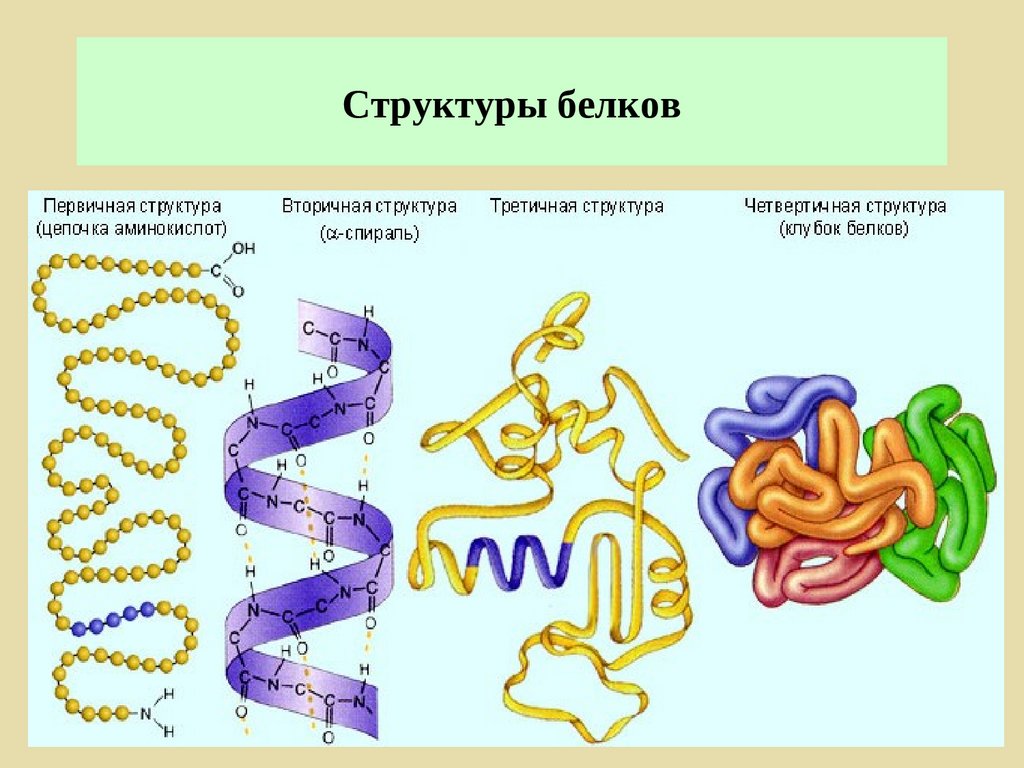 [7]
[7]
- Количество белка, которое нам нужно, меняется на протяжении всей жизни, и пожилым людям на самом деле требуется больше белка, чем молодым.
- Продукты, богатые белком, как правило, заставляют людей дольше чувствовать себя сытыми по сравнению с жирами или углеводами [6] . Белки делают это за счет усиления термогенеза и прямого воздействия составляющих его аминокислот (особенно лейцина) на мозг [8] .
- Миллионы людей принимают спортивные добавки в надежде на целый ряд преимуществ для здоровья, от потери веса до набора мышечной массы. Но некоторые добавки продаются нелегально и могут быть очень вредными. [9]
Сопутствующие заболевания[править | править код]
Девушка с квашиоркором
Белки играют решающую роль в биохимии человека . Основная роль заключается в обеспечении организма строительными блоками. Они являются предшественниками нескольких биологически значимых молекул. Следовательно, как избыток, так и недостаток белка может привести к заболеваниям, дефектам нервной системы, проблемам с обменом веществ, отказу органов и даже смерти. например, самая тяжелая форма дефицита белка называется квашиоркор [6] ; Нервная анорексия.
Следовательно, как избыток, так и недостаток белка может привести к заболеваниям, дефектам нервной системы, проблемам с обменом веществ, отказу органов и даже смерти. например, самая тяжелая форма дефицита белка называется квашиоркор [6] ; Нервная анорексия.
- Дисфункциональный белок может привести к различным заболеваниям и часто к смерти.
- Дисфункциональные белки могут привести к ожирению у детей, разрушению сетчатки, что приводит к слепоте, потере слуха и диабету 2 типа.
Например, белковые реснички и как проявляется их дисфункция.
- Неадекватные реснички жгутиков приводят к нарушению подвижности сперматозоидов.
- Дефектные реснички в дыхательных путях приводят к хроническим инфекциям легких.
- Дисфункциональные реснички в фаллопиевых трубах вызывают бесплодие Каушик Р. Физиология, Белки. StatPearls [Интернет]. 2020, 5 декабря. Доступно: https://www.ncbi.nlm.nih.gov/books/NBK555990/ (по состоянию на 21.
 10.2021)
10.2021) - ↑ 2.0 2.1 Thought Co. Белки в клетке Доступно: https://www.thoughtco.com/protein-function-373550 (по состоянию на 21.10.2021)
- ↑ 3.0 3.1 3.2 3.3 Britannica Proteins Доступно: https://www.britannica.com/science/protein (по состоянию на 22.10.2021)
- ↑ Стоссель ТП. Сократительные белки в структуре и функциях клетки. Ежегодный обзор медицины. 1978 февраль; 29 (1): 427-57. Доступно: https://pubmed.ncbi.nlm.nih.gov/206188/ (дата обращения: 22.10.2021).
- ↑ Эрнандес Р.Дж., Кравиц Л. Тайна гипертрофии скелетных мышц. ACSM Health Fit. J. 2003 1 марта; 7:18-22. Доступно: https://www.unm.edu/~lkravitz/Article%20folder/hypertrophy.html (дата обращения: 21.10.2021)
- ↑ 6.0 6.1 6.2 6.3 Kidadl 50 фактов о белках: объяснение того, что они собой представляют и как они действуют для детей (и родителей) Доступно: https://kidadl.

 ..
.. Дефицит таурина возникает при недостатке метионина и цистеина;
Дефицит таурина возникает при недостатке метионина и цистеина; Белки значительно больше пептидов. Пептиды состоят из 2–50 аминокислот, а белки — из более чем 50 аминокислот.
Белки значительно больше пептидов. Пептиды состоят из 2–50 аминокислот, а белки — из более чем 50 аминокислот. Например, альбумин (яичный белок), казеин (молочный белок). Такие белки растворимы в воде;
Например, альбумин (яичный белок), казеин (молочный белок). Такие белки растворимы в воде; Изменение всего лишь одной аминокислоты влечет за собой последствия: например, если вместо глутаминовой кислоты в молекуле гемоглобина находится валин, то у человека образуется серповидноклеточная анемия. При замене глутаминовой кислоты на валин клетки гемоглобина вытягиваются и принимают форму месяца или серпа.
Изменение всего лишь одной аминокислоты влечет за собой последствия: например, если вместо глутаминовой кислоты в молекуле гемоглобина находится валин, то у человека образуется серповидноклеточная анемия. При замене глутаминовой кислоты на валин клетки гемоглобина вытягиваются и принимают форму месяца или серпа. Эта структура обусловлена взаимодействиями между R-группами аминокислот, которые входят в состав белка. Среди взаимодействий между R-группами, формирующими третичную структуру, встречаются водородные, ионные и диполь-дипольные связи, а также дисперсионные силы.
Эта структура обусловлена взаимодействиями между R-группами аминокислот, которые входят в состав белка. Среди взаимодействий между R-группами, формирующими третичную структуру, встречаются водородные, ионные и диполь-дипольные связи, а также дисперсионные силы. Вурм ( 2004 ). «Производство рекомбинантных белковых терапевтических средств в культивируемых клетках млекопитающих. в Природа Биотехнология . 22 : 1393–1398. ПабМед
Вурм ( 2004 ). «Производство рекомбинантных белковых терапевтических средств в культивируемых клетках млекопитающих. в Природа Биотехнология . 22 : 1393–1398. ПабМед ) « Отслеживание белков клеток-хозяев во время биофармацевтического производства: передовые методологии для обеспечения высокого качества продукции » в APR
) « Отслеживание белков клеток-хозяев во время биофармацевтического производства: передовые методологии для обеспечения высокого качества продукции » в APR 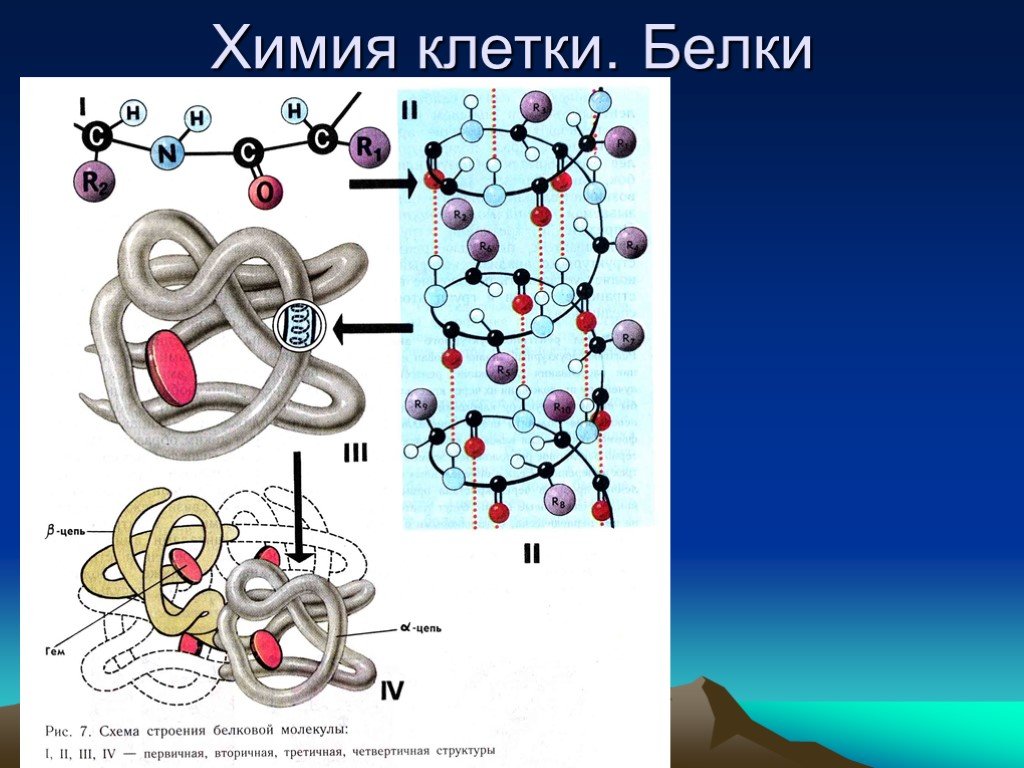 Незаменимыми аминокислотами являются: гистидин; изолейцин; лейцин; лизин; метионин; фенилаланин; треонин; триптофан; Валин [1] .
Незаменимыми аминокислотами являются: гистидин; изолейцин; лейцин; лизин; метионин; фенилаланин; треонин; триптофан; Валин [1] . Актиновые филаменты являются основными компонентами этой сети [4] . См. Мышечные клетки (миоциты)
Актиновые филаменты являются основными компонентами этой сети [4] . См. Мышечные клетки (миоциты) Факторы роста стимулируют деление и дифференцировку определенного типа клеток. При гипертрофии скелетных мышц факторы роста включают инсулиноподобный фактор роста (IGF). IGF секретируется скелетными мышцами. Он регулирует метаболизм инсулина и стимулирует синтез белка. [5] .
Факторы роста стимулируют деление и дифференцировку определенного типа клеток. При гипертрофии скелетных мышц факторы роста включают инсулиноподобный фактор роста (IGF). IGF секретируется скелетными мышцами. Он регулирует метаболизм инсулина и стимулирует синтез белка. [5] .
 10.2021)
10.2021)