Как дать кошке лекарство: таблетки, жидкие лекарства, капли и уколы
Болеть — это совсем не весело, особенно когда для выздоровления приходится принимать лекарства. Так же считают и наши пушистые друзья. Чтобы поправиться, кошкам тоже иногда требуются лекарственные препараты. Как давать лекарство кошке, без стресса и помочь ей выздороветь?
Как правильно зафиксировать положение кошки
Некоторые животные нервничают, даже когда их просто пытаются подержать на руках против их воли. Нужно осторожно подойти к кошке и взять её на руки. При этом говорите с ней нежным и успокаивающим голосом. Затем можно обернуть её полотенцем или одеялом, поддерживая лапы, чтобы они не находились на весу.
Как дать кошке таблетку
Дать лекарство кошке в форме таблеток,может стать испытанием как для вас, так и для вашей любимицы. В отличие от собак, которым таблетку,можно замаскировать “любимым” лакомством, кошки требуют спокойного и расчётливого подхода.
Если кошка не сопротивляется, можно положить таблетку прямо ей в пасть. Но не следует просто закидывать туда лекарство, так как есть риск, что животное подавится или просто выплюнет таблетку обратно. Вместо этого нужно положить таблетку в центр языка кошки ближе к задней части, а затем осторожно почесать ей шею спереди, чтобы помочь проглотить таблетку. Затем следует предложить кошке миску со свежей водой, чтобы запить лекарство.
Но не следует просто закидывать туда лекарство, так как есть риск, что животное подавится или просто выплюнет таблетку обратно. Вместо этого нужно положить таблетку в центр языка кошки ближе к задней части, а затем осторожно почесать ей шею спереди, чтобы помочь проглотить таблетку. Затем следует предложить кошке миску со свежей водой, чтобы запить лекарство.
«Фрикадельки»
Есть и другой, более незаметный способ, как лучше дать таблетку кошке. Можно спрятать таблетку в миске с кормом. Для этого лучше всего подходит влажный или полувлажный корм для кошек. Но если пушистый друг ест только сухой корм, во время приёма таблетки можно предложить ему немного влажного корма в качестве интересного лакомства.
Также можно спрятать таблетку в небольшой шарик с кошачьим кормом. Эта «игра» состоит в том, чтобы засунуть таблетку в ложку влажного корма и, скатав его в шарик, предложить эту фрикадельку кошке в качестве забавной закуски.
Если упрямица не берёт таблетку, спрятанную в корме, не стоит предлагать ей человеческую еду. Многие продукты могут вызывать у кошек желудочно-кишечные расстройства. Необходимо посоветоваться с ветеринарным специалистом, прежде чем давать кошке еду, не предназначенную для домашних животных.
Многие продукты могут вызывать у кошек желудочно-кишечные расстройства. Необходимо посоветоваться с ветеринарным специалистом, прежде чем давать кошке еду, не предназначенную для домашних животных.
Подлива из кошачьего корма
Если описанные выше способы не помогли, можно измельчить таблетку в порошок. Но при этом не следует разламывать и измельчать таблетки, чтобы добавить их в корм или воду. Исключение составляют случаи, когда такую рекомендацию дал ветеринарный врач. Измельчённые лекарства часто имеют горький привкус, поэтому кошка скорее всего не съест таблетку до конца и не получит необходимую дозировку. Прежде чем давать кошке лекарство таким способом, обязательно нужно проконсультироваться с ветеринарным врачом.
Можно раздавить таблетку между двумя ложками или подумать о приобретении измельчителя для таблеток в местной аптеке. Такое устройство упрощает процесс измельчения, обеспечивает чистоту, поскольку лекарство остаётся внутри контейнера, и стоит совсем недорого.
После этого необходимо размешать измельчённое лекарство в небольшой порции кошачьего корма, превратив его в подливу. Сильный аромат такого угощения должен смягчить резкий вкус таблетки. Нельзя давать кошкам лекарства в молоке, поскольку многие из них страдают непереносимостью лактозы. Если пушистик отказывается от ложки подливы, можно добавить её в обычный корм, сделать дополнением к сухому корму либо смешать с влажным кормом.
Как дать кошке жидкое лекарство
Если кошка отказывается принимать лекарства, не может нормально есть из-за болезни или лекарство есть только в жидкой форме, ветеринарный врач может прописать лекарство в виде жидкой смеси для перорального введения с помощью шприца. Большинство жидких лекарств необходимо хранить в холодильнике, но кошки лучше принимают лекарства комнатной температуры. Препарат нельзя подогревать в микроволновой печи, но можно согреть, подержав шприц в руке в течение нескольких минут или опустив его в чашку с тёплой, но не горячей водой.
Зная, как правильно давать кошке лекарство из шприца, можно снизить количество стресса у любимицы. Кошку следует держать безопасным и комфортным для нее способом, а шприц — в удобной для Вас руке. Можно дать питомице и обнюхать и лизнуть кончик шприца, чтобы она могла попробовать лекарство, а затем медленно надавить на поршень. Струю лекарства следует направить на заднюю стенку горла, но необходимо следить, чтобы кошка не запрокинула голову. Если это произойдёт, животное может вдохнуть немного жидкости или поперхнуться.
После того как лекарство окажется у кошки во рту, следует закрыть ей пасть, чтобы убедиться, что она проглотила жидкость. Не стоит волноваться, если она выплюнет лекарство, — это обычное дело. Даже если часть лекарства оказалась у владельца на коленях, не стоит пытаться дать кошке ещё одну дозу. В этом случае нужно дождаться времени следующего приёма препарата.
Глазные и ушные капли
Иногда кошке необходимо закапывать глазные или ушные капли. Как и в случае с таблетками и жидкими лекарствами, при закапывании капель необходимо правильно держать кошку.
Чтобы закапать лекарство в глаза, подносить пипетку лучше сверху или снизу, а не спереди. Так кошка не увидит её приближения. Затем нужно положить руку на макушку кошки и, используя мизинец и указательный палец той же руки, оттянуть верхнее веко. Остальные пальцы необходимо поместить под челюсть кошки, чтобы поддерживать голову. Нижнее веко будет выполнять роль мешочка для капель. Ни в коем случае нельзя касаться поверхности глаза кошки пипеткой или пальцами.
Чтобы закапать ушные капли, нужно мягко помассировать основание уха круговыми движениями. По мере проталкивания лекарства глубоко в слуховой проход должен раздаться «хлюпающий» звук». Кошке скорее всего не понравится ни один из этих методов, но, как и в случае любых других лекарств для кошек, он жизненно важен для её здоровья.
Уколы: как делать их кошке
При некоторых заболеваниях, например диабете, хозяевам домашних животных приходится вводить лекарства им под кожу. Во время укола пригодятся вторые руки, поэтому лучше привлечь помощника, который будет фиксировать питомца В зависимости от лекарства, кошке может потребоваться укол в бедро (внутримышечно), шею(подкожно) или в другое место. Лучше попросить ветеринарного врача показать, как и куда следует делать инъекцию. Всегда необходимо использовать новый шприц для каждой инъекции и записывать время и дату проведения процедуры.
Лучше попросить ветеринарного врача показать, как и куда следует делать инъекцию. Всегда необходимо использовать новый шприц для каждой инъекции и записывать время и дату проведения процедуры.
После укола нужно предложить кошке дополнительную порцию ласки. Она также может захотеть побыть в одиночестве, поэтому, если кошка пытается спрятаться, нужно дать ей такую возможность. Сделав укол, не стоит бросать использованную иглу в мусор. Её следует утилизировать в одобренном контейнере для острых предметов или сдать в местную аптеку или ветеринарный кабинет.
Если кошка заболеет, надо сначала записать её на приём к ветеринарному специалисту и давать только те лекарства, которые прописал врач. Никогда нельзя давать кошке лекарства для человека, отпускаемые без рецепта, включая глазные капли, потому что многие из этих лекарств могут быть опасны для домашних животных.
Представленные рекомендации предназначены только в качестве отправных идей. Конкретные назначения в отношении того, как давать питомцу лекарства, необходимо получать у Вашего лечащего ветеринарного врача. Тщательное обследование в ветеринарной клинике — это лучший способ правильной диагностики и лечения любимца от любых болезней.
Тщательное обследование в ветеринарной клинике — это лучший способ правильной диагностики и лечения любимца от любых болезней.
Будь то короткий курс антибиотиков или средство пожизненного контроля заболевания, но иногда пушистой любимице приходится давать лекарства. Возможно, она не скажет владельцу за это спасибо, но в конечном итоге довольная кошка — это здоровая кошка.
Читайте также:
Облегчение боли у кошки: какие лекарства опасны?
Выбираем ветеринарного врача
Важность профилактических визитов к ветеринарному врачу с пожилой кошкой
Ваша кошка и ветеринарный врач
Как понять, что кошке больно? Признаки и симптомы заболеваний
Contributor Bio
Кристин О’Брайен
Кристин О’Брайен — писательница, мама и давняя владелица двух русских голубых кошек, которые являются главными в доме. Ее статьи также можно найти на ресурсах Care.com, What to Expect и Fit Pregnancy, где она пишет о семейной жизни, домашних животных и беременности. Подписывайтесь на нее в Instagram и Twitter @brovelliobrien.
Подписывайтесь на нее в Instagram и Twitter @brovelliobrien.
Как сделать укол кошке — пошаговая инструкция
Забота и любовь — это не единственное, что требуется нашим четвероногим подопечным. Случается так, что в непредвиденной ситуации питомцу нужна неотложная помощь. Если обработать ранки или почистить ушки владельцам кошек совсем не трудно, то укол коту осмелится сделать не каждый. Внутривенные и внутрисуставные инъекции лучше всего доверить специалисту.
Но при желании способы введения лекарств в мышцу может освоить кто угодно. Понятно, что у профессионалов уже есть навык и практика. Но зачастую, получив рекомендации у ветеринара, владелец не готов ежедневно несколько раз в день или в выходной приходить с питомцем на процедуры. Единственный выход – освоить технику введения препаратов самостоятельно. Несложная процедура постановки внутримышечной инъекции не вызовет проблем даже у новичка, если действовать по общепринятому алгоритму.
Как выбрать шприц для инъекции
Эксперты утверждают, что легче всего кошки переносят укол в холку. Наиболее безболезненные – инъекции с обезболивающими препаратами.
Наиболее безболезненные – инъекции с обезболивающими препаратами.
В любом случае, в зависимости от способа введения лекарств и их назначения специалисты рекомендуют выбирать разные шприцы, толщина иглы при этом тоже имеет значение:
- Для внутримышечного укола с большим объемом выбирают обычные шприцы на 1 мл с уплотнителем, для подкожного введения – на 5 мл.
- Градуированные инсулиновые шприцы с тоненькой иглой отлично подходят при введении препарата в мышцу плеча или бедра кошки, а также для котят это идеальный вариант. Тонкая игла, плунжер и удобный небольшой размер позволяют сделать инъекцию аккуратно, не травмируя седалищный нерв или сустав.
- Маслянистые вязкие препараты вводят с помощью обычных шприцов, объемом не менее 5 или 10 мл – так как у них диаметр иглы больше (4*0.7 мм), чем у инсулиновых, соответственно помогают провести процедуру быстро и безболезненно.
- Для животных весом до 3 кг используют шприцы объемом 1 мл.
 Кошкам более 3-4 кг удобно вводит лекарства под кожу 5 или 10-миллилитровыми шприцами.
Кошкам более 3-4 кг удобно вводит лекарства под кожу 5 или 10-миллилитровыми шприцами.
Чтобы поставить укол коту инструмент выбирают исходя из дозировки и консистенции назначенных лекарств.
Как подготовить кота к уколу
Процесс введения препаратов кошке несложный, но требует некоторой подготовки. Если вы решили самостоятельно сделать инъекцию коту, одномоментно завершить эту процедуру не получится.
Подготовка пушистого друга к – это полпути к победе.
- Заранее готовим медицинские инструменты и препараты.
- Учтите, что на каждое введение требуется новая стерильная игла.
- Далее изучаем инструкцию препарата. Лекарство, извлеченное из холодильника необходимо подогреть до комнатной температуры – достаточно в течение нескольких минут подержать ампулу в крепко сжатой ладони (или опустить ампулу в емкость с теплой водой (до 40 градусов) на пару минут).
- Фиксируем котика на жесткой, ровной и нескользкой поверхности — это может быть стол или пол.

- Доброжелательность и мягкое обращение по кличке к питомцу определенно не заставят кота все терпеть, но вызовут доверие и расположение духа. Вы сможете спокойно подготовить препараты для введения и набрать их в шприц.
- Лучше и удобнее всего внутримышечные уколы делать вдвоем, когда один человек фиксирует животное, второй – проводит процедуру.
- Если помощников не оказалось рядом – проще воспользоваться одеялом и завернуть кота, полностью скрыв лапы. Оставьте в доступе только заднюю часть – а именно бедро, или при подкожном введении холку.
- Очень важно делать укол в расслабленную мышцу. Если лапка напряжена, внутримышечный укол делают после того, как помассируют конечность.
- Препарат набирают в цилиндр шприца в том объеме, который указан в рекомендации. Порошковые лекарства предварительно разбавляют новокаином (физраствором или любым аптечным препаратом, указанным в аннотации или рекомендованным ветеринаром).
Все движения должны быть четкими, выверенными и аккуратными
В какие места можно ставить укол
Чаще всего внутримышечно инъекции кошкам вводят в бедренную мышцу или в холку под кожу. Как вариант, можно сделать укол коту в локтевую часть – в самую «мясистую» область, в мышцу, но это немного сложней, чем в бедро. Дело в том, что в этой части тела у кошек мышца мельче и тоньше.
Как вариант, можно сделать укол коту в локтевую часть – в самую «мясистую» область, в мышцу, но это немного сложней, чем в бедро. Дело в том, что в этой части тела у кошек мышца мельче и тоньше.
Подкожное введение практикуется исключительно в холку — под оттянутую кожу.
Как сделать внутримышечный укол коту
Существует усредненный расчет, общепринятый специалистами: на один участок тела у кошки с весом 4-5 кг необходимо ввести в среднем 1 мл лекарства – скорость введения при этом 2-3 сек. Если требуется применить большее количество препарата по рекомендации ветеринара – желательно разделить дозировку на несколько введений в разные места.
Стоит помнить, что внутримышечное введение препаратов всегда более болезненное, чем в холку. Именно поэтому ветеринары рекомендуют приступать к процедуре, заручившись помощью. Хорошо, если будет рядом напарник, который поможет зафиксировать животное. Внешняя центральная (самая мягкая) сторона бедра должна быть открыта и доступна.
Извлекаем шприц из упаковки и набираем необходимую дозировку лекарства, плотно насаживаем иглу на шприц.
Выпускаем пузырьки воздуха и откладываем шприц:
- Один человек держит кота за холку ближе к ушам. Фиксируем удобно голову и аккуратно захватываем передние лапки.
- Второй человек плотно, но не сдавливая между собой, прижимает задние лапы левой рукой.
- Правой рукой вводим обычную иглу на треть под острым углом к поверхности кожи, инсулиновую на половину в мышцу.
- Лекарство вводят не спеша, без чрезмерного давления.
Читайте также про первую помощь кошке при отравлении.
Как сделать укол кошке в бедро
Укол в бедро более болезненный, чем инъекции под кожу. Поэтому не исключено, что даже самое спокойное животное будет вести себя агрессивно и может дернуться. Крайне важно надежно зафиксировать конечность в своей руке и животное.
Пошаговая инструкция введения препаратов коту в бедро:
1. Фиксируем большой палец сверху, ладонь – снизу.
Фиксируем большой палец сверху, ладонь – снизу.
- Прощупываем мышцу – бережно, аккуратно, ласково, не вызывая агрессии и болевых ощущений у кошки. Пальпация позволяет ощутить толщину мышцы, чтобы при инъекции не проколоть бедренную кость.
- Быстро (но не резко) вводится игла на одну треть длины – не более, чем на 1 см под углом 45 градусов. Чтобы удостовериться, что игла не попала в сосуд – натягиваем немного на себя поршень шприца – если кровь не попала в цилиндр, значит все в порядке.
- Поршнем выталкиваем лекарство. Если препарат болезненный, делаем это медленно.
- Если процедуру проводят без помощников и питомец вырвался – не стоит сразу выдергивать шприц из мышцы. Отпускаем инструмент и перехватываемся руками – снова фиксируем животное. Первый болевой шок от введения иглы у кошки на тот момент проходит, остается аккуратно ввести лекарство – с питомцем будет все в порядке.
Когда ветеринар назначает лечение на несколько дней, лекарственную форму вводят поочередно в обе конечности, чередуя их.

Подкожные инъекции
Во-первых, введение лекарств под кожу переносится питомцами менее болезненно. Во-вторых, в область холки можно ввести больший объем препарата, чем в мышечную ткань. В среднем согласно рекомендации экспертов на один участок под кожу кошке можно ввести до 50 мл препарата. Вот как это делают:
- Тремя пальцами оттягивают кожу в области холки (в месте расположения лопаток) вверх. Участок кожи принимает вертикальное положение, при этом освобождается полость между спиной и зафиксированной пальцами кожей.
- Препарат попадет в этом случае под кожу, а не глубоко в мышцу. Поэтому иглу достаточно ввести наполовину под углом примерно 45 градусов (почти параллельно спине).
- Не торопясь вводят препарат и извлекаем иглу.
Только после этого отпускаем животное.
Полезные советы и рекомендации
Вот несколько особенностей, которые нужно знать:
- Нош-па, анальгин, цефтриаксон – весьма болезненные лекарства, их вводят аккуратно и хорошо фиксируют животное.

- Цефтриакон рекомендуется разводить только новокаином.
- Когда требуется сделать укол коту в очень маленькой дозировке – до 0,1 мл, выбирают исключительно инсулиновый шприц – с удобно расположенными делениями.
- В ветеринарии место инъекции не сбривают, а участок кожи под шерстью не дезинфицируют.
Читайте также, как подготовить кошку к прививке.
Что будет, если неправильно сделать укол
Неподготовленный владелец всегда боится просчитаться при введении препарата своему питомцу. Существует ряд ошибок при внутримышечных и подкожных инъекциях, но исправить ситуацию можно и нужно.
Если лекарство плохо рассасывается, и питомец стал прихрамывать, следует немного растереть (промассировать) пораженное место (не вызывая дискомфорт у кошки). Как правило, уже на следующий день котейка будет бегать как прежде. Если этого не произошло – следует срочно обратиться к опытному специалисту. Он назначит аппликации от гематомы и при необходимости откачает жидкость, скопившуюся в мягких тканях.
Он назначит аппликации от гематомы и при необходимости откачает жидкость, скопившуюся в мягких тканях.
Если следует провести подкожную инъекцию – следим, чтобы не проткнуть кожу складки. Если с обратной стороны от введения иглы появились капельки – возможно, игла вошла слишком глубоко, сделав отверстия в смежной складке. Исправляем ошибку: отводим поршень немного назад и пробуем ввести лекарство, внимательно следим, чтобы жидкость не просачивалась.
Нельзя допускать, чтобы в кровоток попало лекарство на масляной основе.
Не рекомендуется вводить сразу несколько препаратов в одном шприце.
Любые уплотнения, шишки или нагноения в области инъекции должны насторожить владельца. Питомца следует обязательно показать ветеринару, чтобы исключить попадание инфекции в рану.
После процедуры следите за самочувствием кота – не всегда препарат подходит животным.
Естественно, ошибки в дозировке и подборе препарата нужно исключить – такие промахи могут быть летальными для питомцев. Поэтому любое лечение можно начинать только после консультации ветеринара.
Поэтому любое лечение можно начинать только после консультации ветеринара.
Вся процедура введения лекарственных препаратов котам состоит из нескольких шагов. Важно получить квалифицированную консультацию и воспроизвести весь процесс поэтапно. Помните, что главный результат – здоровье пушистого друга.
Читайте также, как своими руками изготовить воротник для кота.
- Автор: masha_zagaynova
- Распечатать
Оцените статью:
(0 голосов, среднее: 0 из 5)
Поделитесь с друзьями!
Как правильно сделать кошке укол: подготовка и сам процесс
Содержание
- 1 Почему уколы лучше ставить без посторонней помощи?
- 1.1 Типы инъекций
- 1.2 Как подготовиться к инъекции?
- 1.3 Как ставится укол котам?
- 1.4 Осложнения после уколов
- 1.5 Похожие статьи
Бывают ситуации, когда животному нужно сделать инъекцию, поэтому каждый хозяин должен знать, как сделать укол кошке в холку или бедро. Когда домашний любимчик теряет аппетит и начинает вести себя не так, как обычно, это очень плохой признак, который говорит о том, что животное нужно показать специалисту. Кошки и собаки могут болеть различными заболеваниями. Некоторые из них требуют серьезного подхода и проведения операции, но большинство случаев можно устранить и консервативными методами.
Когда домашний любимчик теряет аппетит и начинает вести себя не так, как обычно, это очень плохой признак, который говорит о том, что животное нужно показать специалисту. Кошки и собаки могут болеть различными заболеваниями. Некоторые из них требуют серьезного подхода и проведения операции, но большинство случаев можно устранить и консервативными методами.
В отличие от людей, домашних животных в больницу, как правило, не кладут. Госпитализация возможна, но это крайние случаи. Чаще всего после осмотра пушистого пациента врач ставит диагноз и назначает соответствующее лечение. Нередко приходится использовать медикаментозную терапию, но тут могут возникнуть проблемы. Все дело в том, что давать животному таблетки может быть очень сложно. Как правило, коты и собаки отказываются от их приема, как бы ни настаивал хозяин. И тут будет наиболее удачным решением использование препаратов в виде инъекций.
Стоит заметить, что некоторые лекарственные средства, которые назначаются домашним любимцам, выпускаются только в ампулах. Но ставить уколы в ветеринарной клинике неудобно, ведь в таком случае придется 2–3 раза в день доставлять туда пациента. Значительно проще проводить эту несложную процедуру самостоятельно, тем более что никаких сложностей в этом нет.
Но ставить уколы в ветеринарной клинике неудобно, ведь в таком случае придется 2–3 раза в день доставлять туда пациента. Значительно проще проводить эту несложную процедуру самостоятельно, тем более что никаких сложностей в этом нет.
Если заболел котик, а ветеринар назначил ему препараты в инъекциях, заводчик должен действовать решительно и знать, как делать укол кошке в бедро или область загривка.
Это очень важно, ведь для кота путешествие, пусть и в ближайшую ветеринарную клинику, будет сильным стрессом.
Если ему придется совершать такие поездки по несколько раз в день, это может вызвать еще большее ухудшение здоровья. Выздоровление ускорится, если создать для животного спокойную и комфортную обстановку. Просить других людей поставить укольчик тоже будет не лучшим вариантом. Кот доверяет только своему человеку, а в руках чужака будет сильно нервничать.
Существует и еще один вариант, а именно отдать домашнего любимца в стационар. Но это будет не только дорого, но и хлопотно. В любом случае кота придется постоянно навещать, чтобы он не переживал сильный стресс от одиночества. Более того, котики всегда привыкают к своему дому, поэтому времяпрепровождение на чужой территории будет для них психологической травмой. Это не только замедлит выздоровление, но и может привести к развитию дополнительных недугов.
В любом случае кота придется постоянно навещать, чтобы он не переживал сильный стресс от одиночества. Более того, котики всегда привыкают к своему дому, поэтому времяпрепровождение на чужой территории будет для них психологической травмой. Это не только замедлит выздоровление, но и может привести к развитию дополнительных недугов.
Научиться ставить уколы несложно. Когда речь идет о домашнем животном, тут и вовсе не должно возникнуть проблем. Один раз освоив подобный навык, можно забыть о лишних тратах денег и нервов при посещении клиник и вызове платных медсестер.
Типы инъекций
В зависимости от того, что именно стало причиной возникновения недуга, будет отличаться лечебная терапия. Врач может назначить различные препараты, но в каждом случае специалист обязательно объясняет, какой вид инъекции будет использован. Дополнительно стоит ознакомиться с инструкцией, которая прилагается к каждому лекарству.
Всего существует три типа инъекций, которые могут быть использованы для лечения кота.
- внутримышечно;
- подкожно;
- внутривенно.
Последний вариант считается наиболее сложным, но такие уколы кошке делаются нечасто.
Большая часть препаратов, которые применяются для лечения заболеваний у кошек и котов, ставятся подкожно. Это максимально простой и самый безболезненный способ доставить лекарство через иглу, особенно когда нужно сделать инъекцию котенку. Но не все медикаментозные препараты можно использовать таким способом. Стоит заметить, что подкожный укол кошке чаще всего делается в тех случаях, когда объем жидкости достаточно большой. Подкожные инъекции ставятся в холку, так как здесь большая и удобная складка кожи.
Внутримышечный укол кошке вводится в область бедра. Это тоже простой вариант укола, чего нельзя сказать о внутривенном введении лекарственных препаратов. Самостоятельно, то есть, не имея медицинской квалификации, проводить подобные процедуры не рекомендуется. У кота очень сложно найти вену.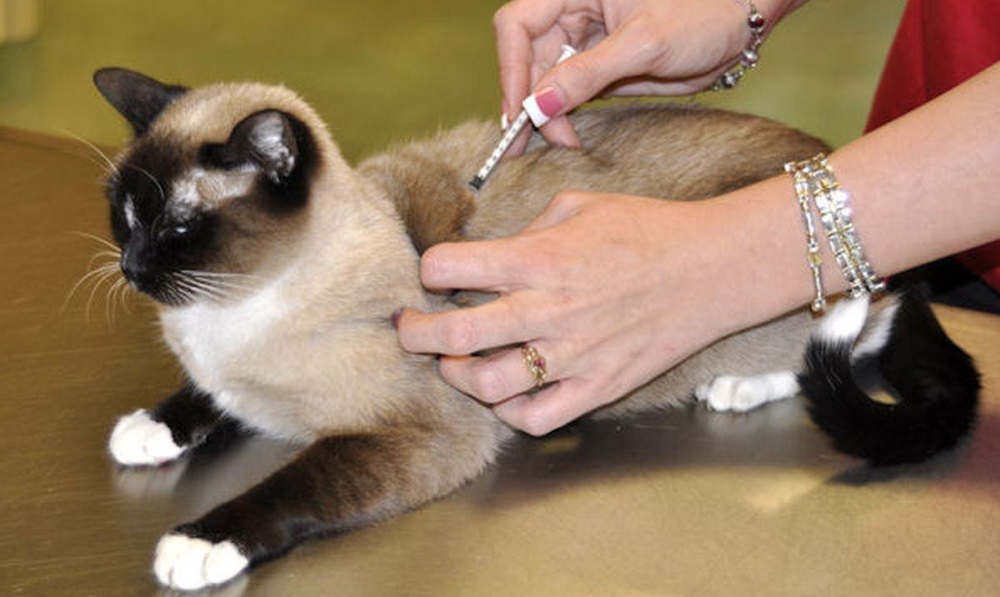 Чаще всего, если животному требуется несколько внутривенных уколов в день, ему просто ставят катетер, к которому необходимо подключать капельницу с лекарственным препаратом. Подведение ампулы может выполнять и сам хозяин животного.
Чаще всего, если животному требуется несколько внутривенных уколов в день, ему просто ставят катетер, к которому необходимо подключать капельницу с лекарственным препаратом. Подведение ампулы может выполнять и сам хозяин животного.
Как подготовиться к инъекции?
Но нужно обращать внимание не только на количество препарата, но и на его состав.
Если лекарственное средство изготовлено на масляной основе, использование инсулинового шприца недопустимо. Тут нужно взять небольшое приспособление для внутримышечных инъекций.
После приобретения подходящего приспособления для введения инъекции нужно обязательно ознакомиться с инструкцией к препарату, иначе укол может быть сделан неправильно. Это необходимо по причине того, что специалист может просто забыть сообщить какую-либо важную деталь относительно использования медикаментозного препарата.
Поэтому нужно обязательно свериться с инструкцией, чтобы уточнить дозировку, допустимое количество уколов в день и продолжительность курса. Если вся информация совпадает с рекомендациями врача, можно приступать к лечению домашнего любимца.
Если лечебный курс состоит из нескольких инъекций, которые нужно делать каждый день на протяжении определенного периода, стоит составить график и вывесить его на видном месте. Так будет проще и удобнее, а главное, безопаснее для пушистого пациента.
Перед проведением инъекции нужно обратить внимание на такой момент, как концентрация вещества. Некоторые виды препаратов для кошек продаются в порошке, который перед использованием нужно разбавить растворителем. Его тоже требуется заранее подготовить. Специалисты рекомендуют выбирать те растворители, которые позволят сократить болезненность введения лекарственного средства. Это важно для психического состояния кота.
Чаще всего в качестве растворителя применяют новокаин. Но нужно учитывать, что этот препарат не всеми живыми существами переносится нормально. Поэтому нужно предварительно проверить, нет ли у кота аллергии на данное средство. Если негативные реакции организма все же проявляются, стоит заменить новокаин обычным физраствором либо водой для инъекций.
Те препараты, которые выпускаются уже в виде жидкостей, необходимо обязательно встряхивать перед использованием. Кроме того, нужно аккуратно применять средства, которые должны храниться в холодильнике. Перед тем как вколоть такой препарат, его потребуется обязательно согреть.
Желательно вводить лекарственные средства, температура которых составляет 38ºС. Для кошки это считается оптимальным вариантом.
Отдельно стоит отметить возможность приготовления смеси из нескольких лекарств. Иногда врачи назначают такие варианты, чтобы сократить травмирование животного уколами. Но тут необходимо внимательно следить за состоянием жидкости. Если смесь стала необычного цвета либо в ней выпал осадок, нужно обязательно сообщить об этом лечащему врачу, а от совместного использования лекарственных средств отказаться.
После того как все будет готово и препарат окажется в шприце, необходимо позвать животное, взять на руки и прочно его зафиксировать. Если хозяин собирается колоть самостоятельно, нужно взять кота так, чтобы правая рука оказалась свободной.
Стоит заметить, что отдельно дезинфицировать место укола у обычных кошек необязательно. У них на кожном покрове имеется специальный слой, который защищает и быстро заживляет ранки.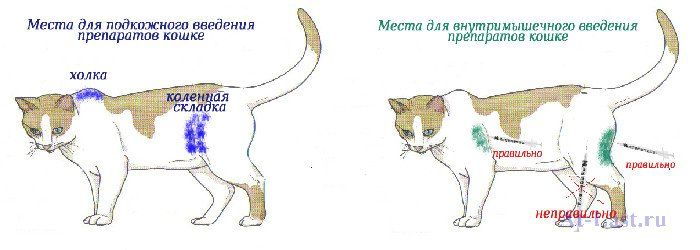
Как ставится укол котам?
В зависимости от того, какое лекарственное средство будет вводиться, врач должен определить, куда делать укол. Это может быть:
- подкожная;
- внутримышечная;
- внутривенная инъекция.
Первый вариант является самым простым. После того как препарат будет загружен в шприц, нужно аккуратно взять кота и прочно зафиксировать его левой рукой. Далее кожа в области лопаток оттягивается двумя пальцами, а игла вводится под углом в 45º. Нужно действовать аккуратно, чтобы не проткнуть кожу насквозь. После введения жидкости необходимо аккуратно и медленно вытянуть иглу. Тут требуется предельная осторожность, так как кожа в области холки очень толстая, поэтому иголка может погнуться либо вовсе сломаться. Это очень опасно и грозит дальнейшим воспалением и операцией.
Если укол в холку кошке не удается поставить, стоит переместиться на коленку.
Тут достаточно тонкая кожа, поэтому и уколы ставить проще. Но в данном случае мышцы будут расположены очень близко, поэтому нужно быть осторожными.
В случае когда врач назначает несколько видов препаратов, которые должны вводиться по несколько раз в день, необходимо обязательно чередовать места уколов.
При введении внутримышечных инъекций чаще всего используется бедренная часть кошачьего тела. Такие уколы более болезненные, и в данном случае нельзя вводить одновременно большое количество препарата.
Рекомендованная дозировка составляет от 1 до 1,5 м для кота среднего размера.
Чтобы проще попасть в мышцу бедра, нужно для начала взять животное на руки и прощупать верхнюю часть ноги. Мышечная ткань будет перекатываться под пальцами. При этом необходимо определить середину мышцы. Это важно, иначе можно попасть в сустав либо в кость. Делать уколы кошкам внутримышечно нужно быстро.
При этом необходимо определить середину мышцы. Это важно, иначе можно попасть в сустав либо в кость. Делать уколы кошкам внутримышечно нужно быстро.
Одним резким движением необходимо опустить иглу на 1 см в мышечную ткань. Вводится шприц под углом в 45º.
Специалисты иногда ставят внутримышечные уколы и в передние лапы. Но это довольно сложный вариант, поэтому для начинающих домашних медсестер лучше ограничиться бедром домашнего любимца. Колите препарат медленно. На каждую половину миллилитра должно уходить не менее одной секунды. Лучше всего лекарственные препараты входят в расслабленные мышцы. Поэтому, если кошка напряжена, ее нужно предварительно погладить и успокоить.
Если уколы приходится ставить каждый день, необходимо обязательно менять мышцу ежедневно.
Важно следить и за состоянием кожного покрова.
В случае появления первых намеков на воспаление следует обязательно показать домашнего любимца ветеринару.
Осложнения после уколов
Введение инъекции является травмой кожного покрова. Поэтому тут не исключено кровотечение из места укола. Но длительного выхода крови быть не должно. Чаще всего ранка затягивается за 5–10 минут. Если этого не произошло и место укола кровоточит, стоит приложить к проблемному участку холодный компресс минут на 20. Если кровь не останавливается, нужно бежать к ветеринару.
Поэтому тут не исключено кровотечение из места укола. Но длительного выхода крови быть не должно. Чаще всего ранка затягивается за 5–10 минут. Если этого не произошло и место укола кровоточит, стоит приложить к проблемному участку холодный компресс минут на 20. Если кровь не останавливается, нужно бежать к ветеринару.
Некоторое время после внутримышечной инъекции котик может хромать.
Действие лекарства может оказаться довольно сильным, но подобный побочный эффект должен быстро исчезнуть. Иногда животное хромает, пока не прекратятся уколы. Это считается допустимым явлением.
Похожие статьи
Введение шприцев | Merck Animal Health USA
Узнайте больше о дозировке и применении
Как вводить с помощью инсулинового шприца U-40
Используйте эти пошаговые инструкции, чтобы научить своих клиентов, как вводить Vetsulin ® (суспензия свиного инсулина и цинка).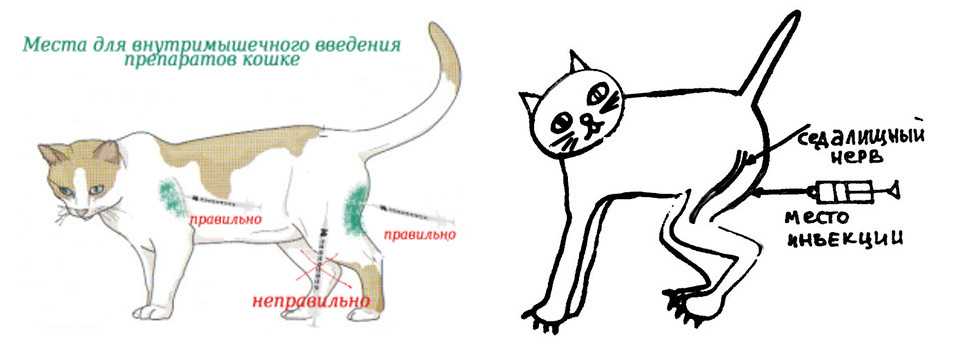 ) своей кошке, не выходя из дома.
) своей кошке, не выходя из дома.
Важная информация о дозировке
Дозы инсулина измеряются в единицах: 40 МЕ/мл инсулина содержит 40 международных единиц (МЕ) на миллилитр (мл) (1 мл = 1 см3).
Поскольку ветсулин имеет концентрацию 40 МЕ на мл раствора, для достижения правильной дозировки необходимо использовать инсулиновый шприц U-40 или VetPen. Использование шприца, отличного от U-40 (или картриджа на 100 МЕ/мл, или инсулиновой шприц-ручки для человека) приведет к неправильной дозировке. Шприцы U-100 и инсулиновые ручки для человека вводят менее половины необходимой дозы ветсулина.
И наоборот, если клиент использует инсулиновый шприц U-40 или VetPen с препаратом инсулина 100 МЕ/мл, он или она будет вводить примерно в два с половиной раза больше необходимого количества инсулина. Это может вызвать фатальную гипогликемию.
Настоятельно поощряйте клиентов приобретать Ветсулин, инсулиновые шприцы U-40 и ВетПен в вашей ветеринарной больнице — это лучший способ защитить ваших пациентов от неправильной дозировки инсулина.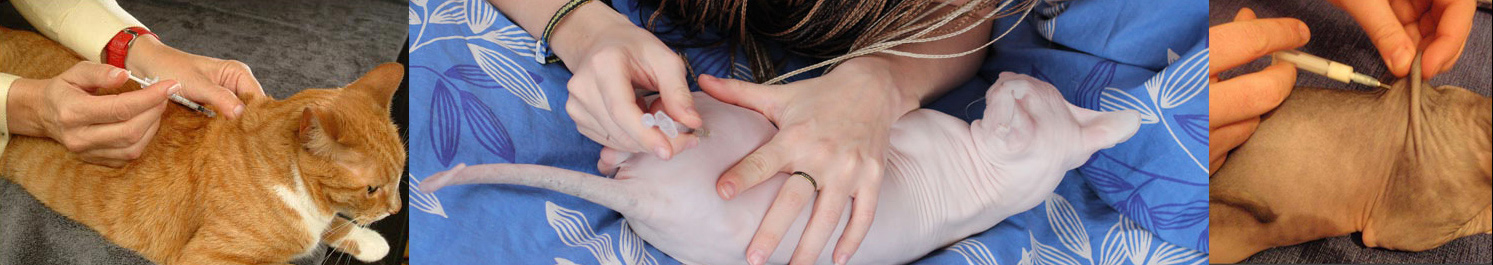 Напомните своим клиентам, что использование шприцев U-100 и инсулиновых ручек из аптеки для людей для введения ветсулина приведет к неправильной дозировке инсулина, что подвергает их питомцев опасности серьезных последствий для здоровья.
Напомните своим клиентам, что использование шприцев U-100 и инсулиновых ручек из аптеки для людей для введения ветсулина приведет к неправильной дозировке инсулина, что подвергает их питомцев опасности серьезных последствий для здоровья.
Администрация
Чтобы помочь вашим клиентам подготовить и ввести Ветсулин своим кошкам, доступны ресурсы, которые помогут им шаг за шагом пройти весь процесс.
Подготовка дозы:
После мытья рук достаньте из холодильника флакон Ветсулина (цинковая суспензия свиного инсулина). Встряхивайте флакон до тех пор, пока инсулин не станет однородно молочного цвета, позволяя рассеяться пене.
- Осторожно снимите колпачок с иглы и вставьте иглу во флакон.
- Переверните флакон вверх дном, убедившись, что кончик иглы остается во флаконе.
- Наберите нужную дозу в инсулиновый шприц U-40.
- Перед извлечением иглы из флакона проверьте шприц на наличие пузырьков воздуха.
- Если есть пузырьки, поднимите шприц и постукивайте по нему, пока пузырьки не всплывут наверх.
 Выдавите их поршнем и наберите нужную дозу.
Выдавите их поршнем и наберите нужную дозу. - Удалите иглу из флакона.
Проведение инъекций
Проведение инъекций может показаться сложным, но с практикой это может быть легко и легко впишется в ваш распорядок дня.
- Инъекцию следует вводить под кожу, на расстоянии от 3/4 до 2 дюймов от середины спины вашей кошки, от лопаток до середины спины и попеременно с боков.
- Аккуратно введите иглу в центр складки кожи.
- Нажимайте на поршень до тех пор, пока не будет введен весь инсулин.
- Вытащите иглу и выбросьте шприц в соответствующий сборник острых предметов.
ВЫ СДЕЛАЛИ ЭТО!
Насадки для инъекций:
- Точка инъекции может зависеть от рекомендации вашего ветеринара и от того, что лучше для вас и вашей кошки.

- Чередуйте места инъекции слева и справа для удобства и достижения наилучших результатов. Повторные инъекции в одно и то же место могут привести к неэффективному лечению.
- Если вводится только частичная доза, не пытайтесь ввести повторную дозу. Подождите и дайте кошке обычную дозу при следующей инъекции.
Полезный PDF-файл, который поможет клиентам подготовить и ввести ветсулин своим кошкам.
СкачатьНет элементов для отображения.
Идет загрузка…
Помогите своей практике справиться с сахарным диабетом
Ознакомьтесь с этими инструментами и ресурсами, которые помогут справиться с кошачьим диабетом.
Создайте кривую уровня глюкозы в крови для мониторинга и оценки лечения диабета.
НачатьСоздайте индивидуальную печатную форму для клиентов с указанием их нового диагноза.
Форма просмотра Получите доступ к онлайн-инструментам и другим ресурсам для поддержки персонала и владельцев домашних животных.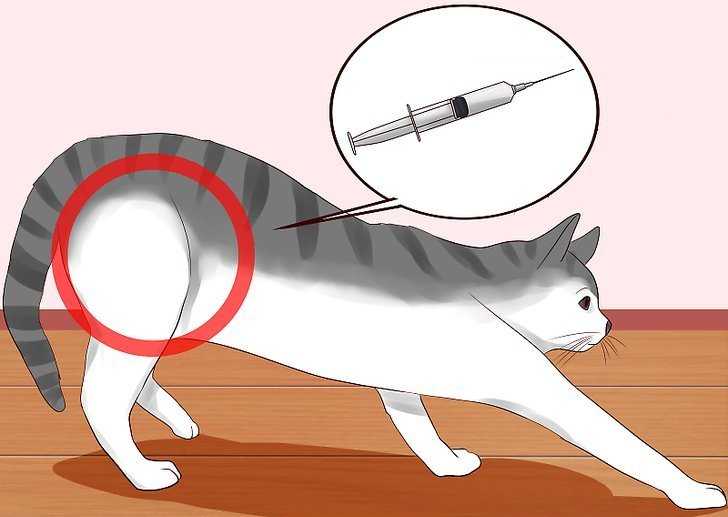
Нет элементов для отображения.
Идет загрузка…
просмотреть все ресурсы
Узнать больше о дозировке и применении
Важная информация по технике безопасности:
Ветсулин ® не следует применять собакам с системной аллергией на свинину или продукты из свинины. Ветсулин противопоказан в периоды гипогликемии. Храните в недоступном для детей месте. Как и в случае со всеми препаратами инсулина, для достижения и поддержания адекватного гликемического контроля и предотвращения сопутствующих осложнений необходим тщательный мониторинг пациента на предмет гипогликемии и гипергликемии. Передозировка может привести к глубокой гипогликемии и смерти. Безопасность и эффективность применения ветсулина у щенков, племенных, беременных и кормящих собак не оценивалась. См. вкладыш в упаковку для получения полной информации о противопоказаниях, предупреждениях и мерах предосторожности.
Каталожные номера:
1. Martin GJ, Rand JS. Фармакология препарата инсулина свиного ленте 40 МЕ/мл у кошек с диабетом: результаты в течение первой недели и после 5 или 9 недель терапии. J Feline Med Surg. 2001;3(1):23–30. 2. Ветсулин ® (цинковая суспензия свиного инсулина) [Сводка по свободе информации]. Миллсборо, Делавэр: Intervet Inc.; 2008. 3. Данные в файле, Merck Animal Health. 4. Грэм П.А., Нэш А.С., МакКеллар К.А. Фармакокинетика цинковой суспензии свиного инсулина у собак с диабетом. J Маленькая Анимная Практика. 1997;38(10):434–438. 5. Мартин Г.Дж., Рэнд Дж.С. Фармакокинетическое и фармакодинамическое исследование канинсулина у кошек с сахарным диабетом. 2000: Отчет о внутреннем исследовании. 6. Фельдман Э.К., Нельсон Р.В. Эндокринология и репродукция собак и кошек. 3-е изд. Сент-Луис, Миссури: Сондерс; 2004: 539–579. 7. Теннант Б., изд.
Martin GJ, Rand JS. Фармакология препарата инсулина свиного ленте 40 МЕ/мл у кошек с диабетом: результаты в течение первой недели и после 5 или 9 недель терапии. J Feline Med Surg. 2001;3(1):23–30. 2. Ветсулин ® (цинковая суспензия свиного инсулина) [Сводка по свободе информации]. Миллсборо, Делавэр: Intervet Inc.; 2008. 3. Данные в файле, Merck Animal Health. 4. Грэм П.А., Нэш А.С., МакКеллар К.А. Фармакокинетика цинковой суспензии свиного инсулина у собак с диабетом. J Маленькая Анимная Практика. 1997;38(10):434–438. 5. Мартин Г.Дж., Рэнд Дж.С. Фармакокинетическое и фармакодинамическое исследование канинсулина у кошек с сахарным диабетом. 2000: Отчет о внутреннем исследовании. 6. Фельдман Э.К., Нельсон Р.В. Эндокринология и репродукция собак и кошек. 3-е изд. Сент-Луис, Миссури: Сондерс; 2004: 539–579. 7. Теннант Б., изд. Фармакологический справочник мелких животных BSAVA. 4-е изд. Глостершир, Великобритания: Британская ветеринарная ассоциация мелких животных; 2002. 8. Фельдман Э.С., Нельсон Р.В. Эндокринология и репродукция собак и кошек. 3-е изд. Сент-Луис, Миссури: Сондерс; 2004: 486–538. 9. Reusch C. Сахарный диабет кошек. В: Эттингер С.Дж., Фельдман Э.К., ред. Учебник ветеринарных внутренних болезней. 7-е изд. Сент-Луис, Миссури: Сондерс; 2010: 1796–1816. 10. Нельсон РВ. Сахарный диабет у собак. В: Эттингер С.Дж., Фельдман Э.К., ред. Учебник ветеринарных внутренних болезней. 7-е изд. Сент-Луис, Миссури: Сондерс; 2010: 1782–1796. 11. Burgaud S, Riant S, Piau N. Сравнительная лабораторная оценка доставки дозы с использованием ветеринарной инсулиновой ручки. В: Материалы конгресса WSAVA/FECAVA/BSAVA; 12–15 апреля 2012 г.; Бирмингем, Великобритания. Abstract 121. 12. Burgaud S, Guillot R, Harnois-Milon G.
Фармакологический справочник мелких животных BSAVA. 4-е изд. Глостершир, Великобритания: Британская ветеринарная ассоциация мелких животных; 2002. 8. Фельдман Э.С., Нельсон Р.В. Эндокринология и репродукция собак и кошек. 3-е изд. Сент-Луис, Миссури: Сондерс; 2004: 486–538. 9. Reusch C. Сахарный диабет кошек. В: Эттингер С.Дж., Фельдман Э.К., ред. Учебник ветеринарных внутренних болезней. 7-е изд. Сент-Луис, Миссури: Сондерс; 2010: 1796–1816. 10. Нельсон РВ. Сахарный диабет у собак. В: Эттингер С.Дж., Фельдман Э.К., ред. Учебник ветеринарных внутренних болезней. 7-е изд. Сент-Луис, Миссури: Сондерс; 2010: 1782–1796. 11. Burgaud S, Riant S, Piau N. Сравнительная лабораторная оценка доставки дозы с использованием ветеринарной инсулиновой ручки. В: Материалы конгресса WSAVA/FECAVA/BSAVA; 12–15 апреля 2012 г.; Бирмингем, Великобритания. Abstract 121. 12. Burgaud S, Guillot R, Harnois-Milon G. Клиническая оценка ветеринарной инсулиновой ручки у собак с диабетом. В: Материалы конгресса WSAVA/FECAVA/BSAVA; 12–15 апреля 2012 г.; Бирмингем, Великобритания. Abstract 122. 13. Burgaud S, Guillot R, Harnois-Milon G. Клиническая оценка ветеринарной инсулиновой ручки у кошек с диабетом. В: Материалы конгресса WSAVA/FECAVA/BSAVA; 12–15 апреля 2012 г.; Бирмингем, Великобритания. Аннотация 45. 14. Davison LJ, Walding B, Herrtage ME, Catchpole B. Антиинсулиновые антитела у собак с диабетом до и после лечения различными препаратами инсулина. J Vet Intern Med. 2008; 22:1317-1325. 15. Отчет Banfield State of Pet Health за 2016 год. стр. 12-13.
Клиническая оценка ветеринарной инсулиновой ручки у собак с диабетом. В: Материалы конгресса WSAVA/FECAVA/BSAVA; 12–15 апреля 2012 г.; Бирмингем, Великобритания. Abstract 122. 13. Burgaud S, Guillot R, Harnois-Milon G. Клиническая оценка ветеринарной инсулиновой ручки у кошек с диабетом. В: Материалы конгресса WSAVA/FECAVA/BSAVA; 12–15 апреля 2012 г.; Бирмингем, Великобритания. Аннотация 45. 14. Davison LJ, Walding B, Herrtage ME, Catchpole B. Антиинсулиновые антитела у собак с диабетом до и после лечения различными препаратами инсулина. J Vet Intern Med. 2008; 22:1317-1325. 15. Отчет Banfield State of Pet Health за 2016 год. стр. 12-13.
Вакциноассоциированная саркома кошек: текущие перспективы
Vet Med (Окл). 2017; 8: 13–20.
Опубликовано в Интернете 12 января 2017 г. doi: 10.2147/VMRR.S116556
Информация об авторе Информация об авторских правах и лицензии Отказ от ответственности
Саркомы в месте инъекций кошек (FISS; также известные как вакциноассоциированные саркомы) известны уже более 20 лет. Несмотря на редкость, эти опухоли являются ятрогенными, и вакцинация против вируса бешенства и кошачьей лейкемии, возможно, является наиболее частой провоцирующей причиной. Точный этиопатогенез неизвестен, но широко признано, что воспаление, вызванное вакцинами или другими инъекциями, вероятно, играет решающую роль в развитии опухоли. Саркомы в месте инъекции чрезвычайно локально инвазивны. Рекомендуется мультимодальная терапия, включающая комбинацию хирургии, лучевой терапии и иногда химиотерапии или иммунотерапии. Однако рецидивы опухоли часты даже при агрессивном лечении, и многие кошки с FISS в конечном итоге погибают от этой разрушительной болезни. В то время как протоколы вакцинации играют важную роль в управлении и контроле инфекционных заболеваний, ветеринары должны тщательно следовать установленным рекомендациям по вакцинации, чтобы свести к минимуму индивидуальный риск развития FISS у каждого пациента. Раннее обнаружение опухоли и обучение клиентов также имеют жизненно важное значение для успешного лечения FISS.
Несмотря на редкость, эти опухоли являются ятрогенными, и вакцинация против вируса бешенства и кошачьей лейкемии, возможно, является наиболее частой провоцирующей причиной. Точный этиопатогенез неизвестен, но широко признано, что воспаление, вызванное вакцинами или другими инъекциями, вероятно, играет решающую роль в развитии опухоли. Саркомы в месте инъекции чрезвычайно локально инвазивны. Рекомендуется мультимодальная терапия, включающая комбинацию хирургии, лучевой терапии и иногда химиотерапии или иммунотерапии. Однако рецидивы опухоли часты даже при агрессивном лечении, и многие кошки с FISS в конечном итоге погибают от этой разрушительной болезни. В то время как протоколы вакцинации играют важную роль в управлении и контроле инфекционных заболеваний, ветеринары должны тщательно следовать установленным рекомендациям по вакцинации, чтобы свести к минимуму индивидуальный риск развития FISS у каждого пациента. Раннее обнаружение опухоли и обучение клиентов также имеют жизненно важное значение для успешного лечения FISS.
Ключевые слова: саркома в месте инъекции, кошка, рак, онкология
Саркома в месте инъекции у кошек (FISS) распознается с начала 1990-х годов. Одновременно с выполнением более строгих рекомендаций по вакцинации и разработкой адъювантных убитых вакцин против вируса бешенства и кошачьей лейкемии (FeLV) патологоанатомы из Университета Пенсильвании начали отмечать рост числа реакций на вакцину. 1 Что еще более важно, они также отметили рост развития сарком в местах вакцинации. 2 , 3 За последние 2 десятилетия эта проблема была признана во всем мире. 4 – 6
Последующее изучение этиопатогенеза FISS привело к гипотезе о том, что эти опухоли индуцируются вторично по отношению к хроническому и сильному воспалительному ответу на вакцину или инъекцию с конечной злокачественной трансформацией окружающих фибробластов и миофибробласты. 7 , 8 Эта теория подтверждается характерными гистологическими проявлениями FISS, которые включают наличие повышенного количества воспалительных клеток (преимущественно лимфоцитов), многоядерных гигантских клеток, центральных областей некроза и, в некоторых случаях, серовато-голубой материал внутри макрофагов, соответствующий адъюванту вакцины на основе алюминия. 1 , 3 , 7 , , 10 , в то время как точная причина и следствие не было полностью выяснено, было широко теоретизировано, что индивидуальная причина и следствие не были полностью выяснены, было широко теоретизировано, что индивидуальная причина и следствие. установлены и характеристики вакцины (или инъекции) играют роль в развитии этих опухолей. 2 , 7 , 8 , 11 – 13
1 , 3 , 7 , , 10 , в то время как точная причина и следствие не было полностью выяснено, было широко теоретизировано, что индивидуальная причина и следствие не были полностью выяснены, было широко теоретизировано, что индивидуальная причина и следствие. установлены и характеристики вакцины (или инъекции) играют роль в развитии этих опухолей. 2 , 7 , 8 , 11 – 13
Была задокументирована значительная корреляция между вакцинацией против бешенства и/или FeLV вакцинами и развитием FISS. 3 , 11 , 12 Кроме того, было показано, что риск развития FISS увеличивается с увеличением количества вакцин, вводимых на объект. В частности, когда вакцины вводятся в межлопаточную область, риск развития FISS примерно на 50% выше, чем у кошек, не получающих вакцины; этот риск возрастает до >127% и >175% при введении двух и трех-четырех вакцин соответственно.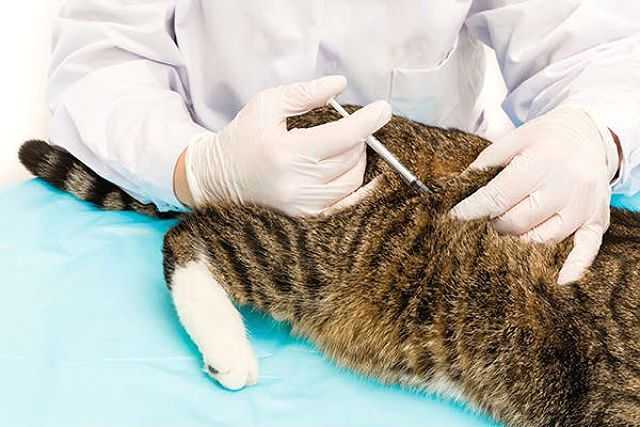 12 В 2003 году были опубликованы результаты проспективного многоцентрового исследования случай-контроль, в котором изучались факторы риска, связанные с развитием FISS. Никакой конкретный тип или производитель вакцины не были замешаны, и факторы, связанные с практикой вакцинации, включая размер иглы, тип шприца, использование многодозовых флаконов с вакциной и смешивание вакцин в одном шприце, по-видимому, не влияли на риск. Фактически температура вакцины была единственным выявленным потенциальным фактором риска, поэтому перед введением вакцины следует нагревать до комнатной температуры. 14 Хотя адъювант на основе алюминия в вакцинах часто обвиняют в содействии развитию FISS, 3 , 15 данное конкретное исследование не подтвердило эту гипотезу. 14 При этом необходимы дополнительные исследования для точного определения конкретных факторов риска развития FISS.
12 В 2003 году были опубликованы результаты проспективного многоцентрового исследования случай-контроль, в котором изучались факторы риска, связанные с развитием FISS. Никакой конкретный тип или производитель вакцины не были замешаны, и факторы, связанные с практикой вакцинации, включая размер иглы, тип шприца, использование многодозовых флаконов с вакциной и смешивание вакцин в одном шприце, по-видимому, не влияли на риск. Фактически температура вакцины была единственным выявленным потенциальным фактором риска, поэтому перед введением вакцины следует нагревать до комнатной температуры. 14 Хотя адъювант на основе алюминия в вакцинах часто обвиняют в содействии развитию FISS, 3 , 15 данное конкретное исследование не подтвердило эту гипотезу. 14 При этом необходимы дополнительные исследования для точного определения конкретных факторов риска развития FISS.
После признания FISS эпидемиологические исследования оценили заболеваемость от 1 на 1000 до 0,63 на 10 000 вакцинированных кошек. 12 , 16 — 18 Вакцины чаще всего связаны с FISS, но другие инъекции и имплантаты, включая стероиды длительного действия и антибиотики, 14 , 1 НЕБОР. 20 , 21 и микрочипы 22 , что привело к изменению названия с вакциноассоциированной саркомы на саркому в месте инъекции. Латентный период между введением вакцины и развитием опухоли составляет от 2 месяцев до 10 лет. 23 , 24
12 , 16 — 18 Вакцины чаще всего связаны с FISS, но другие инъекции и имплантаты, включая стероиды длительного действия и антибиотики, 14 , 1 НЕБОР. 20 , 21 и микрочипы 22 , что привело к изменению названия с вакциноассоциированной саркомы на саркому в месте инъекции. Латентный период между введением вакцины и развитием опухоли составляет от 2 месяцев до 10 лет. 23 , 24
FISS имеют мезенхимальное происхождение. 7 Они являются чрезвычайно локально инвазивными, гораздо более инвазивными, чем их менее распространенные, не связанные с вакциной аналоги саркомы. 11 Сообщаемая частота метастазирования составляет 10-25% с распространенными местами метастазирования, включая легкие и регионарные лимфатические узлы. 17 , 25 – 28 Fibrosarcoma is most commonly diagnosed, but other reported histological types include malignant fibrous histiocytoma, rhabdomyosarcoma, myxosarcoma, liposarcoma, nerve sheath tumor, poorly differentiated sarcomas, and extraskeletal osteosarcoma and chondrosarcoma . 7 , 25 , 29 , 30 По мнению автора, любая саркома, возникающая вблизи любого потенциального места вакцинации или инъекции, должна рассматриваться как агрессивная FISS. В зависимости от места инъекции, угла наклона иглы во время введения и последующего отслеживания вдоль фасциальных плоскостей вакцины или инъецируемого материала саркомы могут возникать в местах, включая (но не ограничиваясь) межлопаточную область, над лопатками или грудная клетка, над бедрами или тазовыми конечностями, а также вдоль каудальной части спины и брюшной полости. 31
7 , 25 , 29 , 30 По мнению автора, любая саркома, возникающая вблизи любого потенциального места вакцинации или инъекции, должна рассматриваться как агрессивная FISS. В зависимости от места инъекции, угла наклона иглы во время введения и последующего отслеживания вдоль фасциальных плоскостей вакцины или инъецируемого материала саркомы могут возникать в местах, включая (но не ограничиваясь) межлопаточную область, над лопатками или грудная клетка, над бедрами или тазовыми конечностями, а также вдоль каудальной части спины и брюшной полости. 31
Когда у кошки обнаруживают подкожное образование, важно учитывать анамнез. Следует отметить историю прививок кошки, местонахождение новообразования, когда оно было впервые замечено, любые изменения в размере и текущий размер новообразования (измеренный штангенциркулем; ). Если FISS даже отдаленно возможен, показания к биопсии основаны на правиле 3-2-1. 13 , 32 , 33 Любое образование, сохраняющееся более 3 месяцев, превышающее 2 см и/или растущее в течение 1 месяца после инъекции в этом месте, настоятельно рекомендуется инцизионная биопсия. Тонкоигольная аспирационная биопсия с цитологическим исследованием является наименее инвазивной и наименее дорогой формой инцизионной биопсии. Хотя это не всегда дает окончательный диагноз FISS, цитология может быть полезна для исключения или исключения других дифференциальных диагнозов, таких как абсцессы. Могут быть рассмотрены альтернативные формы инцизионной биопсии, включая игольчатую, пункционную и клиновидную биопсию. Поскольку FISS представляют собой гетерогенные образования, необходимо собрать несколько образцов из разных областей, чтобы гарантировать окончательный диагноз, особенно при использовании менее инвазивных методов биопсии (например, игольчатой или пункционной биопсии). При выполнении инцизионной биопсии крайне важно контролировать риск обсеменения опухолью путем сведения к минимуму кровотечения и локализации биопсийных путей в пределах будущих полей облучения и/или операционного поля (1).
13 , 32 , 33 Любое образование, сохраняющееся более 3 месяцев, превышающее 2 см и/или растущее в течение 1 месяца после инъекции в этом месте, настоятельно рекомендуется инцизионная биопсия. Тонкоигольная аспирационная биопсия с цитологическим исследованием является наименее инвазивной и наименее дорогой формой инцизионной биопсии. Хотя это не всегда дает окончательный диагноз FISS, цитология может быть полезна для исключения или исключения других дифференциальных диагнозов, таких как абсцессы. Могут быть рассмотрены альтернативные формы инцизионной биопсии, включая игольчатую, пункционную и клиновидную биопсию. Поскольку FISS представляют собой гетерогенные образования, необходимо собрать несколько образцов из разных областей, чтобы гарантировать окончательный диагноз, особенно при использовании менее инвазивных методов биопсии (например, игольчатой или пункционной биопсии). При выполнении инцизионной биопсии крайне важно контролировать риск обсеменения опухолью путем сведения к минимуму кровотечения и локализации биопсийных путей в пределах будущих полей облучения и/или операционного поля (1).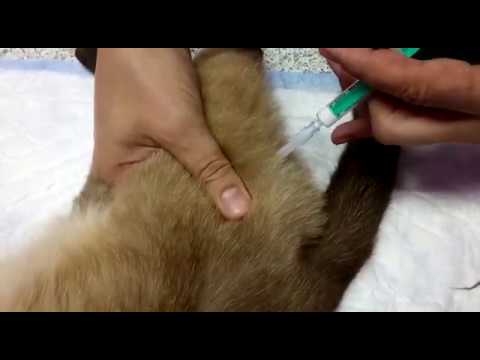 Также следует избегать размещения хирургических дренажей, поскольку они могут контаминироваться опухолевыми клетками и отследить их. При подозрении на FISS эксцизионная биопсия в диагностических целях настоятельно не рекомендуется, так как опухоли быстро и часто рецидивируют при краевом иссечении, что затрудняет будущие попытки лечения. 13 , 23 , 24 , 32 , 33
Также следует избегать размещения хирургических дренажей, поскольку они могут контаминироваться опухолевыми клетками и отследить их. При подозрении на FISS эксцизионная биопсия в диагностических целях настоятельно не рекомендуется, так как опухоли быстро и часто рецидивируют при краевом иссечении, что затрудняет будущие попытки лечения. 13 , 23 , 24 , 32 , 33
Открыть в отдельном окне
Измерение опухолей с узлыми.
Примечания: Из-за размера этого образования (4,4 см) была рекомендована инцизионная биопсия. Фото предоставлено доктором Николь Нортрап.
Открыть в отдельном окне
Инцизионная биопсия FISS.
Примечания: Место биопсии было стратегически расположено таким образом, чтобы оно находилось в пределах будущего облучения и/или хирургических полей. Фото предоставлено доктором Николь Нортрап.
Сокращение: FISS, Саркомы в месте инъекции кошек.
После подтверждения FISS рекомендуется выполнить рентгенографию грудной клетки для выявления признаков легочного метастатического заболевания. Кроме того, расширенная визуализация (чаще всего компьютерная томография, но иногда и магнитно-резонансная томография) рекомендуется для планирования облучения и/или хирургического вмешательства. 23 , 34 Общий анализ крови, биохимический профиль сыворотки, анализ мочи, T4 и тестирование FeLV/вируса кошачьего иммунодефицита (FIV) часто выполняются как часть минимальной базы данных пациента. Однако часто эти тесты являются нормальными или указывают на сопутствующие заболевания, не связанные с FISS. 23 Связь между инфекцией FeLV или FIV и развитием FISS не установлена. 23 , 35
Открыть в отдельном окне
КТ 14-летнего FS DSH с межлопаточной FISS, сразу дорсомедиально к левой лопатке.
Примечание: Фото предоставлено доктором Кристофером Брауэром.
Сокращения: КТ, компьютерная томография; FISS, саркомы в месте инъекций кошек; ДШХ, домашняя короткошерстная.
Хотя широкое или радикальное хирургическое иссечение (определяемое как 3-5 см грубо нормальной ткани во всех направлениях вокруг опухоли и в одной-двух фасциальных плоскостях вглубь от нее) является основным методом устранения макроскопического FISS, излечение остается редкостью. 24 , 25 , 36 , 37 Большинство опухолей рецидивируют локально, особенно при хирургическом лечении, со средней продолжительностью рецидива от > 1 до 2 месяцев. 25 , 37 Рецидивы часто возникают в нескольких местах вдоль операционного рубца, как показано на и . Кошки с опухолями, расположенными достаточно дистально на конечностях или хвостах, где ампутация или гемипельвэктомия приводят к широким микроскопическим хирургическим краям, являются потенциальными кандидатами на успешное лечение только хирургическим путем. 25 , 38 Однако в действительности эти опухоли должны располагаться на уровне или дистальнее скакательного сустава или дистальной трети предплечья или хвоста. Фелпс и др. 36 сообщили о частоте местных рецидивов в 14% у кошек, получавших радикальное иссечение, определяемое как края 5 см и глубина в двух фасциальных плоскостях. Однако эти результаты следует интерпретировать с осторожностью, поскольку более одной трети кошек (35%) были исключены из анализа из-за того, что они были потеряны для последующего наблюдения до документального подтверждения местного рецидива. 36 При хирургическом иссечении края образца должны быть промаркированы или обозначены швом. Весь образец следует надлежащим образом зафиксировать в формалине и отправить единым блоком в коммерческую ветеринарную патологоанатомическую лабораторию для гистопатологического исследования.
25 , 38 Однако в действительности эти опухоли должны располагаться на уровне или дистальнее скакательного сустава или дистальной трети предплечья или хвоста. Фелпс и др. 36 сообщили о частоте местных рецидивов в 14% у кошек, получавших радикальное иссечение, определяемое как края 5 см и глубина в двух фасциальных плоскостях. Однако эти результаты следует интерпретировать с осторожностью, поскольку более одной трети кошек (35%) были исключены из анализа из-за того, что они были потеряны для последующего наблюдения до документального подтверждения местного рецидива. 36 При хирургическом иссечении края образца должны быть промаркированы или обозначены швом. Весь образец следует надлежащим образом зафиксировать в формалине и отправить единым блоком в коммерческую ветеринарную патологоанатомическую лабораторию для гистопатологического исследования.
Открыть в отдельном окне
Повторный рост многоочаговой опухоли после хирургического удаления FISS.
Примечания: Обратите внимание, что по всей длине рубца имеются образования. Фото предоставлено доктором Николь Нортрап.
Сокращение: FISS, Саркомы в месте инъекции кошек.
Открыть в отдельном окне
Повторный рост многоочаговой опухоли с изъязвлением после операции.
Примечания: Обратите внимание, что по всей длине рубца имеются образования. Фото предоставлено доктором Николь Нортрап.
В попытке предотвратить локальный рецидив опухоли или, по крайней мере, продлить безрецидивный период (DFI), часто рекомендуется мультимодальное лечение, включающее хирургическое вмешательство и радикальную лучевую терапию. Протоколы пред- и послеоперационного облучения были описаны с плюсами и минусами обоих. 27 , 39 – 43 При предоперационной доставке всю опухоль плюс широкий край (3–5 см) нормальных тканей вокруг опухоли подвергают лучевой терапии и выполняют хирургическое иссечение 2– 4 недели после завершения протокола облучения. показаны 3D-изображения предоперационного плана облучения кошки, демонстрирующие большое поле ткани, которое необходимо облучить. При этом поля лечения обычно меньше при предоперационном лучевом подходе, подвергая облучению меньше нормальных окружающих тканей. Кроме того, при предоперационной лучевой терапии сохраняется нормальное кровоснабжение опухоли, благодаря чему клетки на периферии хорошо оксигенируются и, следовательно, становятся более радиочувствительными. Минусом этого подхода является повышенный риск расхождения швов послеоперационной раны, поскольку облученная кожа не является нормальной и более склонна к замедленному или нарушенному заживлению. При доставке в послеоперационном периоде весь операционный рубец плюс широкий край (3–5 см) нормальных тканей вокруг рубца обрабатывают после заживления хирургического участка. Преимущество послеоперационной лучевой терапии заключается в том, что операция может быть проведена как можно раньше после постановки диагноза и без дополнительного риска замедленного заживления ран на облученной коже.
показаны 3D-изображения предоперационного плана облучения кошки, демонстрирующие большое поле ткани, которое необходимо облучить. При этом поля лечения обычно меньше при предоперационном лучевом подходе, подвергая облучению меньше нормальных окружающих тканей. Кроме того, при предоперационной лучевой терапии сохраняется нормальное кровоснабжение опухоли, благодаря чему клетки на периферии хорошо оксигенируются и, следовательно, становятся более радиочувствительными. Минусом этого подхода является повышенный риск расхождения швов послеоперационной раны, поскольку облученная кожа не является нормальной и более склонна к замедленному или нарушенному заживлению. При доставке в послеоперационном периоде весь операционный рубец плюс широкий край (3–5 см) нормальных тканей вокруг рубца обрабатывают после заживления хирургического участка. Преимущество послеоперационной лучевой терапии заключается в том, что операция может быть проведена как можно раньше после постановки диагноза и без дополнительного риска замедленного заживления ран на облученной коже. Однако размеры поля облучения, как правило, намного больше, а раковые клетки более гипоксичны из-за нарушения кровоснабжения во время операции. 24 В практике автора предпочтение отдается предоперационной лучевой терапии, в первую очередь из-за меньшего размера поля.
Однако размеры поля облучения, как правило, намного больше, а раковые клетки более гипоксичны из-за нарушения кровоснабжения во время операции. 24 В практике автора предпочтение отдается предоперационной лучевой терапии, в первую очередь из-за меньшего размера поля.
Открыть в отдельном окне
План лучевой терапии для модулированной по интенсивности лучевой терапии у кошки с FISS.
Примечания: (A) Дорсальное 3D-изображение плана облучения для 8-сантиметрового межлопаточного FISS. ( B ) Боковой вид Трехмерное изображение плана облучения для межлопаточного FISS 8 см. Более темный красный цвет обозначает общий объем опухоли (GTV). Более светло-розовый цвет обозначает запланированный объем лечения, который представляет собой GTV плюс 4–5 см нормальной окружающей ткани. Фотографии любезно предоставлены доктором Коичи Нагата.
Сокращение: FISS, Саркомы в месте инъекции кошек.
В большинстве окончательных протоколов лучевой терапии лучевая терапия проводится с понедельника по пятницу в течение нескольких недель до общей лечебной дозы 32–63 Гр.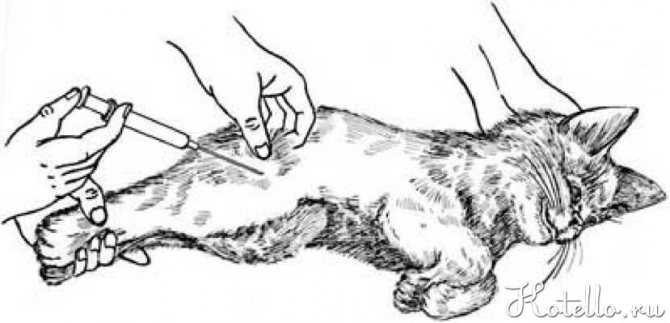 27 , 39 – 42 , 44 Побочные эффекты облучения у кошек обычно легкие и в основном включают сухое шелушение кожи; хотя, как уже упоминалось, возможно замедленное заживление ран. Компьютеризированные планы лучевой терапии и линейные ускорители со встроенными возможностями визуализации все чаще используются при лечении FISS, чтобы помочь свести к минимуму радиационное повреждение окружающих нормальных структур, таких как спинной мозг, легкие, сердце и органы брюшной полости. . Следует отметить, что даже при агрессивном мультимодальном подходе к лечению возможны локальные рецидивы. Кронин и др. 27 сообщили о неэффективности местного лечения в 79% случаев у кошек, получавших радикальную лучевую терапию с последующей операцией. В целом, однако, медиана DFI удлиняется по сравнению с только хирургическим вмешательством и колеблется от 398 до >1000 дней. 27 , 39 – 42 , 44 к повторению.
27 , 39 – 42 , 44 Побочные эффекты облучения у кошек обычно легкие и в основном включают сухое шелушение кожи; хотя, как уже упоминалось, возможно замедленное заживление ран. Компьютеризированные планы лучевой терапии и линейные ускорители со встроенными возможностями визуализации все чаще используются при лечении FISS, чтобы помочь свести к минимуму радиационное повреждение окружающих нормальных структур, таких как спинной мозг, легкие, сердце и органы брюшной полости. . Следует отметить, что даже при агрессивном мультимодальном подходе к лечению возможны локальные рецидивы. Кронин и др. 27 сообщили о неэффективности местного лечения в 79% случаев у кошек, получавших радикальную лучевую терапию с последующей операцией. В целом, однако, медиана DFI удлиняется по сравнению с только хирургическим вмешательством и колеблется от 398 до >1000 дней. 27 , 39 – 42 , 44 к повторению. 27 , 39 – 41
27 , 39 – 41
Меньше известно о роли химиотерапии в лечении FISS. По мнению автора, относительно низкая скорость метастазирования является аргументом против его использования в качестве системной терапии для предотвращения или замедления прогрессирования отдаленного распространения. Однако, поскольку FISS является чрезвычайно локально инвазивным с рецидивами, отмеченными даже в условиях агрессивной лучевой терапии и хирургических протоколов, некоторые онкологи включают химиотерапию в попытке еще больше продлить DFI. Карбоплатин, доксорубицин, липосомальный доксорубицин, циклофосфамид, ифосфамид и ломустин входят в число химиотерапевтических препаратов, о которых сообщается при лечении FISS, с частотой ответа от 0% до > 50%. 41 , 44 – 48 Тем не менее, при тяжелом заболевании немногие из наблюдаемых при химиотерапии ответов являются стойкими. 45 – 48
Местная иммунотерапия также использовалась в качестве дополнения к хирургическому иссечению. Jourdier et al. 49 исследовали генетически аттенуированный вектор вируса коровьей оспы, экспрессирующий человеческий интерлейкин-2 (NYVAC человеческий IL-2), и вектор рекомбинантного вируса оспы канареек, экспрессирующий кошачий интерлейкин-2 (ALVAC feline IL-2), у кошек с фибросаркомой. При таком подходе вирус-переносчик проникает в клетки кошки в непосредственной близости от инъекции; затем эти клетки продуцируют IL-2, вызывая локальный противоопухолевый иммунный ответ. Местная доставка ИЛ-2 снижает риск системной токсичности у пациентов, наблюдаемый при системном введении ИЛ-2. В частности, в исследовании Jourdier кошки были отнесены к одной из трех групп: контрольная, NYVAC, человеческий IL-2, и ALVAC, кошачий IL-2. Всем кошкам было проведено хирургическое иссечение и установка шариков для брахитерапии на основе иридия. Кошкам в группах лечения иммунотерапией впоследствии вводили NYVAC человеческий IL-2 или ALVAC кошачий IL-2 вокруг послеоперационных рубцов. Иммунотерапевтическое лечение хорошо переносилось, отмечалось только самокупирующееся местное воспаление, а частота местных рецидивов в течение 1 года составила 61% [39].
Jourdier et al. 49 исследовали генетически аттенуированный вектор вируса коровьей оспы, экспрессирующий человеческий интерлейкин-2 (NYVAC человеческий IL-2), и вектор рекомбинантного вируса оспы канареек, экспрессирующий кошачий интерлейкин-2 (ALVAC feline IL-2), у кошек с фибросаркомой. При таком подходе вирус-переносчик проникает в клетки кошки в непосредственной близости от инъекции; затем эти клетки продуцируют IL-2, вызывая локальный противоопухолевый иммунный ответ. Местная доставка ИЛ-2 снижает риск системной токсичности у пациентов, наблюдаемый при системном введении ИЛ-2. В частности, в исследовании Jourdier кошки были отнесены к одной из трех групп: контрольная, NYVAC, человеческий IL-2, и ALVAC, кошачий IL-2. Всем кошкам было проведено хирургическое иссечение и установка шариков для брахитерапии на основе иридия. Кошкам в группах лечения иммунотерапией впоследствии вводили NYVAC человеческий IL-2 или ALVAC кошачий IL-2 вокруг послеоперационных рубцов. Иммунотерапевтическое лечение хорошо переносилось, отмечалось только самокупирующееся местное воспаление, а частота местных рецидивов в течение 1 года составила 61% [39].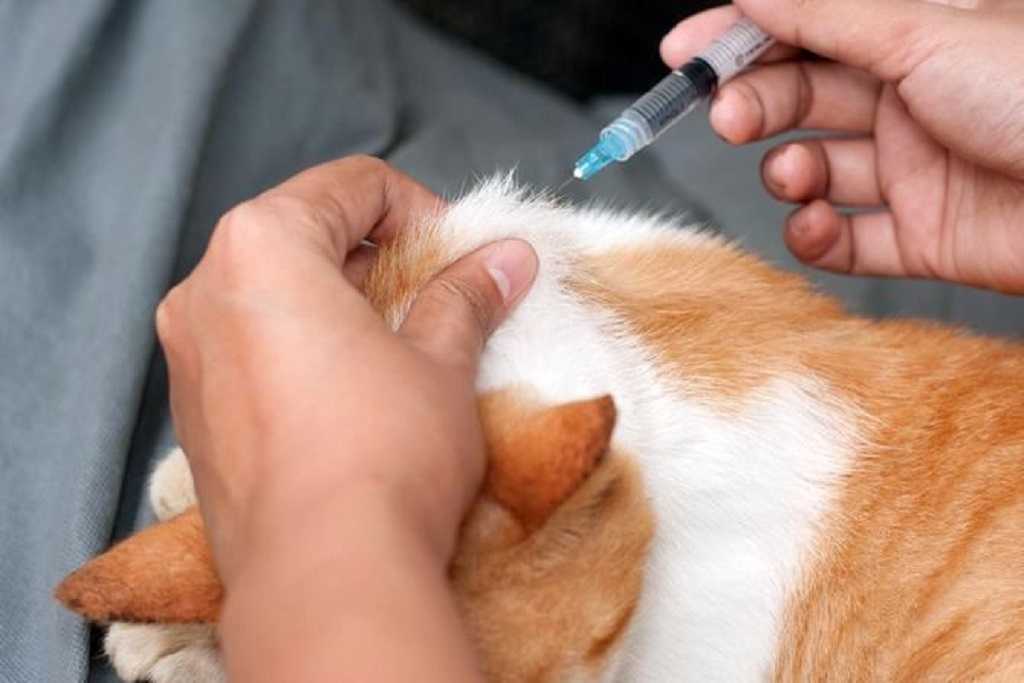 % и 28% наблюдались у контрольных кошек по сравнению с кошками, получавшими человеческий IL-2 NYVAC или кошачий IL-2 ALVAC, соответственно. 49 Более позднее исследование было проведено Jas et al. 50 для дальнейшего изучения безопасности и эффективности иммунотерапии ALVAC IL-2. Опять же, всем кошкам в этом исследовании вырезали опухоли, а затем лечили брахитерапией на основе иридия. Кошки были рандомизированы в одну из следующих групп: контрольная, получавшая низкие дозы ALVAC IL-2 или высокие дозы ALVAC IL-2. Никаких различий в DFI между группами, получавшими низкие и высокие дозы, не наблюдалось. Значительное снижение DFI наблюдалось у леченных кошек по сравнению с контрольной группой. Медиана DFI у леченных кошек не была достигнута (>730 дней), тогда как медиана DFI у контрольных кошек составила 287 дней (9).0106 P =0,046). Лечение хорошо переносилось, и не было отмечено различий в степени токсичности между группами с низкими и высокими дозами. 50 В 2014 году в Европе была выпущена иммунотерапия кошачьим IL-2 ALVAC в качестве адъювантной терапии после хирургического вмешательства для снижения риска локального рецидива опухоли у кошек с фибросаркомой (Merial SAS, Лион, Франция).
% и 28% наблюдались у контрольных кошек по сравнению с кошками, получавшими человеческий IL-2 NYVAC или кошачий IL-2 ALVAC, соответственно. 49 Более позднее исследование было проведено Jas et al. 50 для дальнейшего изучения безопасности и эффективности иммунотерапии ALVAC IL-2. Опять же, всем кошкам в этом исследовании вырезали опухоли, а затем лечили брахитерапией на основе иридия. Кошки были рандомизированы в одну из следующих групп: контрольная, получавшая низкие дозы ALVAC IL-2 или высокие дозы ALVAC IL-2. Никаких различий в DFI между группами, получавшими низкие и высокие дозы, не наблюдалось. Значительное снижение DFI наблюдалось у леченных кошек по сравнению с контрольной группой. Медиана DFI у леченных кошек не была достигнута (>730 дней), тогда как медиана DFI у контрольных кошек составила 287 дней (9).0106 P =0,046). Лечение хорошо переносилось, и не было отмечено различий в степени токсичности между группами с низкими и высокими дозами. 50 В 2014 году в Европе была выпущена иммунотерапия кошачьим IL-2 ALVAC в качестве адъювантной терапии после хирургического вмешательства для снижения риска локального рецидива опухоли у кошек с фибросаркомой (Merial SAS, Лион, Франция). ALVAC feline IL-2 впоследствии был условно лицензирован Министерством сельского хозяйства США (USDA) в 2015 году (Merial Inc., Дулут, Джорджия, США). Показания к лечению включают кошек с фибросаркомой (диаметром 2–5 см) без признаков узлового или отдаленного метастазирования. Дополнительные исследования безопасности и эффективности ALVAC IL-2 продолжаются.
ALVAC feline IL-2 впоследствии был условно лицензирован Министерством сельского хозяйства США (USDA) в 2015 году (Merial Inc., Дулут, Джорджия, США). Показания к лечению включают кошек с фибросаркомой (диаметром 2–5 см) без признаков узлового или отдаленного метастазирования. Дополнительные исследования безопасности и эффективности ALVAC IL-2 продолжаются.
Большинство выявленных прогностических факторов связаны с локальным рецидивом опухоли. По мнению автора, это логично, так как неэффективность местного лечения, приводящая к гуманной эвтаназии, является наиболее частой причиной смерти кошек с FISS. По мере того, как первичная опухоль становится больше и начинает растягивать покрывающую кожу и проникать в подлежащие ткани, изъязвление кожи, боль, постоянное кровотечение, инфекция и некроз негативно влияют на качество жизни кошки, как показано на рис. Одним из распространенных предикторов местного рецидива является полнота хирургического иссечения (т. е. чистые края). Хотя это особенно верно для кошек, которых лечили только хирургическим путем, 25 , 37 неполные края после мультимодального лечения также были связаны с более коротким DFI. 27 , 39 – 41
27 , 39 – 41
Количество предшествующих операций также было обратно пропорционально времени до местного рецидива; по мере увеличения числа хирургических попыток локальный DFI обычно уменьшается. 37 , 39 Этот вывод соответствует принципу, согласно которому первая попытка удаления опухоли является наиболее успешной. До первого иссечения окружающая анатомия все еще остается относительно нормальной, и с каждым последующим рецидивом опухоли и попыткой удаления количество ткани для закрытия становится меньше, что делает невозможным иссечение с чистыми краями. 51 Также согласуются с этим выводом результаты исследования Hershey et al, 25 , в котором установлено, что среднее время до первого рецидива (TFR) было значительно больше у кошек с опухолями, удаленными в специализированном учреждении, по сравнению с удаленными. в условиях общей практики (медиана СКР составила 274 дня против 66 дней соответственно). Это исследование, 25 , как и исследование Phelps et al, 36 , пришло к выводу, что радикальное первое иссечение необходимо для увеличения времени до рецидива.
Это исследование, 25 , как и исследование Phelps et al, 36 , пришло к выводу, что радикальное первое иссечение необходимо для увеличения времени до рецидива.
Одно исследование пришло к выводу, что гистологический тип в значительной степени связан с общей выживаемостью. Кошки с фибросаркомой или опухолью оболочки нерва имели значительно более длительное время выживания по сравнению с кошками со злокачественными фиброзными гистиоцитомами. Зарегистрированное среднее время выживания составило 640 дней против 645 дней против 290 дней соответственно. 30
Гистологическая степень, определяемая митотическим индексом, процентом некроза и степенью плеоморфизма, была связана с вероятностью отдаленных метастазов у собак с саркомами мягких тканей, 52 и аналогичная тенденция отмечена у кошек. Кошки с более высокой степенью FISS, по-видимому, более склонны к развитию метастазов, и одно исследование также продемонстрировало, что кошки с метастазами имели более короткое общее время выживания.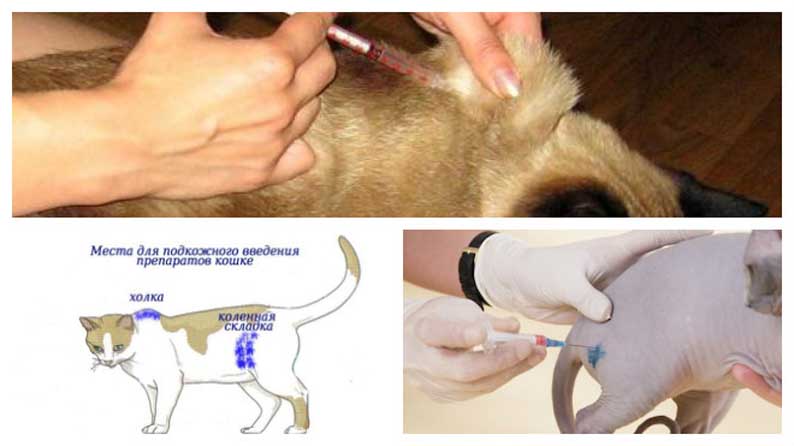 26 Следует признать, что FISS, как правило, более митотически активны, имеют повышенный процент некроза и большую степень плеоморфизма, 10 , что позволяет предположить, что применение схемы классификации сарком мягких тканей собак 52 к FISS может привести к более высокое сообщение об опухолях высокой степени злокачественности. 9 По мнению автора, необходимы дальнейшие исследования для полного выяснения роли гистологической степени в лечении FISS.
26 Следует признать, что FISS, как правило, более митотически активны, имеют повышенный процент некроза и большую степень плеоморфизма, 10 , что позволяет предположить, что применение схемы классификации сарком мягких тканей собак 52 к FISS может привести к более высокое сообщение об опухолях высокой степени злокачественности. 9 По мнению автора, необходимы дальнейшие исследования для полного выяснения роли гистологической степени в лечении FISS.
В 1996 г. была сформирована Целевая группа по вакциноассоциированной саркоме кошек (VAFST), целью которой было предложить изменения в протоколы вакцинации для снижения риска FISS и содействия исследованиям FISS. В 1998 году Американская ассоциация кошачьих врачей (AAFP) создала Консультативную группу по вакцинации кошек для разработки рекомендаций по соответствующим протоколам вакцинации на основе индивидуальной оценки риска. Эти и другие группы, включая Европейский консультативный совет по болезням кошек (ABCD) и Всемирную ветеринарную ассоциацию мелких животных (WSAVA), признают ценность и важность вакцин для профилактики инфекционных заболеваний кошек и сформулировали рекомендации по минимизации риска FISS. развития у кошек. Их рекомендации также направлены на раннее выявление и повышение эффективности лечения FISS. 13 , 33 , 53 – 58
развития у кошек. Их рекомендации также направлены на раннее выявление и повышение эффективности лечения FISS. 13 , 33 , 53 – 58
Различие между базовыми и дополнительными вакцинами. Основные вакцины рекомендуются для всех кошек и включают кошачью панлейкопению (FPV), кошачий герпесвирус-1 (FHV-1), кошачий калицивирус (FCV) и бешенство в эндемичных районах или там, где это требуется по закону. Дополнительные вакцины, в том числе FeLV, FIV, Chlamydophila felis, Bordetella bronchiseptica , кошачий инфекционный перитонит (FIP) и вакцины против дерматофитов, следует вводить на основе индивидуальной оценки риска/пользы. Переменные риска, которые следует учитывать при составлении индивидуального протокола вакцинации кошки, включают возраст, образ жизни и окружающую среду, и кошек следует вакцинировать только так часто, как это необходимо для поддержания защиты от инфекционных агентов, которым у них есть реальный риск воздействия. Соблюдение этих рекомендаций позволяет избежать ненужной вакцинации кошек. 56 , 57
Соблюдение этих рекомендаций позволяет избежать ненужной вакцинации кошек. 56 , 57
Также предлагается введение вакцины подкожно (вместо внутримышечного) и в рекомендуемых местах вакцинации. Подкожное введение позволяет более раннее и легкое обнаружение любых комков, которые могут развиться после вакцинации. Рекомендуемые места вакцинации: ниже правого локтя для вакцин против FPV, FHV-1 и FCV, ниже правого колена для вакцин против бешенства и ниже левого колена для вакцин против FeLV. В качестве альтернативы вакцинация в хвост была продемонстрирована как хорошо переносимая и эффективная. 38 Хотя соблюдение этих рекомендаций не снижает вероятность развития FISS, кошки с опухолями, расположенными дистально на конечностях или хвосте, могут быть отличными кандидатами на ампутацию и, следовательно, на полное хирургическое иссечение. Вакцинация между лопатками и еще более проксимально на конечностях категорически не рекомендуется, поскольку полное хирургическое иссечение FISS в этих местах практически невозможно. 56 – 58
56 – 58
Поскольку предполагается связь между хроническим воспалением и развитием FISS, следует также учитывать тип вакцины. Следует признать, что роль адъювантов в этиологии FISS остается неясной. Однако, поскольку адъюванты используются для усиления иммунной реакции, некоторые эксперты предлагают избегать адъювантных вакцин у кошек. 56 – 58
Наконец, хотя FISS является редким осложнением вакцинации у кошек, важно информировать владельцев об этом риске, чтобы они могли внимательно следить за своими кошками после введения вакцины. Раннее выявление является ключевым фактором успеха лечения. Также рекомендуется точное ведение медицинских карт отдельных пациентов. Документированная информация должна включать: 1) рекомендуемые вакцины; 2) дата введения; 3) имя лица, вводящего вакцину; 4) название вакцины, номер партии или серии, срок годности и производитель; 5) место и способ введения; 6) сопутствующие лекарства и/или терапия; и 7) рекомендации по будущим прививкам. В настоящее время некоторые производители вакцин готовы предоставить средства для компенсации стоимости лечения кошек с FISS. Отличное ведение учета и документация со стороны ветеринара, несомненно, полезны в получении этих средств. 57
В настоящее время некоторые производители вакцин готовы предоставить средства для компенсации стоимости лечения кошек с FISS. Отличное ведение учета и документация со стороны ветеринара, несомненно, полезны в получении этих средств. 57
Раскрытие информации
Доктор Саба принимал активное участие в клинических испытаниях по оценке безопасности и эффективности ALVAC IL-2 у кошек с фибросаркомой совместно с Merial Inc., Дулут, Джорджия, США. Автор сообщает об отсутствии других конфликтов интересов в этой работе.
1. Хендрик М.Дж., Дунаган, Калифорния. Очаговый некротизирующий гранулематозный панникулит, связанный с подкожной инъекцией антирабической вакцины у кошек и собак: 10 случаев (1988–1989 гг.) J Am Vet Med Assoc. 1991;198(2):304–305. [PubMed] [Google Scholar]
2. Hendrick MJ, Goldschmidt MH. Вызывают ли реакции в месте инъекции фибросаркомы у кошек? J Am Vet Med Assoc. 1991;199(8):968. [PubMed] [Google Scholar]
3. Hendrick MJ, Goldschmidt MH, Shofer FS, Wang YY, Somlyo AP. Поствакцинальные саркомы у кошек: эпидемиология и электронно-зондовая микроаналитическая идентификация алюминия. Рак Рез. 1992;52(19):5391–5394. [PubMed] [Google Scholar]
Hendrick MJ, Goldschmidt MH, Shofer FS, Wang YY, Somlyo AP. Поствакцинальные саркомы у кошек: эпидемиология и электронно-зондовая микроаналитическая идентификация алюминия. Рак Рез. 1992;52(19):5391–5394. [PubMed] [Google Scholar]
4. Бертон Г., Мейсон К.В. Встречаются ли поствакцинальные саркомы у австралийских кошек? Ауст Вет Дж. 1997;75(2):102–106. [PubMed] [Google Scholar]
5. Дин Р.С., Пфайффер Д.У., Адамс В.Дж. Заболеваемость саркомой в месте инъекции у кошек в Соединенном Королевстве. BMC Vet Res. 2013;9:17. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Martano M, Morello E, Ughetto M, et al. Только хирургическое вмешательство в сравнении с хирургическим вмешательством и доксорубицином для лечения кошачьих сарком в месте инъекции: отчет о 69 случаях. Вет Дж. 2005;170(1):84–90. [PubMed] [Google Scholar]
7. Hendrick MJ, Brooks JJ. Поствакцинальные саркомы у кошек: гистология и иммуногистохимия. Вет Патол. 1994;31(1):126–129. [PubMed] [Google Scholar]
8. Хендрик М.Дж. Кошачьи вакциноассоциированные саркомы. Рак Инвест. 1999;17(4):273–277. [PubMed] [Google Scholar]
Хендрик М.Дж. Кошачьи вакциноассоциированные саркомы. Рак Инвест. 1999;17(4):273–277. [PubMed] [Google Scholar]
9. Couto SS, Griffey SM, Duarte PC, Madewell BR. Вакциноассоциированная фибросаркома кошек: морфологические различия. Вет Патол. 2002;39(1):33–41. [PubMed] [Google Scholar]
10. Додди Ф.Д., Гликман Л.Т., Гликман Н.В., Яновиц Э.Б. Фибросаркомы кошек в местах вакцинации и невакцинированных местах. J Комп Патол. 1996;114(2):165–174. [PubMed] [Google Scholar]
11. Hendrick MJ, Shofer FS, Goldschmidt MH, et al. Сравнение фибросарком, которые развились в местах вакцинации и в местах, где вакцинация не проводилась у кошек: 239 случаев (1991–1992 гг.) J Am Vet Med Assoc. 1994;205(10):1425–1429. [PubMed] [Google Scholar]
12. Kass PH, Barnes WG, Jr, Spangler WL, Chomel BB, Culbertson MR. Эпидемиологические доказательства причинно-следственной связи между вакцинацией и онкогенезом фибросаркомы у кошек. J Am Vet Med Assoc. 1993;203(3):396–405. [PubMed] [Google Scholar]
13. Целевая группа по вакциноассоциированной саркоме кошек Современное понимание и лечение вакциноассоциированной саркомы у кошек. J Am Vet Med Assoc. 2005; 226(11):1821–1842. [PubMed] [Google Scholar]
Целевая группа по вакциноассоциированной саркоме кошек Современное понимание и лечение вакциноассоциированной саркомы у кошек. J Am Vet Med Assoc. 2005; 226(11):1821–1842. [PubMed] [Google Scholar]
14. Kass PH, Spangler WL, Hendrick MJ, et al. Многоцентровое исследование «случай-контроль» факторов риска, связанных с развитием вакциноассоциированных сарком у кошек. J Am Vet Med Assoc. 2003;223(9):1283–1292. [PubMed] [Академия Google]
15. Мэйси Д.У. Адъюванты вакцин. Semin Vet Med Surg (Small Anim) 1997;12(3):206–211. [PubMed] [Google Scholar]
16. Macy DW, Hendrick MJ. Потенциальная роль воспаления в развитии поствакцинальных сарком у кошек. Ветеринарная клиника North Am Small Anim Pract. 1996;26(1):103–109. [PubMed] [Google Scholar]
17. Лестер С., Клеметт Т., Берт А. Саркомы, связанные с местом вакцинации у кошек: клинический опыт и лабораторный обзор (1982–1993) J Am Anim Hosp Assoc. 1996;32(2):91–95. [PubMed] [Google Scholar]
18. Gobar GM, Kass PH.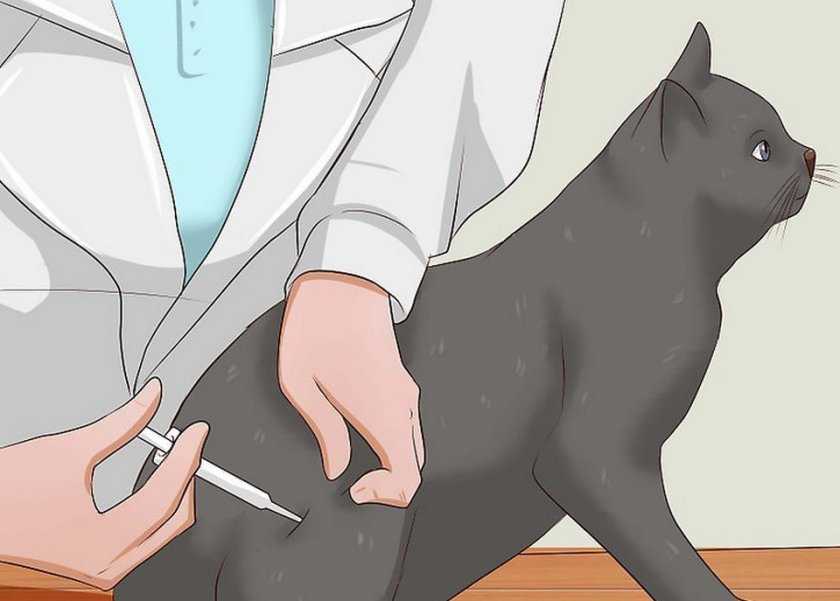 Всемирный веб-обзор методов вакцинации, поствакцинальных реакций и сарком, связанных с местом введения вакцины, у кошек. J Am Vet Med Assoc. 2002; 220(10):1477–1482. [PubMed] [Google Scholar]
Всемирный веб-обзор методов вакцинации, поствакцинальных реакций и сарком, связанных с местом введения вакцины, у кошек. J Am Vet Med Assoc. 2002; 220(10):1477–1482. [PubMed] [Google Scholar]
19. Сривастав А., Касс П.Х., Макгилл Л.Д., Фарвер Т.Б., Кент М.С. Сравнительный риск саркомы в месте инъекции у кошек, связанный с вакциной и другими инъекционными препаратами. J Am Vet Med Assoc. 2012;241(5):595–602. [PubMed] [Академия Google]
20. Буракко П., Мартано М., Морелло Э., Ратто А. Вакциноассоциированная фибросаркома на месте глубокого нерассасывающегося шва у кошки. Вет Дж. 2002;163(1):105–107. [PubMed] [Google Scholar]
21. Carminato A, Vascellari M, Marchioro W, Melchiotti E, Mutinelli F. Микрочип-ассоциированная фибросаркома у кошки. Вет Дерматол. 2011;22(6):565–569. [PubMed] [Google Scholar]
22. Daly MK, Saba CF, Crochik SS, et al. Фибросаркома рядом с местом имплантации микрочипа у кошки. J Feline Med Surg. 2008;10(2):202–205. [PubMed] [Академия Google]
23. McEntee MC, Page RL. Кошачьи вакциноассоциированные саркомы. J Vet Intern Med. 2001;15(3):176–182. [PubMed] [Google Scholar]
McEntee MC, Page RL. Кошачьи вакциноассоциированные саркомы. J Vet Intern Med. 2001;15(3):176–182. [PubMed] [Google Scholar]
24. Seguin B. Саркомы в месте инъекции у кошек. Ветеринарная клиника North Am Small Anim Pract. 2002;32(4):983–95. VIII. [PubMed] [Google Scholar]
25. Hershey AE, Sorenmo KU, Hendrick MJ, Shofer FS, Vail DM. Прогноз при предполагаемой кошачьей вакциноассоциированной саркоме после иссечения: 61 случай (1986–1996) J Am Vet Med Assoc. 2000;216(1):58–61. [PubMed] [Академия Google]
26. Romanelli G, Marconato L, Olivero D, Massari F, Zini E. Анализ прогностических факторов, связанных с саркомами в месте инъекции у кошек: 57 случаев (2001–2007 гг.) J Am Vet Med Assoc. 2008;232(8):1193–1199. [PubMed] [Google Scholar]
27. Cronin K, Page RL, Spodnick G, et al. Лучевая терапия и операция по поводу фибросаркомы у 33 кошек. Ветеринар Радиол Ультразвук. 1998;39(1):51–56. [PubMed] [Google Scholar]
28. Hauck M. Саркомы в месте инъекции у кошек.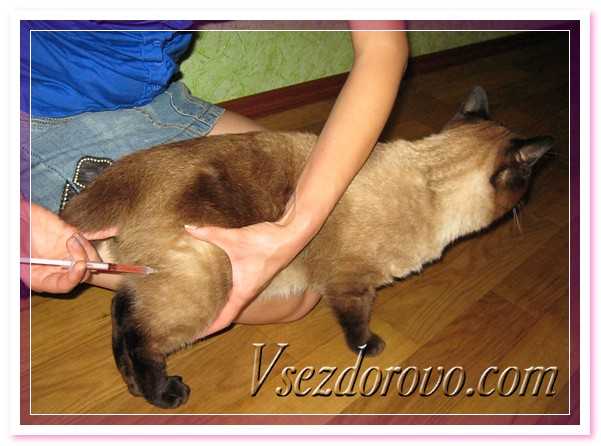 Ветеринарная клиника North Am Small Anim Pract. 2003;33(3):553–7. vii. [PubMed] [Академия Google]
Ветеринарная клиника North Am Small Anim Pract. 2003;33(3):553–7. vii. [PubMed] [Академия Google]
29. Эсплин Д.Г., Макгилл Л.Д., Майнингер А.С., Уилсон С.Р. Поствакцинальные саркомы у кошек. J Am Vet Med Assoc. 1993;202(8):1245–1247. [PubMed] [Google Scholar]
30. Dillon CJ, Mauldin GN, Baer KE. Исход после хирургического удаления невисцеральных сарком мягких тканей у кошек: 42 случая (1992–2000 гг.) J Am Vet Med Assoc. 2005; 227(12):1955–1957. [PubMed] [Google Scholar]
31. Shaw SC, Kent MS, Gordon IK, et al. Временные изменения характеристик сарком в месте инъекции у кошек: 392 случая (1990–2006 гг.) J Am Vet Med Assoc. 2009;234(3):376–380. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Руководство Целевой группы по вакциноассоциированной саркоме кошек. Диагностика и лечение подозрений на саркомы. J Am Vet Med Assoc. 1999; 214(12):1745. Авторы не указаны. [PubMed] [Google Scholar]
33. Моррисон В.Б., Старр Р.М. Вакциноассоциированные саркомы кошек. J Am Vet Med Assoc. 2001;218(5):697–702. [PubMed] [Google Scholar]
J Am Vet Med Assoc. 2001;218(5):697–702. [PubMed] [Google Scholar]
34. Rousset N, Holmes MA, Caine A, Dobson J, Herrtage ME. Клинические и низкопольные МРТ-характеристики саркомы в месте инъекции у 19 пациентов.кошки. Ветеринар Радиол Ультразвук. 2013;54(6):623–629. [PubMed] [Google Scholar]
35. Почки Б.А., Эллис Дж.А., Хейнс Д.М., Джексон М.Л. Оценка фиксированных формалином и залитых в парафин тканей, полученных из вакцинных сарком кошек, на наличие ДНК вируса иммунодефицита кошек. Am J Vet Res. 2000;61(9):1037–1041. [PubMed] [Google Scholar]
36. Фелпс Х.А., Кунц К.А., Милнер Р.Дж., Пауэрс Б.Е., Бэкон Н.Дж. Радикальное иссечение с 5-сантиметровыми полями для лечения сарком в месте инъекции у кошек: 91 случай (1998–2002 гг.) J Am Vet Med Assoc. 2011;239(1):97–106. [PubMed] [Google Scholar]
37. Davidson EB, Gregory CR, Kass PH. Хирургическое иссечение фибросарком мягких тканей у кошек. Вет сург. 1997;26(4):265–269. [PubMed] [Google Scholar]
38. Hendricks CG, Levy JK, Tucker SJ, et al. Вакцинация хвоста у кошек: пилотное исследование. J Feline Med Surg. 2014;16(4):275–280. [PubMed] [Google Scholar]
Hendricks CG, Levy JK, Tucker SJ, et al. Вакцинация хвоста у кошек: пилотное исследование. J Feline Med Surg. 2014;16(4):275–280. [PubMed] [Google Scholar]
39. Cohen M, Wright JC, Brawner WR, Smith AN, Henderson R, Behrend EN. Использование хирургии и облучения электронным пучком с химиотерапией или без нее для лечения вакциноассоциированных сарком у кошек: 78 случаев (1996–2000) J Am Vet Med Assoc. 2001; 219(11):1582–1589. [PubMed] [Google Scholar]
40. Bregazzi VS, LaRue SM, McNiel E, et al. Лечение комбинацией доксорубицина, хирургического вмешательства и лучевой терапии по сравнению с хирургическим вмешательством и только лучевой терапией для кошек с вакциноассоциированными саркомами: 25 случаев (1995–2000 гг.) J Am Vet Med Assoc. 2001;218(4):547–550. [PubMed] [Google Scholar]
41. Kobayashi T, Hauck ML, Dodge R, et al. Предоперационная лучевая терапия вакциноассоциированной саркомы у 92 кошек. Ветеринар Радиол Ультразвук. 2002; 43(5):473–479.. [PubMed] [Google Scholar]
42. Хан К.А., Эндикотт М.М., Кинг Г.К., Харрис-Кинг Ф.Д. Оценка лучевой терапии отдельно или в сочетании с химиотерапией доксорубицином для лечения кошек с неполностью удаленными саркомами мягких тканей: 71 случай (1989–1999) J Am Vet Med Assoc. 2007;231(5):742–745. [PubMed] [Google Scholar]
Хан К.А., Эндикотт М.М., Кинг Г.К., Харрис-Кинг Ф.Д. Оценка лучевой терапии отдельно или в сочетании с химиотерапией доксорубицином для лечения кошек с неполностью удаленными саркомами мягких тканей: 71 случай (1989–1999) J Am Vet Med Assoc. 2007;231(5):742–745. [PubMed] [Google Scholar]
43. McLeod DA, Thrall DE. Сочетание хирургии и лучевой терапии в лечении рака. Обзор. Вет сург. 1989;18(1):1–6. [PubMed] [Академия Google]
44. Экштейн С., Гушетти Ф., Роос М., Мартин де лас Мулас Дж., Казер-Хотц Б., Рорер Блей С. Ретроспективный анализ лучевой терапии для лечения кошачьей вакциноассоциированной саркомы. Вет Комп Онкол. 2009;7(1):54–68. [PubMed] [Google Scholar]
45. Барбер Л.Г., Соренмо К.Ю., Кронин К.Л., Шофер Ф.С. Комбинированная химиотерапия доксорубицином и циклофосфамидом при неоперабельной фибросаркоме кошек. J Am Anim Hosp Assoc. 2000;36(5):416–421. [PubMed] [Google Scholar]
46. Saba CF, Vail DM, Thamm DH. Клиническая оценка фазы II химиотерапии ломустином для кошачьей вакциноассоциированной саркомы. Вет Комп Онкол. 2012;10(4):283–29.1. [PubMed] [Google Scholar]
Вет Комп Онкол. 2012;10(4):283–29.1. [PubMed] [Google Scholar]
47. Poirier VJ, Thamm DH, Kurzman ID, et al. Инкапсулированный в липосомы доксорубицин (Доксил) и доксорубицин в лечении вакциноассоциированной саркомы у кошек. J Vet Intern Med. 2002;16(6):726–731. [PubMed] [Google Scholar]
48. Rassnick KM, Moore AS, Northrup NC, et al. Испытание фазы I и фармакокинетический анализ ифосфамида у кошек с саркомами. Am J Vet Res. 2006;67(3):510–516. [PubMed] [Google Scholar]
49. Jourdier TM, Moste C, Bonnet MC, et al. Локальная иммунотерапия спонтанных фибросарком кошек с использованием рекомбинантных поксвирусов, экспрессирующих интерлейкин 2 (IL2) Gene Ther. 2003;10(26):2126–2132. [PubMed] [Академия Google]
50. Jas D, Soyer C, De Fornel-Thibaud P, et al. Адъювантная иммунотерапия сарком в месте инъекции у кошек рекомбинантным вирусом оспы канареек, экспрессирующим кошачий интерлейкин-2, оценивалась в контролируемом моноцентрическом клиническом исследовании при использовании в сочетании с хирургией и брахитерапией.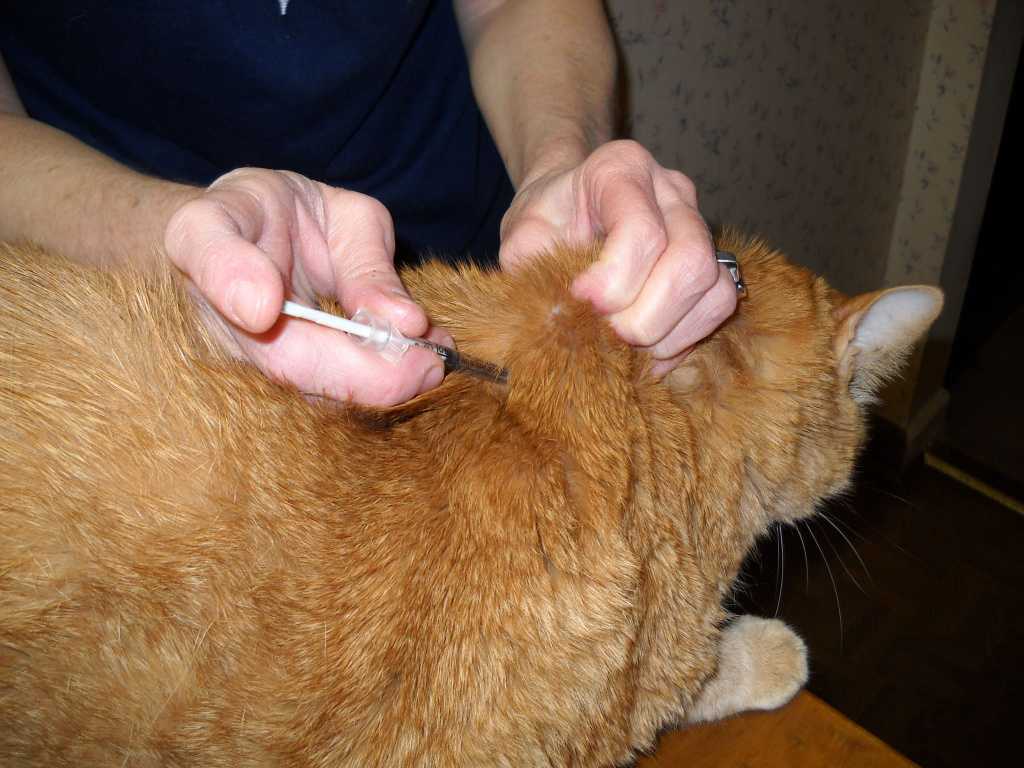 Испытания Вакцинол. 2015; 4:1–8. [Google Scholar]
Испытания Вакцинол. 2015; 4:1–8. [Google Scholar]
51. Farese JP, Withrow SJ. Хирургическая онкология. В: Withrow SJ, Vail DM, Page RL, редакторы. Клиническая онкология мелких животных. 5-е изд. Сент-Луис: Эльзевир; 2013. С. 149.–150. [Google Scholar]
52. Kuntz CA, Dernell WS, Powers BE, Devitt C, Straw RC, Withrow SJ. Прогностические факторы хирургического лечения сарком мягких тканей у собак: 75 случаев (1986-1996 гг.) J Am Vet Med Assoc. 1997;211(9):1147–1151. [PubMed] [Google Scholar]
53. Romatowski J. Рекомендации Целевой группы по вакциноассоциированной саркоме кошек. J Am Vet Med Assoc. 1997; 210(7):890. [PubMed] [Google Scholar]
54. Старр Р.М. Целевая группа по вакциноассоциированной саркоме кошек: новая модель решения проблем в ветеринарии. J Am Vet Med Assoc. 1998;213(10):1428–1429. [PubMed] [Google Scholar]
55. Elston T, Rodan H, Flemming D, et al. Отчет Американской ассоциации кошачьих врачей и Консультативной группы Академии кошачьей медицины за 1998 год по кошачьим вакцинам. J Am Vet Med Assoc. 1998;212(2):227–241. [PubMed] [Google Scholar]
J Am Vet Med Assoc. 1998;212(2):227–241. [PubMed] [Google Scholar]
56. Richards JR, Elston TH, Ford RB, et al. Отчет Консультативной группы по вакцинам против кошек Американской ассоциации практикующих врачей-фелинологов за 2006 год. J Am Vet Med Assoc. 2006;229(9):1405–1441. [PubMed] [Академия Google]
57. Шерк М.А., Форд Р.Б., Гаскелл Р.М. и соавт. Отчет Консультативной группы по вакцинации кошек AAFP. J Feline Med Surg. 2013;15(9):785–808. [PubMed] [Google Scholar]
58. Хартманн К., Дэй М.Дж., Тири Э. и др. Европейский консультативный совет по болезням кошек Саркома в месте инъекции у кошек: рекомендации ABCD по профилактике и лечению. J Feline Med Surg. 2015;17(7):606–613. [PubMed] [Google Scholar]
Подкожные жидкости для кошек — VetRxDirect BlogVetRxDirect Blog
Опубликовано Уэс Хепкер
Кошачья почечная недостаточность и жидкости для инъекций
Кошки могут быть предрасположены к почечному заболеванию, которое в конечном итоге может привести к почечной недостаточности, когда почки перестают функционировать должным образом. Во многих случаях этот диагноз требует введения вашей кошке жидкости для инъекций, чтобы предотвратить обезвоживание и помочь почкам. К счастью, жидкости часто необходимы только несколько раз в неделю. Процесс инъекции вашей кошке может показаться пугающим, и мы полностью понимаем любые опасения. Эта статья от VetRxDirect призвана помочь вам пройти эти сложные процедуры.
Во многих случаях этот диагноз требует введения вашей кошке жидкости для инъекций, чтобы предотвратить обезвоживание и помочь почкам. К счастью, жидкости часто необходимы только несколько раз в неделю. Процесс инъекции вашей кошке может показаться пугающим, и мы полностью понимаем любые опасения. Эта статья от VetRxDirect призвана помочь вам пройти эти сложные процедуры.
Подкожные жидкости для кошек Принадлежности и терминология:
- Игла: Игла представляет собой металлическое устройство, используемое для прокалывания кожи и введения жидкости. У него есть основание, называемое ступицей, которое навинчивается или надевается на шприц, содержащий жидкости. Скос иглы – это отверстие на самом ее кончике, которое прокалывает кожу. Иглы различаются по длине и калибру, который измеряет толщину иглы и ее отверстие. Измерение манометра может показаться обратным, потому что чем меньше номер манометра, тем больше отверстие иглы.
- Шприц: Шприц представляет собой пластиковое устройство, используемое для забора и введения жидкости в кошку.
 Основание шприца называется цилиндром, а поршень — это часть, которая перемещается внутри цилиндра, всасывая жидкости и выталкивая их наружу. Наконечник — это самая верхняя часть шприца, к которой будет крепиться игла.
Основание шприца называется цилиндром, а поршень — это часть, которая перемещается внутри цилиндра, всасывая жидкости и выталкивая их наружу. Наконечник — это самая верхняя часть шприца, к которой будет крепиться игла. - Пакет для жидкости: Жидкости, которые вы будете вводить своей кошке, скорее всего, поставляются в пластиковых литровых пакетах. Существует несколько типов жидкостей, таких как плазмалит, физиологический раствор и раствор Рингера с лактатом. На мешках для жидкости есть два порта: один — это выходной порт, куда вы можете вставить линии для введения жидкостей, а другой — это точка инъекции, где вы можете набирать жидкости с помощью иглы и шприца.
- Набор растворов: Некоторые ветеринары могут потребовать, чтобы вы использовали линию от мешка к кошке для введения жидкости, называемую набором растворов. В VetRxDirect у нас есть линия Venoset для внутривенного введения (внутривенная), которая также подходит для подкожного введения жидкости.
 Линия позволяет вводить жидкости медленно и может быть полезна для больших объемов.
Линия позволяет вводить жидкости медленно и может быть полезна для больших объемов.
Детали набора растворов следующие: сверху вниз: пластиковый белый штифт наверху используется для входа в мешок с жидкостью. Капельница — это место, где капли формируются до того, как они попадут в роликовый зажим, который представляет собой пластиковую деталь с роликом, который может двигаться вверх и вниз, чтобы остановить или запустить поток жидкости. Это также контролирует, насколько быстро жидкость будет поступать к вашей кошке. Затем, после всех трубок, вы найдете порт для инъекций, куда будет помещена игла для введения жидкости вашей кошке.
Ниже приведены диаграммы, которые я создал, чтобы помочь вам пройти через различные части стерильных продуктов:Иглу и шприц
СТАВИТЕЛЬНОСТЬ И СПОЛЕНИЕ СТАВИТЬ
999444ST STER. введение подкожных жидкостей для кошек: Жидкости, вводимые кошке, будут вводиться с помощью иглы в тело кошки, обычно под кожу (подкожно). Это означает, что все, что находится на игле или на коже вокруг места инъекции, теперь может попасть в организм. Делая инъекцию своей кошке, вы нарушаете барьерную функцию кожи, которая обычно служит для защиты тела кошки от вредных веществ. Вот почему важно использовать стерильные продукты и использовать антисептическую (или чистую) технику.
Это означает, что все, что находится на игле или на коже вокруг места инъекции, теперь может попасть в организм. Делая инъекцию своей кошке, вы нарушаете барьерную функцию кожи, которая обычно служит для защиты тела кошки от вредных веществ. Вот почему важно использовать стерильные продукты и использовать антисептическую (или чистую) технику.
Иглы, трубки, пакеты для жидкостей и шприцы стерильны на момент получения. Однако стерильность нарушается, когда вы снимаете пластиковую упаковку, колпачки или защитные чехлы. Это когда ваше надлежащее обращение необходимо больше всего, чтобы уберечь вашего питомца от инфекции. Следующие советы могут помочь вам с этой частью.
Советы по уменьшению заражения при подкожном введении жидкостей кошкам:- Всегда мойте руки перед работой со стерильными продуктами и оборудованием.
- Нитриловые или латексные перчатки могут защитить вас и вашего питомца.
- Не открывайте упаковку продуктов, пока не будете готовы их использовать.

- Продезинфицируйте рабочую поверхность, например прилавок, изопропиловым спиртом или любым другим дезинфицирующим средством.
- Протрите спиртом все поверхности, через которые будет проходить игла. Примерами могут служить флаконы, порты на мешках с жидкостью и, возможно, даже место инъекции вашей кошки, в зависимости от рекомендаций вашего ветеринара.
- При использовании шприца старайтесь держать пальцы подальше от места прикрепления иглы и сторон поршня. Прикосновение к обеим этим областям может привести к заражению жидкостей, которые вы будете вводить своей кошке.
- Никогда не используйте повторно иглы, которые были введены в кровь. Вы никогда не должны повторно использовать одну и ту же иглу, введенную вашей кошке, для забора жидкости или повторной инъекции кошке. Это переносит бактерии и/или кровь в новое место. Однако вы можете использовать ту же иглу, чтобы взять жидкость из мешка, а затем сделать инъекцию кошке, поскольку она никогда не касалась крови и должна оставаться несколько чистой.
 Иглы заточены при изготовлении, спроектированы с необходимой точностью, чтобы легко входить в поверхности. Каждый раз, когда они используются, скошенное отверстие повреждается и становится более тусклым, что затрудняет и делает более болезненным повторное использование. Это еще одна причина, по которой иглы нельзя использовать повторно.
Иглы заточены при изготовлении, спроектированы с необходимой точностью, чтобы легко входить в поверхности. Каждый раз, когда они используются, скошенное отверстие повреждается и становится более тусклым, что затрудняет и делает более болезненным повторное использование. Это еще одна причина, по которой иглы нельзя использовать повторно. - Также не рекомендуется повторно использовать спиртовые тампоны, поскольку они могут переносить бактерии.
- Иногда не рекомендуется повторно надевать колпачки на иглы, так как это может привести к тому, что вы уколетесь.
- Спросите ветеринара вашей кошки о его конкретных рекомендациях.
Ветеринар вашего питомца, вероятно, продемонстрирует вам, как давать жидкости вашему питомцу, и лучше следовать их указаниям. Это всего лишь несколько простых советов, которые могут помочь давать жидкости вашей кошке.
- Ветеринар вашего питомца может попросить вас просто набрать жидкость из пакета с помощью шприца, а затем ввести ее кошке.

- Вы также можете использовать трубку между шприцем и иглой у кошки и проталкивать жидкость через шприц.
- Последний способ — использовать леску между самим мешком и иглой, которую вводят в кота.
- При наборе жидкости из флакона важно создать давление. Для этого вы просто впрыскиваете количество воздуха, эквивалентное необходимому объему жидкости, во флакон перед набором жидкости. Это помогает обеспечить одинаковое давление внутри и снаружи флакона.
- Чтобы убедиться, что вы не задели другие ткани, вы можете натянуть кожу вашей кошки прямо вверх и сделать форму, напоминающую палатку. Затем другой рукой вы можете ввести иглу прямо в сделанную вами конструкцию палатки и медленно отпустить ее.
- Большинству кошек требуется введение жидкости в спину, но следуйте рекомендациям ветеринарного врача.
- Инъекция, скорее всего, сформирует карман жидкости под кожей, который может стекать вниз в течение дня.
- Всегда проверяйте существующие карманы жидкости, прежде чем делать новый, потому что они должны полностью исчезнуть перед следующей инъекцией.

 Кошкам более 3-4 кг удобно вводит лекарства под кожу 5 или 10-миллилитровыми шприцами.
Кошкам более 3-4 кг удобно вводит лекарства под кожу 5 или 10-миллилитровыми шприцами.


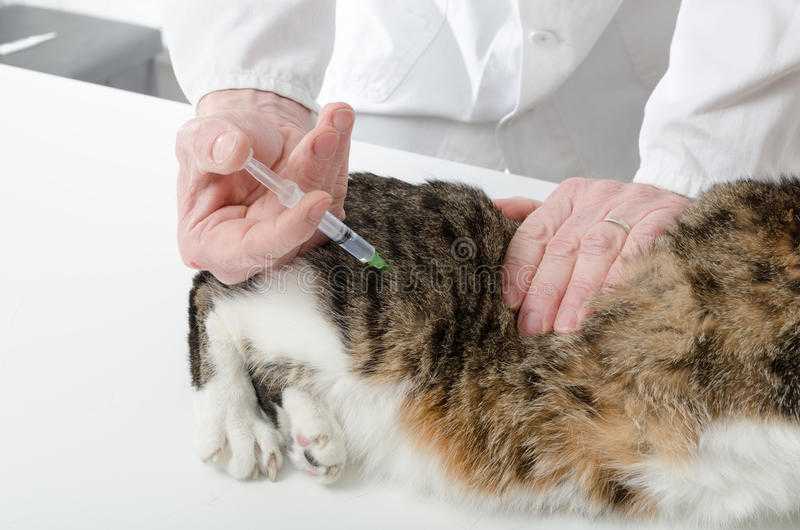 Выдавите их поршнем и наберите нужную дозу.
Выдавите их поршнем и наберите нужную дозу.
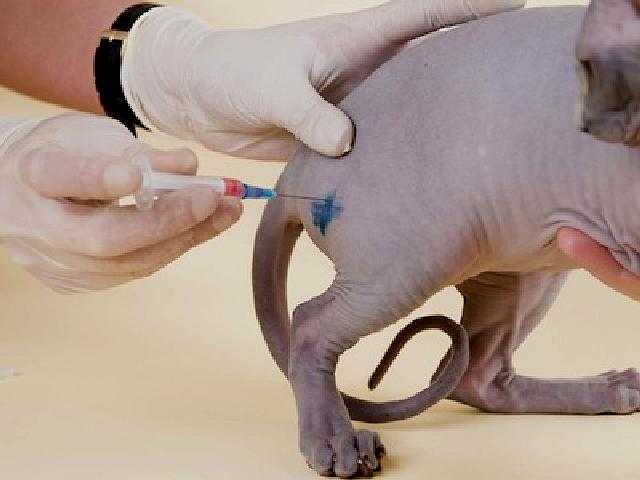 Основание шприца называется цилиндром, а поршень — это часть, которая перемещается внутри цилиндра, всасывая жидкости и выталкивая их наружу. Наконечник — это самая верхняя часть шприца, к которой будет крепиться игла.
Основание шприца называется цилиндром, а поршень — это часть, которая перемещается внутри цилиндра, всасывая жидкости и выталкивая их наружу. Наконечник — это самая верхняя часть шприца, к которой будет крепиться игла. Линия позволяет вводить жидкости медленно и может быть полезна для больших объемов.
Линия позволяет вводить жидкости медленно и может быть полезна для больших объемов.